Журнал «Почки» Том 10, №1, 2021
Вернуться к номеру
Гломерулярные поражения почек у детей с ювенильным ревматоидным артритом (обзор литературы)
Авторы: Борисова Т.П., Самсоненко С.В., Вакуленко Л.И., Маковейчук А.А.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Огляд літератури присвячений опису різних форм гломерулонефриту (ГН) у дітей із поліартикулярною і системною формами ювенільного ревматоїдного артриту (ЮРА). У доступній літературі представлено 21 клінічний випадок розвитку ГН, а саме: ANCA-асоційований ГН, мезангіопроліферативний ГН, у тому числі IgA- і IgМ-нефропатія, мембранозна нефропатія, фокально-сегментарний гломерулосклероз, хвороба мінімальних змін, екстракапілярний ГН. Механізм гломерулярних уражень при ЮРА пояснюється гіперпродукцією прозапальних цитокінів, а також нефротоксичною дією базисних протизапальних лікарських засобів. Детально проаналізовані клінічні прояви й ефективність проведеної терапії кожного варіанту ГН у дітей з ЮРА. Найбільше публікацій присвячено ANCA-асоційованому ГН, що розвинувся у пацієнтів із торпідним перебігом і високим рівнем активності поліартикулярної і системної форм ЮРА. Особливістю ANCA-асоційованого ГН стали наявність гіперкреатинінемії і практично в половині випадків — розвиток термінальної ниркової недостатності, незважаючи на проведену імунодепресивну терапію. Поодинокі випадки інших варіантів ГН описані більше 10 років тому. Клінічно відзначалися протеїнурія і рідше — нефротичний синдром, що стало підставою для прижиттєвого морфологічного дослідження нирок. Імунодепресивна терапія була ефективною при мезангіопроліферативному ГН і хворобі мінімальних змін. У всіх випадках при фокально-сегментарному гломерулосклерозі, екстракапілярному ГН відзначено формування термінальної ниркової недостатності. Сприятливий прогноз виявився у дітей із мембранозною нефропатією, індукованою препаратами, після скасування останніх. Надані публікації з позитивним терапевтичним ефектом застосування генно-інженерних біологічних препаратів при ANCA-асоційованому ГН, IgМ-нефропатії, гормонорезистентному варіанті хвороби мінімальних змін у дітей з ЮРА.
Обзор литературы посвящен описанию различных форм гломерулонефрита (ГН) у детей с полиартикулярной и системной формами ювенильного ревматоидного артрита (ЮРА). В доступной литературе представлен 21 клинический случай развития ГН, а именно: ANCA-ассоциированный ГН, мезангиопролиферативный ГН, в том числе IgA- и IgМ-нефропатия, мембранозная нефропатия, фокально-сегментарный гломерулосклероз, болезнь минимальных изменений, экстракапиллярный ГН. Механизм гломерулярных поражений при ЮРА объясняется гиперпродукцией провоспалительных цитокинов, а также нефротоксическим действием базисных противовоспалительных лекарственных средств. Подробно проанализированы клинические проявления и эффективность проводимой терапии каждого варианта ГН у детей с ЮРА. Больше всего публикаций посвящено ANCA-ассоциированному ГН, который развился у пациентов с торпидным течением и высокой степенью активности полиартикулярной и системной форм ЮРА. Особенностью ANCA-ассоциированного ГН явилось наличие гиперкреатининемии и практически в половине случаев — развитие терминальной почечной недостаточности, несмотря на проводимую иммунодепрессивную терапию. Единичные случаи других вариантов ГН описаны более 10 лет назад. Клинически отмечались протеинурия и реже — нефротический синдром, что стало основанием для прижизненного морфологического исследования почек. Иммунодепрессивная терапия была эффективной при мезангиопролиферативном ГН и болезни минимальных изменений. Во всех случаях при фокально-сегментарном гломерулосклерозе, экстракапиллярном ГН отмечено формирование терминальной почечной недостаточности. Благоприятный прогноз оказался у детей с мембранозной нефропатией, индуцированной препаратами, после отмены последних. Представлены публикации с положительным терапевтическим эффектом применения генно-инженерных биологических препаратов при ANCA-ассоциированном ГН, IgМ-нефропатии, гормонорезистентном варианте болезни минимальных изменений у детей с ЮРА.
The literature review describes the different forms of glomerulonephritis (GN) in children with polyarticular and systemic forms of juvenile rheumatoid arthritis (JRA). In the available literature, there are 21 clinical cases of GN: ANCA-associated GN, mesangial proliferative GN, including IgA- and IgM-nephropathy, membranous nephropathy, focal-segmental glomerulosclerosis, minimal change disease, and extracapillary GN. The mechanism of glomerular lesions in JRA is explained by hyperproduction of pro-inflammatory cytokines and by nephrotoxic action of basal anti-inflammatory medications. The clinical manifestations and the effectiveness of treatment of each variant of GN in children with JRA were analyzed in detail. Most publications are devoted to ANCA-associated GN, which developed in patients with a torpid course and a high activity of polyarticular and systemic forms of JRA. The peculiarity of ANCA-associated GN was the presence of hypercreatininemia and in almost half of cases the development of terminal renal failure, despite conducted immunosuppressive therapy. Single cases of other variants of GN were described more than 10 years ago. Proteinuria and the rare nephrotic syndrome were clinically observed, which was the reason for intravital renal morphological examination. Immunosuppressive therapy was effective in mesangial proliferative GN and minimal change disease. All cases of focal-segmental glomerulosclerosis, extracapillary GN were accompanied by the formation of terminal renal failure. Favorable prognosis appeared in children with drug-induced membranous nephropathy after their withdrawal. There are publications on a positive therapeutic effect of genetically engineered biological drugs in ANCA-associated GN, IgM-nephropathy, and a hormone-resistant variant of MCD in children with JRA.
ювенільний ревматоїдний артрит; діти; гломерулонефрит
ювенильный ревматоидный артрит; дети; гломерулонефрит
juvenile rheumatoid arthritis; children; glomerulonephritis
Заключение
- Petty R.E., Southwood T.R., Manners P. et al. International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton, 2001. J. Rheumatol. 2004 Feb. 31 (2). P. 390-2. PMID: 14760812.
- Barut K., Adrovic A., Şahin S. et al. Juvenile Idiopathic Arthritis. Balkan. Med. J. 2017 Apr. 5. 34 (2). P. 90-101. doi: 10.4274/balkanmedj.2017.0111.
- Lee J., Schneider R. Systemic Juvenile Idiopathic Arthritis. Pediatr. Clin. North Am. 2018 Aug. 65 (4). P. 691-709. doi: 10.1016/j.pcl.2018.04.005.
- Crayne C.B., Beukelman T. Juvenile Idiopathic Arthritis: Oligoarthritis and Polyarthritis. Pediatr. Clin. North Am. 2018 Aug. 65 (4). P. 657-674. doi: 10.1016/j.pcl.2018.03.005.
- Dursun I., Yel S., Yilmaz K. et al. Renal Involvement in Children with Rheumatic Diseases Other Than Systemic Vasculitis, SLE and Autoinflammatory Diseases. Annals of Paediatric Rheumatology. 2012. 1 (2). Р. 97-105. DOI: 10.5455/аpr.033120121350.
- Sihvonen S., Korpela M., Mustonen J. et al. Renal disease as a predictor of increased mortality among patients with rheumatoid arthritis. Nephron. Clin. Pract. 2004. 96 (4). Р. 107-14. doi: 10.1159/000077372.
- Icardi A., Araghi P., Ciabattoni M. et al. Coinvolgimento renale in corso di artrite reumatoide [Kidney involvement in rheumatoid arthritis]. Reumatismo. 2003. 55 (2). P. 76-85. doi: 10.4081/reumatismo.2003.76.
- Борисова Т.П., Самсоненко С.В., Бадогина Л.П. К вопросу о вторичном амилоидозе почек при ювенильном ревматоидном артрите у детей. Здоровье ребенка. 2020. 15 (4). Р. 252-257. doi: 10.22141/2224-0551.15.4.2020.208477.
- Gicchino M.F., Di S.A., Guarino S. et al. Prevalence of and factors associated to chronic kidney disease and hypertension in a cohort of children with juvenile idiopathic arthritis. Eur. J. Pediatr. 2020 Aug. 29. doi: 10.1007/s00431-020-03792-4.
- Delplanque M., Pouchot J., Ducharme-Bénard S. et al. AA amyloidosis secondary to adult onset Still's disease: About 19 cases. Semin. Arthritis Rheum. 2020 Feb. 50 (1). P. 156-165. doi: 10.1016/j.semarthrit.2019.08.005.
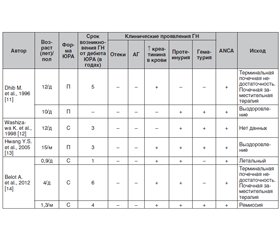
- Dhib M., Prieur A.M., Courville S. et al. Crescentic glomerulonephritis in juvenile chronic arthritis. J. Rheumatol. 1996 Sep. 23 (9). P. 1636-40. PMID: 8877938.
- Washizawa K., Wakabayashi Y. A case of juvenile rheumatoid arthritis with MPO-ANCA associated nephritis. Ryumachi. 1998 Feb. 38 (1). Р. 29-33. PMID: 9564775.
- Hwang Y.S., Rhie Y. J., Ahn S.Y. et al. A Case of ANCA-associated Pauci-immune Crescentic Glomerulonephritis in Juvenile Rheumatoid Arthritis. Journal of the Korean Society of Pediatric Nephrology. 2005. 9 (2). P. 231-236. http://www.chikd.org/journal/view.php?number = 343
- Belot A., Bader-Meunier B., Niaudet P. et al. ANCA-associated glomerulonephritis in systemic-onset juvenile idiopathic arthritis. Am. J. Kidney Dis. 2012 Mar. 59 (3). P. 439-43. doi: 10.1053/j.ajkd.2011.11.002.
- Heeringa P., Huugen D., Tervaert J.W. Anti-neutrophil cytoplasmic autoantibodies and leukocyte-endothelial interactions: a sticky connection? Trends Immunol. 2005 Nov. 26 (11). Р. 561-4. doi: 10.1016/j.it.2005.08.010.
- Mustila A., Korpela M., Mustonen J. et al. Perinuclear antineutrophil cytoplasmic antibody in rheumatoid arthritis: a marker of severe disease with associated nephropathy. Arthritis Rheum. 1997 Apr. 40 (4). P. 710-7. doi: 10.1002/art.1780400417.
- Mulder L., Rossum M., Horst G. et al. Antineutrophil cytoplasmic antibodies in juvenile chronic arthritis. J. Rheumatol. 1997. 24 (3). P. 568-75. PMID: 9058667.
- Bakkaloglu A., Ozen S., Saatci U. et al. Antineutrophil cytoplasmic antibodies in juvenile chronic arthritis. Clin. Rheumatol. 1999.18 (4). P. 304-7. doi: 10.1007/s100670050106.
- Speckmaier M., Röther E., Terreri T. et al. Prevalence of anti-neutrophil cytoplasmic antibodies (ANCA) in juvenile chronic arthritis. Clin. Exp. Rheumatol. 1996. 14 (2). P. 211-6. PMID: 8737731.
- Gedalia A., Mendez E.A., Craver R. et al. Renal involvement in juvenile rheumatoid arthritis: report of two cases. Clin. Rheumatol. 2001. 20 (2). P. 153-6. doi: 10.1007/pl00011196.
- Bandin F., Merhenberger M., Modesto A. et al. Steroid-responsive nephrotic syndrome in a child with juvenile idiopathic arthritis. Pediatr. Nephrol. 2008 Apr. 23 (4). P. 651-4. doi: 10.1007/s00467-007-0678-9.
- Voyer L.E., Alvarado C., Cuttica R.J. et al. Nephrotic syndrome due to immunoglobulin M mesangial glomerulonephritis preceding juvenile idiopathic arthritis. Iran. J. Kidney Dis. 2013. 7 (3). P. 231-234. PMID: 23689157.
- Matsukura H., Igarashi N., Kazama T. et al. Concurrent occurrence of juvenile reactive arthritis and IgA nephropathy. Clin. Nephrol. 2014 May. 81 (5). P. 379-80. doi: 10.5414/CN108200.
- Kallen K.J. The role of transsignalling via the agonistic soluble IL-6 receptor in human diseases. Biochim. Biophys. Acta. 2002 Nov. 1592 (3). P. 323-43. doi: 10.1016/s0167-4889 (02)00325-7.
- Peake N.J., Khawaja K., Myers A. et al. Interleukin-6 signalling in juvenile idiopathic arthritis is limited by proteolytically cleaved soluble interleukin-6 receptor. Rheumatology (Oxford). 2006 Dec. 45 (12). P. 1485-9. doi: 10.1093/rheumatology/kel154.
- Tanaka T., Narazaki M., Kishimoto T. Interleukin (IL-6) Immunotherapy. Cold Spring Harb. Perspect. Biol. 2018 Aug. 10 (8). a028456. doi: 10.1101/cshperspect.a028456.
- Akioka S. Interleukin-6 in juvenile idiopathic arthritis. Mod. Rheumatol. 2019 Mar. 29 (2). P. 275-286. doi: 10.1080/14397595.2019.1574697.
- Gohda T., Makita Y., Shike T. et al. Dilazep hydrochloride, an antiplatelet drug, inhibits lipopolysaccharide-induced mouse mesangial cell IL-6 secretion and proliferation. Kidney Blood Press Res. 2001. 24 (1). P. 33-8. doi: 10.1159/000054203.
- Su H., Lei C.T., Zhang C. Interleukin-6 Signaling Pathway and Its Role in Kidney Disease: An Update. Front Immunol. 2017. 8. P. 405. doi:10.3389/fimmu.2017.00405
- Lu H., Zhou J. HBV X gene transfection upregulates IL-1beta and IL-6 gene expression and induces rat glomerular mesangial cell proliferation. J. Huazhong Univ. Sci Technolog. Med. Sci. 2008 Jun. 28 (3). P. 247-50. doi: 10.1007/s11596-008-0304-5.
- Kawasaki Y., Suzuki J., Sike T. et al. Bucillamine-induced nephropathy in a child with juvenile rheumatoid arthritis and Kartagener’s syndrome. Pediatrics international: Official Journal of the Japan Pediatric Society. 2000. 42 (3). P. 316-8. DOI: 10.1046/j.1442-200x.2000.01211.x
- Suzuki K., Tanaka H., Ito E. et al. Therapy-related membranous nephropathy in juvenile idiopathic arthritis with Turner syndrome. Pediatr. Int. 2004 Jun. 46 (3). P. 377-9. doi: 10.1111/j.1442-200x.2004.01906.x.
- Foster B.J., Duffy C.M., Sharma A.K. Systemic juvenile rheumatoid arthritis complicated by two different renal lesions. Pediatr. Nephrol. 1998 Feb. 12 (2). P. 113-6. doi: 10.1007/s004670050416.
- Gedalia A., Mendez E.A., Craver R. et al. Renal involvement in juvenile rheumatoid arthritis: report of two cases. Clin. Rheumatol. 2001. 20 (2). P. 153-6. doi: 10.1007/pl00011196.
- Varma S. Juvenile rheumatoid arthritis with focal segmental glomerulosclerosis: a rare association. Pediatr. Nephrol. 2010. 25. P. 2189-2190. https://doi.org/10.1007/s00467-010-1504-3
- Lévy M., Prieur A.-M., Gubler M.-C. et al. Renal Involvement in Juvenile Chronic Arthritis: Clinical and Pathologic Features. American Journal of Kidney Diseases. 1987. 9 (2). P. 138-146. https://doi.org/10.1016/S0272-6386 (87)80091-4.
- Kari J.A., Bamashmous H., Mahan J.D. Steroid-sensitive nephrotic syndrome and juvenile idiopathic arthritis. Pediatr. Nephrol. 2002 Nov. 17 (11). P. 975-6. doi: 10.1007/s00467-002-0957-4.
- Ito S., Tsutsumi A., Harada T. et al. Long-term remission of nephrotic syndrome with etanercept for concomitant juvenile idiopathic arthritis. Pediatr. Nephrol. 2010 Oct. 25 (10). P. 2175-7. doi: 10.1007/s00467-010-1571-5.
- Kim S.H., Park S.J., Han K.H. et al. Pathogenesis of minimal change nephrotic syndrome: an immunological concept. Korean J. Pediatr. 2016 May. 59 (5). P. 205-11. doi: 10.3345/kjp.2016.59.5.205.
- Otero G.A., Esteban J., Salgado J. et al. Chronic juvenile arthritis and minimal change glomerulonephritis (MCGN), the same pathogenic basis? Anales de Medicina Interna. 1991. 8 (8). P. 413-414. PMID: 1768756.
- Shi D., Zhang Y., Liu D. et al. Analysis of the clinical cha–racteristics of arthritis with renal disease caused by a NPHS2 gene mutation. Clin. Rheumatol. 2021. https://doi.org/10.1007/s10067-020-05574-7
- Mene P., Franeta A.-J., Conti G. et al. Extracapillary glome–rulonephritis during etanercept treatment for juvenile psoriatic arthritis. Clinical and Experimental Rheumatology. 2010. 18 (2010). P. 91-93. https://doi.org/10.2165/00128415-201013030-00050].

/68.jpg)