Журнал "Гастроэнтерология" Том 55, №1, 2021
Вернуться к номеру
Взаємний вплив стану клітинної ланки імунітету, цитокінової регуляції та порушень кишкової мікробіоти на процеси фіброзування при хронічних дифузних захворюваннях печінки
Авторы: Діденко В.І., Татарчук О.М., Зигало Е.В., Коненко І.С., Ягмур В.Б.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
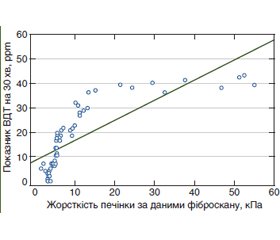
Актуальність. Відомо, що порушення кишкової мікробіоти у хворих на хронічні дифузні захворювання печінки (ХДЗП) пов’язані з дисрегуляцією імунної системи. При цьому виникає питання, що є первинним: або процес починається з порушення кишкової мікробіоти, що веде до імунорегуляторного дисбалансу, з подальшим фіброзуванням печінки, або порушення кишкового біоценозу є наслідком несприятливого впливу на організм існуючого патологічного стану, внаслідок чого знижуються функції імунної системи. Метою роботи стало визначення стану клітинної ланки імунітету та цитокінової регуляції організму у хворих на ХДЗП при формуванні та прогресуванні фіброзу печінки залежно від особливостей мікробіозу кишечника. Матеріали та методи. Обстежено 76 хворих на ХДЗП. Усім хворим проводили водневий дихальний тест (ВДТ), зсувнохвильову еластографію та виконували дослідження параметрів жорсткості печінки на апараті FibroScan, за показниками яких були сформовані групи залежно від наявності синдрому надлишкового бактеріального росту (СНБР) у тонкому кишечнику при формуванні та прогресуванні фіброзу печінки. Субпопуляційний склад лімфоцитів визначали за допомогою моноклональних антитіл фірми «Сорбент ТМ» до молекул CD4, CD8. Рівень ІЛ-6, ІЛ-10, TNF-α в сироватці крові визначали імуноферментним методом (ELISA) наборами реактивів фірми «Вектор-БЕСТ». Результати. Підвищений рівень прозапальних цитокінів (ІЛ-6 та TNF-α) у крові хворих на ХДЗП із наявністю СНБР не індукує секрецію протизапальних цитокінів (ІЛ-10), що призводить до підтримки запального процесу та прогресування фіброзу печінки залежно від порушень кишкового біоценозу за виявленими кореляціями між показниками жорсткості печінки та рівнем водню за даними ВДТ (r = 0,79; р < 0,001). У хворих на ХДЗП порушення клітинної ланки імунітету пов’язане з порушенням мікробіоти кишечника, про що свідчать кореляційні зв’язки з рівнем водню (ppm): CD8+ (r = –0,439, р < 0,05) та CD4/CD8 (r = +0,492, р < 0,05). Висновки. Таким чином, етіологічний чинник викликає запальний процес через порушені імунорегуляторні механізми, що сприяє процесам фіброзування та порушенню кишкової мікробіоти.
Background. It is known that disorders of the intestinal microbiota in patients with chronical liver disease (CLD) are associated with immune dysregulation. The process begins with a violation of the intestinal microbiota, leading to the development of immunodeficiency, affecting the course of the underlying disease (with progression of liver fibrosis). Besides, violation of intestinal biocenosis is a consequence of adverse effects on the body and its microflora state resulting in reduced immune function. The purpose of the study was to determine the mechanisms of cytokine regulation in the body of patients with CLD in the formation and progression of liver fibrosis depending on the damage of the intestinal microbiota. Materials and methods. Seventy-six patients with CLD were examined. All patients underwent a hydrogen breath test (HBT), shear wave elastography; the liver stiffness parameters were studied on a FibroScan. Depending on the indices obtained and the presence of small intestinal bacterial overgrowth (SIBO) in the small intestine in the formation and progression of liver fibrosis, the patients were divided into groups. The subpopulation of lymphocytes — CD4 and CD8 was determined using monoclonal antibodies from the company “Sorbent TM”. The serum level of IL-6, IL-10, TNF-α was determined by enzyme-linked immunosorbent assay (ELISA) using the reagent kits from the company “Vector-BEST”. Results. The elevated levels of inflammatory cytokines (IL-6 and TNF-α) do not induce the secretion of anti-inflammatory cytokines (IL-10) with the presence of SIBO, which leads to the maintenance of inflammation and progression of liver fibrosis depending on intestinal biocenosis (a correlation was found between liver stiffness and hydrogen levels r = 0.79; р < 0.001). In patients with CLD, the violation of the cellular component of immunity is associated with an impairment of the intestinal microbiota, as evidenced by correlations with the hydrogen level (ppm): CD8+ (r = –0.439; p < 0.05) and CD4/CD8 (r = +0.492; p < 0.05). Conclusions. Impaired immunoregulatory mechanisms contribute to the fibrotic processes with subsequent violation of the gut microbiota.
імунорегуляція; запальний процес; фіброз печінки; кишкова мікробіота; синдром надмірного бактеріального росту; прозапальні та протизапальні цитокіни; хронічні дифузні захворювання печінки
immunoregulation; inflammatory process; liver fibrosis; intestinal microbiota; syndrome of intestinal bacterial overgrowth; inflammatory and anti-inflammatory cytokines; chronic diffuse liver disease
Вступ
Матеріали та методи
Результати та обговорення
/39.jpg)
Висновки
- Ткач С.М. Роль кишечно-печеночной ассоциации и кишечной микробиоты в развитии неалкогольной жировой болезни печени. Сучасна гастроентерологія. 2015. № 5(85). С. 96-109.
- Om Parkash, Subha Saeed. Molecular Basis for Pathogenesis of Steatohepatitis: Contemporary Understanding and New Insights, Non-Alcoholic Fatty Liver Disease. Molecular Bases, Prevention and Treatment, Rodrigo Valenzuela, Intech Open. 2018. 54 р. DOI: 10.5772/intechopen.71405.
- Sanyal A.J. Past, present and future perspectives in nonalcoholic fatty liver disease. Nat. Rev. Gastroenterol. Hepatol. 2019. № 16(6). P. 377-386. doi: 10.1038/s41575-019-0144-8.
- Mauss S., Berg T., Rockstroh J. Hepatology: A Clinical Textbook. Sydney: Flying Publisher, 2015. 655 p.
- Caballería L., Pera G., Arteaga I., Rodríguez L., Alumà A., Morillas R.M. et al. High Prevalence of Liver Fibrosis Among European Adults With Unknown Liver Disease: A Population-Based Study. Clin. Gastroenterol Hepatol. 2018. № 16(7). P. 1138-1145. doi: 10.1016/j.cgh.2017.12.048.
- Bedossa P. Pathology of non-alcoholic fatty liver disease. Liver Int. 2017. № 37(1). Р. 85-89. doi: 10.1111/liv.13301.
- Иванов А.С., Гармаш И.В., Аришева О.С. и др. Значение иммуновоспалительных и генетических факторов в развитии алкогольного фиброза печени. Клиническая фармакология и терапия. 2018. № 27(5). Р. 30-35. doi: 10.32756/0869- 5490-2018-5-30-35.
- Круглов А.А. Микробиота, иммунитет кишечника и мышиная возня. Acta Naturae. 2014. № 1(20). С. 6-8.
- Горецкая М.В. Синтетическая функция печени и гуморальные факторы иммунитета. Журнал ГрГМУ. 2008. № 2. С. 7-11.
- Корниенко Е.А. Микробиота кишечника как ключевой фактор формирования иммунитета и толерантности. Возможности пробиотиков. Медицинский совет. Аллергология и иммунология. 2020. № 10. С. 92-100. doi: 10.21518/2079-701х-2020-10-92-100.
- Shi N., Li N., Duan X., Niu H. Interaction between the gut microbiome and mucosal immune system. Military Medical Research. 2017. № 4. 59. doi: 10.1186/s40779-017-0122-9.
- Clavel T., Lagkouvardos I., Gomes-Neto J.C., Ramer-Tait A.E. Deciphering interactions between the gut microbiota and the immune system via microbial cultivation and minimal microbiomes. Immunol. Rev. 2017. № 279(1). P. 8-22. doi: 10.1111/imr.12578.
- Mannaa F.A., Abdel-Wahhab K.G. Physiological potential of cytokines and liver damages / F.A. Mannaa, K.G. Abdel-Wahhab. Hepatoma Res. 2016. № 2. P. 131-143.
- Niederreiter L. Cytokines and fatty liver diseases. Liver Research. 2018. № 2(1). P. 14-20.
- Ledochowski М. Hydrogen Breath tests. Инсбрук: Akademie, 2008. 20 с.
- Деклараційний патент на корисну модель UA 140554 А61В 5/00 G01N 29/00 Спосіб діагностики фіброзу печінки у хворих на хронічний гепатит С / Степанов Ю.М., Діденко В.І., Коненко І.С., Ягмур В.Б., Петішко О.П., Орловский Д.В.; заявник та патентовласник ДУ ІГ НАМН. Заявка u2019 05179, заявл. 16.05.2019, опубл. 10.03.2020. Бюл. № 5.
- Деклараційний патент на корисну модель UA № 136479 А61В 8/00 А61В 8/12 (2006.1) Спосіб діагностики стеатозу печінки у хворих на неалкогольну жирову хворобу печінки / Степанов Ю.М., Діденко В.І., Коненко І.С., Ягмур В.Б., Петішко О.П.; заявник та патентовласник ДУ ІГ НАМН. Заява № 2019 00966, заявл. 30.01.2019, опубл. 27.08.2019. Бюл. № 16.

/39_2.jpg)
/40_2.jpg)
/40.jpg)
/41.jpg)