Журнал "Гастроэнтерология" Том 55, №1, 2021
Вернуться к номеру
Роль пробіотиків у корекції кишкового дисбіозу при функціональних захворюваннях кишечника
Авторы: Ткач С.М.
Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
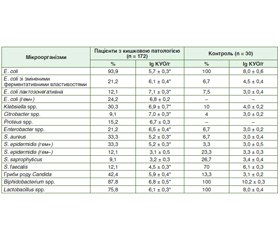
Актуальність. На даний час вивчення фізіологічного впливу кишкового мікробіому (КМ) на здоров’я господаря, а також патогенетичної ролі його змін при різних захворюваннях, як гастроентерологічних, так і негастроентерологічних, розглядається як одна з найбільш перспективних галузей у медицині. При багатьох гастроентерологічних захворюваннях зміни якісного і/або кількісного складу кишкової мікробіоти, а також її транслокація в невластиві біотопи, відомі в медицині як кишковий дисбіоз, відіграють важливу патогенетичну роль, сприяюють розвитку й прогресуванню як органічної, так і функціональної кишкової патології та багатьох інших захворювань. Мета дослідження: вивчення клінічної та мікробіологічної ефективності й безпеки мультикомпонентного пробіотика (Пробіз®) при функціональній кишковій патології. Матеріали та методи. Обстежені 172 хворі (90 жінок, 82 чоловіки) віком від 18 до 56 років із функціональною кишковою патологією, зокрема 105 хворих із синдромом подразненої кишки (СПК), 32 хворі із функціональним здуттям (ФЗ) і 35 хворих із функціональним запором. У всіх хворих при проведенні мікробіологічного дослідження випорожнень був виявлений кишковий дисбіоз різного ступеня тяжкості. До складу контрольної групи входили 30 клінічно здорових осіб віком від 18 до 35 років. Залежно від проведеного лікування всі пацієнти були рандомізовані на дві підгрупи. Пацієнтам підгрупи А призначали базисну терапію, пацієнтам підгрупи В додатково призначали Пробіз® по 1 капсулі 2 рази на день упродовж 4 тижнів. Клінічну ефективність лікування в кожній підгрупі через один місяць оцінювали за кількістю респондерів і хворих зі зменшенням/регресією кишкового дисбіозу. Результати. У хворих підгрупи В, у якій додатково до базисної терапії використовували Пробіз®, відзначене підвищення ефективності лікування порівняно з хворими підгрупи А, у якій проводили тільки базисне лікування. Зазначене поліпшення стосувалося як клінічних, так і мікробіологічних критеріїв ефективності. У всіх підгрупах хворих частота кишкового дисбіозу після застосування Пробізу® впродовж 1 місяця була вірогідно нижчою, ніж вихідні дані (42,6 % проти 100 %; р < 0,001), і вірогідно не відрізнялася від показників контрольної групи (40 %). У той же час у пацієнтів із функціональною кишковою патологією, які отримували тільки базисну терапію, частота кишкового дисбіозу (75 %) хоча й знизилась, однак була вірогідно вищою, ніж у хворих, які отримували Пробіз®, і в групі контролю (р < 0,001). Висновки. Результати проведеного дослідження продемонстрували ефективність і безпеку комбінованого мультиштамового пробіотика Пробіз® в лікуванні таких функціональних кишкових захворювань, як СПК, функціональне здуття й функціональний запор. Застосування Пробізу® супроводжувалося вираженим клініко-мікробіологічним ефектом, що виявлявся у вірогідно більш частому зникненні/поліпшенні основних клінічних симптомів, а також у зниженні частоти виявлення кишкового дисбіозу після одномісячного курсового лікування.
Background. Currently, the study of the physiological effect of the intestinal microbiome (IM) on the health of the host, as well as the pathogenetic role of its changes in various diseases, both gastroenterological and non-gastroenterological, is considered as one of the most promising areas in medicine. In many gastroenterological diseases, changes in the qualitative and/or quantitative composition of the IM, as well as its translocation into unusual biotopes, known in medicine as gut dysbiosis, play an important pathogenetic role, contributing to the development and progression of both organic and functional intestinal pathology and many other diseases. The purpose was to study the clinical and microbiological efficacy and safety of a multicomponent probiotic (Probiz®) in functional intestinal pathology. Materials and methods. We examined 172 patients (90 females and 82 males) aged 18–56 years with functional bowel disorders, in particular 105 patients with irritable bowel syndrome (IBS), 32 patients with functional bloating and 35 patients with functional constipation. In all patients, during the microbiological examination of feces, intestinal dysbiosis of varying severity was revealed. As a control group, 30 clinically healthy people aged 18 to 35 years were examined. All patients were randomized into 2 subgroups depending on the treatment. Patients of subgroup A were prescribed basic therapy; patients of subgroup B were additionally prescribed Probiz® 1 capsule twice a day for 4 weeks. The clinical efficacy of treatment in each subgroup after 1 month was assessed by the number of responders and patients with a decrease/regression of intestinal dysbiosis. Results. In patients of subgroup B, where Probiz® was used in addition to basic therapy, there was an increase in the effectiveness of treatment compared to patients in subgroup A of basic treatment only. This improvement concerned both clinical and microbiological efficacy criteria. In all subgroups of patients, the frequency of intestinal dysbiosis after 1-month use of Probiz® was significantly lower than the initial data (42.6 % versus 100 %; p < 0.001), and did not differ significantly from the indicators of the control group (40 %). At the same time, in patients with functional intestinal pathology who received only basic therapy, the frequency of intestinal dysbiosis (75 %), although decreased, was significantly higher than in patients receiving Probiz® and in the control group (p < 0.001). Conclusions. The results of the study have demonstrated the efficacy and safety of the combined multi-strain probiotic Probiz® in the treatment of functional intestinal diseases such as IBS, functional bloating and functional constipation. The use of Probiz® was accompanied by a pronounced clinical and microbiological effect, manifested itself in a significantly more frequent disappearance/improvement of the main clinical symptoms, as well as a decrease in the frequency of detection of intestinal dysbiosis after a 1-month course of treatment.
кишковий дисбіоз; синдром подразненої кишки; функціональне здуття; функціональний запор; пробіотики
intestinal dysbiosis; irritable bowel syndrome; functional bloating; functional constipation; probiotics
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Barbara G., Grover M., Bercik P. et al. Rome Foundation Working Team Report on Post-Infection Irritable Bowel Syndrome. Gastroenterology. 2019. 156. 46-58.
- Borchers A.T., Selmi C., Meyers F.J. et al. Probiotics and immunity. J. Gastroenterol. 2009. 44. 26-46.
- Brenner D.M., Moeller M.J., Chey W.D. et al. The utility of probiotics in the treatment of irritable bowel syndrome: a systematic review. Am. J. Gastroenterol. 2009. 104. 1033-49; quiz 1050. PMID: 19277023. doi: 10.1038/ajg.2009.25.
- Bron P.A., van Baarlen P., Kleerebezem M. Emerging molecular insights into the interaction between probiotics and the host intestinal mucosa. Nat. Rev. Microbiol. 2012. 10. 66-78.
- Caselli M., Cassol F., Calo G. et al. Actual concept of “probiotics”: is it more functional to science or business? World J. Gastroenterol. 2013. 19. 1527-40.
- Chang L., Lembo A., Sultan S. American Gastroenterological Association technical review on the pharmacological management of irritable bowel syndrome. Gastroenterology. 2014. 147. 1149-1172.
- Clarke G., Cryan J.F., Dinan T.G., Quigley E.M. Review article: probiotics for the treatment of irritable bowel syndrome ––focus on lactic acid bacteria. Aliment. Pharmacol. Ther. 2012. 35. 403-413. PMID: 22225517. doi: 10.1111/j.1365–2036.2011.04965.x.
- Cordina C., Shaikh I., Shrestha S. Probiotics in the management of gastrointestinal disease: analysis of the attitudes and prescribing practices of gastroenterologists and surgeons. J. Dig. Dis. 2011. 12. 489-496.
- De Simone C. The Unregulated Probiotic Market. Clin. Gastroenterol. Hepatol. 2019. 17. 809-817.
- Didari T., Mozaffari S., Nikfar S., Abdollahi M. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World J. Gastroenterol. 2015. 21. 3072–3084. PMID: 25780308. doi: 10.3748/wjg.v21.i10.3072.
- Distrutti E., Monaldi L., Ricci P., Fiorucci S. Gut microbiota role in irritable bowel syndrome: New therapeutic strategies. World J. Gastroenterol. 2016 February 21. 22(7). 2219-2241.
- Drossman D. Rome IV: functional gastrointestinal disorders — disorders of gut-brain interaction. Gastroenterology. 2016. 150. 1257-1261. doi: 10.1053/j.gastro.2016.03.035.
- Flint H.J. The role of the gut microbiota in nutrition and health. Nat. Rev. Gastroenterol. Hepatol. 2012. 9. 577-589.
- Ghouri Y.A., Richards D.M., Rahimi E.F., Krill J.T., Jelinek K.A., DuPont A.W. Systematic review of randomized controlled trials of probiotics, prebiotics, and synbiotics in inflammatory bowel disease. Clin. Exp. Gastroenterol. 2014. 7. 473-487. PMID: 25525379. doi: 10.2147/CEG.S27530.
- Goldenberg J.Z., Yap C., Lytvyn L. et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children. Cochrane Database Syst. Rev. 2017. 12. CD006095.
- Guarner F., Requena T., Marcos A. Consensus statements from the workshop “Probiotics and health: scientific evidence”. Nutr. Hosp. 2010. 25. 700-4.
- Hempel S., Newberry S.J., Maher A.R. et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012. 307. 1959-1969.
- Hickson M. Probiotics in the prevention of antibiotic-associated diarrhoea and Clostridium difficile infection. Therap. Adv. Gastroenterol. 2011 May. 4(3). 185-197.
- Hill C., Guarner F., Reid G., Gibson G.R., Merenstein D.J., Pot B., Morelli L., Canani R.B., Flint H.J., Salminen S., Calder P.C., Sanders M.E. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol. 2014. 11. 506–-514. PMID: 24912386. doi: 10.1038/nrgastro.2014.66.
- Hoveyda N., Heneghan C., Mahtani K.R. et al. A systematic review and meta-analysis: probiotics in the treatment of irritable bowel syndrome. BMC Gastroenterology. 2009. 9. 15.
- Hungin A.P., Mulligan C., Pot B., Whorwell P., Agréus L., Fracasso P., Lionis C., Mendive J., Philippart de Foy J.M., Rubin G., Winchester C., de Wit N. Systematic review: probiotics in the management of lower gastrointestinal symptoms in clinical practice –– an evidencebased international guide. Aliment. Pharmacol. Ther. 2013. 38. 864–886. PMID: 23981066. doi: 10.1111/apt.12460.
- Kajander K., Krogius-Kurikka L., Rinttila T. et al. Effects of multispecies probiotic supplementation on intestinal microbiota in irritable bowel syndrome. Aliment. Pharmacol. Ther. 2007. 26. 463-73.
- Lee K.N., Lee O.Y. Intestinal microbiota in pathophysiology and management of irritable bowel syndrome. World J. Gastroenterol. 2014. 20. 8886-97.
- Macdougall J.E., Johnston J.M., Lavins B.J. et al. An evaluation of the FDA responder endpoint for IBS-C clinical trials: analysis of data from linaclotide phase 3 clinical trials. Neurogastroenterol. Motil. 2013. 25. 481-486.
- Moayyedi P., Ford A.C., Talley N.J., Cremonini F., Foxorenstein A.E., Brandt L.J., Quigley E.M. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut. 2010. 59. 325-332. PMID: 19091823. doi: 10.1136/gut.2008.167270.
- Quigley E.M. Therapies aimed at the gut microbiota and inflammation: antibiotics, prebiotics, probiotics, synbiotics, anti-inflammatory therapies. Gastroenterol. Clin. North. Am. 2011. 40. 207-22.
- Parker E.A., Roy T., D’Adamo C.R. et al. Probiotics and gastrointestinal conditions: An overview of evidence from the Cochrane Collaboration. Nutrition. 2018. 45. 125-134.
- Preidis G.A., Hill C., Guerrant R.L. et al. Probiotics, enteric and diarrheal diseases, and global health. Gastroenterology. 2011. 140. 8-14.
- Ringel Y., Quigley E., Lin H. Probiotics and gastrointestinal disorders. Am. J. Gastroenterol. Suppl. 2012. 1. 34-40.
- Sanders M.E., Merenstein D.J., Reid G. et al. Probiotics and prebiotics in intestinal health and disease: from biology to the clinic. Nat. Rev. Gastroenterol. Hepatol. 2019. 16. 605-616.
- Sekirov I., Russell S.L., Antunes L.C. et al. Gut microbiota in health and disease. Physiol. Rev. 2010. 90. 859-904.
- Simrén M., Barbara G., Flint H.J., Spiegel B.M., Spiller R.C., Vanner S., Verdu E.F., Whorwell P.J., Zoetendal E.G. Intestinal microbiota in functional bowel disorders: a Rome foundation report. Gut. 2013. 62. 159-176. PMID: 22730468. doi: 10.1136/gutjnl–2012–302167.
- Sniffen J.C., McFarland L.V., Evans C.T. et al. Choosing an appropriate probiotic product for your patient: An evidence-based practical guide. PLoS One. 2018. 13. e0209205.
- Suez J., Zmora N., Segal E. et al. The pros, cons, and many unknowns of probiotics. Nat. Med. 2019. 25. 716-729.
- Whelan K. Probiotics and prebiotics in the management of irritable bowel syndrome: a review of recent clinical trials and systematic reviews. Curr. Opin. Clin. Nutr. Metab. Care. 2011. 14. 581-587.
- Williams M.D., Ha C.Y., Ciorba M.A. Probiotics as therapy in gastroenterology: a study of physician opinions and recommendations. J. Clin. Gastroenterol. 2010. 44. 631-636.
- Williams E.A., Stimpson J., Wang D. et al. Clinical trial: a multistrain probiotic preparation significantly reduces symptoms of irritable bowel syndrome in a double-blind placebo-controlled study. Aliment. Pharmacol. Ther. 2009. 29. 97-103.
- Young V.B., Schmidt T.M. Overview of the gastrointestinal microbiota. Adv. Exp. Med. Biol. 2008. 635. 29-40.

/47.jpg)
/47_2.jpg)