Журнал "Гастроэнтерология" Том 55, №2, 2021
Вернуться к номеру
Оцінка стану кишкової мікробіоти та концентрації коротколанцюгових жирних кислот у хворих на хронічні запальні захворювання кишечника
Авторы: Стойкевич М.В., Федорова Н.С., Недзвецька Н.В., Кленіна І.А., Татарчук О.М.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
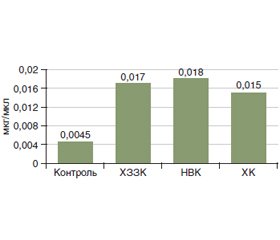
Актуальність. Патогенез хронічних запальних захворювань кишечника (ХЗЗК) досі залишається до кінця не вивченим. Відомо, що порушення мікробіоти кишечника призводять до підвищеної проникності кишечника, порушення продукції та кишкового всмоктування коротколанцюгових жирних кислот (КЖК), співвідношення яких є важливим показником цілісності мікробної спільноти кишечника. Таким чином, вивчення складу мікробіоти кишечника і концентрацій фекальних КЖК є дуже перспективним підходом до розширення розуміння патогенезу ХЗЗК. Метою дослідження було визначити особливості продукції фекальних КЖК та складу мікробіоти товстої кишки у хворих на ХЗЗК. Матеріали та методи. У дослідження, що проводилось у відділенні захворювань кишечника ДУ «Інститут гастроентерології НАМН України», були залучені 74 пацієнти з ХЗЗК, які були розподілені на 2 групи: І група — хворі на неспецифічний виразковий коліт (НВК) (n = 66), II — хворі на хворобу Крона (ХК) (n = 8). Діагнози ХК та НВК були встановлені згідно із загальноприйнятими стандартами діагностики в гастроентерології. Проведене визначення фекальних КЖК, дослідження видового та кількісного складу мікрофлори вмісту кишечника. Результати. У хворих на ХЗЗК виявлені значні зміни в спектрі КЖК, які були аналогічними як при НВК, так і при ХК: зменшення вмісту оцтової кислоти в групі НВК у 5,7 раза і в групі ХК у 10,5 раза (р < 0,05), масляної кислоти — у групі НВК у 1,6 раза і в групі ХК у 1,5 раза (р < 0,05) та підвищення пропіонової кислоти в групі НВК у 4 рази і в групі ХК в 3,3 раза (р < 0,05), порівняно з групою контролю. Також спостерігалось значне підвищення анаеробного індексу в пацієнтів із ХЗЗК. Мікробіологічне дослідження калу показало значне зниження Lactobacillus, що спостерігалось у всіх хворих на ХЗЗК, а також зниження Bifidobacterium у 19,7 % хворих на НВК та у 37,5 % хворих на ХК. У меншому ступені спостерігалось зниження інших представників нормальної мікрофлори: Enterococcus (у 15,2 % у групі НВК та у 25 % у групі ХК) та Escherichia coli (у 15,2 % у групі НВК та 12,5 % у групі ХК). Також було виявлене надмірне зростання умовно-патогенної флори: Hemolytic Escherichia coli була підвищена в 19,7 % хворих із НВК та 12,5 % хворих на ХК; Proteus виявлений у 12,1 % хворих на НВК та 37,5 % хворих на ХК. Підвищений вміст дріжджоподібних грибів роду Candida спостерігався в 43,9 % хворих на НВК та 87,5 % хворих на ХК. Висновки. Кількісні та якісні відхилення мікробіоти кишечника, такі як зменшення кількості основних симбіонтів та збільшення кількості умовно-патогенної мікрофлори, спостерігались у всіх досліджених хворих із ХЗЗК. Отримані результати показали, що зміни концентрацій КЖК при обох нозологіях ХЗЗК суттєво відрізнялись від показників групи контролю, що в поєднанні з іншими патогенетичними факторами може призводити до погіршення перебігу та прогнозу ХЗЗК. Оцінка співвідношення фракцій КЖК із розрахунком анаеробного індексу може бути корисною для діагностики дисбактеріозу кишечника у хворих із ХЗЗК.
Background. The pathogenesis of chronic inflammatory bowel disease (IBD) is still not fully clarified. It is known that disorders of the intestinal microbiota lead to an increased intestinal permeability, activation of mucous and adaptive immunity, impaired production and intestinal absorption of short-chain fatty acids (SCFA). The ratio of acetic, propionic, butyric acids is an important indicator of the integrity of the intestinal microbial community. Thus, the study of the composition of the intestinal microbiota and the concentrations of fecal SCFA is a very promising approach to broadening the understanding of IBD pathogenesis. The purpose of our study was to determine the features of the production of fecal SCFA and the composition of colon microbiota in patients with IBD. Materials and methods. The study, which was carried out at the Department of Intestinal Diseases of the Institute of Gastroenterology of the National Academy of Medical Sciences of Ukraine, involved 74 patients with IBD with an average age of (43.2 ± 1.8) years, who according to nosology were divided into 2 groups: group I — those with ulcerative colitis (UC) (n = 66), group II — individuals with Crohn’s disease (CD) (n = 8). The diagnoses of CD and UC were established according to generally accepted diagnostic standards in gastroenterology. Determination of fecal SCFA was carried out by chromatographic method with the use of hardware-software complex for medical researches on the basis of the gas chromatographer Chromateс Crystal 5000. The intestinal microflora was evaluated using a microbiological study of the colon content. Results. Patients with IBD had significant changes in the spectrum of SCFA, which were similar in both UC and CD: a decrease in acetic acid in the UC group by 5.7 times, in the CD group by 10.5 times (p < 0.05), butyric acid in the UC group by 1.6 times, in the CD group by 1.5 times (p < 0.05), and an increase in propionic acid in the UC group by 4 times and in the CD group by 3.3 times (p < 0.05) compared with the control group. There was also a significant increase in the anaerobic index in patients with IBD. Microbiological study of feces showed a significant decrease in Lactobacillus, which was observed in all patients with IBD, as well as a decrease in Bifidobacterium in 19.7 % of those with UC and in 37.5 % with CD. There was a decrease of other representatives of the normal microflora: Enterococci (in 15.2 % in the UC group and 25 % in the CD group) and Escherichia coli (in 15.2 % in the UC group and 12.5 % in the CD group). Excessive growth of opportunistic flora was also detected: hemolytic Escherichia coli was increased in 19.7 % of patients with UC and in 12.5 % of those with CD; Proteus was detected in 12.1 % of people with UC and in 37.5 % with CD. The excessive growth of Candida was found in 43.9 % of patients in the UC group and in 87.5 % of individuals with CD. Conclusions. Quantitative and qualitative deviations of the intestinal microbiota, such as a decrease in the number of major symbionts and an increase in the number of opportunistic pathogens, were observed in all examined patients with IBD. The obtained results showed that changes in SCFA concentrations in both nosologies of IBD differed significantly from those in the control group, which in combination with primary genetic defects of the barrier function of the epithelium and its regenerative ability can lead to deterioration in the course and prognosis of IBD. Evaluation of the ratio of SCFA fractions with the calculation of the anaerobic index may be useful for the diagnosis of intestinal dysbiosis in patients with IBD.
коротколанцюгові жирні кислоти; мікробіота товстої кишки; неспецифічний виразковий коліт; хвороба Крона
short-chain fatty acids; colon microbiota; ulcerative colitis; Crohn’s disease
Вступ
Матеріали та методи
Результати та їх обговорення
Висновки
- Maaser C., Sturm A., Vavricka S.R. et al. Guideline for Diagnostic Assessment in IBD. Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. J. Crohns Colitis. 2019. Vol. 13. № 2. P. 144-164.
- Dmochowska N., Wardill H.R., Hughes P.A. Advances in Imaging Specific Mediators of Inflammatory Bowel Disease. Int. J. Mol. Sci. 2018. Vol. 19. № 9. P. 2471. doi: 10.3390/ijms19092471.
- Su H.J., Chiu Y.T., Chiu C.T. et al. Inflammatory bowel disease and its treatment in 2018: Global and Taiwanese status updates. J. Formos Med. Assoc. 2019. Vol. 118. № 7. P. 1083-1092.
- Foster A., Jacobson K. Changing incidence of inflammatory bowel disease: Environmental influences and lessons learnt from the South Asian population. Front. Pediatr. 2013. Vol. 34. № 1. P. 1-7. doi: 10.3389/fped.2013.00034.
- De Souza H.S., Fiocchi C. Immunopathogenesis of IBD: Current state of the art. Nat. Rev. Gastroenterol. Hepatol. 2016. № 13. P. 13-27. doi: 10.1038/nrgastro.2015.186.
- Rosen C.E., Palm N.W. Navigating the Microbiota Seas: Triangulation Finds a Way Forward. Cell. Host Microbe. 2018. № 23. P. 1-3. doi: 10.1016/j.chom.2017.12.015.
- Tlaskalová-Hogenová H., Štěpánková R., Kozáková H. et al. The role of gut microbiota (commensal bacteria) and the mucosal barrier in the pathogenesis of inflammatory and autoimmune diseases and cancer: Contribution of germ-free and gnotobiotic animal models of human diseases. Cell. Mol. Immunol. 2011. № 8. P. 110-120. doi: 10.1038/cmi.2010.67.
- Hoffmann C., Dollive S., Grunberg S. et al. Archaea and fungi of the human gut microbiome: Correlations with diet and bacterial residents. PLoS ONE. 2013. № 8. P. 1-12. doi: 10.1371/journal.pone.0066019.
- Clemente J.C., Ursell L.K., Parfrey L.W., Knight R. The impact of the gut microbiota on human health: An integrative view. Cell. 2012. Vol. 148. P. 1258-1270. doi: 10.1016/j.cell.2012.01.035.
- Shreiner A.B., Kao J.Y., Young V.B. The gut microbiome in health and in disease. Curr. Opin. Gastroenterol. 2015. № 31. P. 69-75. doi: 10.1097/MOG.0000000000000139.
- Wu W., Chen F., Liu Z., Cong Y. Microbiota-specific Th17 cells: Yin and Yang in regulation of inflammatory bowel disease. Inflamm. Bowel Dis. 2016. Vol. 22. P. 1473-1482. doi: 10.1097/MIB.0000000000000775.
- Bäumler A.J., Sperandio V. Interactions between the microbiota and pathogenic bacteria in the gut. Nature. 2016. № 535. P. 85-93. doi: 10.1038/nature18849.
- Bures J., Cyrany J., Kohoutova D. et al Small intestinal bacterial overgrowth syndrome. World J. Gastroenterol. 2010. Vol. 16. № 24. P. 2978-2990. doi: 10.3748/wjg.v16.i24.2978.
- Степанов Ю.М., Федорова Н.С. Ефективність рифаксиміну у корекції синдрому надлишкового бактеріального росту при хронічних запальних та функціональних захворюваннях кишечника. Гастроентерологія. 2019. Т. 54. № 1. С. 49-54. doi: 10.22141/2308-2097.53.4.2019.182740.
- Gijs den Besten, Karen van Eunen, Albert K. Groen, Koen Venema, Dirk-Jan Reijngoud, Barbara M. Bakker. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism. J. Lipid Res. 2013. Vol. 54. № 9. P. 2325-40. doi: 10.1194/jlr.R036012.
- Haenen D., Zhang J., Souza da Silva C. et al. Hooiveld GJA diet high in resistant starch modulates microbiota composition, SCFA concentrations, and gene expression in pig intestine. J. Nutr. 2013. Vol. 143. № 3. P. 274-83.
- Sun M., Wu W., Liu Z., Cong Y. Microbiota metabolite short chain fatty acids, GPCR, and inflammatory bowel diseases. Journal of Gastroenterology. 2016. Vol. 52. № 1. P. 1-8. doi: 10.1007/s00535-016-1242-9.
- Tan J., McKenzie C., Potamitis M., Thorburn A.N., Mackay C.R., Macia L. The Role of Short-Chain Fatty Acids in Health and Disease. Advances in Immunology. 2014. Vol. 121. P. 91-119. doi: 10.1016/b978-0-12-800100-4.00003-9.
- Vinolo M.A., Rodrigues H.G., Nachbar R.T., Curi R. Regulation of inflammation by Short Chain Fatty Acids. Nutrients. 2011. Vol. 3. P. 858-876. doi: 10.3390/nu3100858.
- Guohua Zhao. Rapid determination of shot-chain fatty acids in colonic contens and faeces of humans and rats by acidified water-extraction and direct injection gas chromatography. Biomedical chromatography. 2006. Vol. 20. № 8. P. 675-682.
- Alyoshkin V.A., Selkova E.P., Zatevalov A.M., Mironov A.Yu., Volchetsky A.L., Gudova N.V. Determination of dysbiotic changes in the gastrointestinal tract by markers of intestinal contents — Federal clinical guidelines. N. Novgorod: Publishing House Remediium Volga Region, 2016. 40 p.
- Головенко О.В., Халиф И.Л., Головенко А.О. Роль масляной кислоты в лечении органических и функциональных заболеваний толстой кишки. Сучасна гастроентерологія. 2011. № 4(60). С. 124-134.
- Per G. Farup, Knut Rudi, Knut Hestad. Faecal short-chain fatty acids — a diagnostic biomarker for irritable bowel syndrome? BMC Gastroenterology. 2016. Vol. 16. 51 p.

/49.jpg)
/50.jpg)
/50_2.jpg)