Газета «Новости медицины и фармации» №7 (761), 2021
Вернуться к номеру
Особливості інтенсивної терапії у хворих на діабетичний кетоацидоз у період пандемії COVID-19
Авторы: Галушко О.А.(1), Кучинська І.А.(1, 2), Бабак С.І.(3), Юрків В.В.(3), Антонюк Л.В.(2), Кушнір М.В.(2)
(1) — Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) — Універсальна клініка «Оберіг», м. Київ, Україна
(3) — КНП КОР «Київська обласна клінічна лікарня», м. Київ, Україна
Рубрики: Семейная медицина/Терапия
Разделы: Справочник специалиста
Версия для печати
Вступ
Діабетичний кетоацидоз (ДКА) — стан вираженої декомпенсації цукрового діабету (ЦД), обумовлений абсолютним дефіцитом інсуліну, підвищенням рівня контрінсулярних гормонів, різким зниженням утилізації глюкози тканинами, активацією ліполізу та кетогенезу. ДКА характеризується класичною тріадою: гіперглікемія (або наявний діагноз діабету), метаболічний ацидоз та кетонемія [1]. Незважаючи на удосконалення методів лікування, рівень летальності пацієнтів із ДКА залишається все ще високим (до 5 %), особливо в пацієнтів із тяжкими коморбідними станами та у хворих похилого віку [2].
Патогенетичні механізми
Внаслідок дії стресу, інфекції, недостатнього введення інсуліну відбувається різке збільшення концентрації глюкагону в крові (гормона — антагоніста інсуліну). Унаслідок цього різко посилюються процеси, що стимулюються глюкагоном: глікогеноліз та ліполіз. У результаті збільшується продукція глюкози. У той же час утилізація глюкози печінкою, м’язами та жировою тканиною за відсутності інсуліну різко знижується. Наслідком цих процесів стає виражена гіперглікемія.
Посилення розпаду ліпідів (ліполіз) призводить до різкого підвищення концентрації вільних жирних кислот (ВЖК) у крові, які починають включатися в кетогенез [3]. При інсуліновій недостатності 80 % енергії організм отримує шляхом окиснення жирних кислот, що призводить до накопичення побічних продуктів їх розпаду — кетонових тіл (ацетон, ацетооцтова та β-оксимасляна кислоти). Порушується кислотно-лужна рівно–вага — виникає метаболічний ацидоз (кето–ацидоз).
Як гіперглікемія, так і висока циркулююча концентрація кетонових тіл призводять до осмотичного діурезу, що призводить до гіповолемії та подальшого зниження швидкості клубочкової фільтрації. Осмотичний діурез призводить до небезпечної для життя дегідратації [4]. На цьому фоні у хворих часто розвивається гіпокаліємія — один із важливих компонентів метаболічних порушень при діабетичному кетоацидозі.
Особливості виникнення кетоацидозу при COVID-19
У попередніх публікаціях ми вже обговорювали причини виникнення ДКА і більш тяжкий його перебіг у разі розвитку у хворого COVID-19 [5, 6]. Нагадаємо основні фактори, що, на нашу думку, погіршують перебіг інфекційного захворювання у хворих на ЦД:
1. Особливості власне ЦД, взаємний вплив ЦД на COVID-19 і навпаки (пригнічення противірусної імунної відповіді, особливості вегетативної іннервації у хворих на ЦД, порушення функції підшлункової залози на фоні інфекції тощо).
2. Вплив окремих груп препаратів, що застосовують при лікуванні обох захворювань (інгібітори ангіотензинперетворю–ючого ферменту, глюкокортикостероїди, гідроксихлорохін та хлорохін, метформін, інгібітори SGLT-2 і багато інших).
3. Недоліки в організації лікування і догляду за пацієнтами (неправильна організація амбулаторного прийому, недостатнє і незбалансоване харчування, відсутність забезпеченості лікарськими засобами і діагностичним приладдям, недостатня комунікація з ендокринологом і сімейним лікарем, а в стаціонарі — відсутність вчасної консультації ендокринолога тощо) [6].
Усі ці фактори призводять до того, що наявний ДКА може ускладнювати перебіг COVID-19, погіршувати стан хворих та підвищувати летальність.
Клінічна картина
Пацієнти з ДКА можуть мати деякі або всі такі симптоми: поліурію, полідипсію, нудоту, блювання, біль у животі, порушення зору, млявість, зміни чутливості, гіпотензію, тахікардію, тахіпное та дихання Куссмауля [7].
Дегідратація є найбільш типовим і вираженим порушенням при ДКА. Шкіра суха, тургор її знижений. Спрага є найчастішою скаргою пацієнтів із кетоацидозом, що віддзеркалює внутрішньоклітинний дефіцит води. Значна дегідратація (понад 10 % маси тіла) може проявитись ознаками гіповолемії з можливою артеріальною гіпотензією.
Ацидоз обумовлює розвиток одного з класичних симптомів діабетичного кетоацидозу — дихання Куссмауля (прискорене і глибоке) як намагання організму компенсувати метаболічний ацидоз. З’являється запах гниючих яблук у повітрі, що видихає хворий. Цей запах дає ацетон, інші кетокислоти запаху не мають [4].
Частими проявами діабетичного кетоацидозу є: нудота, блювання і біль у животі. Прогресування ДКА супроводжується порушеннями психоемоційного статусу. Хворий стає апатичним, сонливим. –Однак повна втрата свідомості спостерігається нечасто — менше ніж у 10 % випадків.
Рівень глікемії при ДКА може мати варіації від помірного підвищення до значної гіперглікемії. Підвищення глікемії понад 30 ммоль/л зазвичай асоціюють із тяжким перебігом ДКА.
При ЦД існує декілька причин порушень водно-електролітного балансу. Основні з них такі: осмотичний діурез із втратою води та електролітів (Na, K, Ca, Mg, Cl, PO4); використання сечо–гінних; лихоманка, пронос; нудота, блювання; нестача інсуліну (інсулін стимулює реабсорбцію води та натрію в проксимальних канальцях). Осмотичний діурез сприяє також втратам натрію, калію, кальцію, магнію, хлориду та фосфату, що додатково сприяє електролітним порушенням, пов’язаним із діабетичним кетоацидозом [7]. Втрата води може становити близько 10–15 % від маси тіла або 20–25 % від загальної кількості води в організмі, а загальний дефіцит води при ДКА може становити близько 100 мл на 1 кг маси тіла і досягати 6–7 літрів [8].
Зміни кислотно-лужного стану (КЛС) також можуть бути різного ступеня. Значення pH як інтегрального показника КЛС можуть коливатися від субнормальних до значень, менших за 7,0. Рівень бікарбонатів знижений, зазвичай розвивається суттєва гіпокапнія внаслідок респіраторної компенсації (дихання Куссмауля) метаболічного ацидозу.
Терапія діабетичного кетоацидозу
Терапія діабетичного кетоацидозу повинна бути патогенетично обґрунтованою й адекватною. Основні напрямки лікувальної тактики включають:
- регідратацію (інфузійну терапію);
- інсулінотерапію;
- парціальну корекцію метаболічного ацидозу тяжкого ступеня;
- компенсацію втрат калію;
- препарати антикетогенної дії (глюкоза з інсуліном, ксиліт);
- діагностику й усунення причин метаболічної кризи [9].
Інфузійна терапія
Введення рідини — це перша лінія лікування. Відповідне введення рідини не тільки відновлює внутрішньосудинний об’єм, але і знижує рівень глюкози в крові, підвищує артеріальний тиск, забезпечує перфузію периферичних тканин і полегшує купірування метаболічного ацидозу [10]. Для адекватної регідратаційної терапії та відновлення втрат електролітів і рідини потрібно дотримуватись таких правил інфузійної терапії:
- Розпочинається енергійно і в перші години проводиться у високому темпі. У хворих з артеріальною гіпотензією проведення інфузії для стабілізації гемодинаміки є головною метою перших годин лікування.
- Чинні європейські та американські рекомендації щодо лікування ДКА у дорослих рекомендують для початкової ресусцитації використовувати 0,9% розчин хлориду натрію [9, 10].
- 1000 мл 0,9% розчину NaCl вводять упродовж перших 30–60 хвилин.
- Після початкової години швидкість в/в рідини повинна бути відрегульована з урахуванням стану гемодинаміки й електроліту пацієнта і, як правило, підтримуватися між 250 і 500 мл/год у дорослих пацієнтів без серцевих чи ниркових порушень, запущених захворювань печінки або інших станів перевантаження рідиною [11].
- Коли нормалізується глюкоза при лікуванні, до програми інфузії слід додати глюкозу, щоб продовжувати тривалу інфузію інсуліну зі швидкістю, достатньою для усунення кетонемії, але уникаючи при цьому гіпоглікемії. У настановах Великобританії рекомендують додавати 10% розчин глюкози з моменту, коли рівень глікемії стає нижче 13,9 ммоль/л [9]. АDА рекомендує додавати 5% розчин глюкози, коли глікемія знижується нижче 11 ммоль/л [10].
Інфузійні препарати, що застосовуються для лікування декомпенсованого цукрового діабету, мають відповідати таким вимогам:
- поповнювати об’єм циркулюючої крові (для ліквідації гіповолемії);
- мати антикетогенні властивості;
- відновлювати водно-електролітний баланс;
- відновлювати кислотно-лужну рівновагу;
- покращувати мікроциркуляцію;
- забезпечувати дезінтоксикацію [12].
Останнім часом заслужений авторитет при лікуванні хворих на ДКА здобув вітчизняний препарат ксилат («Юрія-Фарм»), фармакологічні властивості якого відповідають більшості перелічених вимог. Завдяки своєму складу він належить до багатокомпонентних гіпер–осмолярних розчинів і, таким чином, сприяє ре–гідратації організму при декомпенсації ЦД. Зменшуючи рівень кетонемії, ксиліт сприяє корекції ацидозу та відновленню нормальних показників кислотно-лужного балансу.
Корекція метаболічного ацидозу
Слід пам’ятати, що діабетичний ацидоз розвивається через посилене надходження кетонових тіл внаслідок інсулінової недостатності. Тому етіологічним лікуванням даного виду ацидозу є замісна інсулінотерапія, що здебільшого допомагає його усунути [14].
Унаслідок можливої шкоди та відсутності стійких переваг вчені Великобританії не рекомендує використовувати бікарбонат будь-яким пацієнтам із діабетичним кетоацидозом [9]. З іншого боку, оскільки пацієнти з рН нижче 6,9 мають високий ризик поганого результату, керівництво ADA рекомендує повільне введення 100 ммоль (100 мЕкв) NaHCO3 протягом двох годин у випадках, коли рН нижче 6,9 [10].
Інсулінотерапія
Інсулінотерапія розпочинається одразу ж після встановлення факту наявності у хворого гіперглікемії й ознак декомпенсації ЦД. Використовується інсулін короткої дії.
При визначенні режиму інсулінотерапії слід дотримуватись кількох рекомендацій:
- стартовий болюс: 0,15 Од/кг (близько 10 Од) внутрішньовенно;
- потім потрібно налагодити постійну інфузію з початковою швидкістю 4–5 Од/год (0,05–0,1 Од/кг/год). Якщо рівень глікемії за перші 3 години не знизився на 30 % від початкового рівня (по 10 % за годину), то стартову дозу збільшують удвічі. При зменшенні глікемії до 16,7 ммоль/л швидкість введення зменшують до 2–4 Од/год;
- по досягненні 14 ммоль/л у програму інфузійної терапії додають розчини 5% глюкози з адекватною кількістю інсуліну [4, 14].
Введення в організм глюкози з інсуліном підвищує внутрішньоклітинний рівень моноцукру та нормалізує гліколіз, що призводить до активізації утилізації ацетил-КоА в циклі трикарбонових кислот і зменшення утворення кетонових тіл.
Компенсація втрат калію
Компенсація втрат калію є важливим компонентом у лікуванні ДКА. Під час лікування внаслідок інтенсивного надходження/повернення калію у внутрішньоклітинний сектор швидко виникає гіпокаліємія, що часто стає реальною загрозою ускладнень (появи аритмій). Тому бажано починати компенсацію втрат калію ще при нормокаліємії, можливо, через 2 години лікування.
Слід ще додати, що ксилат є комплексним полііонним препаратом. Він містить основні катіони (Na+, K+, Ca2+, Mg2+) та аніони Cl– й CH3COO–. Концентрація іонів у названих розчинах близька до фізіологічної. Тому можна вважати, що переливання ксилату в одному терапевтичному комплексі з багатокомпонентними розчинами електролітів сприяє також корекції електролітних порушень у хворих на ДКА та відновленню електролітного балансу.
Власний досвід
Проведений аналіз даних клінічних, лабораторних й інструментальних методів дослідження в 36 пацієнтів із ДКА, які перебували на лікуванні у відділенні інтенсивної терапії НКП КОР «Київська обласна клінічна лікарня». Усі хворі отримували лікування згідно з протоколами Міністерства охорони здоров’я та міжнародними рекомендаціями з ведення хворих на ЦД. Основні напрямки лікувальної тактики в наших хворих включали: регідратацію, інсулінотерапію, корекцію метаболічного ацидозу тяжкого ступеня, компенсацію електролітних розладів, регулярний моніторинг і контроль ефективності лікування. Хворі, включені в дослідження, випадковим чином (методом «конвертів») були розподілені на три групи. Додатково до програми лікування хворі 1-ї групи (n = 12) отримували розчин ксилат по 200 мл двічі на добу після виявлення значної кетонурії («3+» або «4+» при проведенні нітропрусидного тесту), хворі 2-ї групи (n = 12) отримували розчин ксилат по 200 мл двічі на добу після виявлення перших ознак кетонурії («0» або «1+» при проведенні нітропрусидного тесту). Лікування ксилатом в обох групах проводили до значного покращення стану, повної ліквідації кетонурії та компенсації показників вуглеводного обміну. Хворі 3-ї групи (n = 12) отримували лише базову терапію без додавання ксилітвмісних препаратів. Були проаналізовані частота виявлення різних порушень вуглеводного обміну, електролітних порушень, особливості перебігу, піддатливість до терапії та необхідність оптимізації методів лікування.
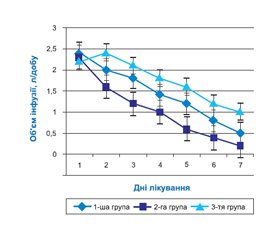
Основні характеристики та показники хворих за віком, індексом маси тіла, тривалістю ЦД та ступенем компенсації вуглеводного обміну на момент включення в дослідження в усіх групах були ідентичні і не мали статистичної різниці (p < 0,05). Для лікування хворих, які були включені в дослідження, використовувалися середні об’єми інфузійної терапії в усіх групах пацієнтів. Середній стартовий об’єм інфузії становив 30,0–32,5 мл/кг за добу. У подальшому в міру стабілізації стану, показників гемодинаміки та вуглеводного обміну об’єми інфузійної терапії поступово знижувалися. Динаміка об’ємів інфузійної терапії під час лікування наведена на рис. 1.
При аналізі рис. 1 видно, що у хворих усіх груп лікування спостерігалося поступове неухильне зниження об’ємів інфузій. Проте у хворих 3-ї групи (без ксилату) об’єми інфузійної терапії були значно вищими на всіх етапах лікування. І навпаки, раннє застосування ксилату (2-га група) призвело до зниження потреби у високих об’ємах інфузій вже на 2-гу — 3-тю добу терапії (p < 0,05).
У хворих усіх груп дослідження розчини натрію бікарбонату не використовували. Корекція метаболічного ацидозу в пацієнтів відбувалася природним шляхом на фоні проведення регідратації, застосування антикетогенних засобів та інсулінотерапії.
Моніторинг показників парціального тиску газів артеріальної крові та показників КЛС здійснювали в три етапи — на 1-шу, 3-тю та 5-ту добу лікування (відповідно 1, 2 та 3-й етапи). Динаміка показників кислотно-лужного стану на етапах дослідження відображена в табл. 1.
Аналіз табл. 1 дає підстави для таких висновків.
У хворих із ДКА 1-ї та 2-ї груп у перший день спостерігався більш тяжкий ацидоз, проте в подальшому він швидко компенсувався, і до 3-го етапу дослідження значення показників газів крові та КЛС наближалися до референтних. Цікаво, що у хворих, у яких при ДКА не застосовувався ксилат (3-тя група), протягом лікування спостерігалися нові епізоди зниження рН, і загалом перебіг кетоацидозу в цих пацієнтів можна характеризувати як хвилеподібний. При аналізі табл. 1 також видно, що найбільш інформативними показниками, які характеризували тяжкість кетоацидозу в цих пацієнтів, були рівні рН та ВЕ.
Результати лікування у всіх хворих груп дослідження були позитивними, у всіх пацієнтів була досягнута нормалізація показників вуглеводного обміну. Хворі задовільно перенесли запропоновану програму лікування. Побічних реакцій та ускладнень на введення препаратів ксилітолу (ксилату) не спостерігалося.
Досвід лікування кетоацидозу у хворих на COVID-19
Ми маємо досвід лікування 14 пацієнтів (3,55 % від загальної кількості (n = 394) пролікованих пацієнтів), які перебували у відділенні COVID-1 Універсальної клініки «Оберіг», у яких під час стаціонарного лікування розвинулися ознаки ДКА.
Серед 14 хворих були 6 жінок та 8 чоловіків, середній вік хворих жіночої статі — 70,1 року (52–91), пацієнтів чоловічої статі — 53,5 року (52–71), ЦД 1-го типу був у 4 пацієнтів, ЦД 2-го типу — у 10 пацієнтів. Середня тривалість ЦД становила 6,4 року, у 2 хворих ЦД був виявлений вперше під час стаціонарного лікування.
Більшість пацієнтів, які надійшли на лікування на 4–5-ту добу захворювання, отримували таблетовані форми цукро–знижуючих препаратів на догоспітальному етапі та під час лікування при перевищенні рівня глікемії 10,5 ммоль/л переводилися на парентеральне введення інсуліну короткої дії (внутрішньовенне чи підшкірне, залежно від величини глікемії в динаміці). Усім пацієнтами проводилися моніторинг глікемії кожні 4–6 годин, а за потреби — і частіше, а також кетонемії (за допомогою системи моніторингу кетонів крові Taidoc TD-4183), показників КЛС, виявлення кетонурії, маркерів вираженості запальної відповіді, лактату.
Слід зазначити, що прояви ДКА в більшості пацієнтів із коронавірусною хворобою з’являлися на 7-му — 10-ту добу від моменту виникнення перших проявів захворювання внаслідок характерного для коронавірусної хвороби етапного перебігу. За патогенезом перебігу захворювання 7-ма — 10-та доба є пізньою фазою захворювання і характеризується розвитком синдрому гіперзапальної відповіді (різке зростання прозапальних маркерів), а також появою тяжких респіраторних розладів чи погіршенням вже наявних до цього часу дихальних порушень.
Цікавим є той факт, що в жодного пролікованого пацієнта з ДКА не спостерігалося зростання рівня рСО2, тобто на фоні часткового протезування респіраторної функції у вигляді або кисневої терапії, або СРАР-терапії (CPAP — continuous positive airway pressure), або у вигляді NIV (non-invasive ventilation) метаболічний ацидоз частково компенсувався респіраторною функцією. Крім того, прогресування респіраторної дисфункції, згідно з українськими, європейськими та американськими протоколами, вимагало від клініцистів збільшення дозування стероїдів, що, з одного боку, справляло задовільний вплив на покращення вентиляційних параметрів пацієнта, покращення респіраторної функції, зниження прояву системної запальної відповіді, з іншого — значний негативний вплив на прояви ДКА зі зростанням гіперглікемії до 18–26 ммоль/л та ускладненням можливості компенсації вираженої гіперглікемії.
У табл. 2 наведені основні дані з прив’язкою до добових (10, 14 та 20-та години) коливань гіперглікемії та маніфестації ДКА в пацієнтів із коронавірусною хворобою, а також вказані показники прозапальних маркерів, що діагностувалися в пацієнтів на початку пізньої фази захворювання. Також слід відмітити, що для моніторингу кислотно-лужного складу крові здебільшого використовувалися венозні зразки, оскільки часті пункції артеріальних судин викликають виражений дискомфорт у пацієнтів, окрім того, 100 % пацієнтів із тяжким перебігом коронавірусної хвороби отримують лікувальні дози антикоагулянтів, що підвищує ризик виникнення постпункційних гематом, кровотеч у місці пункцій і, як наслідок, інфекційних ускладнень.
Які особливості були виявлені нами при лікуванні ДКА у хворих на COVID?
По-перше, ДКА розвивався на фоні менш високих рівнів глікемії (у хворих на COVID за наявності розгорнутої картини ДКА рівень глікемії був 12–16 ммоль/л, тоді як у хворих без інфекції — 20–22 ммоль/л, p < 0,05). Це може бути пояснено порушенням звичного режиму харчування і розвитком елементів «кетоацидозу голодування» у хворих на фоні COVID-19. У таких пацієнтів у зв’язку з технічними особливостями (постійне використання лицевої маски і швидка десатурація при втраті позитивного тиску в кінці видиху), неможливістю повноцінного прийому твердої їжі використовували сипінг (Sip feeding) — споживання необхідної кількості суміші протягом доби маленькими ковтками.
По-друге, усі хворі на ДКА попередньо отримували терапію глюкокортикостероїдами (дексаметазон у середній добовій дозі 14 мг або солу-медрол у середній добовій дозі 65 мг залежно від тяжкості стану пацієнтів), що додатково підтверджує антиінсулінову і катаболічну роль глюкокортикостероїдів.
По-третє, у всіх хворих на ДКА рівень осмолярності крові перевищував 310 мосмоль/л, що свідчить про наявність комбінованої декомпенсації вуглеводного обміну — кетоацидозу та гіперосмолярного стану. Таке поєднання вимагало більш активної тактики волемічної підтримки і ретельної організації режиму харчування і пиття в пацієнтів.
Результати лікування у всіх пацієнтів були позитивними: у всіх пацієнтів з епізодами ДКА була досягнута нормалізація показників вуглеводного обміну. Проте тривалість перебування в лікарняному закладі пацієнтів з епізодами ДКА була подовженою на 4,1 доби порівняно з іншими пацієнтами без декомпенсації перебігу цукрового діабету. Також усі пацієнти були одночасно консультовані ендокринологом, і тактика лікування їх увесь час контролювалася мультидисциплінарною командою (анестезіолог, ендокринолог, терапевт, інфекціоніст).
Висновки
1. У комплексі адекватної, патогенетично обґрунтованої інтенсивної терапії діабетичного кетоацидозу важливе місце посідають раціональна інфузійна терапія і застосування розчинів антикетогенної дії, створених на основі ксилітолу. Застосування розчину ксилітолу дозволяє розірвати замкнене коло взаємного обтяження та позитивно впливати на різні ланки патологічного процесу — від усунення дегідратації до корекції порушень кислотно-лужного стану.
2. У хворих на COVID-19 розвиток кетоацидозу характеризується такими особливостями:
- ДКА розвивався на фоні менш високих рівнів глікемії, ніж у хворих без інфекції;
- усі хворі на ДКА попередньо отримували терапію глюкокортикостероїдами;
- у хворих часто наявна комбінована декомпенсація вуглеводного обміну — кетоацидоз та гіперосмолярний стан.
3. Зазначені особливості розвитку ДКА у хворих на COVID-19 вимагають застосування більш активної стратегії волемічної підтримки, ретельної організації режиму харчування і пиття в пацієнтів та зваженої тактики гормонотерапії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
Список літератури знаходиться в редакції

/9_m2.jpg)
/9_m.jpg)
/9_m3.jpg)