Журнал «Медицина неотложных состояний» Том 17, №4, 2021
Вернуться к номеру
Ефективність комбінації реґіонарних методів знеболювання із загальною анестезією при трансплантації рогівки
Авторы: Минка Н.В.(1, 2), Кобеляцький Ю.Ю.(2)
(1) — КП «Дніпропетровська обласна клінічна офтальмологічна лікарня», м. Дніпро, Україна
(2) — Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
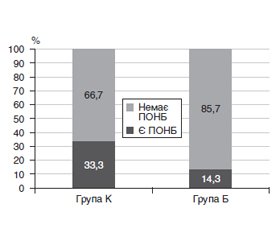
Актуальність. Незважаючи на значний розвиток сучасної анестезіології, знеболювання хірургічних пацієнтів продовжує залишатись незадовільним. Недостатнє лікування болю викликає психологічний дискомфорт та призводить до виникнення ускладнень. Наблизитись до вирішення проблеми болю дозволяє доповнення загальної анестезії різними варіантами місцевого знеболювання. Метою дослідження було порівняти вплив багатокомпонентної збалансованої анестезії (внутрішньовенна + інгаляційна) та багатокомпонентної збалансованої анестезії, доповненої блокадою крило-піднебінної ямки, на безпеку й ефективність знеболювання трансплантації рогівки. Матеріали та методи. У дослідження були включені 73 пацієнти, розподілені на дві групи. У групі К використовували багатокомпонентну збалансовану анестезію, у групі Б додатково застосовували блокаду крило-піднебінної ямки. Основними критеріями оцінки результатів дослідження були прийняті: стабільність гемодинаміки та газообміну під час оперативного втручання, вираженість інтраопераційного больового синдрому шляхом реєстрації індексу ANI, вираженість післяопераційного больового синдрому і частота розвитку післяопераційної нудоти і блювання. Результати. Обидві схеми анестезіологічного забезпечення дозволяли уникнути виражених коливань показників гемодинаміки і газообміну на всіх етапах дослідження. Аналізуючи вираженість інтраопераційного болю, ми встановили, що в групі К знеболювання може вважатися недостатнім протягом перших 7 хвилин найбільш травматичного етапу операції, тоді як у групі Б показники індексу ANI не опускалися нижче 50. Статистично значимі відмінності отримані протягом 8 з 10 хвилин етапу. При аналізі якості знеболювання в післяопераційному періоді було встановлено, що рівень болю за візуальною аналоговою шкалою після пробудження в обох групах дорівнював 0, на наступних трьох етапах дослідження (через 2 години, 6 годин після операції і на ранок наступного дня) рівень болю в групі К був вірогідно вище, ніж у групі Б. Висновки. Доповнення багатокомпонентної загальної анестезії реґіонарною блокадою дозволяє адекватно контролювати післяопераційний біль без погіршення профілю безпеки.
Background. Despite the significant development of modern anesthesiology, the pain relief of surgical patients is still unsatisfactory. Inadequate pain management causes psychological discomfort and complications. The combination of general anesthesia with various options for local anesthesia allows one to get closer to solving the problem of pain. The aim of the study was to compare the effect of multicomponent balanced anesthesia (intravenous + inhalation) and multicomponent balanced anesthesia, supplemented by pterygopalatine fossa blockade on the safety and efficacy of anesthesia for corneal transplantation. Materials and methods. The study included 73 patients, divided into two groups. Group С received multicomponent balanced anesthesia, group B — pterygopalatine fossa blockade additionally. The main criteria for evaluating the results of the study were: stability of hemodynamics and gas exchange during surgery, the severity of intraoperative pain syndrome by recording the analgesia nociception index, the severity of postoperative pain syndrome and the incidence of postoperative nausea and vomiting. Results. Both schemes of anesthetic management made it possible to avoid pronounced fluctuations in hemodynamic and gas exchange parameters at all stages of the study. Analyzing the severity of intraoperative pain, we found that in group С, pain relief could be considered insufficient during the first 7 minutes of the most traumatic stage of the operation, while in group B the analgesia nociception index did not decrease below 50. Statistically significant differences were obtained during 8 out of 10 minutes of the stage. Analysis of the pain relief quality in the postoperative period has shown that the level of pain according to the visual analogue scale upon awakening was equal to 0 in both groups, at the next three stages of the study (two and six hours after surgery and on the morning of the next day) the level pain in group C was significantly higher than in group B. Conclusions. The addition of regional blockade to multicomponent general anesthesia allows for adequate control of postoperative pain without compromising the safety profile.
післяопераційний біль; оцінювання болю; схеми знеболювання; офтальмохірургія
postoperative pain; assessment of pain; scheme of anesthesia; ophthalmic surgery
Вступ
Матеріали та методи
Результати та їх обговорення
/81.jpg)
/82_2.jpg)
Висновки
- Oderda G. Challenges in the Management of Acute Postsurgical Pain. Pharmacotherapy. 2012. Vol. 32(9). P. 1-5.
- Gerbershagen H.J., Aduckathil S., Van Wijck A.J. M. et al. Pain Intensity on the First Day after Surgery. A prospective cohort study comparing 179 surgical procedures. Anesthesiology. 2013. Vol. 118(4). P. 934-944.
- Овечкин А.М. Клиническая патофизиология и анатомия острой боли. Регионарная анестезия и лечение острой боли. 2012. Т. 6. С. 32-40.
- Connor D.J. Field hospital analgesia. J.R. Army Med. Corps. 2009. Vol. 155(1). Р. 49-56.
- Клигуненко Е.Н., Лященко О.В. Нестероидные противовоспалительные препараты в лечении послеоперационного болевого синдрома. Днепропетровск, 2010.
- Schaffer I. Postoperative pain as the fifth vital parameter. Med. Pregl. 2001. Vol. 54(5–6). P. 283-287. PMID: 11759227.
- Wu C., Raja S. Treatment of acute postoperative pain. Lancet. 2011. Vol. 377(9784). P. 2215-2225. DOI: 10.1016/S0140-6736(11)60245-6.
- Антомонов М.Ю. Математическая обработка и анализ медико-биологических данных. К.: Мединформ, 2018. 579 с.

/81_2.jpg)
/82.jpg)