Поширеність та клінічні особливості перебігу генералізованих захворювань пародонта при кардіоваскулярній патології
Згідно з даними вітчизняних та закордонних учених, вивчення етіології та патогенезу захворювань пародонта є однією з найактуальніших проблем у сучасній стоматології через високу поширеність захворювань, тяжкий перебіг, подальше формування хронічного одонтогенного вогнища інфекції, несприятливий вплив на організм людини в цілому та недостатню ефективність існуючих методів терапії [1].
За даними епідеміологічних досліджень, на захворювання пародонта у світі страждає більше 95 % населення віком понад 45 років, а серед осіб віком до 44 років поширеність захворювань пародонта становить понад 75 %, що свідчить не лише про високі рівні захворюваності, а й про значне зниження віку пацієнтів, які страждають на цю патологію [2]. Фахівці відмічають, що лише 12 % населення має здоровий пародонт, у 53 % наявні початкові запальні зміни, у 23 % — початкові дистрофічно-запальні зміни та у 12 % є ураження більш тяжкого ступеня, при цьому наявність запального й дистрофічно-запального процесів у тканинах пародонта в наш час дуже часто (в 38 і 23 % відповідно) виявляють в осіб 25–34 років [3, 4]. У структурі захворювань пародонта 90 % випадків становлять запальне та дистрофічно-запальне захворювання — гінгівіт і пародонтит. Генералізований пародонтит (ГП) є одним із найбільш поширених серед захворювань порожнини рота [5].
R.C. Page та J.D. Beck (1997) виділили низку чинників ризику розвитку і прогресування захворювань пародонта: цукровий діабет, паління, низька індивідуальна гігієна і специфічна мікрофлора порожнини рота, стреси, расові й гендерні особливості [6]. Сучасні знання дозволили розширити цей список. Багатьма дослідниками доведено існування взаємозв’язку запальних та дистрофічно-запальних захворювань тканин пародонта з соматичною патологією: кардіоваскулярними захворюваннями, атеросклерозом, ендокринними захворюваннями, патологією шлунково-кишкового тракту і дихальних шляхів, опорно-рухової та сечовивідної систем, з наявністю генетичної схильності, при цьому ступінь ураження пародонта тим більший, чим тяжчим і тривалішим є перебіг соматичної патології [7–9].
Отже, захворювання пародонта має до 98 % населення України, при цьому більше ніж у половини обстежених (57 %) виявляють супутні захворювання [10]. Поширеність хронічного генералізованого гінгівіту і пародонтиту серед гастроентерологічних пацієнтів у середньому становить 7,4 і 90,1 % відповідно, серед пульмонологічних хворих — 7,8 і 88,2 % відповідно, серед обстежених із кардіологічною патологією — 5,9 і 90,8 % відповідно при показниках 11,2 і 85,8 % серед соматично необтяжених пацієнтів [11]. При цьому найбільш чутливою є серцево-судинна система [12–15].
Так, S.S. Oberoi та співавт. (2016) обстежили 660 пацієнтів із кардіоваскулярною патологією (КВП) (n = 220), респіраторним захворюванням (n = 220) та цукровим діабетом (n = 220) [16]. Стан пародонта пацієнтів оцінювали за показником індексу потреби в лікуванні (CPITN, де 0 балів — лікування не потрібне, 1 бал — навчання індивідуальної гігієни порожнини рота і контроль за гігієнічним станом, 2–3 бали — професійна гігієна порожнини рота й навчання індивідуальної гігієни порожнини рота, 4 бали — потрібне комплексне лікування захворювань пародонта). Критерії оцінки CPITN 1, 2 та 3 виявлялися частіше серед пацієнтів із респіраторним захворюванням (100; 97,73 та 54,8 %), цукровим діабетом (100; 100 та 46,4 %), а також КВП (100; 97,73 та 38,1 %). Авторами зроблений висновок, що цукровий діабет, КВП та респіраторні захворювання пов’язані з більшою тяжкістю захворювань пародонта порівняно з контролем (n = 340) [16].
A.C. Goulart та співавт. (2017) обстежили 539 осіб молодого й середнього віку, серед яких 82 % були старші за 45 років. При цьому захворювання пародонта виявили в 63,2 % пацієнтів. Особи із захворюванням пародонта були старшого віку, частіше страждали на ожиріння. Серед пацієнтів із діабетом без захворювань пародонта було 5,1 % осіб [17]. Як підкреслюють C.H. Peng та співавт. (2017), цукровий діабет, особливо в пацієнтів із тяжким пародонтитом, підвищує ризик смертності від КВП, а стоматологічне лікування знижує частоту серцево-судинних ускладнень, особливо інфаркту міокарда та серцевої недостатності, що сприятливо впливає на здоров’я і якість життя пацієнтів [18].
Аналіз даних, отриманих нами при обстеженні 348 пацієнтів, проведений із метою виявлення захворюваності тканин пародонта в різних вікових групах населення м. Києва, показав, що в пацієнтів у віці до 49 років найбільш часто були діагностовані різні форми гінгівіту — 36,3–51,65 % (у 93 % — хронічний катаральний гінгівіт, 7 % — гіпертрофічний гінгівіт) і ГП І–ІІ ступеня — у 48,35–59,42 % обстежених. Серед пацієнтів старшого віку (50–69 років) був діагностований ГП (90,7–93,2 %), в основному І–ІІ ступеня (43,41–50,84 %) і ІІ–ІІІ ступеня тяжкості (35,66–40,68 %). Найбільш тяжкий перебіг ГП спостерігався у хворих, що палять (22,48 % жінок, 42,86 % чоловіків), при цьому тяжкість його перебігу була прямо пов’язана зі стажем тютюнопаління (χ2 = 4,4, р < 0,05); у 44,5 % хворих із гіподинамією (χ2 = 4,2, р < 0,05); у 43,2 % хворих із нераціональним харчуванням (χ2 = 3,9, р < 0,05); у 58,2 % хворих, які знаходилися довгий час у стані стресу (χ2 = 11,2, р < 0,05).
Установлено, що більша частка (77,87 %) обстежених із захворюваннями тканин пародонта мала супутню соматичну патологію з превалюванням кардіоваскулярної патології (56,03 %). За нашими даними, ГП був домінуючим захворюванням у хворих віком 50–69 років та становив 93,2 %, при цьому 56,03 % обстежених мали супутню КВП.
Серед стаціонарних хворих із КВП поширеність генералізованих захворювань пародонта сягала 91,2 % та найчастіше була асоційована з гіпертонічною хворобою (ГХ) (100 % хворих) та ішемічною хворобою серця (ІХС) (84,95 % хворих). Діагноз ГП установлений у 96,77 % обстежених (ГП ІІ ступеня — 55,55 %, ГП ІІІ ступеня — 37,78 %), частіше діагностували ГП хронічного перебігу — 64,44 % хворих, пародонтоз — у 3,23 % обстежених.
Було встановлено, що серед обстежених хворих ІХС була виявлена у 79 осіб (84,95 %), із яких 17 осіб (18,28 %) в анамнезі перенесли інфаркт міокарда або гостре порушення мозкового кровообігу. Наявність серцевої недостатності (СН) діагностували у 45 хворих (48,39 %), при цьому СН І ступеня виявлена у 22 хворих (23,66 %), СН ІІ ступеня — у 23 хворих (24,73 %). Крім того, у 47 хворих (50,54 %) діагностована наявність дифузного кардіосклерозу, у 37 хворих (39,78 %) — дисліпідемії, у 23 хворих (24,73 %) — аритмії, у 18 хворих (19,35 %) діагностована нейроциркуляторна енцефалопатія. У 41 хворого (44,09 %) крім захворювань серцево-судинної системи були виявлені захворювання шлунково-кишкового тракту (хронічний ерозивний гастрит, хронічний панкреатит, хронічний холецистит).
Слід підкреслити, що нами були встановлені характерні ознаки ГП при КВП — це хронічний перебіг, виражений набряк та поява сильної кровоточивості ясен навіть при початковому ГП І ступеня, індекс кровоточивості (ІК) — 2,60 ± 0,07 бала з трьох можливих проти 1,50 ± 0,04 бала (р < 0,05) у хворих без КВП (табл. 1).
/14.jpg)
Аналіз отриманих даних клінічних спостережень дозволив встановити існування спільних для ГП та ГХ факторів ризику, що одночасно впливали на характер їх перебігу: вік (r = 0,28, р < 0,05 та r = 0,44, р < 0,001); гіподинамія (r = 0,24, р < 0,05 та r = 0,26, р < 0,05); стрес (r = 0,28, р < 0,05 та r = 0,27, р < 0,05); паління (r = 0,26, р < 0,05 та r = 0,24, р < 0,05 відповідно). Окрім цього, визначено, що на тяжкість ГП безпосередньо впливають фактори, пов’язані з прогресуванням КВП (збільшення тяжкості ГХ, r = 0,39, р < 0,001, наявність ІХС, r = 0,37, р < 0,001). При цьому слід зазначити, що виявлені кореляційні зв’язки між станом кардіоваскулярної системи і тяжкістю ГП мають більш високу вірогідність, ніж зв’язок із віком, тютюнопалінням та іншими факторами ризику в розвитку захворювань тканин пародонта, що є підтвердженням негативного впливу серцево-судинних захворювань на стан пародонта.
Наші дослідження показали, що, незважаючи на значну поширеність захворювань пародонта при КВП (63 % хворих), ці хворі систематично не відвідують лікарів-стоматологів із приводу стану тканин пародонта. Деякі (37 %) з обстежених пацієнтів не були проінформовані лікарями про те, що наявність кровоточивості ясен, зубного каменю може не тільки призводити до втрати зубів і порушення якості посмішки, але і вплинути на їх здоров’я та якість життя.
Нова концепція патогенезу генералізованого пародонтиту та його зв’язку з кардіоваскулярними захворюваннями, що супроводжуються розвитком ендотеліальної дисфункції
Кінець минулого і початок ХХІ століття пов’язані із значною еволюцією поглядів на патогенез та клінічні особливості захворювань пародонта [19, 20]. До робіт A. Hugoson та T. Jordan (1982) хронічні захворювання пародонта розглядалися як неминуче захворювання осіб віком понад 35 років [21]. Накопичення епідеміологічних і клінічних даних зумовило формування іншої гіпотези: у розвитку і прогресуванні захворювань пародонта істотну роль відіграють певні чинники ризику. Парадигма патогенетичного каскаду ураження тканин пародонта полягає у балансі між патогенними чинниками й початковим станом пародонта, що визначається резервними (у тому числі генетичними) можливостями організму [19, 20].
Проведені нами дослідження свідчать про значну роль автоімунних процесів у формуванні й прогресуванні хронічних генералізованих захворювань пародонта в пацієнтів із супутніми коморбідними станами, зокрема КВП. Отримані нами дані переконливо свідчать, що одним із важливих автоантигенів, що визначає форми системної запальної відповіді та прогресування локальної і системної ЕД при ГП і КВП, є білки теплового шоку (БТШ).
Білки теплового шоку (шаперони), як стрес-лімітуючі чинники, посилено синтезуються клітинами при будь-якій патології. Зокрема, встановлено, що їх уміст значно зростає при хронічному запаленні, ГХ, атеросклерозі, ІХС, інфаркті міокарда та інсультах [22, 23]. У цілому синтез БТШ є універсальною неспецифічною відповіддю клітини на стрес, і, за сучасними даними, немає такого виду клітинного стресу, при якому не відбувалося б синтезу БТШ. У деяких випадках уміст БТШ у клітинах може досягати 20 % усіх розчинних цитоплазматичних білків [24].
БТШ людини мають високий рівень гомогенності з БТШ мікроорганізмів. Однак утворення великих титрів автоантигенів на БТШ зазвичай у нормі не відбувається.
Установлено, що причинними мікроорганізмами у розвитку ендогенних інфекцій, що є основою багатьох хронічних захворювань, є представники не тільки патогенної, а й постійної мікрофлори, до яких у здоровому організмі формується регіональна, так звана оральна, толерантність (oral tolerance). Факт наявності оральної толерантності до постійної мікрофлори організму відомий давно, проте тільки в останні роки він набув наукового підтвердження завдяки відкриттю й усвідомленню ролі образрозпізнаючих рецепторів (ОРР) у виникненні оральної толерантності [25]. У сучасній імунології ОРР, які присутні у всіх клітинах організму, включаючи клітини епітелію й ендотелію, відводиться основна роль не тільки в ініціації та розвитку імунної відповіді, а й у підтримці мікробного біоценозу організму людини [26].
При будь-якому запальному процесі в клітинах тканин запального вогнища в організмі у великій кількості утворюються БТШ, які виявляються і в кровотоці. Проте не менш інтенсивне утворення БТШ спостерігається і в мікроорганізмах у відповідь на несприятливі впливи [27].
Існує гіпотеза, згідно з якою зрив місцевої толерантності й активація мікроорганізмів нормальної мікрофлори пов’язані з підвищеним утворенням в них БТШ, що обумовлене дією на мікроорганізми антибактеріальних речовин та інших стресових чинників [27, 28]. Дані, що підтверджують цю гіпотезу, отримані при вивченні таких стоматологічних захворювань, як ГП, стоматити, кандидоз, і зводяться до такого: дія різних стресових чинників, включаючи антимікробні препарати, вживані в стоматології, викликає активацію продукції БТШ в мікроорганізмах нормальної мікрофлори; БТШ мають потенційно високу імуногенність для організму як автоантигени; при даних патологіях у мікрофлорі ротової порожнини, у тканинах пародонта й сироватці крові виявлені підвищені рівні БТШ і антитіл до них; в експериментах на тваринах показано, що анти-БТШ вакцина гальмує розвиток захворювань пародонта [27, 28]. За висновками авторів, в основі зняття толерантності організму до мікроорганізмів його постійної мікрофлори і розвитку ендогенних запальних процесів, які, у свою чергу, стимулюють виникнення алергічних, автоімунних і системних захворювань, лежить багатократне збільшення на поверхні мікроорганізмів БТШ під впливом стресогенів. Перераховане вище передбачає принципово нові підходи до профілактики і лікування захворювань, що базуються на скороченні до розумного мінімуму прийому антибіотиків широкого спектра дії та інших засобів, що можуть бути причиною різкого підвищення продукції БТШ клітинами мікроорганизмів [27, 28].
Ґрунтуючись на отриманих даних, ми можемо припустити, що патогенні мікроорганізми пародонтальних кишень здатні продукувати БТШ (БТШ60), на які починає реагувати імунна система (вроджений імунітет).
У тому випадку, коли міра пошкодження перевищує міру захисту, тобто при великій кількості мікроорганізмів в ПК, коли система вродженого імунітету не може повністю самостійно захищати організм, відбувається сенсибілізація організму з формуванням антитіл проти прокаріотичних БТШ60, формуються комплекси антиген — антитіло (набутий імунітет). При цьому стресовані клітини тканин пародонта у відповідь на шкідливу дію мікрофлори також синтезують БТШ (БТШ60 людини), які за рахунок молекулярної мімікрії подібні до БТШ патогенних мікроорганізмів.
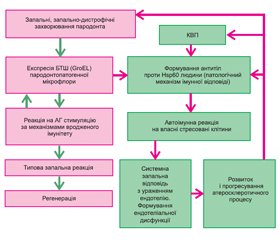
У результаті відбувається синтез антитіл проти БТШ60 людини, а власні стресовані клітини пародонта стають автоантигенами, що на молекулярному рівні пояснює хронічний перебіг патологічного процесу в тканинах пародонта (рис. 1).
/16.jpg)
Розроблена нами концепція патогенезу ГП при КВП базується на тому, що, оскільки в нормі імунна система реагує на виділення БТШ безпосередньо за механізмом вродженого імунітету, формування антитіл проти БТШ60 людини (автоантитіл) призводить до виникнення низки патологічних змін. Так, утворення автоантитіл призводить до каскаду імуномолекулярних реакцій, що завершуються підвищенням виділення медіаторів запалення та розвитком системної імунної відповіді. Зокрема, за нашими даними, у сироватці крові хворих із ГП відбувається зростання прозапальних цитокінів: ІL-6 — на 76 %, ІL-8 — на 27,4 %, ІL-1β — на 76 %, TNF-α — на 145,4 %, яке вірогідно (р < 0,05) корелює з вмістом антитіл проти БТШ (БТШ60) різної специфічності. Розвиток запального процесу є основою ураження ендотеліальних клітин, тому що будь-які стресовані клітини (зокрема, стресовані клітини ендотелію при ГХ, ІХС) починають експресувати БТШ (БТШ60) та стають мішенями для ураження автоантитілами. Непрямим підтвердженням цього є виявлення акумульованих комплексів антиген — антитіло в тканинах пародонта хворих із ГП при проведенні імуноблот-аналізу з використанням афінно-очищених анти-БТШ60 антитіл, виділених із крові пацієнтів із ГХ.
Збільшення вмісту прозапальних цитокінів і розвиток місцевої та системної запальної відповіді призводять до активації індуцибельної NOS (індуцибельної NO-синтази), яка генерує виділення великої кількості оксиду азоту, що, за нашими даними, підтверджується зростанням вмісту нітритів у сироватці крові та ротовій рідині хворих із ГП при КВП в 1,9 та 1,6 раза відповідно.
Порушення синтезу оксиду азоту є основним елементом, що пов’язує автоімунні реакції, зумовлені пародонтопатогенною мікрофлорою, запальний процес у тканинах пародонта та формування локальної й системної ендотеліальної дисфункції (ЕД). Проведені нами електронно-мікроскопічні дослідження дали змогу виявити у хворих із ГП надійні підтвердження наявності місцевої ЕД, які були виражені більшою мірою при КВП:
1) зміна структури ендотеліоцитів — стоншення цитоплазми, ущільнення її матриксу, зменшення органел метаболічного плану, утворення в ній вакуолей, часткова відсутність мікропіноцитозних пухирців та розширення міжендотеліальних контактів;
2) стоншення ендотеліоцитів та їх трансформація у фенестрований ендотелій, який для ясен не характерний;
3) виявлення ендотеліоцитів на різних стадіях апоптозу, починаючи з ущільнення ядра, втрати міжклітинних зв’язків, ущільнення цитоплазми і до утворення апоптозних тілець та часткової або повної десквамації ендотелію;
4) порушення цілісності внутрішнього вистелення окремих ланок гемомікроциркуляторного русла, обтурація судин форменими елементами крові, підвищення проникності стінок судин. Формування подібного комплексу патоморфологічних змін створює несприятливий фон для перебігу (порушення трофічних процесів, ішемія тканин пародонта) та веде до прогресування захворювань тканин пародонта. У хворих із ГП при КВП системне ураження ендотелію також підтверджувалось результатами агрегатограм з індуктором ристоцитин, де середнє значення ступеня агрегації тромбоцитів (САТ) було вірогідно (р < 0,05) вище, ніж у пацієнтів із ГП без супутньої КВП, що свідчить про накопичення в крові фактора фон Віллебранда, який є верифікованим маркером ЕД. Вірогідне (р < 0,05) підвищення середнього значення САТ також було відзначене при проведенні агрегації з індуктором колаген у хворих із ГП при КВП.
Вищезазначене вказує на зниження резистентності тканин пародонта й можливості ефективно протидіяти бактеріальній інвазії. Замикається порочне коло патогенезу, оскільки подальше проникнення мікроорганізмів підсилює виділення інтерлейкінів, сприяє руйнуванню пародонтальної зв’язки та кісткової тканини й веде до подальшого прогресування захворювань пародонта.
Наслідком формування порочного кола патогенезу і запуском цих патогенетичних механізмів у подальшому буде те, що прогресування захворювань пародонта відбуватиметься навіть за умови зниження бактеріальної контамінації, оскільки існують автоімунні механізми.
Нова концепція патогенезу пояснює резистентність до традиційного лікування ГП при КВП, бо застосування лише традиційного первинного пародонтологічного лікування, направленого на видалення пародонтопатогенної мікрофлори, може бути недостатньо для усунення ЕД, а застосування препаратів бактерицидної чи бактеріостатичної дії (наприклад, антибіотикотерапія та ін.) буде лише погіршувати ситуацію шляхом виділення автоантигенів. В основі цього лежить той факт, що виділення БТШ пародонтопатогенною мікрофлорою на рівні антигенної стимуляції викликає низку системних ефектів, які, у свою чергу, що дуже важливо, можуть запускати розвиток і прогресування атеросклеротичного процесу та здатні впливати на перебіг КВП, погіршувати її, а це, у свою чергу, погіршуватиме стан судин в тканинах пародонта, що пов’язує КВП та захворювання тканин пародонта воєдино, дає синдром взаємного обтяження станів і потребує комплексного підходу до їх лікування з урахуванням вираженості КВП (зокрема, проявів системної ЕД), особливостей перебігу дистрофічно-запального процесу (наявності місцевої ЕД), імуномолекулярних механізмів їх розвитку, а також антигенної стимуляції з боку мікрофлори ПК.
Диференційовані підходи до комплексного лікування хворих із генералізованим пародонтитом
На підставі даних, отриманих при проведенні клініко-лабораторних та експериментальних досліджень, було розроблено новий диференційований підхід до лікування ГП при КВП, оснований на новій концепції патогенезу з урахуванням клінічних особливостей пародонтиту й тяжкості серцево-судинних захворювань.
Принципи, що покладені в основу патогенетичної терапії, були спрямовані на корекцію виявлених порушень, пов’язаних з розвитком ендотеліальної дисфункції на системному та місцевому рівнях, та базувались на зменшенні антигенної стимуляції, яка відбувається внаслідок виділення пародонтопатогенною мікрофлорою ПК білків теплового шоку з розвитком імунної відповіді у вигляді продукції антитіл проти прокаріотичних БТШ60 та антитіл проти БТШ60 людини та їх перехресної реактивності з утворенням комплексів антиген — антитіло на стресованих клітинах тканин пародонта.
У зв’язку з цим в основі патогенетичної терапії ГП при КВП лежать засоби, спрямовані на зменшення мікробного обсіменіння пародонтальних кишень за рахунок підвищення якості індивідуальної гігієни та професійної гігієни порожнини рота хворих. Зважаючи на те, що антитіла проти БТШ мають перехресну реактивність, додавання методів лікування ГП, спрямованих лише на бактерицидний та бактеріостатичний ефекти (в тому числі й призначення антибіотикотерапії), вважаємо не завжди доцільним, оскільки при загибелі або порушенні функції мікроорганізмів відбувається активне виділення БТШ з одночасним підвищенням продукції антитіл проти БТШ та активацією автоімунного процесу. З огляду на це профілактична направленість (індивідуальна та професійна гігієна порожнини рота) в терапії ГП, метою якої є зниження кількості стресованих мікроорганізмів у пародонтальних кишенях і, таким чином, зменшення циркулюючих антитіл проти БТШ різної специфічності, має дуже важливе значення для досягнення стабілізації патологічного процесу не тільки в тканинах пародонта, а й в організмі в цілому.
Зважаючи на встановлений статистично значущий зв’язок між підвищенням вмісту нітритів у сироватці крові хворих на ГП при КВП, патогенетична терапія була спрямована на нормалізацію вмісту оксиду азоту та корекцію системної ендотеліальної дисфункції, що більшою мірою відзначається у хворих на ГП при ГХ ІІ стадії ІІ ступеня, ІХС. На підставі проведених досліджень встановлено, що найкращий терапевтичний ефект був отриманий в групі хворих, які окрім первинного пародонтологічного лікування (фаза І) отримували стандартну терапію КВП, призначену лікарем-кардіологом із додатковим включенням антиоксиданту, донатора оксиду азоту.
Проте, як показали наші дослідження, призначення системної терапії в комбінації з місцевою базисною терапією у пацієнтів з ГП при КПВ в умовах автоімунного процесу та наявної активації системної запальної відповіді не завжди достатньо для отримання вираженого терапевтичного ефекту та стійкої стабілізації місцевої ендотеліальної дисфункції. Це диктує необхідність застосування методів лікування, що не тільки спрямовані на поліпшення трофіки ендотелію на системному рівні, а й стимулюють його відновлення місцево (безпосередньо в тканинах пародонта). Протягом останніх років європейські та вітчизняні вчені велику увагу приділяють застосуванню методу ін’єкційної PRP-терапії (platelet reach plasma), яка проводиться для місцевого стимулювання процесів репаративної регенерації в тканинах пародонта за рахунок збільшення концентрації тромбоцитів плазми, що отримують при центрифугуванні венозної крові пацієнта [31]. Проведені дослідження показали, що ефективність стимуляції процесів регенерації пов’язана з концентраційною здатністю автотромбоцитів в отриманій плазмі крові (КТК – коефіцієнт тромбоцитарної концентрації). Це можна пояснити тим, що в α-гранулах тромбоцитів містяться фактори росту, які відіграють важливу роль у процесах клітинної проліферації, диференціювання й ангіогенезу. Модифікована нами методика отримання препаратів PRP у комплексі з розробленим алгоритмом проведення PRP-терапії дозволила ефективно корегувати прояви місцевої ЕД у хворих із ГП та ГП при ГХ І стадії І ступеня, що дозволяє додати її до комплексної схеми лікування хворих з ГП при ГХ ІІ стадії ІІ ступеня, ІХС [32–35].
Враховуючи вищезазначене, нами були розроблені наступні диференційовані патогенетично обґрунтовані протоколи лікування ГП при КВП.
Протокол 1
Показання до лікування: ГП І–ІІ ступеня, хронічний перебіг на тлі гіпертонічної хвороби І стадії І ступеня.
Системне лікування — за призначенням лікаря-кардіолога (стандартний протокол МОЗ України, наказ № 384 від 24.05.2012).
Базисне пародонтологічне лікування (фаза І) — індивідуальний підбір засобів гігієни, інструментальний та апаратний скейлінг (Cavitron Select SPS — Dentsply Sirona), закритий кюретаж (зоноспецифічні кюрети — Hu-Friedy), за показаннями — шинування зубів та усунення травматичної оклюзії за методикою Дженкельсона.
PRP-терапія за розробленим нами алгоритмом. Спосіб оцінки концентраційної здатності тромбоцитів для отримання збагаченої тромбоцитами плазми (PRP) та визначення оптимального об’єму при лікуванні та профілактиці стоматологічних захворювань (деклараційний патент України на корисну модель № 119951 від 10.10.2017 р.). Спосіб отримання збагаченої тромбоцитами плазми (platelet reach plasma, PRP) з венозної крові (деклараційний патент України на корисну модель № 119952 від 10.10.2017).
Ін’єкції автоплазми — циркулярна методика. Спосіб лікування запальних та запально-дистрофічних захворювань тканин пародонта (патент № 98756).
Підтримуюче лікування — професійна гігієна порожнини рота та 3 сеанси PRP-терапії кожні 6 місяців.
Протокол 2
Показання до лікування: ГП І–ІІ ступеня на тлі ГХ ІІ стадії ІІ ступеня, ІХС.
Системне лікування — за призначенням лікаря-кардіолога (стандартний протокол МОЗ України, наказ № 384 від 24.05.2012) додатково до основної терапії — призначення антиоксиданта та донатора оксиду азоту тівортіну аспартату (per os по 5 мл 3 рази на день, курс — 30 днів).
Базисне пародонтологічне лікування (фаза І) та PRP-терапія за розробленим нами алгоритмом — аналогічно до лікування згідно з протоколом 1.
Підтримуюче лікування — тівортіну аспартат (per os по 5 мл 3 рази на день, курс — 30 днів), професійна гігієна порожнини рота та 3 сеанси PRP-терапії кожні 6 місяців.
Показання до призначення PRP-терапії за розробленим нами алгоритмом:
— уміст тромбоцитів у нативній крові відповідний референтним значенням;
— коефіцієнт тромбоцитарної концентрації > 1;
— функціональна активність тромбоцитів не менше від референтних значень.
Таким чином, патогенетична терапія ГП при КВП базується на симультантному лікуванні захворювань з урахуванням тяжкості патологічних процесів, що мають взаємообтяжувальний перебіг. У зв’язку з цим міждисциплінарна інтеграція лікарів-стоматологів та кардіологів дозволить оптимізувати протоколи лікування з урахуванням наявності й тяжкості соматичної патології та, відповідно, підвищить якість лікування ГП в умовах коморбідності.
У зв’язку з тим, що через 6 місяців після лікування спостерігається поступове зниження терапевтичного ефекту, для досягнення стійкої ремісії в перебігу ГП підтримуюча терапія при ГП І–ІІ, хронічному перебігу та ГХ І стадії І ступеня повинна включати професійну гігієну порожнини рота та 3 сеанси PRP-терапії кожні 6 місяців, при ГП І–ІІ ступеня, хронічному перебігу без КВП — одноразове введення кожні 6 місяців, при ГП І–ІІ, хронічному перебігу та ГХ ІІ стадії ІІ ступеня — тівортіну аспартат (per os по 5 мл 3 рази на день, курс — 30 днів), професійну гігієну порожнини рота та 3 сеанси PRP-терапії кожні 6 місяців.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 19.05.2021
Рецензовано/Revised 02.06.2021
Прийнято до друку/Accepted 09.06.2021
Список литературы
1. Вороненко Ю.В., Мазур І.П., Павленко О.В. Стоматологічна допомога в Україні: аналіз основних показників діяльності за 2018 рік: довідник. Кропивницький: Поліум, 2019. 176 с.
2. Dye B.A. Global periodontal disease epidemiology. Periodontol 2000. 2012 Feb. 58(1). 10-25. doi: 10.1111/j.1600-0757.2011.00413.x.
3. Costa F.О., Susin C., Cortelli J.R., Almeida Pordeus I. Epidemiology of periodontal disease. Int. J. Dent. 2012. 2012. 848641. doi: 10.1155/2012/848641.
4. Heaton B., Dietrich T. Analytic epidemiology and periodontal diseases. Periodontol 2000. 2012 Feb. 58(1). 112-20. doi: 10.1111/j.1600-0757.2011.00419.x
5. Мазур І.П., Павленко О.В., Близнюк В.Г. Сучасний стан стоматологічної допомоги в Україні. Здоров’я України. 2017. 18 (415). 74-75.
6. Page R.С., Beck J.D. Risk assessment for periodontal diseases. Int. Dent. J. 1997 Apr. 47(2). 61-87.
7. Fernandez-Solari J., Barrionuevo P., Mastronardi C.A. Periodontal disease and its systemic associated diseases. Mediators Inflamm. 2015. 2015. 153074. doi: 10.1155/2015/153074.
8. John V., Alqallaf H., De Bedout T. Periodontal Disease and Systemic Diseases: An Update for the Clinician. J. Indiana Dent. Assoc. 2016 Winter. 95(1). 16-23.
9. Nazir M.A. Prevalence of periodontal disease, its association with systemic diseases and prevention. Int. J. Health Sci. (Qassim). 2017 Apr-Jun. 11(2). 72-80.
10. Дрогомирецька М.С., Мірчук Б.М., Дєньга О.В. Розповсюдженість зубно-щелепних деформацій і захворювань тканин пародонта в дорослих у різні вікові періоди. Укр. стоматол. альманах. 2010. 1(2). 51-7.
11. Ашуров Г.Г., Исмоилов А.А. Результаты оценки состояния тканей пародонта у больных с общесоматической патологией. Вестн. последиплом. образования в сфере здравоохранения. 2012. 4. 10-2.
12. Вейсгейм Л.Д., Люмкис Е.В. Состояние вопроса о влиянии соматических заболеваний на клинику и лечение пародонтитов. Новое в стоматологии. 2004. 6. 75-6.
13. Трухан Д.И., Трухан Л.Ю. Пародонтит и сердечно-сосудистые заболевания: параллельно или в одной связке? Consilium Medicum. 2015. 17(5). 73-9.
14. Витовский Р.М., Мазур И.П., Слободяник М.В., Мартыщенко И.В. Взаимосвязь патологии сердечно-сосудистой системы и заболеваний тканей пародонта (обзор литературы). Вісник серцево-судинної хірургії. 2018. 1. 72-78.
15. Desvarieux M., Demmer R.Т., Jacobs D.R. et al. Periodontal bacteria and hypertension: the oral infections and vascular disease epidemiology study (INVEST). J. Hypertens. 2010 Jul. 28(7). 1413-21. doi: 10.1097/HJH.0b013e328338cd36.
16. Oberoi S.S., Harish Y., Hiremath S., Puranik M. A cross-sectional survey to study the relationship of periodontal disease with cardiovascular disease, respiratory disease, and diabetes mellitus. J. Indian. Soc. Periodontol. 2016 Jul-Aug. 20(4). 446-452. doi: 10.4103/0972-124X.186946.
17. Goulart A.С., Armani F., Arap A.М. et al. Relationship between periodontal disease and cardiovascular risk factors among young and middle-aged Brazilians. Cross-sectional study. Sao Paulo Med. J. 2017 May-Jun. 135(3). 226-233. doi: 10.1590/1516-3180.2016.0357300117.
18. Peng C.Н., Yang Y.S., Chan K.C. et al. Periodontal treatment and the risks of cardiovascular disease in patients with type 2 diabetes: a retrospective cohort study. Intern Med. 2017. 56(9). 1015-1021. doi: 10.2169/internalmedicine.56.7322.
19. Максимова О.П. Старт болезней пародонта. Клин. стоматология. 2012. 4. 44-50.
20. Kitagawa M., Kurahashi T., Matsukubo T. Relationship between general health, lifestyle, oral health, and periodontal disease in adults: a large cross-sectional study in Japan. Bull. Tokyo Dent. Coll. 2017. 58(1). 1-8. doi: 10.2209/tdcpublication.2016-2100.
21. Hugoson A., Jordan T. Frequency distribution of individuals aged 20–70 years according to severity of periodontal disease. Community Dent. Oral. Epidemiol. 1982 Aug. 10(4). 187-92.
22. Титов В.Н., Крылин В.В. Стресс, белки-шапероны, нарушение биологической функции эндоэкологии и биологических реакций экскреции, воспаления и артериального давления (лекция). Клин. лаб. диагностика. 2010. 5. 20-36.
23. Gomez-Pastor R., Burchfiel E.Т., Thiele D.J. Regulation of heat shock transcription factors and their roles in physiology and disease. Nat. Rev. Mol. Cell Biol. 2017 Aug 30. doi: 10.1038/nrm.2017.73.
24. Никитин К.Д. Белки теплового шока: биологические функции и перспективы применения. Клин. онкогематология. Фундам. исслед. и клин. практика. 2008. 1(2). 125-130.
25. Чиркова О.В. Белки теплового шока: физиологическая роль, методики определения и клиническое значение. Вестн. новых мед. технологий. 2006. 13(3). 45-8.
26. Лебедев К.А. Физиологическая целесообразность функций образраспознающих рецепторов в иммунологии. Физиология человека. 2007. 33(5). 133-7.
27. Волчегорский И.А., Корнилова Н.В., Бутюгин И.А. Сравнительный анализ состояния системы «перекисное окисление липидов — антиоксидантная защита» в слюне больных хроническим пародонтитом легкой и средней тяжести. Стоматология. 2010. 89(6). 24-7.
28. Цыбиков Н.Н., Баранов С.В., Кузник Б.И., Малежик Л.П., Исакова Н.В. Уровень белка теплового шока-70, цитокинов и автоантител к ним в сыворотке крови, ротовой и зубодесневой жидкости при пародонтите. Стоматология. 2014. 1. 16-8.
29. Белоклицкая Г.Ф., Волинская Т.Б. Азбука ручного скейлинга. Киев: КИТ, 2011. 68 с.
30. Улитовский С.Б. Роль гигиены полости рта в развитии заболеваний пародонта. Пародонтология. 2000. 3. 21-3.
31. Ахмеров Р.Р. Регенеративная медицина на основе автологичной плазмы. Технология PlasmoliftingTM. М.: Литтерра, 2014. 160 с.
32. Білоклицька Г.Ф., Копчак О.В., винахідники; НМАПО ім. П.Л. Шупика, патентовласник. Спосіб лікування запальних та запально-дистрофічних захворювань тканин пародонта. Патент України № 98756. 2015 трав. 12.
33. Білоклицька Г.Ф., Копчак О.В, винахідники; НМАПО ім. П.Л. Шупика, патентовласник. Спосіб оцінки концентраційної здатності тромбоцитів для отримання збагаченої тромбоцитами плазми (PRP) та визначення оптимального об’єму при лікуванні та профілактиці стоматологічних захворювань. Патент України № 119952. 2017 жовт. 10.
34. Копчак О.В., Білоклицька Г.Ф., Стеченко Л.О., Кривошеєва О.І. Ультраструктурна організація тканин ясен хворих на генералізований пародонтит при кардіоваскулярній патології. Світ медицини та біології. 2017. (1). 121-6.
35. Копчак О.В., Білоклицька Г.Ф., Стеченко Л.О., Кривошеєва О.І. Ультраструктура пародонта при проведенні комплексного лікування генералізованого пародонтиту у пацієнтів з кардіоваскулярними захворюваннями в умовах застосування PRP. Вісн. пробл. біології і медицини. 2017. 2(3). 179-88.

/14.jpg)
/16.jpg)