Вступ
Реальна поширеність SARS-CoV-2 серед дітей невідома. Спочатку здавалося, що порівняно з дорослими діти хворіють менше і захворювання у них перебігає легше. Однак з кінця квітня 2020 року в декількох звітах провідних медичних спільнот світу описано виникнення у дітей тяжкого мультисистемного запального синдрому, що нагадує хворобу Кавасакі (KD), тимчасово пов’язану з інфекцією COVID-19. Немає ще загального розуміння цього патологічного синдрому, але поширеність серед дитячої популяції привертає увагу педіатрів усього світу. Цей огляд спрямований на узагальнення наявної літератури з цієї теми і висвітлення власного досвіду.
Епідеміологія
Одне з перших епідеміологічних досліджень здійснене в Китаї: у більшості з 2143 педіатричних пацієнтів, про яких повідомили Y. Dong et al. (2020), захворювання перебігало безсимптомно або з легкими та помірними симптомами [1, 34]. Відсоток пацієнтів з тяжкими формами був значно нижчим, ніж серед дорослих (5,9 проти 18,5 %, р < 0,05), з найвищим піком тяжких форм у вікової категорії дітей 0–5 років та дуже низьким рівнем смертності (0,1 %) [1, 34]. Передбачалося, що легкий ступінь вираженості дитячих форм COVID-19 був пов’язаний з факторами зовнішнього середовища (меншим впливом патогенних агентів) та імуногенними факторами (розвиток імунної системи, нижча експресія рецепторів ангіотензинперетворюючого ферменту 2 (АСЕ-2), кількість АСЕ-2 на тканинах-мішенях) [2].
У більш недавньому систематичному огляді проаналізували 18 китайських досліджень з 1065 учасниками (444 пацієнти були молодше 10 років, а 553 — віком від 10 до 19 років) із підтвердженою інфекцією SARS-CoV-2 [3, 34]. Автори дійшли висновку, що найпоширенішим перебігом COVID-19 у дітей була сукупність ознак і симптомів від абсолютно безсимптомних до симптомів гострої інфекції верхніх дихальних шляхів, таких як лихоманка, втома, кашель, біль у горлі, ринорея та застійні явища, а також задишка. Порівняно з дорослими у дітей рідко прогресували тяжкі симптоми верхніх дихальних шляхів, які вимагали б спрямування в реанімаційне відділення. Крім того, були описані шкірні прояви у дітей при інфекції SARS-CoV-2, при цьому особлива увага приділяється синдрому «обмороженої шкіри», одній із ознак деяких ревматологічних порушень [4, 34].
Незважаючи на те, що у більшості дітей COVID-19 може перебігати безсимптомно, у повідомленнях з Європи та Америки висловлювались занепокоєння щодо запального процесу у дітей, які були хворі або перехворіли на COVID-19. Клінічна картина цього запального синдрому подібна до хвороби Кавасакі, синдрому активації макрофагів (MAS), шокового синдрому при хворобі Кавасакі (KDSS) або синдрому токсичного шоку (TSS) [5–10].
Хвороба Кавасакі — рідкісний гострий васкуліт середніх і дрібних судин. Відповідно до італійських рекомендацій, опублікованих у 2018 році, діагностичними критеріями типової або повної KD є наявність лихоманки > 5 днів та > 4 з таких клінічних критеріїв: двобічний неексудативний кон’юнктивіт, еритема губ та слизової оболонки рота, набряки кінцівок, шкірний висип та шийні лімфаденопатії [35].
Неповна KD виникає у пацієнтів із лихоманкою без достатньої кількості основних клінічних критеріїв, тоді як атипова KD характеризується лихоманкою, пов’язаною з ознаками, та симптомами, що відрізняються від класичних (запалення мозкових оболонок, шлунково-кишкові симптоми, гострий живіт, артрит, пневмонія та ін.) [34].
У невеликого відсотка пацієнтів може розвинутися більш тяжка форма KD, відома як KDSS, яка визначається на основі систолічної гіпотензії (стійкого зниження систолічного артеріального тиску від вихідного рівня > 20 %) або клінічних ознак порушення перфузії. KD має потенційні серйозні серцеві ускладнення, такі як аневризми коронарних артерій, і залишається основною причиною набутих захворювань серця в розвинених країнах [34].
Етіологія досі не зрозуміла, хоча, як вважають, це сильна запальна реакція на інфекційний тригер у генетично схильних осіб. Докази ролі вірусної інфекції на серцево-судинні захворювання свідчать про сезонні епідемічні тенденції [11, 34].
Низка вірусів були визначені як етіологічний чинник KD, і родина коронавірусів була запропонована як можлива пов’язана причина. Визначення вищої частоти зустрічальності нового коронавірусу (HCoV-NH) у дихальних секретах пацієнтів з хворобою Кавасакі, ніж у контролі (72 проти 4,5 %), описано Esper et al. [12], але подальші дослідження дали суперечливі результати [13, 14]. Інформація щодо можливої ролі SARS-CoV-2 у патогенезі класичної KD все ще відсутня, але сучасні дані, схоже, не підтверджують цю гіпотезу.
Jones et al. (2020) описали перший випадок одночасного захворювання на COVID-19 та хворобу Кавасакі: автори лише детально описали випадок 6-місячного немовляти, у якого були всі критерії повно ї KD, а також позитивне тестування PCR на COVID-19. Пацієнта успішно лікували IVIG та ацетилсаліциловою кислотою [6, 34].
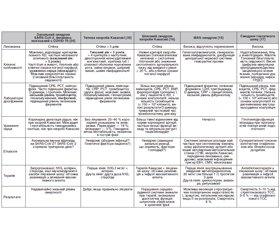
З кінця квітня 2020 р. у кількох повідомленнях з Європи та США описані випадки захворювання у дітей, які проявляються тяжким запальним синдромом, що тимчасово пов’язаний з інфекцією SARS-CoV-2, та схожі за перебігом з KD, MAS [15], KSS [16] та TSS [17] (табл. 1).
Серія випадків тяжкого запального синдрому, який тимчасово пов’язаний з інфекцією SARS-CoV-2, призвела до розробки настанов та рекомендацій від різних наукових товариств, які використовували різні абревіатури: Королівський коледж педіатрії та охорони здоров’я дітей (RCPCH) визначив абревіатуру PIMS-TS (педіатричний запальний синдром, тимчасово асоційований з SARS-CoV-2) [18]; Центри з контролю та профілактики захворювань (CDC) описали цей синдром під маркою MIS-C (багатосистемний запальний синдром у дітей) [19]. Італійський Istituto Superiore di Sanità опублікував рекомендації з цієї теми наприкінці травня 2020 року [20].
Перші звіти з’явились у Великій Британії [7, 21] та Італії [5, 9], потім у Франції [8, 10, 22, 23], Нью-Йорку та інших регіонах США [7, 24]. Майже в усіх описаних пацієнтів виявляли позитивні антитілa IgG до SARS-CoV-2, тоді як лише невеликий відсоток мав позитивний мазок з носоглотки (PCR): ці дані свідчать про пізній початок захворювання порівняно з первинною інфекцією через імунну реакцію господаря [35].
Усе більше доказів свідчать про те, що пошкодження тканин при COVID-19 в основному опосередковується вродженим імунітетом господаря, який активує шторм цитокінів, що нагадує активацію макрофагів вірусно-індукованого гемофагоцитарного лімфогістіоцитозу [25, 26]. Нові докази імунної відповіді при COVID-19, схоже, з’являються в результаті недавнього гістологічного дослідження [27]. Автори повідомляють про ескалацію дисбалансу від імунної відповіді Th2 до гіперчутливості ІІІ типу з подальшим відкладенням комплексів «антиген-антитіло», особливо всередині стінок кровоносних судин, активацію факторів комплементу (C3a та C5a) та вивільнення цитокінів, здатних викликати гострий некротизуючий васкуліт [25, 26]. Синдром цитокінового шторму з підвищеним рівнем маркерів запалення (IL-1, IL-6, TNF-α) був описаний у дорослих із COVID-19, і це було пов’язано із високим ризиком летальності [28]. Цей шторм клінічно відображається серцевою недостатністю, пневмонією, шлунково-кишковими, неврологічними та нирковими ураженнями, пов’язаними із підвищенням рівнів СРБ, феритину та певних прозапальних цитокінів (IL-1, IL-6, TNF-α).
Точних епідеміологічних даних щодо запального синдрому, який тимчасово пов’язаний із SARS-CoV-2, поки що немає, але кілька країн, включаючи Італію, Францію, Іспанію та Велику Британію, створили національні реєстри [34]. Перші результати французького національного інфекційного контролю повідомили про 108 випадків PIMS з 1 березня по 17 травня. Крива епідемії показала різке збільшення захворюваності після 13 квітня, що завершилися через 4–5 тижнів після піку епідемії COVID-19 у Франції. Ці результати, разом із кореляцією між географічним розподілом випадків COVID-19 та пацієнтів з клінікою, подібною до хвороби Кавасакі, підтверджують причинно-наслідковий зв’язок між інфекцією SARS-CoV-2 та PIMS. Початок захворювання через 4–5 тижнів після COVID-19 підтверджує гіпотезу про те, що PIMS є постінфекційним процесом. У цій серії випадків було зафіксовано одну смерть [22].
Внутрішньовенні імуноглобуліни були ефективними у цих пацієнтів: їх імуномодулюючі властивості не є специфічними, але призводять до сильних протизапальних ефектів. Однак термінове призначення IVIG в дозі 2 г/кг передбачає інфузію великої кількості рідини (рекомендовано вливати їх розподіленими на дві окремі дози та використовувати переважно концентровані імуноглобуліни з високим вмістом антитіл). У разі ожиріння (індекс маси тіла > 30 кг/м2) зменшення 20% терапевтичної дози допоможе уникнути ниркових ускладнень, пов’язаних із підвищенням онкотичного тиску та в’язкості крові [4].
В одному з нещодавніх оглядів Nakra пропонує лікувати всіх пацієнтів, які відповідають критеріям KD, IVIG + ацетилсаліцилова кислота [29]. Крім того, IVIG може мати сприятливий імуномодулюючий ефект також у пацієнтів, які не відповідають цим критеріям.
Licciardi et al. (2020) відмітили значне покращення стану всіх пацієнтів після застосування високих доз стероїдів (метилпреднізолон внутрішньовенно, після чого преднізон per os) [9, 34]. У деяких випадках вводили також IVIG. Більше того, Verdoni et al. (2020) підтверджують необхідність введення додаткових стероїдів у пацієнтів з ознаками, що нагадують MAS (стероїди, виходячи з їх досвіду, безпечні та ефективні) [5].
Якщо розглядати цей гіперзапальний синдром як постінфекційний процес, імунодепресивні ефекти терапії не несуть ризику відновити інфекцію. Якщо полімеразна ланцюгова реакція у реальному часі на SARS-CoV-2 дає позитивний результат (що свідчить про активну інфекцію), то можливе застосування додаткових методів лікування, таких як призначення рекомбінантних антагоністів IL-1 (наприклад, анакінри). Іншими можливими методами лікування є тоцилізумаб — інгібітор IL-6, який застосовується для встановлення рефрактерної KD, однак слід дотримуватися обережності через одне повідомлення, яке продемонструвало швидкий розвиток аневризми коронарних артерій після такої терапії [33].
Противірусна терапія ремдесивіром може бути розглянута для пацієнтів з позитивною PCR на SARS-CoV-2, однак дослідження показали, що її користь найбільша при застосуванні на початку захворювання [31, 32].
Загальна смертність при MIS-C (PIMS) була низькою. У Великій Британії спостерігалася одна смерть (через цереброваскулярне ускладнення під час перебування в ECMO) [7], про одну смерть повідомили у французькому спостереженні [22] та про чотири випадки смерті в США [33].
В Україні на піку підвищення захворюваності в жовтні — грудні 2020 р. педіатри почали діагностувати випадки мультисистемного запалення, асоційованого з COVID-19. У КНП «Хмельницька міська дитяча лікарня» були успішно проліковані більше 10 пацієнтів з цією патологією. Два клінічних випадки ми пропонуємо до уваги медичної спільноти.
Випадок 1. Хлопчик, 9 р., м. Хмельницький, 14.11.2020 доставлений до КП «ХМДЛ» бригадою швидкої медичної допомоги зі скаргами на нудоту, гіпертермію 39–40 °С, блювання, зниження апетиту, загальну слабкість.
З анамнезу хвороби відомо, що хлопчик захворів гостро 10.11.2020, коли з’явились вищеописані скарги. Лікувався амбулаторно (жарознижуючі засоби, глюкоза, антибактеріальні засоби, пробіотики). Однак стан дитини прогресивно погіршувався, що змусило звернутись за допомогою в ХМДЛ.
З анамнезу життя відомо, що хлопчик зрідка хворів на гострі респіраторні вірусні інфекції (ГРВІ), бронхіт, краснуху, мав приступи синдрому циклічного блювання. Вакцинований згідно з календарем щеплень. Спадковий та алергологічний анамнез не обтяжені.
На час госпіталізації стан дитини середнього ступеня тяжкості, при об’єктивному огляді: зів злегка гіперемований, шкірні покриви чисті, блідо-рожеві, над легенями жорстке дихання, дещо ослаблене в нижніх відділах. Тони серця ритмічні, середньогучні. Живіт м’який, помірно болючий при пальпації. Дитина оглянута хірургом — хірургічну патологію виключено.
При дообстеженні виявлено лейкоцитоз із зсувом формули вліво. Загальний аналіз крові (ЗАК) 14.11.2020: ер. — 4,49 × 10 12/л, Нb — 123 г/л, КП — 0,84, тр. — 180 × 10 9/л, лейк. — 14,2 × 10 9/л, пал. — 24 %, с. — 67 %, е. — 1 %, б. — 1 %, лім. — 3 %, мон. — 4 %, швидкість осідання еритроцитів (ШОЕ) — 28 мм/год.
Отримано результати імунохроматографічного дослідження (Сito test «Фармаско») на IgM та IgG до SARS-CoV-2: IgM — негативні, IgG — позитивні.
Попередній діагноз «гострий бронхіт, пневмонія?». Дитина була госпіталізована. Розпочато антибактерійну та посиндромну терапію. 15.11.2020 стан дитини прогресивно погіршувався: утримувалась лихоманка, наростали прояви інтоксикаційного синдрому, приєдналось затьмарення свідомості, хлопчик став відмічати сторонні звуки, у зв’язку з чим переведений у відділення анестезіології та інтенсивної терапії (ВАІТ).
Стан дитини був тяжкий, обумовлений інтоксикаційним синдромом, гіпертермією, погіршенням зору, міалгією. Скарги на головний біль, слабкість, розмитість перед очима, помірний біль в животі в ділянці епігастрію. Хлопчик в свідомості, капризний при огляді. Об’єктивно: шкіра чиста, блідо-рожева, при підйомі температури тіла з’являється плямистий зливний висип з локалізацією на долонях і верхніх кінцівках. Слизові оболонки чисті, блідо-рожеві. Має місце почервоніння очей за типом негнійного кон’юнктивіту. Гемодинаміка стабільна, тони серця ритмічні, приглушені, незначна тахікардія. Дихання самостійне, адекватне. Аускультативно в легенях жорстке дихання, ослаблене в нижніх відділах. Проводилася киснева терапія зволоженим киснем через носові канюлі. Живіт дещо піддутий, симетричний, доступний глибокій пальпації, болісний у ділянці епігастрію. Паренхіматозні органи не збільшені. Сечопускання самостійне, діурез достатній. Випорожнення — 1 р/д. 18.11.2020 стан дитини дещо покращився, температура тіла була в діапазоні субфебрильних цифр, однак 19.11.2020 знову з’явилась лихоманка. При аускультації в легенях дихання жорстке , ослаблене в нижніх відділах. SpO2 — 90 %.
За час перебування у ВАІТ проведено обстеження: виявлено зміни, що вказували на наявність запального процесу бактеріального генезу, оскільки утримувався лейкоцитоз із зсувом формули вліво. ЗАК 19.11.2020: Нb — 96 г/л, ер. — 3,47 × 10 12/л, КП — 0,82, лейк. — 24,0 × 109/л, тр. — 329 × 10 9/л, пал. — 1 %, с. — 85 %, е. — 1 %, б. — 1 %, лімф. — 9 %, мон. — 4 %, ШОЕ — 49 мм/год, гематокрит — 0,30.
Мали місце підвищення показників прокальцитоніну, феритину, С-реактивного протеїну: 16.11.2020 тропонін І — 0,11 ng/ml (норма до 0,5 ng/ml), прокальцитонін — 1,82 ng/ml (норма < 0,1 ng/ml); D-димер — 2,1 mg/l (норма < 0,5 mg/l); креатинфосфокіназа СК — МВ-фракція — 12,0 U/l (норма < 25 U/l); СРП — 81,0 mg/l (норма < 5 mg/l), феритин — 266,4 (норма 20–250,0 mg/l), які знижувались в динаміці: тропонін І — 0,04 ng/ml (норма до 0,5 ng/ml), прокальцитонін — 0,89 ng/ml (норма < 0,1 ng/ml); креатинфосфокіназа СК — МВ-фракція — 20,0 U/l (норма < 25 U/l); СРП — 87,9 mg/l (норма < 5 mg/l), феритин — 218,0 (норма 20–250,0 mg/l), D-димер — 1,6 mg/l (норма < 0,5 mg/l).
У біохімічному аналізі крові відмічалась гіпопротеїнемія (заг. білок — 50 г/л, альб. — 30 %, глоб. — 20 %), незначне підвищення трансаміназ (АлТ — 35 од/л, АсТ — 40 од/л). Показники коагулограми від 18.11.2020 (D-димер — 2,1 mg/l (норма < 0,5 mg/l), ТТ — 15,8 с, фібриноген — 1,82 г/л, АЧТЧ — 24,9 с, ПТ — 14,9 с) показали наявність ознак внутрішньосудинного згортання.
При інструментальному обстеженні методом ультразвукового дослідження (УЗД) в дитини виявлено ознаки полісерозиту (асцит, гідроперикард). УЗД легень (19.11.2020) — рідина в плевральному синусі до 14 мм зліва та до 11 мм справа; ознаки інфільтрації в лівій легені — 35 × 16 мм, з обох сторін субплевральна виражена інфільтрація. УЗД органів черевної порожнини (ОЧП) 17.11.2020: виражені ознаки гіперпневматизації кишечника, ознаки спленомегалії, виражені зміни в нирках (нефропатія), незначно виражений асцит. Ехокардіографія (ЕхоКГ) 17.11.2020: фракція викиду — 52 %, ознаки сепарації листків перикарда до 2 мм. Вільна рідина в перикарді. Знижена скоротлива здатність лівого шлуночка.
Електрокардіографія 16.11.2020 — варіант норми.
Rӧ органів грудної клітки (ОГК) 18.11.2020: інфільтративних змін не виявлено, судинно-інтерстиційний рисунок посилений з обох сторін, синуси вільні, серце в нормі.
Пацієнт неодноразово був консультований кардіологом, гематологом, неврологом, офтальмологом, гематологом. Встановлено діагноз «PAST-SARS-CoV-2-інфекція. MIS-C (мультисистемний синдром), асоційований з COVID-19».
Лікування: інфузійна терапія у складі глюкозо-сольових розчинів, імуноглобулін внутрішньовенним (в/в) шляхом інфузії впродовж 24 год; гормонотерапія; антибіотикотерапія, антикоагулянтна терапія; симптоматична та посиндромна терапія.
23.11.2020 стан дитини стабілізувався. Нормалізувались клінічні та параклінічні показники. 02.12.2020 у задовільному стані під нагляд сімейного лікаря/педіатра виписаний додому. Рекомендації: продовжити прийом гормональних препаратів з поступовим зниженням дози і відміною, контроль аналізу крові, ЕхоКГ, УЗД ОЧП.
Випадок 2. Хлопчик, 11 р., м. Хмельницький. 11.11.2020 доставлений бригадою ШМД до КП «ХМДЛ» зі скаргами на підвищення температури тіла 39–40 оС, плямистий папульозний висип зливного характеру по всьому тілу, блювання, надмірну пітливість.
З анамнезу хвороби відомо, що хлопчик захворів гостро 04.11.2020, коли відчув нездужання та появу нудоти, 08.11.20 приєдналась гіпертермія. Лікувався амбулаторно (жарознижуючі препарати та антибіотик), однак стан дитини прогресивно погіршувався, що змусило звернутись до ХМДЛ.
З анамнезу життя: зрідка хворів на ГРВІ, отит, аденоїдит. Вакцинований згідно з календарем щеплень. Спадковий та алергологічний анамнез не обтяжені.
На час госпіталізації стан дитини середнього ступеня тяжкості, температура 38,7 °С, частота дихання — 24/хв, частота серцевих скорочень — 122/хв. Об’єктивно: зів злегка гіперемований, язик обкладений білими нашаруваннями, шкірні покриви рожеві, з елементами плямистого папульозного висипу зливного характеру по всьому тілу, над легенями жорстке дихання, перкуторно — ясний легеневий звук. Тони серця ритмічні, середньогучні. Живіт м’який, болючий при пальпації в правій здухвинній ділянці. Симптоми подразнення очеревини сумнівні. Випорожнення не було, діурез достатній. При лабораторному обстеженні виявлено лейкоцитоз із зсувом лейкоцитарної формули вліво. ЗАК 11.11.2020: ер. — 4,9 × 10 12/л, Нb — 123 г/л, КП — 0,77, тр. — 194 × 10 9/л, лейк. — 15,3 × 10 9/л, пал. — 7 %, с. — 77 %, е. — 2 %, б. — 0 %, лімф. — 10 %, мон. — 4 %, ШОЕ — 10 мм/год.
УЗД ОЧП 11.11.2020: у проєкції гіпогастрію справа візуалізуються виражені інфільтративні зміни петель кишечника, значно збільшені і змінені лімфатичні вузли на фоні інфільтрованого сальника. Апендикс чітко не візуалізується. Виявлена невелика кількість вільної рідини в плевральній порожнині.
Rӧ ОГК 12.11.2020 — інфільтративних змін не виявлено. Синуси вільні. Серце в нормі.
Дитина оглянута хірургом — хірургічну патологію виключити неможливо, тому хлопчик госпіталізований до хірургічного відділення. 12.11.2020 стан дитини відносно покращився, біль в животі помірно регресував, дитина переведена до педіатричного відділення.
12.11.2020 визначено антитіла класу IgG до коронавірусу SARS-CoV-2, результат позитивний (ІР більше 15,77).
У динаміці збільшився лейкоцитоз: 13.11.2020 лей. — 16,4 × 10 9/л, пал. — 2 %, с. — 86 %, е. — 1 %, лім. — 5 %, мон. — 5 %, ШОЕ — 47 мм/год, відмічалось підвищення гострофазових показників: тропонін І — 0,26 ng/ml (норма до 0,5 ng/ml), прокальцитонін — 2,39 ng/ml (норма < 0,1 ng/ml); D-димер — 2,4 mg/l (норма < 0,5 mg/l); креатинфосфокіназа СК — МВ-фракція — 76,0 U/l (норма < 25 U/l); СРП — 21,7 mg/l (норма < 5 mg/l), феритин — 218,4 (норма 20–250,0 mg/l).
Згідно з показниками коагулограми від 13.11.2020: D-димер — 2,4 mg/l (норма < 0,5 mg/l), ТТ — 120 с, фібриноген — 2,72 г/л, АПТТ — 26,3 с, ПТ — 12,3 с — у дитини з’явились ознаки внутрішньосудинного згортання.
13.11.2020 стан хлопчика різко погіршився за рахунок посилення інтоксикаційного синдрому (фебрильна лихоманка, посилення болю в животі, поширеність плямистого папульозного висипу по всьому тілу, наявність позивів до блювання). При огляді шкіра рожево-гіперемована, з елементами плямистого папульозного висипу з тенденцією до злиття. Язик обкладений білим нашаруванням. У легенях ослаблене дихання, серцева діяльність ритмічна, серцеві тони ослаблені. У зв’язку з погіршенням стану дитину переведено до ВАІТ.
13.11.2020 під загальним знеболюванням хлопчику проведено пальпацію живота під седацією в стані медикаментозного сну — даних за гостру хірургічну патологію не виявлено.
Обстеження за період перебування у ВАІТ вказуали на наявність запального процесу у дитини. Бохімічний аналіз крові: глюкоза — 5,97 мМоль/л, заг. білірубін — 10,2 мкмоль/л, АлТ — 57 од/л, АсТ — 43 од/л, креатинін — 84,4 мкмоль/л, сечовина — 6,7 мкмоль/л. 14.11.2020: прокальцитонін — 2,51 ng/ml, СРП — 65,4 mg/l (норма < 5 mg/l). 16.11.2020: прокальцитонін — 1,7 ng/ml (норма < 0,1 ng/ml), D-димер — 1,9 mg/l (норма < 0,5 mg/l), креатинфосфокіназа — МВ-фракція — 17 U/l (норма < 25 U/l); СРП — 65,4 mg/l (норма < 5 mg/l), феритин — 218,4 (норма 20–250,0 mg/l). Загальний аналіз сечі — у межах фізіологічних показників.
Згідно з даними інструментальних методів обстеження, у дитини наросли прояви полісерозиту. УЗД серця 14.11.2020: знижена скоротлива здатність лівого шлуночка. Дилатація лівого шлуночка; рідина в плевральному синусі справа — 12 мм, зліва — 5–6 мм. УЗД ОЧП 14.11.2020 — збільшилась кількість рідини між петлями кишечника.
Хлопчик консультований гематологом, кардіологом, хірургом.
Під час лікування у ВАІТ стан дитини динамічно покращувався: біль в животі зменшився, висип помірно регресував, у звязку з чим для подальшого лікування хлопчик переведений до педіатричного відділення.
Встановлено діагноз «PAST-SARS-CoV-2-інфекція. MIS-C (мультисистемний синдром), асоційований з COVID-19».
Під час лікування у відділенні стан дитини покращувався. Нормалізувались також показники параклінічних методів дослідження.
Лікування: інфузійна терапія; імуноглобулін в/в шляхом безперервної 24-годинної інфузії; гормонотерапія; антибіотикотерапія; антикоагулянтна терапія; симптоматична та посиндромна терапія.
23.11.2020 хлопчик був виписаний із стаціонару під нагляд сімейного лікаря/педіатра, дані рекомендації: продовжити метіпред із зниженням дози та повною відміною, аспірин 6 тижнів, золопент, відеїн, контроль аналізу крові, ЕхоКГ та УЗД ОЧП.
Висновки
Знання про гіперзапальний синдром та його зв’язок з KD та COVID-19 постійно удосконалюються. Поточні дані підкреслюють, що ці дві патології, ймовірно, мають кілька спільних шляхів для активації цитокінового шторму, однак є відмінності між MIS-C та KD. Клінічна інформація та наукові дані в майбутньому дадуть уявлення про патофізіологію та покращать наше розуміння KD та синдрому мультисистемного запалення.
Необхідні подальші дослідження для ранньої діагностики цього гіперзапального синдрому, оптимального лікування та профілактики, а також розуміння ефективності довгострокового спостереження за дітьми, які пережили COVID-19.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 26.02.2021
Рецензовано/Revised 05.03.2021
Прийнято до друку/Accepted 15.03.2021

/61.jpg)