Журнал «Медицина неотложных состояний» Том 17, №6, 2021
Вернуться к номеру
Вентиляція легень у хворих із тяжкою черепно-мозковою травмою: огляд сучасних рекомендацій
Авторы: Кріштафор Д.А., Клигуненко О.М., Кравець О.В., Єхалов В.В., Лященко О.В.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
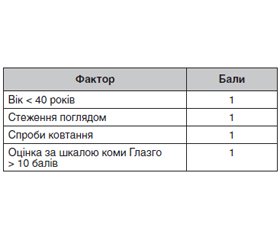
Черепно-мозкова травма (ЧМТ) є найпоширенішою групою травм у постраждалих, які надходять до відділень невідкладної допомоги. До 20 % пацієнтів з ушкодженням головного мозку потребують ендотрахеальної інтубації та механічної вентиляції легень, тривалість якої вірогідно довша, ніж у пацієнтів неневрологічного профілю. У таких пацієнтів вища частота розвитку гострого респіраторного дистрес-синдрому та вентилятор-асоційованої пневмонії, а відлучення від респіратора та екстубація супроводжуються значними труднощами. При цьому пацієнти з ЧМТ часто виключаються з рандомізованих досліджень, а міжнародні керівництва з лікування тяжкої ЧМТ не викладають чітких рекомендацій щодо стратегій вентиляції. Аналіз літературних джерел дозволив виділити сучасні принципи респіраторної підтримки при тяжкій ЧМТ, які включають: інтубацію трахеї при оцінці за шкалою коми Глазго ≤ 8 балів; ранню механічну вентиляцію; підтримання PaO2 у межах 80–120 мм рт.ст. (SaO2 ≥ 95 %), PaCO2 — 35–45 мм рт.ст.; дихальний об’єм ≤ 8 мл/кг; частоту дихання ≈ 20/хв; PEEP ≥ 5 см H2O; піднесений на 30° головний кінець ліжка; седацію при поганій синхронізації з респіратором; відлучення від респіратора через застосування допоміжних режимів вентиляції; екстубацію при досягненні 3 балів за шкалою VISAGE; ранню (до 4 діб) трахеостомію при прогнозованих труднощах з екстубацією.
Traumatic brain injury is the most common group of injuries among victims admitted to the emergency departments. Up to 20 % of individuals with brain damage require endotracheal intubation and mechanical ventilation, the duration of which is significantly longer than in non-neurological patients. Such patients have a higher incidence of acute respiratory distress syndrome and ventilator-associated pneumonia, and weaning and extubation are associated with significant difficulties. However, patients with traumatic brain injury are often excluded from randomized trials, and international guidelines for the treatment of severe traumatic brain injury do not provide clear ventilation strategies. Analysis of the literature allowed us to identify modern principles of respiratory support in severe traumatic brain injury, which include: tracheal intubation in Glasgow coma scale score of ≤ 8 points; early mechanical ventilation; PaO2 in the range of 80–120 mm Hg (SaO2 ≥ 95 %), PaCO2 — 35–45 mm Hg; tidal volume ≤ 8 ml/kg; respiratory rate ≈ 20/min; PEEP ≥ 5 cm H2O; head elevation by 30°; sedation in poor synchronization with the respirator; weaning from the respirator through the use of support ventilation modes; extubation when reaching 3 points on the VISAGE scale; early (up to 4 days) tracheostomy in predicted extubation failure.
черепно-мозкова травма; респіраторна підтримка; механічна вентиляція легень; огляд
traumatic brain injury; respiratory support; mechanical ventilation; review
/34.jpg)
- American College of Surgeons Committee on Trauma. Advanced trauma life support: student course manual (10th ed). Illinois: American College of Surgeons, 2016. 474 p.
- Дубров С.О., Суслов Г.Г., Биліна В.М. та ін. Інтенсивна терапія пацієнтів із черепно-мозковою травмою: чи є можливість покращити результати лікування? Медицина невідкладних станів. 2016. № 3(74). С. 51-57.
- Дубров С.О. Лікування черепно-мозкової травми: головна мета — зберегти мозок. Здоров’я України. Хірургія. Ортопедія.Травматологія. Інтенсивна терапія. 2021. № 1(44). С. 27.
- Brain Trauma Foundation. Guidelines for the Management of Severe Traumatic Brain Injury (4th Edition). Neurosurgery. 2017. Vol. 80. № 1. P. 6-15.
- Rosenfeld J.V., Maas A.I., Bragge P. et al. Early management of severe traumatic brain injury. Lancet. 2012. Vol. 380(9847). P. 1088-1098.
- Robba C., Poole D., McNett M. et al. Mechanical ventilation in patients with acute brain injury: recommendations of the European Society of Intensive Care Medicine consensus. Intensive Care Med. 2020. Vol. 46(12). P. 2397-2410. doi: 10.1007/s00134-020-06283-0.
- Ngubane T. Mechanical ventilation and the injured brain. Southern African Journal of Anaesthesia and Analgesia. 2011. Vol. 17. 1. P. 76-80. doi: 10.1080/22201173.2011.10872737.
- Bruni A., Garofalo E., Pelaia C. et al. Mechanical ventilation in brain injured patients: seeing the forest for the trees. J. Thorac. Dis. 2017. Vol. 9(10). P. 3483-3487. http://dx.doi.org/10.21037/jtd.2017.08.149
- Koutsoukou A., Katsiari M., Orfanos S.E. et al. Respiratory mechanics in brain injury: A review. World J. Crit. Care Med. 2016. Vol. 5. P. 65-73. doi: 10.5492/wjccm.v5.i1.65.
- Asehnoune K., Roquilly A., Cinotti R. Respiratory Management in Patients with Severe Brain Injury. Crit. Care. 2018. Vol. 22. P. 76. https://doi.org/10.1186/s13054-018-1994-0
- Cinotti R., Dordonnat-Moynard A., Feuillet F. et al. Risk factors and pathogens involved in early ventilator-acquired pneumonia in patients with severe subarachnoid hemorrhage. Eur. J. Clin. Microbiol. Infect. Dis. 2014. Vol. 33(5). P. 823-30. doi: 10.1007/s10096-013-2020-8.
- Cinotti R., Bouras M., Roquilly A., Asehnoune K. Management and weaning from mechanical ventilation in neurologic patients. Ann. Transl. Med. 2018. Vol. 6(19). P. 381. doi: 10.21037/atm.2018.08.16.
- Дубров С.О. Патофізіологічне обґрунтування слабкості відлучення від респіратора у пацієнтів, яким проводять тривалу штучну вентиляцію легень. Біль, знеболювання і інтенсивна терапія. 2011. № 4. С. 23-30.
- Дубров С.О., Трофимович О.О. Вплив складності та тривалості відлучення від респіратора на летальність пацієнтів з тяжкою травмою після проведення тривалої штучної вентиляції легень. Український науково-медичний молодіжний журнал. 2012. № 2. С. 79-81.
- Kallet R.H., Matthay M.A. Hyperoxic acute lung injury. Respir. Care. 2013. Vol. 58(1). P. 123-141. doi: 10.4187/respcare.01963.
- Fan E., Del Sorbo L., Goligher E.C. et al. An Official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine Clinical Practice Guideline: Mechanical Ventilation in Adult Patients with Acute Respiratory Distress Syndrome. Am. J. Respir. Crit. Care Med. 2017. Vol. 195(9). P. 1253-1263. doi: 10.1164/rccm.201703-0548ST.
- Bein T., Grasso S., Moerer O. et al. The standard of care of patients with ARDS: ventilatory settings and rescue therapies for refractory hypoxemia. Intensive Care Med. 2016. Vol. 42(5). P. 699-711. doi: 10.1007/s00134-016-4325-4.
- Madan A. Correlation between the levels of SpO2 and PaO2. Lung. India. 2017. Vol. 34(3). P. 307-308. doi: 10.4103/lungindia.lungindia_106_17.
- Geukens P., Oddo M. Brain Tissue Oxygen Monitoring in Neurocritical Care. Annual Update in Intensive Care and Emergency Medicine. Springer, Berlin, Heidelberg, 2012. P. 735-745. https://doi.org/10.1007/978-3-642-25716-2_66
- Jakkula P., Reinikainen M., Hastbacka J. et al. Targeting two different levels of both arterial carbon dioxide and arterial oxygen after cardiac arrest and resuscitation: a randomized pilot trial. Intensive Care Med. 2018. Vol. 44. P. 2112-2121. doi: 10.1007/s00134-018-5453-9.
- Ni Y.N., Wang Y.M., Liang B.M., Liang Z.A. The effect of hyperoxia on mortality in critically ill patients: a systematic review and meta analysis. BMC Pulm. Med. 2019. Vol. 19(1). P. 53. doi: 10.1186/s12890-019-0810-1.
- Damiani E., Adrario E., Girardis M. et al. Arterial hyperoxia and mortality in critically ill patients: a systematic review and meta-analysis. Crit. Care. 2014. Vol. 18. P. 711. doi: 10.1186/s13054-014-0711-x.
- Helmerhorst H.J., Roos-Blom M.J., van Westerloo D.J. et al. Association Between Arterial Hyperoxia and Outcome in Subsets of Critical Illness: A Systematic Review, Meta-Analysis, and Meta-Regression of Cohort Studies. Crit. Care Med. 2015. Vol. 43. P. 1508-1519. doi: 10.1097/CCM.0000000000000998.
- Vincent J.L., Taccone F.S., He X. Harmful Effects of Hyperoxia in Postcardiac Arrest, Sepsis, Traumatic Brain Injury, or Stroke: The Importance of Individualized Oxygen Therapy in Critically Ill Patients. Can. Respir. J. 2017. Vol. 2017. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/28246487/. doi: 10.1155/2017/2834956.
- Warner K.J., Cuschieri J., Copass M.K. et al. The impact of prehospital ventilation on outcome after severe traumatic brain injury. J. Trauma. 2007. Vol. 62. P. 1330-1336. doi: 10.1097/TA.0b013e31804a8032.
- Godoy D.A., Seifi A., David Garza D. et al. Hyperventilation Therapy for Control of Posttraumatic Intracranial Hypertension. Front. Neurol. 2017. Vol. 8. P. 250. doi: 10.3389/fneur.2017.00250.
- Mascia L., Zavala E., Bosma K. et al. High tidal volu-me is associated with the development of acute lung injury after severe brain injury: An international observational study. Critical Care Medicine. 2007. Vol. 35(8). P. 1815-1820. doi: 10.1097/01.CCM.0000275269.77467.DF.
- Li J., Gelb A.W., Flexman A.M. et al. Definition, evaluation, and management of brain relaxation during craniotomy. Br. J. Anaesth. 2016. Vol. 116. P. 759-769. https://doi.org/10.1093/bja/aew096
- Zhang Zh., Guo Q., Wang E. Hyperventilation in neurological patients. Current Opinion in Anaesthesiology. 2019. Vol. 32. № 5. P. 568-573. doi: 10.1097/ACO.0000000000000764.
- Liu S., Wan X., Wang S., et al. Posttraumatic cerebral infarction in severe traumatic brain injury: characteristics, risk factors and potential mechanisms. Acta Neurochir. (Wien). 2015. Vol. 157(10). P. 1697-1704. doi: 10.1007/s00701-015-2559-5.
- Godoy D.A., Seifi A., Garza D. et al. Hyperventilation Therapy for Control of Posttraumatic Intracranial Hypertension. Front Neurol. 2017. Vol. 8. P. 250. doi: 10.3389/fneur.2017.00250.
- Asehnoune K., Mrozek S., Perrigault P. F. et al. A Multi-Faceted Strategy to Reduce Ventilation-Associated Mortality in Brain-Injured Patients. The BI-VILI Project: A Nationwide Quality Improvement Project. Intensive Care Med. 2017. Vol. 43(7). P. 957-970. doi: 10.1007/s00134-017-4764-6.
- Della Torre V., Badenes R., Corradi F. et al. Acute respiratory distress syndrome in traumatic brain injury: how do we manage it? J. Thorac. Dis. 2017. Vol. 9(12). P. 5368-5381. doi: 10.21037/jtd.2017.11.03.
- Garg S.K. Permissive hypercapnia: Is there any upper limit? Indian J. Crit. Care Med. 2014. Vol. 18(9). P. 612-614. doi: 10.4103/0972-5229.140154.
- Guérin C., Reignier J., Richard J.C. et al. Prone positioning in severe acute respiratory distress syndrome. N. Engl. J. Med. 2013. Vol. 368(23). P. 2159-2168.
- Oddo M., Citerio G. ARDS in the brain-injured patient: what's different? Intensive Care Med. 2016. Vol. 42(5). P. 790-793. doi: 10.1007/s00134-016-4298-3.
- Durante G., Turco M., Rustichin L. et al. ARDSNet Lower Tidal Volume Ventilatory Strategy May Generate Intrinsic Positive End-Expiratory Pressure in Patients with Acute Respiratory Distress Syndrome. Am. J. Respir. Crit. Care Med. 2002. Vol. 165. P. 1271-1274. doi: 10.1164/rccm.2105050.
- Boone M.D., Jinadasa S.P., Mueller A. et al. The Effect of Positive End-Expiratory Pressure on Intracranial Pressure and Cerebral Hemodynamics. Neurocrit Care. 2017. Vol. 26(2). P. 174-181. doi: 10.1007/s12028-016-0328-9.
- Mascia L., Grasso S., Fiore T. et al. Cerebro-pulmonary interactions during the application of low levels of positive end-expiratory pressure. Intensive Care Med. 2005. Vol. 31. P. 373-379. https://doi.org/10.1007/s00134-004-2491-2
- Nemer S.N., Caldeira J.B., Santos R.G. et al. Effects of positive end-expiratory pressure on brain tissue oxygen pressure of severe traumatic brain injury patients with acute respiratory distress syndrome: A pilot study. J. Crit. Care. 2015. Vol. 30(6). P. 1263-1266. doi: 10.1016/j.jcrc.2015.07.019.
- Oddo M., Crippa I.A., Mehta S. et al. Optimizing sedation in patients with acute brain injury. Crit. Care. 2016. Vol. 20(1). P. 128. doi: 10.1186/s13054-016-1294-5.
- Luo X.Y., He X., Zhou Y.M. et al. Patient-ventilator asynchrony in acute brain-injured patients: a prospective observatio-nal study. Ann. Intensive Care. 2020. Vol. 10. P. 144. https://doi.org/10.1186/s13613-020-00763-8
- Torbic H., Duggal A. Neuromuscular blocking agents for acute respiratory distress syndrome. J. Crit Care. 2019. Vol. 49. P. 179-184. doi: 10.1016/j.jcrc.2018.10.019.
- Alhazzani W., Belley-Cote E., Møller M.H. et al. Neuromuscular blockade in patients with ARDS: a rapid practice guideline. Intensive Care Med. 2020. Vol. 46(11). P. 1977-1986. doi: 10.1007/s00134-020-06227-8.
- Sanfilippo F., Santonocito C., Veenith T. et al. The Role of Neuromuscular Blockade in Patients with Traumatic Brain Injury: A Systematic Review. Maybauer. Neurocrit. Care. 2015. Vol. 22. P. 325-334. doi: 10.1007/s12028-014-0061-1.
- Price D.R., Mikkelsen M.E., Umscheid C.A., Armstrong E.J. Neuromuscular Blocking Agents and Neuromuscular Dysfunction Acquired in Critical Illness: A Systematic Review and Meta-Analysis. Crit. Care Med. 2016. Vol. 44(11). P. 2070-2078. doi: 10.1097/CCM.0000000000001839.
- Apostolakis E., Papakonstantinou N.A., Baikoussis N.G. et al. Intensive care unit-related generalized neuromuscular weakness due to critical illness polyneuropathy/myopathy in critically ill patients. J. Anesth. 2015. Vol. 29. P. 112-121. https://doi.org/10.1007/s00540-014-1875-x
- Rajajee V., Riggs B., Seder D.B. Emergency Neurological Life Support: Airway, Ventilation, and Sedation. Neurocrit. Care. 2017. Vol. 27 (Suppl 1). P. 4-28. doi: 10.1007/s12028-017-0451-2.
- Aghadavoudi O., Alikiaii B., Sadeghi F. Comparison of respiratory and hemodynamic stability in patients with traumatic brain injury ventilated by two ventilator modes: Pressure regulated volume control versus synchronized intermittent mechanical ventilation. Adv. Biomed. Res. 2016. Vol. 5. P. 175. doi: 10.4103/2277-9175.190991.
- Godet T., Chabanne R., Marin J. et al. Extubation Failure in Brain-injured Patients: Risk Factors and Development of a Prediction Score in a Preliminary Prospective Cohort Study. Anesthesiology. 2017. Vol. 126. P. 104-114. doi: https://doi.org/10.1097/ALN.0000000000001379.
- Asehnoune K., Seguin P., Lasocki S. et al. Extubation Success Prediction in a Multicentric Cohort of Patients with Severe Brain Injury. Critical. Care Medicine. 2017. Vol. 127. P. 338-346. doi: 10.1097/ALN.0000000000001725.
- Lin W.C., Chen C.W., Wang J.D., Tsai L.M. Is tracheostomy a better choice than translaryngeal intubation for critically ill patients requiring mechanical ventilation for more than 14 days? A comparison of short-term outcomes. BMC Anesthesiol. 2015. Vol. 15. P. 181. doi: 10.1186/s12871-015-0159-9.
- Young D., Harrison D.A., Cuthbertson B.H. et al. Effect of early vs late tracheostomy placement on survival in patients receiving mechanical ventilation: the TracMan randomized trial. JAMA. 2013. Vol. 309(20). P. 2121-2129. doi: 10.1001/jama.2013.5154.
- Hyde G.A., Savage S.A., Zarzaur B.L. et al. Early tracheostomy in trauma patients saves time and money. Injury. 2015. Vol. 46(1). P. 110-114. doi: 10.1016/j.injury.2014.08.049.

/32.jpg)