Журнал «Медицина неотложных состояний» Том 17, №8, 2021
Вернуться к номеру
Роль магнію в лікуванні стану відміни алкоголю з делірієм
Авторы: Гаврилов О.О., Гомон М.Л.
Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
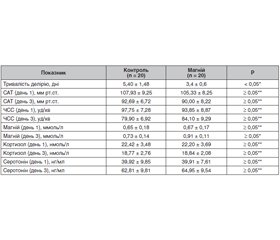
Актуальність. На сьогодні роль магнію в лікуванні алкогольного делірію є невизначеною, хоча відомо про його участь в патогенезі цього тяжкого стану. Мета дослідження: виявлення переваг і недоліків седації з додаванням магнію сульфату порівняно зі стандартною седативною терапією. Матеріали та методи. Досліджено 40 пролікованих пацієнтів, які були рандомізовані на 2 групи. Рівень седації контролювався за Richmond agitation-sedation scale та утримувався в діапазоні від 0 до –2 балів. У всіх групах оцінювалися параметри: тривалість делірію, середній артеріальний тиск (САТ), пульс, магній, кортизол і серотонін плазми, лабораторні показники стану нирок і печінки. У контрольній групі проводилася седація 10–20 мг діазепаму кожні 4–6 годин з інфузією барбітуратів при необхідності. У дослідній групі лікування було ідентичним із додаванням магнію сульфату 50 мг/кг кожні 8 годин. Результати. Тривалість делірію була вірогідно нижчою в дослідній групі порівняно з контролем, p < 0,05. Гіпомагніємію виявлено майже в половини пацієнтів. При порівнянні показників гемодинаміки виявлено вірогідне зниження САТ та частоти серцевих скорочень на третій день в обох групах, p < 0,05. У дослідній групі виявлено 4 випадки (20 %) гіпотонії, у контрольній групі — 2 випадки (10 %). При дослідженні динаміки кортизолу та серотоніну виявлено вірогідну різницю на третій день в обох групах, p < 0,05. Вірогідної різниці в цих показниках на третій день між групами не виявлено, p ≥ 0,05. Лабораторні показники стану печінки та нирок в обох групах не відрізнялися, p ≥ 0,05. Висновки. Використання магнію сульфату дозволяє зменшити тривалість делірію, але має надлишковий вплив на гемодинаміку. Ефект магнезії не верифікується такими біомаркерами, як кортизол і серотонін.
Background. The role of magnesium in the treatment of alcohol withdrawal with delirium is indefinite, although it is well known about its participation in the pathogenesis of this severe condition. The study was aimed to reveal the benefits and disadvantages of the sedation with added magnesium sulfate in comparison with traditional sedative therapy. Materials and methods. In our study, we tested 40 treated patients, which were randomized in two groups. We controlled the level of sedation by the Richmond agitation-sedation scale. The target level of sedation was between 0 and –2 points. We maintained this level in all the patients. In all groups, we evaluated the following values: duration of delirium, mean arterial pressure, pulse, the level of serum magnesium, cortisol and serotonin, laboratory indicators of kidneys, and liver condition. In the control group, we carried out the sedation with 10–20 mg of diazepam every 4–6 hours with infusion of barbiturates as needed. The treatment in the research group was identical with addition of magnesium sulfate 50 mg/kg every 8 hours. Results. The results of the study demonstrated that the duration of delirium is significantly lower in the research group in comparison with the control (p < 0.05). We found hypomagnesemia in almost half of the patients. The indicators of haemodynamics such as mean arterial pressure and pulse were significantly lower in both groups on the third day (p < 0.05). We found 4 cases (20 %) of hypotension in the research group and 2 cases (10 %) in the control group. The study of the dynamics of serum cortisol and serotonin showed the significant difference on the third day in both groups (p < 0.05). We found no difference in these laboratory parameters on the third day between groups (p ≥ 0.05). There was no significant difference between the laboratory indicators of kidneys and liver condition in both groups (p ≥ 0.05). Conclusions. The use of magnesium sulfate allowed decreasing the duration of delirium but had an excessive effect on haemodynamics. Such biomarkers as serum cortisol and serotonin didn’t verify the effect of magnesium sulfate.
магній; седація; стан відміни алкоголю; делірій
magnesium; sedation; alcohol withdrawal; delirium
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Langlois H., Cormier M., Villeneuve E., Hoffman R.S., Longo C., Gosselin S. Benzodiazepine resistant alcohol withdrawal: What is the clinician’s preferred definition? CJEM. 2020. № 22(2). Р. 165-169.
- Calixto E. GABA withdrawal syndrome: GABAA receptor, synapse, neurobiological implications and analogies with other abstinences. Neuroscience. 2016. № 313. Р. 57-72.
- Hansen A.W., Almeida F.B., Bandiera S., Pulcinelli R.R., Caletti G., Agnes G., Fernandes de Paula L., Nietiedt N.A., Nin M.S., Tannhauser Barros H.M., Gomez R. Correlations between subunits of GABAA and NMDA receptors after chronic alcohol treatment or withdrawal, and the effect of taurine in the hippocampus of rats. Alcohol. 2020. № 82. Р. 63-70.
- Hou H., Wang L., Fu T., Papasergi M., Yule D.I., Xia H. Magnesium Acts as a Second Messenger in the Regulation of NMDA Receptor-Mediated CREB Signaling in Neurons. Mol. Neurobiol. 2020. № 57(6). Р. 2539-2550.
- Sarai M., Tejani A.M., Chan A.H., Kuo I.F., Li J. Magnesium for alcohol withdrawal. Cochrane Database Syst. Rev. 2013. doi: 10.1002/14651858.CD008358.pub2. PMID: 23740536.
- Maguire D., Ross D.P., Talwar D., Forrest E., Naz Abbasi H., Leach J.P., Woods M., Zhu L.Y., Dickson S., Kwok T., Waterson I., Benson G., Scally B., Young D., McMillan D.C. Low serum magnesium and 1-year mortality in alcohol withdrawal syndrome. Eur. J. Clin. Invest. 2019. № 49(9). doi: 10.1111/eci.13152. Epub 2019 Jul 1. PMID: 31216056.
- Yoldas H., Yildiz I., Karagoz I., Sit M., Ogun M.N., Demirhan A., Bilgi M. Effects of Bispectral Index-controlled Use of Magnesium on Propofol Consumption and Sedation Level in Patients Undergoing Colonoscopy. Medeni Med. J. 2019. № 34(4). Р. 380-386.
- Diringer M. Neurologic manifestations of major electrolyte abnormalities. Handb. Clin. Neurol. 2017. № 141. Р. 705-713.
- Ishida Y., Tabuchi A. Severe Hypermagnesemia with Normal Renal Function Can Improve with Symptomatic Treatment. Case Rep. Emerg. Med. 2020. doi: 10.1155/2020/2918249. PMID: 32733713; PMCID: PMC7376418.
- Kurajoh M., Ohsugi K., Kakutani-Hatayama M., Shoji T., Koyama H. Hypokalemia associated with pseudo-Cushing’s syndrome and magnesium deficiency induced by chronic alcohol abuse. CEN Case Rep. 2018. № 7(1). Р. 148-152.
- Kirkland A.E., Sarlo G.L., Holton K.F. The Role of Magnesium in Neurological Disorders. Nutrients. 2018. № 10(6). Р. 730.
- Vink R. Magnesium in the CNS: recent advances and developments. Magnes Res. 2016. № 29(3). Р. 95-101.
- Van Laecke S. Hypomagnesemia and hypermagnesemia. Acta Clin. Belg. 2019. № 74(1). Р. 41-47.
- Ismail A.A.A., Ismail Y., Ismail A.A. Chronic magnesium deficiency and human disease; time for reappraisal? QJM. 2018. № 111(11). Р. 759-763.
- Dyal S., MacLaren R. The Assessment and Management Practices of Acute Alcohol Withdrawal: Results of a Nationwide Survey of Critical Care Pharmacists. Hosp. Pharm. 2019. № 54(1). Р. 22-31.
- Виноградов Д.Б., Синицкий А.И. Лабораторные предикторы тяжести алкогольного делирия. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015. № 115. С. 9-13.
- Jochum T., Hoyme J., Schulz S., Weißenfels M., Voss A., Bär K.J. Diverse autonomic regulation of pupillary function and the cardiovascular system during alcohol withdrawal. Drug. Alcohol. Depend. 2016. № 159. Р. 142-151.

/54.jpg)