Архив офтальмологии Украины Том 10, №1, 2022
Вернуться к номеру
Прогресування початкових стадій діабетичної непроліферативної ретинопатії та маркери глікування при цукровому діабеті 2-го типу
Авторы: Коробов К.В.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
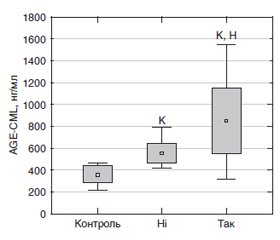
Актуальність. В розвитку та прогресуванні непроліферативної діабетичної ретинопатії (НПДР) при цукровому діабеті 2-го типу (ЦД2) важлива роль належить активності процесу глікування білків та утворення досконалих кінцевих продуктів глікації (Advanced Glicated End Products, AGE). Мета: встановити зв’язок маркерів глікування — карбоксиметил-лізину (AGE-CML) і циркулюючого рецептора AGE (sRAGE) із прогресією початкових стадій непроліферативної діабетичної ретинопатії в пацієнтів з цукровим діабетом 2-го типу. Матеріали та методи. Був обстежений 91 пацієнт (182 ока) з ЦД2 віком від 42 до 80 років. До контрольної групи було залучено 25 осіб відповідного віку. На момент первинного обстеження та через 1 рік була встановлена стадія НПДР відповідно до модифікованої ETDRS системи клінічних ознак Airlie House. Вміст маркерів глікування визначали імуноферментним методом у плазмі крові. Для статистичних досліджень використані програмні пакети MedStat і MedCalc v.15.1 (MedCalc Software bvba). Результати. Початкові прояви діабетичного ураження сітківки проявлялися у 27,5 % пацієнтів, починалися через 7,16 ± 1,11 року та супроводжувались більшою глікемією. Вміст AGE-CML при ЦД2 був суттєво збільшеним порівняно з контролем, що було більш вираженим за наявності початкових змін сітківки — він був у 1,3 раза більшим, ніж у пацієнтів без таких змін (р = 0,015). Вміст sRAGE багаторазово зменшувався, що також було пов’язано з наявністю діабетичних змін сітківки — за їх наявності він був у 2,2 раза нижчим (p < 0,001). Вміст AGE-CML був суттєво більшим (в 1,5 раза; p < 0,001) за наявності прогресії НПДР протягом 1 року спостереження, ніж без неї. Вміст sRAGE за наявності прогресії був у 1,6 раза (p < 0,001) нижчим. Висновки. Початкові прояви діабетичного ураження сітківки відзначались у 27,5 % пацієнтів, починались через 7,16 ± 1,11 року та супроводжувались більшою глікемією. Вміст AGE-CML при ЦД2 був збільшеним порівняно з контролем, що було більш вираженим за наявності початкових змін сітківки — він був у 1,3 раза більшим, ніж у пацієнтів без таких змін (р = 0,015). Вміст sRAGE зменшувався, що також було пов’язано з наявністю змін сітківки, і був у 2,2 раза нижчим (p < 0,001). Прогресування НПДР було пов’язано з початковим вмістом маркерів глікування протягом 1 року спостереження. Вміст AGE-CML був більшим у 1,5 раза (p < 0,001) за наявності прогресії діабетичної ретинопатії, ніж без неї. Вміст sRAGE за наявності прогресії був у 1,6 раза (p < 0,001) нижчим, ніж без неї. Через 1 рік була встановлена залежність вираженості НПДР від початкового вмісту продуктів глікування, і найбільші зміни відзначались при помірній НПДР: приріст AGE-CML був максимальним, а sRAGE сягав мінімальних значень.
Background. In the development and progression of non-proliferative diabetic retinopathy (NPDR) with type 2 diabetes mellitus, an important role belongs to the activity of the protein glycation process and the formation of advanced glycation end-products (AGE). The purpose was to establish a correlation between glycation markers — carboxymethyl lysine (AGE-CML) and circulating soluble receptor for AGE (sRAGE) — with the progression of initial stages of non-proliferative diabetic retinopathy in patients with type 2 diabetes. Material and methods. Ninety-one patients (182 eyes) with diabetes mellitus aged 42 to 80 years were examined. The control group included 25 people of the corresponding age. At the time of primary assessment and one year later, the NPDR stage was established according to the modified ETDRS system of clinical signs Airlie House. The content of glycation markers was determined by enzyme-linked immunosorbent assay in the blood plasma. MedStat and MedCalc v.15.1 (MedCalc Software bvba) software packages were used for statistical processing. Results. The initial manifestations of diabetic retinal lesions occurred in 27.5 % of patients, began after 7.16 ± 1.11 years and were accompanied by higher glycemia. The content of AGE-CML in diabetes mellitus was increased significantly compared to controls that was more pronounced in the presence of initial retinal changes — it was 1.3 times higher than in patients without such changes (p = 0.015). The level of sRAGE decreased several times, which was also associated with diabetic retinal changes — in their presence, it was 2.2 times lower (p < 0.001). The content of AGE-CML was significantly higher (1.5 times; p < 0.001) in NPDR progression during one year of observation than without it. The level of sRAGE in the presence of progression was 1.6 times (p < 0.001) lower. Conclusions. 1. The initial manifestations of diabetic retinal lesions were detected in 27.5 % of patients, began after 7.16 ± 1.11 years and were accompanied by higher glycemia. 2. The content of AGE-CML in diabetes mellitus was significantly increased compared to controls that was more pronounced in the presence of initial changes in the retina (1.3 times higher than in patients without such changes; p = 0.015). The level of sRAGE decreased several times, which was also associated with diabetic retinal changes (in their presence, it was 2.2 times lower; p < 0.001). 3. The progression of NPDR was associated with the initial content of glycation markers during one year of follow-up. The level of AGE-CML was significantly higher (1.5 times; p < 0.001) in diabetic retinopathy progression than without it. The content of sRAGE in the presence of progression was 1.6 times (p < 0.001) lower than without it. 4. Stratification by the stage of retinopathy after one year of observation showed the dependence of the severity of diabetic changes on the initial content of glycation products — the most significant changes were observed in moderate NPDR. In these cases, an increase in AGE-CML was highest, and sRAGE reached lowest values.
Advanced Glicated End Products; AGE-CML; sRAGE; непроліферативна діабетична ретинопатія; прогресування; цукровий діабет 2-го типу
advanced glycation end-products; AGE-CML; sRAGE; non-proliferative diabetic retinopathy; progression; type 2 diabetes mellitus
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Ulyte A., Bähler C., Schwenkglenks M., von Wyl V., Gruebner O., Wei W., Blozik E., Brüngger B., Dressel H. Measuring diabetes guideline adherence with claims data: systematic construction of indicators and related challenges. BMJ Open. 2019 Apr 24. 9(4). e027138. doi: 10.1136/bmjopen-2018-027138.
- Kowall B., Rathmann W., Stang A., Bongaerts B., Kuss O., Herder C., Roden M., Quante A., Holle R., Huth C., Peters A., Meisinger C. Perceived risk of diabetes seriously underestimates actual diabetes risk: The KORA FF4 study. PLoS One. 2017 Jan 31. 12(1). e0171152. doi: 10.1371/journal.pone.0171152.
- Heidemann C., Paprott R., Stühmann L.M., Baumert J., Mühlenbruch K., Hansen S., Schiborn C., Zahn D., Gellert P., Scheidt-Nave Ch. Perceived diabetes risk and related determinants in individuals with high actual diabetes risk: results from a nationwide population-based survey. BMJ. Open Diabetes Res Care. 2019 Jun 21. 7(1). e000680. doi: 10.1136/bmjdrc-2019-000680.
- Khan R.M., Chua Z.J., Tan J.C., Yang Y., Liao Z., Zhao Y. From pre-diabetes to diabetes: diagnosis, treatments and translational research. Medicina. Kaunas. 2019 Aug 29. 55(9). 546. doi: 10.3390/medicina55090546.
- Lotfy M., Adeghate J., Kalasz H., Singh J., Adeghate E. Chronic complications of diabetes mellitus: a mini review. Curr. Diabetes Rev. 2017. 13(1). 3-10. doi: 10.2174/1573399812666151016101622.
- Davies M.J., D’Alessio D.A., Fradkin J., Kernan W.N., Mathieu C., Mingrone G., Rossing P., Tsapas A., Wexler D.J., Buse J.B. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2018 Dec. 41(12). 2669-701. doi: 10.2337/dci18-0033.
- Tronko M.D. Priority issues of diabetology in Ukraine at the present stage and ways to solve them. 2020 [Internet]. [cited 20.10.2020]. Available on: http://iem.net.ua/endocrinology_task/ [in Ukrainian]
- Nowak M.S., Grzybowski A. Rewie of the epidemiology of diabetic retinopathy [Internet]. Modern Retina. Ophtalmology Times. 2018 June 11. Available from: https://www.modernretina.com/diabetic-retinopathy/review-epidemiology-diabetic-retinopathy
- Internetional Diabetes Federation and The Fred Hollows Fundation. Diabetes eye health: A guide for health care professionals. Brussel, Belgium: International Diabetic Federation [Internet], 2015 [cited 15.07.20]. Р. 10. Available from: https://idf.org/our-activities/care-prevention/eye-health/eye-health-guide.html#sub-content-tab-nav
- Kirsch S., Iroku-Malize T. Eye conditions in older adults: diabetic retinopathy. FP Essent. 2016 Jun. 445. 29-37. 38-9.
- Safi H., Safi S., Ali H.-M., Hamid A. Early detection of diabetic retinopathy. Survey of Ophthalmology. 2018 Apr. 63(5). 601-8. doi: 10.1016/j.survophthal.2018.04.003.
- Voigt M., Schmidt S., Lehmann T., Köhler B., Kloos C., Voigt U.A., Meller D., Wolf G., Müller U.A., Müller N. Prevalence and Progression Rate of Diabetic Retinopathy in Type 2 Diabetes Patients in Correlation with the Duration of Diabetes. Exp. Clin. Endocrinol. Diabetes. 2018 Sep. 126(9). 570-6. doi: 10.1055/s-0043-120570.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading diabetic retinopathy from stereoscopic color fundus photographs — an extension of the modified Airlie house classification: ETDRS report № 10. Ophthalmology. 2020 Apr. 127(4S). 99-119. doi: 10.1016/j.ophtha.2020.01.030.
- Perrone A., Giovino A., Benny J., Martinell F. Advanced glycation end products (AGEs): biochemistry, signaling, analytical methods, and epigenetic effects [Internet]. Oxidative Medicine and Cellular Longevity. 2020 Mar 18. 2020. doi.org/10.1155/2020/3818196.
- Yang P., Feng J., Peng Q., Liu X., Fan Z. Advanced glycation end products: potential mechanism and therapeutic target in cardiovascular complications under diabetes [Internet]. Oxidative Medicine and Cellular Longevity. 2019. 2019. 12. doi.org/ 10.1155/2019/9570616. Available from: https://www.hindawi.com/journals/omcl/2019/9570616/
- Fishman S.L., Sonmez H., Basman C., Singh V., Poretsky L. The role of advanced glycation end-products in the development of coronary artery disease in patients with and without diabetes mellitus: a review. Mol. Med. 2018 Nov 23. 24(1). 59. doi: 10.1186/s10020-018-0060-3.
- Аltmann C., Schmidt M.H.H. The role of microglia in diabetic retinopathy: inflammation, microvasculature defects and neurodegeneration. Int. J. Mol. Sci. 2018 Jan 1. 19(1). 110. doi: 10.3390/ijms19010110.
- Egaña-Gorroño L., López-Díez R., Yepuri G., Ramirez L.S., Reverdatto S., Gugger P.F., Shekhtman A. et al. Receptor for advanced glycation end products (RAGE) and mechanisms and therapeutic opportunities in diabetes and cardiovascular disease: insights from human subjects and animal models [Internet]. Front. Cardiovasc. Med. 2020 March 10. doi.org/10.3389/fcvm.2020.
- Kay A.M., Simpson C.L., Stewart J.A. The role of AGE/RAGE signaling in diabetes-mediated vascular calcification. J. Diab. Res. Complic of diab. 2016. 2016. 6. doi.org/10.1155/2016/6809703.
- Scavello F., Zeni F., Tedesco C.C., Mensà E., Veglia F., Procopio A.D., Bonfigli A.R. et al. Modulation of soluble receptor for advanced glycation end-products (RAGE) isoforms and their ligands in healthy aging. Aging (Albany NY). 2019 Mar 23. 11(6). 1648-63. doi: 10.18632/aging.101860.
- Zhuoshi W., Xiaxia Y., Ling Xu, Wei He. Relationship of lens advanced glycosylation end products with diabetic retinopathy [Internet]. Chin. J. Exp. Ophthalmol. 2017. 35(1). 64-8. Available from: https://cjeo-journal.org/relationship-of-lens-advanced-glycosylation-end-products-with-diabetic-retinopathy/
- Ahmad S., Khan H., Siddiqui Z., Khan M.Y. et al. AGEs, RAGEs and s-RAGE; friend or foe for cancer. Semin. Cancer Biol. 2018 Apr. 49. 44-55. doi: 10.1016/j.semcancer.2017.07.001.
- Saleh I., Maritska Z., Parisa N., Hidayat R. Inhibition of Receptor for Advanced Glycation End Products as new promising strategy treatment in Diabetic Retinopathy. Open Access Maced. J. Med Sci. 2019 Oct 14. 7(23). 3921-4. doi: 10.3889/oamjms.2019.759.
- Khan R., Ooi X.Y., Parvus M., Valdez L., Tsin A. Advanced glycation end products: formation, role in diabetic complications, and potential in clinical applications [Internet]. IntechOpen. 2019 Oct 3. doi: 10.5772/intechopen.89408. Available from: https://www.intechopen.com/online-first/advanced-glycation-end-products-formation-role-in-diabetic-complications-and-potential-in-clinical-a.
- Iqbal Z., Morahan G., Arooj M., Sobolev A.N., Hameed S. Synthesis of new arylsulfonylspiroimidazolidine-2',4'-diones and study of their effect on stimulation of insulin release from MIN6 cell line, inhibition of human aldose reductase, sorbitol accumulations in various tissues and oxidative stress. Eur. J. Med. Chem. 2019 Apr 15. 168. 154-75. doi: 10.1016/j.ejmech.2019.02.036.
- Liu C., Ge H.-M., Liu B.-H. et al. Targeting pericyte-endothelial cell crosstalk by circular RNA-cPWWP2A inhibition aggravates diabetes-induced microvascular dysfunction. Proc. Natl. Acad. Sci. USA. 2019 Apr 9. 116(15). 7455-64. doi: 10.1073/pnas.1814874116.
- Moemen L.A., Abdel-Hamid M.A., Wahab S.A., Kenawy M., Abuelela M.H., Hassanin O.A., Fouly M.A., Abdelazeem A.A. et al. Role of advanced glycation end products and sorbitol dehydrogenase in the pathogenesis of diabetic retinopathy. Bull. Natl. Res. Cent. 2020 Apr 19. 58. 44. doi: 10.1186/s42269-020-00304-0.
- Mogilevskyy S.Iu., Bushuieva O.V., Ziablitsev S.V., Natrus L.V. Relationship of the AKR1B1 rs759853 and rs9640883 with the development of diabetic retinopathy. J. ophthalmol. (Ukraine). 2017. 2. 3-7. doi: 10.31288/oftalmolzh2017237.
- Chuang P.Y., Dai Y., Liu R., He H., Kretzler M., Jim B., Cohen C.D., He J.C. Alteration of forkhead box O (foxo4) acetylation mediates apoptosis of podocytes in diabetes mellitus. PLoS One. 2011. 6(8). e23566. doi: 10.1371/journal.pone.0023566.
- Xu J., Chen L.J., Yu J., Wang H.J., Zhang F., Liu Q., Wu J. Involvement of Advanced Glycation End Products in the Pathogenesis of Diabetic Retinopathy. Cell. Physiol. Biochem. 2018. 48(2). 705-717. doi: 10.1159/000491897.

/19.jpg)
/20.jpg)
/20_2.jpg)
/21.jpg)
/21_2.jpg)
/22.jpg)