Архив офтальмологии Украины Том 10, №2, 2022
Вернуться к номеру
Офтальмологічна характеристика та прогноз стадій первинної відкритокутової глаукоми
Авторы: Майденко К.М.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
Актуальність. Існуюче лікування неспроможне відновити глаукоматозне пошкодження ока, однак оптимізація діагностики може запобігти прогресуванню глаукоми та сліпоті. Мета: вивчити офтальмологічні показники при первинній відкритокутовій глаукомі (ПВКГ) різних стадій та оцінити можливість їх прогнозу. Матеріали та методи. Обстежені 92 пацієнти (179 очей) віком від 34 до 91 року (69,5 ± 0,7 року), серед яких жінок було 53 %, чоловіків — 47 %. До контрольної групи увійшло 45 очей без патології. Усім пацієнтам проводили офтальмоскопію, візометрію, периметрію, пневмотонометрію та оптичну когерентну томографію (ОКТ) з визначенням товщини шарів нервових волокон сітківки (RNFL, мкм), комплексу гангліозних клітин макули (GCC, мкм), локального (FLV, %) і загального (GLV, %) потоншення комплексу гангліозних клітин сітківки. Статистичну обробку проводили у програмі EZR v. 1.54 (Австрія) та з використанням модуля лінійних та нелінійних моделей (GLZ) Statistica 10 (StatSoft, Inc., США). Результати. Встановлена пряма лінійна залежність віку та стадії ПВКГ (R2adjusted = 0,70). Гострота зору зменшувалася за стадіями ПВКГ (p < 0,001), тоді як значення середнього та стандартного відхилень при периметричному обстеженні (MD та PSD) наростали (p < 0,001). Товщина RNFL суттєво зменшувалася з мінімальними значеннями при III і IV стадіях (p < 0,001), тоді як FLV і GLV наростали на очах з II і, більшою мірою, III та IV стадіями ПВКГ (p < 0,001). Аналіз стану парних очей показав, що переважна більшість пар (88,4 %) мала однакові стадії ПВКГ або незначну різницю (не більше ніж на 1 стадію). Розроблена модель ймовірності стадії ПВКГ, яка включила MD, RNFL, GCC, FLV і GLV та має точність прогнозу 80,1 % (95% ВІ 73,8–85,7 %). Висновки. Отримані результати дозволили розробити лінійну регресійну модель стадій ПВКГ на підставі комплексної оцінки MD, RNFL та інших показників ОКТ, що може бути клінічно значущим методом діагностики.
Background. Existing treatments are unable to repair glaucomatous eye damage but optimizing the diagnosis may prevent the progression of glaucoma and blindness. This study was aimed to establish the ophthalmic parameters in primary open-angle glaucoma (POAG) of different stages and to assess the possibility of their prognosis. Materials and methods. Ninety-two patients (179 eyes) aged 34 to 91 years (69.5 ± 0.7 years) were examined, of which 53 % were women and 47 % were men. The control group included 45 eyes without pathology. All patients underwent ophthalmoscopy, visometry, perimetry, pneumotonometry and optical coherence tomography (OCT) to determine the thickness of the retinal nerve fiber layers (RNFL, μm), macular ganglion cell complex (GCC, μm), focal (FLV, %) and general loss volume (GLV, %). Statistical processing was performed in the program EZR v.1.54 (Austria), and using the module of linear and nonlinear models (GLZ) Statistica 10 (StatSoft, Inc. USA). Results. A direct linear relationship between age and stage of POAG was established (R2adjusted = 0.70). Visual acuity decreased with the POAG stages (p < 0.001), while the values of mean (MD) and pattern standard deviations during the perimetry increased (p < 0.001). The thickness of RNFL decreased significantly with minimal values in stages III and IV (p < 0.001), while FLV and GLV increased in the eyes with POAG stage II and, to a greater extent, stages III and IV (p < 0.001). Analysis of the paired eyes condition showed that the vast majority of eyes (88.4 %) had the same POAG stages or a slight difference (not more than one stage). The model of the POAG stage probability was developed, which included MD, RNFL, GCC, FLV and GLV and had a prediction accuracy of 80.1 % (95% confidence interval 73.8–85.7 %). Conclusions. The obtained results allowed to develop a linear regression model of POAG stages based on a comprehensive assessment of MD, RNFL and other OCT indicators, which may be a clinically significant method of diagnosis.
глаукома; стадії; лінійна регресія; оптична когерентна томографія
glaucoma; stages; linear regression; optical coherence tomography
Вступ
Матеріали та методи
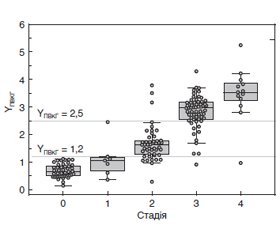
Результати та обговорення
/21_2.jpg)
Обговорення
Висновки
- GBD 2019 Blindness and Vision Impairment Collaborators; Vision Loss Expert Group of the Global Burden of Disease Study. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: the Right to Sight: an analysis for the Global Burden of Disease Study. Lancet Glob. Health. 2021 Feb. 9(2). e144-e160. doi: 10.1016/S2214-109X(20)30489-7.
- Sun Y., Chen A., Zou M., Zhang Y., Jin L., Li Y., Zheng D., Jin G., Congdon N. Time trends, associations and prevalence of blindness and vision loss due to glaucoma: an analysis of observational data from the Global Burden of Disease Study 2017. BMJ Open. 2022 Jan 6. 12(1). e053805. doi: 10.1136/bmjopen-2021-053805.
- Kang J.M., Tanna A.P. Glaucoma. Med. Clin. North Am. 2021 May. 105(3). 493-510. doi: 10.1016/j.mcna.2021.01.004.
- Tham Y.C., Li X., Wong T.Y., Quigley H.A., Aung T., Cheng C.Y. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology. 2014 Nov. 121(11). 2081-90. doi: 10.1016/j.ophtha.2014.05.013.
- Reis T.F., Paula J.S., Furtado J.M. Primary glaucomas in adults: Epidemiology and public health — A review. Clin. Exp. Ophthalmol. 2022 Mar. 50(2). 128-142. doi: 10.1111/ceo.14040.
- Abitbol O. Dépistage et prévention des glaucomes [Glaucoma screening and prevention]. Rev. Prat. 2016 May. 66(5). 496-498. French. PMID: 30512568.
- Kotowski J., Wollstein G., Folio L.S., Ishikawa H., Schuman J.S. Clinical use of OCT in assessing glaucoma progression. Ophthalmic Surg Lasers Imaging. 2011 Jul. 42 (Suppl. 0). S6-S14. doi: 10.3928/15428877-20110627-01.
- Mardin C.Y. Are There Static-Structural Biomarkers for Glaucoma with OCT? Klin. Monbl. Augenheilkd. 2022 Feb. 239(2). 149-157. English, German. doi: 10.1055/a-1688-1601.
- Mardin C.Y. Grundlagen der optischen Kohärenztomographie-basierten Glaukomdiagnostik [Principles of glaucoma diagnostics with optical coherence tomography]. Ophthalmologe. 2015 Aug. 112(8). 639-45. German. doi: 10.1007/s00347-015-0098-3.
- Artero-Castro A., Rodriguez-Jimenez F.J., Jendelova P., VanderWall K.B., Meyer J.S., Erceg S. Glaucoma as a neurodegenerative disease caused by intrinsic vulnerability factors. Prog. Neurobiol. 2020 Oct. 193. 101817. doi: 10.1016/j.pneurobio.2020.101817.
- De Moraes C.G., Liebmann J.M., Levin L.A. Detection and measurement of clinically meaningful visual field progression in clinical trials for glaucoma. Prog. Retin. Eye Res. 2017 Jan. 56. 107-147. doi: 10.1016/j.preteyeres.2016.10.001.
- Baudouin C., Kolko M., Melik-Parsadaniantz S., Messmer E.M. Inflammation in Glaucoma: From the back to the front of the eye, and beyond. Prog. Retin. Eye Res. 2021 Jul. 83. 100916. doi: 10.1016/j.preteyeres.2020.100916.
- Glaucoma. American Optometric Association. 2020 [Internet]. Available from: https://www.aoa.org/healthy-eyes/eye-and-visionconditions/glaucoma?sso = y.
- Terminology and Guidelines for Glaucoma. 4th edition. European Glaucoma Society. Available on: www.eugs.org
- Kanda Y. Investigation of the freely available easy-to-use software 'EZR' for medical statistics. Bone Marrow Transplant. 2013 Mar. 48(3). 452-8. doi: 10.1038/bmt.2012.244.
- Guryanov V.G., Lyakh Yu.E., Pariy V.D., Korotkyi O.V., Chalyi O.V., Chalyi K.O., Tsekhmister Ya.V. Posibnyk z biostatystyky. Analiz rezul’tativ medychnykh doslidzhen’ u paketi EZR (R-statistics) [Handbook of Biostatistics. Analysis of the results of medical research in the package EZR (R-statistics)]. Kyiv: News, 2018. 208. Ukrainian.
- Saba T., Bokhari S.T.F., Sharif M., Yasmin M., Raza M. Fundus image classification methods for the detection of glaucoma: A review. Microsc. Res. Tech. 2018 Oct. 81(10). 1105-1121. doi: 10.1002/jemt.23094.
- Lešták J., Fůs M., Bartošová L., Marešová K. OCT angiography, visual field and RNFL with various medications in hypertensive glaucomas. Cesk. Slov. Oftalmol. 2021 Winter. 77(6). 285-288. doi: 10.31348/2021/33.
- Brusini P. OCT Glaucoma Staging System: a new method for retinal nerve fiber layer damage classification using spectral-domain OCT. Eye (Lond). 2018 Jan. 32(1). 113-119. doi: 10.1038/eye.2017.159.
- Koprowski R., Rzendkowski M., Wróbel Z. Automatic method of analysis of OCT images in assessing the severity degree of glaucoma and the visual field loss. Biomed Eng Online. 2014 Feb 14. 13. 16. doi: 10.1186/1475-925X-13-16.
- Sánchez-Pulgarín M., Saenz-Frances F., Martinez-de-la-Casa J.M., García-Feijoó J., Ferreras-Amez A., Pablo L.E. Structure-function relationship in a series of glaucoma cases. J. Fr. Ophtalmol. 2020 Feb. 43(2). 111-122. doi: 10.1016/j.jfo.2019.07.009.

/19.jpg)
/20.jpg)
/20_2.jpg)
/21_3.jpg)
/22.jpg)