Комбінації глюкокортикоїдів (ГК) із протимікробними препаратами широко застосовуються офтальмологами для лікування різної офтальмологічної патології: алергічних та інфекційно-запальних захворювань очей — дерматитів повік, блефаритів, кератитів, кератокон’юнктивітів, кон’юнктивітів, увеїтів, симпатичної офтальмії, для профілактики й лікування запальних явищ після травм і операцій, відновлення прозорості рогівки й пригнічення неоваскуляризації після перенесених кератитів, хімічних, радіаційних і термічних опіків (після повної епітелізації рогівки). Клінічно симптоми запалення ока проявляються ін’єкцією/гіперемією, подразненням, порушенням зору, болем, хемозом/набряком, виділеннями з ока, відчуттям стороннього предмета, сухістю, свербінням. Запалення може зберігатися навіть після видалення тригера і за відсутності лікування може призвести до тимчасової або постійної втрати зору [1, 2].
До останнього часу в Україні найчастіше застосовувалися комбінації на основі дексаметазону, змінювався лише протимікробний компонент — тобраміцин, гентаміцин, неоміцин і поліміксин тощо. Глюкокортикоїди — це найпотужніші універсальні протизапальні препарати, які мають виражену імуномодулювальну активність і визначають швидкість і ефективність дії таких комбінацій [3].
На сьогодні золотим стандартом у лікуванні запальних захворювань очей є топічні глюкокортикоїди, які зберігають структурну цілісність тканин ока [2, 6, 7]. Їх ефекти реалізуються за рахунок двох механізмів дії — геномного й негеномного [7]. Геномний механізм дії забезпечується шляхом зв’язування ГК з цитоплазматичним рецептором і проникнення цього комплексу в ядро клітини. Активований комплекс «ГК — рецептор» з’єднується з ДНК і стимулює утворення інформаційної РНК. У результаті трансляції РНК на рибосомах синтезуються різні регуляторні білки. Одним з найважливіших є ліпокортин, який інгібує фермент фосфоліпазу А2 і тим самим гальмує синтез простагландинів і лейкотрієнів, що відіграють ключову роль у розвитку запальної реакції. Для прояву повного геномного ефекту ГК необхідно не менше за 30 хв, причому ефект спостерігається при будь-якій терапевтичній дозі [4, 5].
Негеномний протизапальний ефект ГК пов’язують зі стабілізацією лізосомальних мембран, зменшенням проникності клітинних мембран, капілярної проникності й локального кровотоку в ділянках запалення, зниженням здатності імунних комплексів проникати через базальну мембрану, пригніченням міграції та акумуляції лейкоцитів у вогнищі запалення, гальмуванням росту фібробластів, пригніченням синтезу колагену [5, 7].
Отже, ГК забезпечують широкий спектр протизапальної дії, що, на жаль, супроводжується не менш широким спектром побічних ефектів, які включають очну гіпертензію, утворення задньої субкапсулярної катаракти, витончення рогівки й суперінфекцію умовно-патогенними мікроорганізмами [5, 9, 10]. Згідно з численними дослідженнями, підвищення внутрішньоочного тиску (ВОТ) при застосуванні глюкокортикоїдів обумовлене низкою механізмів: пригніченням активності ферменту NO-синтази, що зменшує продукцію оксиду азоту, підвищенням епісклерального венозного тиску внаслідок вазоконстрикції, спричиненої ГК, підвищенням осмолярності водянистої вологи за рахунок зміни секреції електролітів циліарними відростками, підвищенням синтезу мукополісахаридів трабекулярної сітки і зміною організації актину в його клітинах, пригніченням фагоцитозних властивостей ендотеліальних клітин трабекулярної сітки [2, 5, 9, 11, 12].
Прагнучи звести до мінімуму небажані реакції та інші ускладнення, пов’язані з глюкокортикоїдами, професор Ніколас Бодор (Університет Флориди) і його колеги вперше розробили концепцію дизайну ретрометаболічних препаратів для офтальмологічної терапії. Це технологія створення нової молекули з кращим профілем безпеки, передбачуваним метаболізмом і покращенням властивостей вихідної молекули на основі її неактивного метаболіту. Основними завданнями в розробці нових ліків були: висока метаболічна стабільність; висока ліпофільність, розподіл у тканинах; зв’язування з рецепторами; швидка метаболічна деактивація. Дослідники синтезували з Δ1-кортієнової кислоти (неактивного метаболіту преднізолону) за допомогою хімічних замін близько 100 нових молекул, серед яких найбільш перспективною була молекула лотепреднолу етабонату (ЛЕ) [2, 13].
Лотепреднолу етабонат відкриває нові можливості в лікуванні запальних захворювань очей
Лотепреднолу етабонат являє собою складноефірний стероїд, що містить хлорметиловий ефір замість кетонової групи в положенні вуглецю 20 (рис. 1). ЛЕ зберігає високу протизапальну активність преднізолону, забезпечуючи швидкий і передбачуваний метаболізм, знижує ризик значного підвищення ВОТ та утворення катаракти, покращуючи безпеку застосування. Незв’язаний ЛЕ швидко розщеплюється локалізованими тканинними естеразами до неактивного метаболіту [2, 13, 14].
/53.jpg)
На відміну від дексаметазону новий глюкортикоїд — лотепреднолу етабонат має безперечні переваги. Він відзначається вираженою протизапальною активністю, за якою в 1,5 раза перевершує дексаметазон; високим ступенем ліпофільності, у 10 раз вищим за такий у дексаметазону; високою спорідненістю і здатністю до зв’язування з ГК-рецепторами людини, яка в 4,3 раза вище, ніж у дексаметазону; посиленим проникненням через біологічні мембрани, що забезпечує високу протизапальну активність; швидкою метаболічною деактивацією для підвищення безпеки застосування [2, 13].
Важливою характеристикою безпеки глюкокортикоїдів є терапевтичний індекс — співвідношення середньої токсичної дози (TD50) і середньої ефективної дози (ED50). Вище значення терапевтичного індексу є кращим за низьке: пацієнту доведеться прийняти набагато більшу дозу такого препарату, щоб досягти порога токсичності, ніж доза, яку приймають для досягнення терапевтичного ефекту. Для ЛЕ характерний високий терапевтичний індекс, який у 20 разів більший порівняно з іншими глюкокортикоїдами, що свідчить про кращий профіль безпеки лотепреднолу етабонату [2, 13, 15].
В експериментальному дослідженні S.S. Samudre et al. [16] доведено, що лотепреднолу етабонат є потужним глюкокортикоїдом. При введенні ЛЕ, дексаметазону, фторметолону, преднізолону ацетату кролям з переднім увеїтом, індукованим введенням ендотоксину, протягом 24 або 72 год було встановлено, що ЛЕ має найвищий ступінь поглинання ГК-рецепторами в різні часові проміжки порівняно з іншими глюкокортикоїдами й фізіологічним розчином, а також більшу протизапальну активність щодо зменшення кількості запальних клітин у стромі й епітелії рогівки (рис. 2).
Клінічна ефективність ЛЕ також була продемонстрована при лікуванні сухості очей у пацієнтів із затримкою слізного кліренсу. У пацієнтів з помірним або тяжким запаленням спостерігалася значна різниця між групами ЛЕ і плацебо після двох тижнів лікування [17].
У рандомізованому плацебо-контрольованому дослідженні з паралельними групами на базі 14 клінік було продемонстровано, що лікування дорослих пацієнтів з гігантським папілярним кон’юнктивітом, пов’язаним з носінням контактних лінз (n = 223), 0,5% лотепреднолу етабонатом значно перевершує плацебо щодо таких клінічних ознак, як свербіж (95 % vs 81 %) і виділення з ока (87 % vs 77 %). Також спостерігалось покращання стану сосочків принаймні на один ступінь порівняно з пацієнтами, які отримували плацебо (78 % vs 51 %). Обидва методи лікування добре переносилися, і ніяких серйозних несподіваних ускладнень, пов’язаних з лікуванням, зареєстровано не було. Лише у 8 з 109 пацієнтів було визначено підвищення ВОТ на 10 мм рт.ст. (7 %, усі приймали лотепреднол), який повертався до нормального рівня після припинення терапії [19].
Ефективність і безпека лікування запалення очей лотепреднолу етабонатом з приводу хірургії ока була продемонстрована в дослідженні E.J. Holland (2008). У пацієнтів з трансплантацією рогівки при переході з преднізолону на ЛЕ в післяопераційному періоді через 3 тижні лікування зниження ВОТ становило 32,6 %, через 39 тижнів — 44,9 % [18]. У дослідженні М. Amon et al. [20] призначення ЛЕ було ефективним і більш безпечним у пацієнтів із запаленням очей після хірургічного лікування катаракти порівняно з преднізолону ацетатом і дексаметазоном.
Тобраміцин — ефективний компонент комбінованого засобу для лікування інфекційно-запальних захворювань очей
Залежно від дії усі антибактеріальні препарати поділяються на антибіотики з бактеріостатичною дією (тетрацикліни, макроліди, сульфаніламіди, хлорамфенікол, фузидова кислота), які затримують ріст і розмноження бактерій, і препарати з бактерицидною дією (β-лактами, фторхінолони, ванкоміцин, аміноглікозиди), при якій спостерігається загибель бактерій за рахунок пригнічення синтезу клітинної стінки [21].
При лікуванні запальних захворювань очей перевага надається антибактеріальним засобам, які чинять бактерицидну дію, мають широкий спектр дії, високу проникаючу здатність, низький рівень резистентності збудників, низьку токсичність, добру переносимість, а також зручність використання й дозування [2]. Усім цим умовам відповідає аміноглікозид ІІ покоління — тобраміцин.
Тобраміцин чинить бактерицидну дію, що пов’язана з порушенням синтезу білка рибосомами. Він зв’язується з полірибосомами, порушує зчитування мРНК і викликає передчасне закінчення трансляції, пригнічуючи таким чином синтез білка. Аномальні білки, що утворюються, вбудовуючись у цитоплазматичну мембрану, можуть змінювати її проникність і прискорювати проникнення аміноглікозидів усередину клітини [22].
Тобраміцин — аміноглікозидний антибіотик, який має широкий спектр дії. Він активний щодо грампозитивних і грамнегативних бактерій. Доведена його активність відносно стафілококів (Staphylococcus aureus і Staphylococcus epidermidis, включно з метицилінорезистентними й пеніцилінорезистентними Staphylococcus aureus), стрептококів (зокрема, деякі бета-гемолітичні види групи А, деякі негемолітичні й деякі Streptococcus pneumonia). Серед грамнегативних бактерій Pseudomonas aeruginosa (аміноглікозиди ІІ–ІІІ поколінь), Escherichia coli, Klebsiella pneumoniae, Enterobacter spp., Haemophilus influenzae, Haemophilus aegyptius, Moraxella spp., Morganella morganii, Serratia marcescens, деякі види Neisseria [22, 23].
Вивчення ефективності аміноглікозидів дозволило встановити, що аміноглікозиди ІІ покоління гентаміцин і тобраміцин більш ефективні за неоміцин. Останній призначається місцево завжди в комбінації з іншими засобами [22, 24]. Тобраміцин і гентаміцин мають подібний спектр дії, але тобраміцин більш активний щодо Pseudomonas aeruginosa і деяких інших грамнегативних бактерій, тому перекриває спектр найбільш частих збудників очних інфекцій [25].
Ефективність і безпека призначення тобраміцину в офтальмологічній практиці для профілактики й лікування запальних захворювань, після очних операцій і травм ока доведена в кількох клінічних дослідженнях. У 12-денному дослідженні K. Kernt et al. [29] за участю 276 пацієнтів з бактеріальними запальними захворюваннями ока була доведена ефективність 0,3% тобраміцину як у формі очних крапель, так і у формі суспензії. Ерадикація збудників становила 99 і 98 % відповідно. Також відмічалась добра переносимість терапії, небажані явища не були серйозними — легкого або середнього ступеня тяжкості, і вони, як правило, не перешкоджали продовженню дослідження.
У другому дослідженні при використанні 0,3% тобраміцину в пацієнтів з кератитом, іридоциклітом, проникаючими й непроникаючими пораненнями ока, у післяопераційному періоді після хірургії катаракти й глаукоми позитивна динаміка в лікуванні була відзначена на 3–5-й день у 76 % пацієнтів, а в 98 % не було ознак кератопатії [27]. Ефективність тобраміцину показана в пацієнтів із грубими більмами рогівки в поєднанні з вторинною глаукомою, які перенесли наскрізну кератопластику з одномоментним силіконовим трубчастим мікродренуванням. Препарат мав низьку токсичність і алергенність, швидко купірував післяопераційне запалення, не викликав епітеліопатії при регенерації рогівки й сприяв якісному приживленню трансплантата [28].
У рандомізованому подвійному сліпому клінічному дослідженні L.S. Kirsch et al. [26] при лікуванні 55 пацієнтів тобраміцином або офлоксацином після хірургії катаракти була доведена порівнянна ефективність обох препаратів.
У рандомізованому порівняльному дослідженні на базі чотирьох центрів за участю 77 пацієнтів з блефаритом і/або кон’юнктивітом порівнювалася ефективність 0,3% тобраміцину і гентаміцинової офтальмологічної мазі. Після 10-денного режиму лікування 97 % пацієнтів, які отримували тобраміцин, і 91,3 % пацієнтів, які отримували гентаміцин, були клінічно вилікувані. Дослідження антибактеріальної ефективності в кон’юнктиві показали, що тобраміцин знищував або контролював 87,8 % бактеріальних інфекцій проти 77,4 % для гентаміцину. Частота побічних реакцій становила 9,3 % при призначенні тобраміцину і 17,6 % при використанні гентаміцину.
У багатоцентровому рандомізованому дослідженні P.-Y. Robert et al. [30], що включало 1043 пацієнтів з гнійним бактеріальним кон’юнктивітом, порівнювалась ефективність 1,5% азитроміцину і 0,3% тобраміцину. Результати дослідження показали перевагу 0,3% тобраміцину: клінічна ефективність через 7 днів лікування становила 89,4 %, при застосуванні азитроміцину — 87,8 %, виділення із ока були відсутні в 96,3 і 95,1 % пацієнтів відповідно.
Отже, тобраміцин — це аміноглікозид з багаторічним досвідом застосування, який перекриває спектр найбільш частих збудників очних інфекцій. Він чинить бактерицидну дію проти багатьох грампозитивних і грамнегативних бактерій і є перспективним засобом при інфекційних запальних захворюваннях очей, травмі та в післяопераційному періоді з приводу хірургічних операцій на оці.
Лотеп (оригінальна комбінація 0,5% лотепреднолу етабонату і 0,3% тобраміцину) — подвійна ефективність і безпека лікування запальних захворювань очей
Використання комбінації кортикостероїдів і антибіотиків в одному препараті поширене при лікуванні очних запальних станів, для яких показана кортикостероїдна терапія та існує ризик поверхневої бактеріальної інфекції. Лотепреднолу етабонат є кортикостероїдом, розробленим для підтримки потужної протизапальної активності, при мінімізації ризику небажаних ефектів кортикостероїдів, таких як підвищений внутрішньоочний тиск і катаракта. Тобраміцин є аміноглікозидним антибіотиком широкого спектра дії, який вважається в цілому безпечним і добре переноситься. Також використання комбінованої терапії підвищує зручність, що може сприяти прихильності пацієнта. Тому офтальмологічна суспензія, що поєднує ЛЕ 0,5% і тобраміцин 0,3% (ЛE/T), схвалена в США і низці інших країн світу [31].
У багатоцентровому рандомізованому клінічному дослідженні в паралельних групах [32–34] вивчалась ефективність застосування комбінації лотепреднолу етабонату 0,5%/тобраміцину 0,3% і дексаметазону 0,1%/тобраміцину 0,3% (ДМ/Т) у хворих на блефарокератокон’юнктивіти. Це дослідження проводилось у США на базі 17 центрів (січень 2007 р. — червень 2007 р.) і в Китаї на базі 7 центрів (жовтень 2009 р. — лютий 2010 р.). У ньому брали участь дорослі пацієнти віком ≥ 18 років: 276 осіб у США (ЛЕ/Т, n = 138; ДМ/Т, n = 138) і 308 осіб у Китаї (ЛЕ/Т, n = 156; ДМ/Т, n = 152) із діагнозом блефарокератокон’юнктивіту. Усі вони отримували ЛЕ/Т або ДМ/Т 4 рази на день протягом 2 тижнів.
У дослідженні визначали тяжкість очних ознак усіх трьох компонентів захворювання: блефарит (гіперемія повік, лущення або кірочка на повіках, гіпертрофія краю повік); кон’юнктивіт (гіперемія кон’юнктиви, виділення з кон’юнктиви, хемоз кон’юнктиви); кератит (точкова епітеліальна кератопатія рогівки), використовуючи 5-бальну шкалу, де 0 — немає ознак, 1 — слідові ознаки, 2 — легкий ступінь, 3 — помірний ступінь, 4 — тяжкий ступінь. Оцінка стану й результати обстеження визначалися під час візиту 1 (день 1; вихідний рівень); візиту 2 (день 3 ± 1); візиту 3 (день 7 ± 1 (США); день 8 ± 1 (Китай)) і візиту 4 (день 15 ± 1 (США)); день 15 ± 2 (Китай)). Під час обстеження проводили клінічну оцінку очних ознак і симптомів, перевірку гостроти зору, біомікроскопію і вимірювання внутрішньоочного тиску на обох очах.
В обох групах лікування на 15-й день симптоматика блефарокон’юнктивітів зменшилася на 78 %. Однак застосування ЛЕ/Т у хворих на блефарокератокон’юнктивіт різних популяцій було більш ефективним, ніж ДМ/Т (рис. 3).
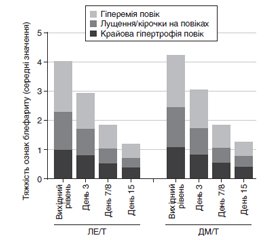
У дослідженні L. Timothy et al. [34] порівнювалось застосування комбінацій лотепреднолу етабонату 0,5%/тобраміцину 0,3% і дексаметазону 0,1%/тобраміцину 0,3% у лікуванні блефаритів. Було включено 495 суб’єктів (247 ЛЕ/Т, 248 ДМ/Т) з діагнозом блефариту. Оцінка стану й результатів обстеження визначалася під час візиту 1 (день 1; вихідний рівень); візиту 2 (день 3 ± 1); візиту 3 (день 7 ± 1 (США); день 8 ± 1 (Китай)) і візиту 4 (день 15 ± 1 (США); день 15 ± 2 (Китай)).
Після 2 тижнів лікування більшість досліджуваних очей продемонстрували покращання — зниження тяжкості окремих ознак блефариту на ≥ 1 ступінь порівняно з вихідним рівнем, а також комбінованих ознак блефаритів, без відмінностей між групами лікування (р ≥ 0,546). Середня тяжкість кожної окремої ознаки блефариту зменшувалася при кожному візиті в обох групах лікування, але більш виражено — у групі ЛЕ/Т (рис. 4).
Повне зникнення ознак блефариту (тобто 0-й ступінь для всіх ознак) було відзначено в однакових пропорціях очей у кожній досліджуваній групі на 15-й день (рис. 5), як для всіх очей (ЛЕ/T 48,1 % проти ДМ/T 42,9 %; p = 0,265), так і для підгрупи очей з найвищим ступенем тяжкості блефариту на вихідному рівні (ЛЕ/T 23,7 % проти ДМ/T 21,3 %; p = 0,828).
Крім того, автори дослідження виявили, що застосування комбінації ЛЕ/Т чинить менший вплив на ВОТ порівняно з комбінацією ДМ/Т. Пацієнти, які отримували комбінацію ДМ/Т, відзначали підвищення ВОТ на ≥ 5 мм рт.ст. у 2 рази частіше, ніж пацієнти, які отримували комбінацію ЛЕ/Т (рис. 6).
Автори дослідження зробили висновки, що застосування комбінації ЛЕ/Т при запальних захворюваннях переднього відрізка ока демонструє вищу ефективність порівняно з комбінацією ДМ/Т, а також кращий профіль безпеки.
У рандомізованому подвійному замаскованому паралельному груповому дослідженні J.D. Bartlett et al. [31] порівнювався комфорт і переносимість комбінації лотепреднолу етабонату 0,5%/тобраміцину 0,3% (Лотеп) і дексаметазону 0,1%/тобраміцину 0,3% (Тобрадекс) у 306 здорових волонтерів, яким призначали ЛЕ/Т або ДМ/Т по 4 рази на день протягом 28 днів. Оцінювали сім параметрів комфорту/переносимості (біль, печіння, подразнення, свербіж, відчуття стороннього предмета, сухість і світлочутливість). Первинною кінцевою точкою була різниця на 4-му тижні порівняно із застосуванням штучної сльози на початковому етапі, потім порівнювали з використанням парадигми неповноцінності (рис. 7).
/57.jpg)
Результати дослідження показали, що волонтери, які отримували Лотеп, частіше повідомляли про кращі оцінки очного комфорту/переносимості порівняно зі штучною сльозою, ніж ті, хто отримував ДM/T. Були виявлені деякі статистично значимі відмінності між Лотепом і ДМ/Т для кожного вимірюваного параметра. Комфорт і переносимість Лотепу пов’язані з включенням до складу повідону (як лубриканту) і гліцерину (як зволожувача).
Слід відзначити, що комбінація 0,5% лотепреднолу етабонату і 0,3% тобраміцину є оригінальною розробкою компанії Bausch+Lomb, і аналоги комбінації відсутні. У США комбінація відома під назвою Зайлет (Zylet®), вона була схвалена до застосування в офтальмологічній практиці в 2004 р., в Україні зареєстрована під назвою Лотеп. Лотеп вже є на українському ринку. Лотеп привернув увагу офтальмологів як оригінальною комбінацією, де на повну силу проявляє себе новий глюкортикоїд — лотепреднолу етабонат, так і комфортністю й переносимістю застосування.
Лотеп чинить високу протизапальну й протимікробну дію, покращує профіль безпеки і переносимість при лікуванні запальних захворювань переднього відрізку ока [23, 31, 34, 35]. Його призначення необхідне при стероїдчутливих запальних захворюваннях очей, при яких показані кортикостероїди і є поверхнева бактеріальна очна інфекція або існує ризик бактеріальної очної інфекції. Він використовується при запальних захворюваннях пальпебральної і бульбарної частин кон’юнктиви, рогівки й переднього сегмента очного яблука, таких як: алергічний кон’юнктивіт, розацеа, поверхневий точковий кератит, кератит, викликаний вірусом оперізуючого герпесу, ірит, цикліт і деякі інфекційні кон’юнктивіти, при яких ризик застосування стероїдів незначний порівняно з користю від зменшення набряку й запалення; при хронічному передньому увеїті й пошкодженнях рогівки хімічними, радіаційними і термічними опіками або сторонніми тілами. Застосування кортикостероїдів у комбінації з протиінфекційними засобами також показане у випадках, коли існує високий ризик виникнення поверхневої очної інфекції або є підозра, що в око потрапила потенційно небезпечна кількість бактерій [23].
Лотеп може призначатися не тільки дорослим пацієнтам, але й дітям від 0 років, що свідчить про високу безпеку лікарського засобу. Застосування Лотепу просте — по 1–2 краплі в кон’юнктивальний мішок ураженого ока кожні 4–6 годин. Протягом перших 24–48 годин дозування можна збільшувати на 1 краплю кожні 1–2 години. Частоту слід зменшувати поступово, відповідно до покращання клінічних ознак [23]. Перед застосуванням препарат слід енергійно збовтати, бо Лотеп є суспензією [23].
Висновки
— Лотеп — це комбінація глюкокортикоїду 0,5% лотепреднолу етабонату та аміноглікозиду 0,3% тобраміцину, у якій кожний компонент доповнює і підсилює ефективність іншого. У сукупності ця комбінація забезпечує протизапальну, антибактеріальну, імуносупресивну й протиалергічну дію, зменшує ризик системних і локальних побічних небажаних явищ.
— Лотепреднолу етобонат 0,5% розроблений із застосуванням оригінальної технології дизайну ретрометаболічного лікарського засобу, є похідним преднізолону. Чинить виражену протизапальну активність, яка перевищує активність дексаметазону. Тобраміцин 0,3% — аміноглікозид з багаторічним досвідом застосування, з широким спектром бактерицидної антибактеріальної дії, перекриває спектр найбільш частих збудників очних інфекцій. Включення до складу повідону (як лубриканту) і гліцерину (як зволожувача) забезпечує комфорт і добру переносимість Лотепу.
— Результати численних рандомізованих клінічних досліджень демонструють високу клінічну ефективність і безпеку Лотепу, за якими він перевершує комбінацію ДМ/Т, що дозволяє рекомендувати його як новий інструмент для покращення лікування пацієнтів із запальними захворюваннями переднього відрізку ока, у тому числі дітей від 0 років.
/53.jpg)
/56.jpg)

/53_2.jpg)
/55.jpg)
/56_2.jpg)
/57.jpg)