Газета «Новости медицины и фармации» №1 (782), 2023
Вернуться к номеру
Оцінка клінічної ефективності застосування Статону в лікуванні хворих на хронічний простатит і доброякісну гіперплазію простати
Авторы: Нікітін О.Д., Грицай В.С., Сич В.І., Самчук П.О., Ясинецький М.О., Рєзніков Г.Д.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Разделы: Медицинские форумы
Версия для печати
Хронічний простатит є поширеним урологічним захворюванням, яке вражає від 8 до 35 % чоловіків молодого і зрілого віку [1, 2]. У чоловіків віком понад 50 років хронічний простатит часто асоціюється з доброякісною гіперплазією передміхурової залози (ДГПЗ). При хронічному простатиті спостерігається хронічне запалення тканин передміхурової залози. Основна відмінність хронічного простатиту від гострого полягає у вираженості й тривалості хвороби, а також у тенденції її розвитку: при гострому простатиті хвороба виникає раптово (протягом кількох годин чи днів), перебігає гостро, але також швидко минає і закінчується повним одужанням. При хронічному простатиті, навпаки, хвороба може розвиватися протягом тривалого часу, симптоми хвороби можуть бути відсутніми або не надто вираженими, а сам простатит погано піддається лікуванню і часто рецидивує.
У даний час хронічний простатит розглядається як інфекційне захворювання, тобто основною причиною виникнення простатиту є патогенні мікроби, що вражають тканини передміхурової залози. Здорова передміхурова залоза є стерильною, тобто не містить бактерій. Згідно з даними літератури, у 5–10 % хронічний простатит викликають інфекційні агенти, а в більшості випадків збудник інфекції виявити не вдається [3, 4].
При гострому простатиті інфекційний процес у простаті перебігає бурхливо, а при хронічному простатиті повільно, з поступовим наростанням запалення. При хронічному простатиті інфекція лише запускає хворобу, яка надалі здатна розвиватися навіть після усунення збудника. Справа в тому, що первинне інфекційне запалення передміхурової залози призводить до порушення іннервації простати і до виникнення автоімунного процесу, спрямованого проти тканин простати. Цей факт пояснює наявність абактеріальних форм простатиту, за яких, незважаючи на наявність хвороби, інфекція в простаті не виявляється. Основний шлях проникнення інфекції в передміхурову залозу — висхідний. Тобто інфекція піднімається сечовипускним каналом і вражає передміхурову залозу. У поодиноких випадках інфекція заноситься в передміхурову залозу зі струмом крові та лімфи або переходить на простату із сусідніх органів. Виникнення хронічного простатиту визначається не тільки наявністю інфекції, але й умовами, що сприяють розвитку хвороби. До факторів ризику розвитку хронічного простатиту належать:
- застій крові в простаті, спричинений малорухомим способом життя або сидячою роботою;
- переохолодження;
- уретрит;
- орхіт;
- епідидиміт;
- неправильне харчування, стрес, зловживання алкоголем і куріння, які можуть сприяти розвитку хронічного простатиту за рахунок зниження загальної реактивності організму.
Хронічний бактеріальний (інфекційний) простатит — хронічне запалення простати, спричинене персистуючою бактеріальною інфекцією. Діагноз хронічного бактеріального простатиту встановлюється в тих випадках, коли при дослідженні секрету простати виявляються бактерії.
Хронічний абактеріальний (неінфекційний) простатит — хронічне запалення простати, при якому в секреті простати не виявляються бактерії. Розвиток хронічного бактеріального простатиту перебігає переважно за рахунок автоімунного ураження тканин простати.
Синдром хронічного тазового болю — це особлива форма хронічного простатиту, при якій на тлі запалення тканин простати спостерігаються хронічні болі в ділянці статевих органів і промежини.
Безсимптомний запальний простатит характеризується повною відсутністю будь-яких симптомів простатиту, незважаючи на наявність запалення в тканинах простати.
Основні симптоми й ознаки хронічного простатиту такі:
- біль і печіння в сечівнику, що посилюються при сечовипусканні або під час статевого акту;
- почуття тяжкості або болю в ділянці промежини або прямої кишки;
- біль внизу живота або в крижовій ділянці;
- часті позиви до сечовипускання;
- порушення статевого життя: слабка ерекція, передчасна еякуляція, відсутність оргазму.
Слід зауважити, що практично в кожного четвертого хворого на хронічний простатит відсутні всілякі симптоми хвороби, у таких випадках хворі пізно звертаються до лікаря.
Діагностика хронічного простатиту починається зі з’ясування скарг і деталей історії хвороби хворого на простатит. Наступний етап діагностики хронічного простатиту включає пальпацію передміхурової залози, мікроскопію та бактеріологічний аналіз секрету простати.
Ультразвукове дослідження передміхурової залози доповнює пальцеве дослідження і дає більш точні дані про стан простати.
Бактеріологічний аналіз секрету простати дозволяє визначити наявність бактеріальної інфекції та встановити чутливість мікробів до антибіотиків.
Визначення рівня простат-специфічного антигену (ПСА) у крові є важливим етапом діагностики хронічного простатиту. Визначення рівня ПСА необхідне для виключення раку простати. Біопсія тканин передміхурової залози застосовується в разі підозри на рак простати.
Лікування хронічного простатиту — складне завдання, успішне виконання якого можливе тільки при злагодженій співпраці пацієнта та його лікаря. Сучасна практика лікування простатиту включає такі методи:
- антибіотикотерапія — у даний час у лікуванні хронічного простатиту частіше використовуються антибіотики групи фторхінолонів;
- масаж передміхурової залози — покращує дренаж простати та мікроциркуляцію на рівні цього органа, що, у свою чергу, сприяє якнайшвидшому одужанню хворого;
- aльфа-адреноблокатори використовуються для зняття спазму гладкої мускулатури простати, поліпшення уро–динаміки і відтоку секрету простати;
- фізіотерапія — покращує трофіку тканин простати і прискорює процес одужання; у лікуванні хворих на хронічний простатит використовуються трансректальна мікрохвильова гіпертермія та низькоенергетична лазерна терапія, діадинамофорез, індуктотермоелектрофорез, ультразвуковий фонофорез;
- фітотерапія — використовується як доповнення до основного курсу лікування.
Одними з найбільш ефективних та успішно застосовуваних у лікуванні хронічного простатиту є фітопрепарати, що містять у своєму складі: Serenoa repens (пальма сабаль) і Cucurbita pepo (олія насіння гарбуза).
Гарбуз є джерелом корисних речовин, але саме в олії сконцентрована найбільша кількість важливих компонентів, що отримуються з насіння. Тому гарбузову олію застосовують з лікувальною метою не тільки в народній, але й у традиційній медицині. Розглянемо основні властивості продукту.
Антимікробна та протипаразитарна властивість. Олія руйнує оболонку мікро–організму та очищує організм від продуктів розпаду бактерій, це сприяє більш швидкій елімінації збудника, що є вкрай важливим при лікуванні хронічного простатиту.
Метаболічна дія. Здійснюється за рахунок регуляції жирового обміну, що позитивно впливає на нормальне функціонування клітин простати.
Регенеративна здатність. Компоненти олії посилюють вироблення колагену та еластину, за рахунок чого відбувається швидке відновлення пошкоджених клітин простати, а також відіграють важливу роль за наявності гемороїдальних змін. Це є показанням до місцевого застосування олії насіння гарбуза при проведенні урологічних процедур з метою уникнення розриву гемороїдальних вузлів і кровотечі з них.
Антисептичний ефект. Його надає поєднання кислот, які знаходяться в гарбузовій олії, що є важливою ланкою пато–генетичного лікування запальних захворювань простати.
Антиоксидантна властивість — через вміст в олії аскорбінової кислоти, ретинолу та вітаміну А. Це дозволяє зменшити кількість вільних радикалів, що здатні пошкоджувати клітини простати.
Поліпшення сперматогенезу. Поєднання компонентів, що необхідні чоловічому здоров’ю, посилює секрецію простати і сприятливо впливає на формування активних здорових сперматозоїдів, вирішуючи проблему безпліддя.
Локальний вплив на передміхурову залозу. Посилює кровопостачання перед–міхурової залози, особливо при місцевому застосуванні олії.
Відновлення гормонального балансу. Олія гарбуза здатна інгібувати активність ферменту 5-альфа-редуктази і зменшення вироблення дигідротестостерону, що є вкрай важливим при прогресуванні доброякісної гіперплазії простати.
Протизапальна дія. Її забезпечують кислоти й електролітний склад олії, це призводить до зменшення синдрому нижніх сечових шляхів (СНСШ) і поліпшує якість життя таких пацієнтів.
В опублікованому у 2016 році огляді ефективності лікування СНСШ в осіб з доброякісною гіперплазією передміхурової залози продуктами з гарбуза було проаналізовано 16 наукових праць, з яких 10 проведено клінічно. Дані цих досліджень вказували, що прийом продуктів гарбуза супроводжувався зменшенням об’єму передміхурової залози, зниженням активності детрузора, поліпшенням показників Міжнародної шкали симптомів передміхурової залози (IPSS), параметрів урофлоуметрії та якості життя (QoL) за рахунок протизапального й антиандрогенного ефектів.
Згідно з даними рандомізованого плацебо-контрольованого дослідження German Research Activities on Natural Urologicals (GRANU), присвяченого вивченню ефективності екстракту з насіння гарбуза в 1431 чоловіка із синдромом нижніх сечових шляхів при ДГПЗ, його річний прийом з цього приводу характеризувався високим клінічним ефектом, зниженням СНСШ середнього ступеня тяжкості порівняно з пла–цебо.
Цілком обґрунтовано вважається, що фітотерапія продуктами гарбуза у вигляді рослинних комбінацій має позитивний вплив на СНШ при ДГПЗ і є частіше затребуваною пацієнтами, ніж терапія класичними продуктами сучасної фармакології. При оцінці ефективності суміші екстракту насіння гарбуза, ізофлаво–ноїдів соєвих зародків і журавлини, що застосовувалася в лікуванні легких і помірних СНСШ при ДГПЗ протягом 90 днів, була встановлена можливість полегшення симптомів розладів сечовипускання, якості життя та позитивного впливу на статеву функцію.
Метою нашого дослідженнябула розробка методу комплекс–ної терапії хворих на хронічний простатит з використанням препарату вітчизняного виробництва Статон у вигляді ректальних свічок, що містять 0,5 г олії гарбуза.
Матеріали та методи
В основу роботи покладено результати оцінки комплексного лікування 138 хворих на хронічний простатит і ДГПЗ.
Усім хворим проводили загально–клінічне обстеження, що включає загальний аналіз крові та сечі, біохімічне дослідження крові, та спеціальне урологічне обстеження — збір скарг, трансректальне ультразвукове дослідження, аналіз числа лейкоцитів і мікроорганізмів у секреті передміхурової залози. Кількість лейкоцитів визначали за допомогою світлового мікро–скопа, підраховуючи в нативному препараті секрету передміхурової залози в полях зору. Патогенну мікрофлору в секреті передміхурової залози виявляли методом посіву на селективні середо–вища [5]. Визначали такі види бактерій: Escherichia coli, Enterococcus faecalis, Proteus mirabilis, Klebsiella spp., Pseudomonas aeruginosa, оскільки вони є найчастішою причиною бактеріального хронічного простатиту з доведеною етіологією [6, 7].
Пацієнти були поділені на дві однорідні групи, які отримували різне лікування: перша — 67 осіб (48,55 %), друга — 71 особа (51,45 %). Вік пацієнтів був від 40 до 59 років у обох групах, середній вік становив 49,5 ± 9,5 року.
Хворі обох груп отримували: 1) антибактеріальну терапію; 2) імуномодулюючу й протизапальну терапію; 3) альфа-адреноблокатори; 4) препарат, що покращує кровообіг у простаті. Тривалість лікування становила 28 днів.
Хворим ІІ групи, крім стандартної –терапії, було призначено Статон одно–разово на ніч протягом 10 днів.
Результати лікування оцінювали через 14 і 28 днів за наявністю або відсутністю скарг, кількістю лейкоцитів і патогенної мікрофлори в секреті передміхурової залози.
Статистичну обробку даних проводили в програмах Microsoft Office Excel 2007, StatSoft Statistica 10. Для порівняння частоти появи аналізованих ознак між досліджуваними групами використовували t-критерій Стьюдента з визначенням рівня значущості критерію.
Результати та обговорення
Симптоматичний комплекс пацієнтів до лікування включав: біль у промежині: І група — 6 осіб (23,08 %), ІІ група — 7 осіб (25,0 %); біль у мошонці: І група — 5 осіб (19,23 %), ІІ група — 6 осіб (21,43 %); біль у статевому члені: І група — 2 особи (7,69 %), ІІ група — 3 особи (10,71 %); біль у сечовому міхурі: І група — 2 особи (7,69 %), ІІ група — 1 особа (3,57 %); ослаб–лення ерекції: І група — 4 особи (15,38 %), ІІ група — 5 осіб (17,86 %); прискорене сечовипускання: І група — 3 особи (11,54 %), ІІ група — 2 особи (7,14 %). У 4 пацієнтів у кожній групі (I група — 15,38 %, II група — 14,29 %) ослаблення ерекції поєднувалося з болем у мошонці, статевому члені й промежині. У І групі з 67 хворих скарги були у 26 (38,81 %), а в ІІ групі з 71 пацієнта — у 28 (39,44 %). Вірогідних відмінностей у скаргах між пацієнтами двох досліджуваних груп не виявлено (p > 0,05).
Біохімічний аналіз крові та загальний аналіз сечі в усіх досліджуваних пацієнтів були в межах норми. Загальний аналіз крові виявив лише підвищення швидкості осідання еритроцитів від 12 до 15 мм/год, яке спостерігалося у 97 (70,3 %) пацієнтів. Проведене трансректальне ультразвукове дослідження не показало патологічних змін у передміхуровій залозі. У секреті передміхурової залози обстежуваних пацієнтів обох груп до лікування вміст лейкоцитів був підвищеним.
Патогенну мікрофлору виявили в секреті передміхурової залози в 15 (10,87 %) пацієнтів, з них Escherichia coli була в 11 хворих (73,33 %), Enterococcus faecalis — у 3 (20,0 %) і Proteus mirabilis — в 1 (6,67 %). Такі збудники захворювання, як Klebsiella spp. і Pseudomonas aeruginosa, не виявлені. Найчастіше в пацієнтів І і ІІ групи виявляли Escherichia coli (5 осіб (71,43 %) і 6 осіб (75,0 %) відповідно). Грампозитивні мікроорганізми Enterococcus faecalis виявлені в 1 пацієнта (14,29 %) І групи і 2 (25,0 %) хворих ІІ групи. Найрідше в секреті зустрічався Proteus mirabilis — 1 пацієнт (14,29 %) І групи.
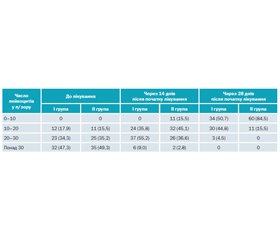
Через 14 днів після початку лікування у хворих обох груп скарг не було. У посівах секрету передміхурової залози в усіх пацієнтів патогенної мікрофлори не виявлено. Відбулася зміна числа лейкоцитів у секреті передміхурової залози. У I групі число пацієнтів з лейкоцитами понад 30 знизилося на 26 осіб, у II групі — на 33 особи, з яких у 26 пацієнтів число лейкоцитів стало 20–30, а в 7 пацієнтів знизилося до 10–20. З І групи у 12 пацієнтів число лейкоцитів знизилося з 20–30 до 10–20, у ІІ групі всі 25 пацієнтів з числом лейкоцитів 20–30 після 14 днів лікування мали число лейкоцитів 10–20, а всі 11 пацієнтів з числом лейкоцитів 10–20 мали нормальну кількість лейкоцитів. Сумарна кількість пацієнтів з різним числом лейкоцитів показана в табл. 1. Отже, очевидна тенденція до прискореного зниження числа лейкоцитів у секреті передміхурової залози пацієнтів, які отримували антибактеріальну терапію із застосуванням Статону.
Результати аналізу секрету передміхурової залози
Через 28 днів після початку лікування в пацієнтів обох груп була відсутня висока (понад 30) кількість лейкоцитів у секреті передміхурової залози, кількість лейкоцитів від 20 до 30 у секреті відзначено лише в 3 пацієнтів I групи. Порівняно з результатами терапії через 14 днів у І групі з 6 пацієнтів, які мали число лейкоцитів понад 30, у половини хворих число лейкоцитів стало 20–30, а в решти 3 осіб знизилося до 10–20. З пацієнтів І групи, які мали число лейкоцитів 20–30, у 30 пацієнтів їхня кількість знизилася до 10–20, а в 7 пацієнтів — до 0–10. У I і II групах усі пацієнти, які мали на 14-й день лікування 10–20 лейкоцитів, на 28-й день мали нормальну кількість лейкоцитів (табл. 1). Отримані результати лікування були статистично вірогідні (p < 0,05).
Терапевтичну ефективність препарату Статон оцінювали також на підставі урофлоуметричних показників. Вивчено показники об’ємної швидкості сечовипускання, часу сечовипускання та обсягу залишкової сечі за даними УЗД. Результати дослідження подані в табл. 2.
На підставі проведеного дослідження можна констатувати, що доповнення комплексного лікування хворих на хронічний простатит прийомом –Статону, підвищувало його ефективність на 33,76 %. Позитивна динаміка лікування до нормалізації лейкоцитів у секреті спостерігалася в 15,5 % уже через 14 днів після початку терапії. Підвищення ефективності лікування може бути обумовлене збільшенням проникності клітин і тканин для антибактеріальних препаратів, прискоренням –кровотоку в передміхуровій залозі та протизапальною дією олії гарбуза.
Висновки
Комплексне лікування хворих на хронічний простатит (використання антибактеріальної, імуномодулюючої, протизапальної терапії, альфа-адреноблокаторів і препаратів, що покращують кровообіг), що поєднується з прийомом Статону, було ефективніше за стандартну терапію на 33,76 %, причому повне одужання спостерігалося через 14 днів після початку.
Результати роботи можуть бути впроваджені не тільки в стаціонарних, але й в амбулаторних умовах і дозволять скоротити терміни тимчасової непрацездатності та реабілітації хворих на хронічний простатит і доброякісну гіперплазію простати.
Список литературы
1. Cheah P.Y., Liong M.L., Yuen K.H. et al. Chronic prostatitis: symptom survey with follow-up clinical evaluation. Urology. 2003. 61. 60-64.
2. Nickel J.C., Elhilali M., Vallancien G. ALF-ONE Study Group. Benign prostatic hyperplasia (BPH) and prostatitis: prevalence of painful ejaculation in men with clinical BPH. BJU Int. 2005. 95. 571-574.
3. Клінічна сексологія і андрологія / За ред. О.Ф. Возіанова, І.І. Горпинченка. Київ: Здо–ров’я, 1996. 536 с.
4. Gravas S., Cornu J.N. et al. EAU Guidelines on Management of Non-neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO); European Association of Urology. 2018.
5. Matteif M. Medikamentose Therapie der benignen Prostatahyperplasie mit einem Extrakt der Sagepaime TW Urol. Nephrol. 1990. № 2. 346-350.
6. Ficarra V., Rossanese M., Zazzara M. et al. The role of inflammation in lower urinary tract symptoms (LUTS) due to benign prostatic hyperplasia (BPH) and its potential impact on medical therapy. Curr. Urol. Rep. 2014. Dec. 15(12). P. 463.
7. Pagano E., Laudato M., Griffo M., Capasso R. Phytotherapy of benign prostatic hyperplasia. A minireview. Phytother. Res. 2014 Jul. 28(7). 949-955.

/18.jpg)