Журнал «Почки» Том 12, №3, 2023
Вернуться к номеру
Вплив антиоксидантної терапії на перебіг додіалізної ХХН у пацієнта з коморбідністю
Авторы: Денова Л.Д.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
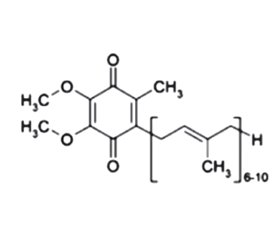
Хронічна хвороба нирок (ХХН) майже завжди пов’язана з такими супутніми захворюваннями, як цукровий діабет (ЦД), гіперурикемія/подагра, сечокам’яна хвороба, часто з інфекцією сечовивідних шляхів, артеріальна гіпертензія, полікістоз нирок тощо. Автосомно-домінантна полікістозна хвороба нирок — це спадкове захворювання нирок (1/1000–1/400 у всьому світі), яке вражає переважно доросле населення, викликане переважно мутаціями в генах PKD1 (85–90 % випадків) і PKD2 (10–15 % випадків), які відповідно кодують протеїни: поліцистин1 (PC1) та поліцистин2 (PC2). У дорослих зі збереженою функцією нирок поширеність подагри зростає з 1 до 2 % (гіперурикемія — до 11 %), у пацієнтів із ХХН 4-ї стадії — до 32 % (гіперурикемія — до 80 %). У 70 % пацієнтів з подагрою та у 50 % пацієнтів із гіперурикемією є ХХН ≥ 2-ї стадії. ХХН сприяє зниженню екскреції сечової кислоти (UA) із сечею. У пацієнтів з ХХН за гіперурикемію вважають рівень UA в сироватці крові у жінок > 6 мг/дл і у чоловіків > 7 мг/дл. Гіперурикемія дуже часто спостерігається при гіпертонії та ЦД типу 2. У пацієнтів із захворюваннями нирок ЦД посідає основне місце серед чинників смертності та захворюваності. Запідозрити діабетичну нефропатію (ДН) у пацієнта з ЦД типу 2 можна за наявності альбумінурії і/або діабетичної ретинопатії. Ознаки ДН: потовщення базальної мембрани, розширення мезангіалу та підвищення проникності судин для альбуміну, що індукуються неферментативною глікацією колагену та ламініну. Коморбідність погано впиває на стан здоров’я пацієнтів через підвищення захворюваності та смертності. Такі пацієнти в групі ризику швидкого прогресування ХХН з переходом у термінальну стадію ХХН, яка потребує нирково-замісної терапії. Тому рання діагностика, лікування та профілактика ускладнень ХХН для таких пацієнтів є важливими. У цій статті висвітлено вплив антиоксидантної терапії на перебіг ХХН у пацієнтів з коморбідністю.
Chronic kidney disease (CKD) is almost always associated with comorbidities such as diabetes, hyperuricemia/gout, urolithiasis, often with urinary tract infection, hypertension, polycystic kidney disease, and other conditions. Autosomal dominant polycystic kidney disease is an inherited kidney disease (1/1000–1/400 worldwide) affecting mainly adults, caused predominantly by mutations in PKD1 (85–90 % of cases) and PKD2 genes (10–15 % of cases), which encode polycystin-1 and polycystin-2 proteins, respectively. In adults with preserved kidney function, the prevalence of gout increases from 1 to 2 % (hyperuricemia up to 11 %), in patients with CKD stage 4 — up to 32 % (hyperuricemia up to 80 %). 70 % of patients with gout and 50 % of patients with hyperuricemia have stage 2 CKD. CKD contributes to a decrease in the urinary excretion of uric acid. In patients with CKD, hyperuricemia is considered to be a serum uric acid level > 6 mg/dL in women and > 7 mg/dL in men. Hyperuricemia is very often observed in hypertension and type 2 diabetes. In patients with kidney disease, diabetes is a major factor of mortality and morbidity. Diabetic nephropathy can be suspected in a patient with type 2 diabetes in the presence of albuminuria and/or diabetic retinopathy. Signs of diabetic nephropathy: basement membrane thickening, mesangial expansion, and increased vascular permeability to albumin induced by nonenzymatic glycation of collagen and laminin. Comorbidity has a negative impact on patients’ health due to increased morbidity and mortality. Such patients are at risk of rapid progression of CKD into the end stage, which requires renal replacement therapy. Therefore, early diagnosis, treatment and prevention of CKD complications are important for such patients. This article highlights the impact of antioxidant therapy and phytoneering on the course of CKD in patients with comorbidities.
хронічна хвороба нирок; полікістоз нирок; подагра; гіперурикемія; діабетична нефропатія; антиоксидантна терапія; глутатіон; убіхінон
chronic kidney disease; polycystic kidney disease; gout; hyperuricemia; diabetic nephropathy; antioxidant therapy; glutathione; ubiquinone