Журнал «Почки» Том 12, №4, 2023
Вернуться к номеру
Лікування і профілактика інфекції сечових шляхів: Пембіна-Блю та Пембіна-Біотик
Авторы: Тетяна Чистик
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Інфекції сечових шляхів (ІСШ) дуже поширені у світі, характеризуються високим ризиком ускладнень і формування хронічних запальних процесів. Це одна з найбільш частих причин застосування антибіотиків, а також значних фінансових витрат для системи охорони здоров’я. Бувши одними з найпоширеніших бактеріальних інфекцій, ІСШ сприяли формуванню імунозалежних/імунонезалежних захисних реакцій в людському організмі. Однак і мікробні патогени виробили низку факторів вірулентності: інгібування міграції нейтрофілів у вогнище запалення, можливість зниження імунної відповіді при реінфекції, а також виживання всередині макрофага і формування стійкості до антибіотиків.
Через формування резистентності мікробіоти сечових шляхів до антибактеріальних засобів актуальним залишається пошук препаратів для лікування та профілактики ІСШ, які стали б альтернативою антибіотикам. Згідно з оглядами іноземної літератури, препарати метиленового синього мають широкі перспективи в контексті використання у випадках резистентності мікробної флори до антибактеріальних препаратів, як додаткової терапії, а також для профілактики рецидивуючих ІСШ.
Доктор медичних наук, професор, завідувач кафедри нефрології та нирково-замісної терапії Національного університету охорони здоров’я України імені П.Л. Шупика Дмитро Дмитрович Іванов виступив з доповіддю «Лайфхаки сучасного нефролога. Методи діагностики та лікування», перша частина якої була присвячена інфекціям сечових шляхів.
ІСШ є найчисленнішою групою в структурі нефрологічних захворювань та посідають друге-третє місце серед інфекцій організму людини загалом. Тактика ведення пацієнтів з ІСШ постійно вдосконалюється з урахуванням результатів клінічних досліджень і настанов Європейської асоціації урологів (EAU). Наразі чітко простежується тенденція до використання лише тих методів обстеження, що мають найвищий ступінь доказовості, а також до більш раціонального підходу у фармакотерапії.
ІСШ розглядаються як мікробно-запальне ураження органів сечової системи без уточнення топічного рівня ураження. За своїм перебігом ІСШ можуть бути гострими (менше ніж 3 місяці) або хронічними (3 місяці і більше), неускладненими або ускладненими. За рівнем інфекції, згідно з останніми рекомендаціями EAU, виділяють уретрити, цистити, пієлонефрити і уросепсис. Перенесені в дитинстві інфекції, урологічні операції та наявність сечокам’яної хвороби підвищують ризик розвитку ускладнень ІСШ. Рецидивуючий пієлонефрит і цистит слід оцінювати як ускладнені або хронічні ІСШ, якщо має місце більше ніж 3 епізоди протягом року або 2 упродовж 6 місяців.
Збудником ІСШ найчастіше (у 80% випадків) є грамнегативні мікроорганізми (переважно кишкова паличка, протей, клебсієла, ентерокок), рідше — грампозитивні, а саме стафілококи, що характерно для хронічних латентних процесів.
Гематогенні інфекції сечового тракту, що переважно спостерігаються в дітей, можуть бути обумовлені такими мікроорганізмами: Staphylococcus aureus, Candidaspp., Salmonella spp., Mycobacterium tuberculosis. Також вони можуть бути наслідком наявності катетера або проведення антибактеріальної терапії.
У пацієнтів дорослого віку частіше має місце висхідний шлях інфікування, нерідко в асоціації зі збудниками статевих інфекцій, при цьому кишкова паличка може потрапляти в нирки навіть за відсутності уродинамічних порушень.
Ключовим етапом патогенезу ІСШ є адгезія мікроорганізмів (Floris-Mireles A.L., 2015). У сечовому міхурі експресія пілей типу 1 уропатогенної Escherichia coli (UPEC) призводить до її колонізації, інвазії та персистенції. Адгезин пілі 1 типу FimH зв’язує манозильовані уроплакіни та інтегрини, які покривають поверхню зонтичних клітин. Зв’язування уроплакіну за допомогою FimH викликає перестановку актину та бактеріальну інтерналізацію через невідомі механізми. Дія інтегрину FimH-α3β1 викликає перебудову актину після активації GTSases сімейства RHO (як-от білки RAS), що призводить до бактеріальної інвазії. Позаклітинне виживання UPEC також вимагає ухилення від вродженої імунної системи шляхом прийняття ниткоподібної морфології, яка робить бактерії більш стійкими до знищення нейтрофілами, ніж бацилярна форма. Ефлюкс і філаментація відбуваються разом з відлущуванням зонтичних клітин, що містять внутрішньобактеріальні спільноти.
Згідно з критеріями ІСШ, запропонованими останніми рекомендаціями EAU, для гострого циститу характерна дизурія, часті болісні сечовипускання, біль над лобком та відсутність таких симптомів протягом останніх 4 тижнів. При цьому лабораторні дані виявляють лейкоцитурію ≥ 103/мм і наявність колонієутворюючих одиниць (КУО) ≥ 103/мл.
Критеріями гострого неускладненого пієлонефриту є гарячка, озноб, біль у животі або поперековій ділянці за відсутності інших діагнозів та урологічних вад розвитку. Лабораторні дослідження демонструють лейкоцитурію ≥ 103/мм і КУО ≥ 104/мл.
Рецидивуючі ІСШ (пієлонефрит і цистит) оцінюють як ускладнені або хронічні ІСШ, для яких характерна будь-яка комбінація вищезазначених симптомів за наявності факторів ризику, лейкоцитурія ≥ 103/мм і КУО ≥ 104–5/мл.
Гострий цистит може спонтанно виліковуватися, призводити до розвитку пієлонефриту, переходити в безсимптомну бактеріурію або рецидивуючу форму циститу.
При лікуванні гострого циститу необхідно використовувати відстрочене призначення антибактеріальної терапії. Якщо симптоми не поліпшуються протягом 3–5 днів або спостерігається їх посилення, треба застосовувати короткі курси антибактеріальних препаратів (5 днів). Призначення антибіотиків необхідне з урахуванням характеристик уропатогенів та бактеріального посіву сечі. Контроль лікування проводиться через 7–10 днів після прийому антибактеріальних препаратів.
Неантимікробне лікування та профілактика циститу проводяться препаратами журавлини (Пембіна-Блю по 1 табл. 2 р/д — 1–2 міс.), D-манозою по 1500 мг (3табл.) 2 р/д — 1 міс.; імунопрофілактика інтерферонами — по 1 табл. 1 р/д — 1–3 міс.; вітамін D3 по 500 мг 2 р/д — 1 міс.; профілактика пробіотиками; гормональна профілактика у постменопаузальному періоді жінкам — інтравагінальне (не пероральне!) застосування естрогенів у вигляді крему або свічок (овестин).
Пембіна-Блю — це комбінований засіб на основі уросептика метилтіонінію хлориду і рослинних екстрактів шавлії і журавлини. Він використовується для профілактики і лікування неускладнених й ускладнених інфекцій сечових шляхів — циститу, пієлонефриту, рекурентних та катетерасоційованих ІСШ, ІСШ у чоловіків, уросепсисі.
Склад Пембіна-Блю базується на рекомендаціях EAU. До її складу входять Vaccinium мacrocarpon (журавлина великоплідна), яка здійснює боротьбу з бактеріальною адгезією, Мethylthonii chloridum (метилтіонінію хлорид) та Salvia officinalis (шавлія лікарська), які забезпечують усунення збудника з глибоких шарів уротелію, справляють пряму бактерицидну дію та зменшують ризик рецидивів ІСШ.
Метилтіонінію хлорид — це похідне фенотіазину з антибактеріальними і відновними властивостями, що входить до переліку життєво важливих препаратів для лікування метгемоглобулінемії. При катетеризації сечовивідних шляхів можливе виникнення катетерасоційованої бактеріурії, найчастіше викликаної грамнегативними патогенами. Так, Escherichia coli стає причиною бактеріурії у 28% випадків, Pseudomonas aeruginosa — у 15%, Klebsiella spp. — у 8%, Proteus mirabillis та Enterobacter spp. — у 4%. Крім того, як збудник виступає Candida spp. — у 18% та грампозитивна Enterococcusspp. — у 17% випадків. Уросептичний ефект метилтіонінію хлориду пояснюється його гідрофільними властивостями, малою молекулярною масою і позитивним зарядом, що дозволяє йому проникати через порин-протеїнові канали зовнішньої мембрани грамнегативних бактерій і надавати бактерицидну дію. Здатність метилтіонінію хлориду руйнувати бактеріальні плівки продемонстрована для Pseudomonas aeruginosa, Candida albicans і, головне, для Escherichia coli — найважливішого збудника інфекцій нижніх відділів сечовидільної системи; ця особливість важлива для запобігання катетерасоційованим інфекціям сечовивідних шляхів та їх лікування.
У роботі P. Kaul et al. (2018) на експериментальній моделі циститу була продемонстрована здатність Пембіна-Блю (метилтіонінію хлориду) усувати збудника зі слизової оболонки, руйнувати бактеріальні плівки й відновлювати цілісність епітелію.
У дослідженні Y.Y. Huong (2018) доведена властивість метилтіонінію хлориду не тільки проникати в біоплівки, але і полегшувати екстерналізацію (усувати збудника, що знаходиться в глибоких шарах перехідного епітелію), у тому числі Escherichia coli, що мають резистентність до антибактеріальної терапії під біоплівками. Це, у свою чергу, скорочує час призначення та дозу антибіотика, забезпечує повне очищення від патогенів, зменшує вираженість основних симптомів і знижує ризик рецидиву циститу.
Salvia officinalis (шавлія лікарська), яка входить до складу Пембіна-Блю, має бактеріостатичний і бактерицидний ефекти щодо бактерій, і це відіграє значну роль під час лікування інфекції сечовидільної системи. Урсолова кислота, що міститься в шавлії і журавлині, обумовлює сечогінний ефект Пембіна-Блю.
У дослідженні Роджеріо Сантоса (Бразилія, 2004) екстракт шавлії продемонстрував підвищену інгібуючу активність щодо основних уропатогенів: 100% ефективність проти видів Klebsiella, 95% — проти Escherichia coli, 85% — проти Proteus mirabillis та 75% — проти Morganella morganii.
Використання Пембіна-Блю в лікуванні й профілактиці рецидивуючих інфекції нижніх сечовивідних шляхів у жінок вивчалось у дослідженні О.С. Возіанова на базі Інституту урології ім. академіка О.Ф. Возіанова НАМН України та Національного університету охорони здоров’я ім. П.Л. Шупика. Це було відкрите моноцентрове порівняльне дослідження, у якому взяли участь 50 жінок віком від 20 до 75 років з рецидивуючими інфекціями нижніх сечовивідних шляхів. З метою лікування хворим було призначено препарат Пембіна-Блю по 1 капсулі 2 рази на добу протягом 10 днів як монотерапія. При дослідженні бралися до уваги об’єктивні зміни показників загального аналізу сечі (фізико-хімічні властивості сечі й мікроскопічне дослідження), а також суб’єктивні зміни клінічних проявів захворювання й переносимість ліків (згідно з розробленими анкетами-опитувальниками). Дані для аналізу були отримані на 1-шу й 7-му добу проведеного лікування.
Результати дослідження продемонстрували, що застосування препарату Пембіна-Блю курсом від 7 днів дає значний антибактеріальний, спазмолітичний і знеболюючий ефект.
Через 7 днів відмічалося значне зменшення клінічних симптомів: болю у ділянці сечового міхура та болю при сечовипусканні, почастішання сечовипускання та імперативних позивів до сечовипускання (рис. 1).
Пембіна-Блю може використовуватись як монозасіб або в комплексному лікуванні з метою підкислення сечі й показує кращі результати у хворих із початковим показником рН сечі ≥ 7. Препарат не має побічної дії, добре переноситься хворими, що дозволяє рекомендувати його для широкого застосування в лікуванні й профілактиці рецидивуючих інфекцій нижніх сечовивідних шляхів у жінок.
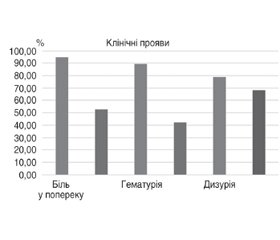
У дослідженні О.Д. Нікітіна (2020) вивчались ефективність та безпека використання Пембіна-Блю у хворих з катетерасоційованими інфекціями. Було проведено клініко-лабораторне обстеження 58 хворих, у яких було діагностовано катетерасоційовані ІСШ. 30 хворих основної групи отримували препарат Пембіна-Блю по 1 капсулі двічі на день протягом 1 місяця, 28 хворих групи порівняння отримували комбінований рослинний препарат із сечогінним та уроантисептичним ефектом.
Результати дослідження (рис. 2) показали, що призначення Пембіна-Блю призвело до вірогідної зміни таких показників, як біль у попереку — з 94,7 до 52,6%, гематурія — з 89,5 до 42,1%, лихоманка — з 84,2 до 47,4%, дизурія — з 78,9 до 68,4%. На відміну від цього вірогідні зміни в групі порівняння стосувались лише такого показника, як гематурія, — з 88,2 до 58,8%.
Лікування було ефективним у 86,7% пацієнтів, які приймали Пембіна-Блю. 93,4% хворих оцінили результативність проведеного лікування як найкращу та задовільну, що дає змогу рекомендувати Пембіна-Блю до застосування в пацієнтів з ускладненими інфекціями сечових шляхів.
У пілотному дослідженні URO-BLUE (Іванов Д.Д., 2021) Пембіна-Блю використовувалася для лікування пацієнтів з рецидивуючими формами сечокам’яної хвороби. У ньому взяли участь 68 пацієнтів, які протягом місяця приймали Пембіна-Блю по 2 капсули 2 рази на добу.
Результати дослідження дозволили виявити зменшення розмірів конкрементів на 31%, зменшення клінічних симптомів ІСШ та поліпшення якості життя на 91%. Крім того, Пембіна-Блю знижувала частоту виникнення епізодів гострого циститу у пацієнток з рецидивуючими ІСШ на тлі сечокам’яної хвороби через 1 (2,6%) та 3 (7,7%) місяці після лікування, тоді як у групі контролю ці показники становили 10,3 та 24% відповідно.
У роботі M. Geller et al. (2008) було доведено, що Пембіна-Блю зменшує частоту рецидивів циститу через 6 місяців після лікування. У пацієнтів, які приймали Пембіна-Блю по 1 капсулі 2 рази на день протягом місяця, рецидивування циститу через 6 місяців становило 10,2%, у групі контролю — 30,1%.
Сьогодні також з’явився новий лікувальний комплекс пробіотичних культур від корпорації «АБ-Біотик» (Іспанія) — Пембіна-Біотик, який спеціально розроблений для боротьби з уропатогенами у кишечнику та піхві.
Пембіна-Біотик — це мікрокапсульований комплекс пробіотичних культур, який має в своєму складі: Lactobacillus plantarum CECT 8675 та Lactobacillus plantarum СЕСТ 8677 не менше ніж 1×109 КУО, сухий екстракт журавлини 240 мг (РАС 120 мг) та L-аскорбінову кислоту (вітамін С) 40 мг. Завдяки рідкісній інноваційній технології мікроінкапсуляції живі бактерії (пробіотик) захищені від інгібуючої дії шлункового соку, журавлини і вітаміну С та здійснюють потрійний захист від ІСШ: сухий екстракт журавлини перешкоджає адгезії патогенів до стінок уроепітелію (механічний захист), Lactobacillus plantarum CECT 8675 та Lactobacillus plantarum СЕСТ 8677 інгібують уропатогени E.coli, K.pneumoniae, P.mirabilis, E.faecalis і S.saprophyticus (біологічний захист), вітамін С підтримує баланс рН та підвищує імунну відповідь (хімічний захист). Крім того, Пембіна-Біотик має сумісність з найбільш поширеними антибіотиками для лікування ІСШ, а саме з фосфоміцином і ципрофлоксацином.
Пембіна-Біотик перешкоджає розмноженню патогенних мікроорганізмів в кишечнику, що сприяє відновленню балансу нормальної мікрофлори кишечника і піхви, усуненню дисбактеріозу і дисбіозу. Пембіна-Біотик підвищує локальний захист шляхом зниження проникнення патогенних мікроорганізмів через стінку кишечника: гальмує адгезивні властивості E.coli, пригнічує розвиток в кишечнику грибів роду Candida, патогенних мікроорганізмів типу Clostridium, Enterobactreriaceae, Pseudomonas, Staphylococcus; стимулює продукцію секреторного lgA та сприяє зменшенню кількості рецидивів вульвовагінального кандидозу та ІСШ.
Європейська асоціація урологів (2011) у своїх рекомендаціях зазначає, що є докази, які підтверджують ефективність журавлини для зниження інфекцій нижніх сечових шляхів у жінок (рівень доказовості 1B, ступінь рекомендацій С). На практиці рекомендується її щоденний прийом у кількості 36 мг проантоціанідинів (активна речовина).
Дослідження, які були проведені на базі Університету Рутгерса, продемонстрували, що журавлинні проантоціанідини пригнічують здатність патогенної кишкової палички прилипати до епітеліальних клітин сечовивідних шляхів.FDA дійшла висновку, що існують наукові докази, які підтверджують, що журавлина може допомогти зменшити ризик повторних інфекцій сечовивідних шляхів у здорових жінок.

/33.jpg)