Архив офтальмологии Украины Том 12, №2, 2024
Вернуться к номеру
Нові фактори ризику і прогнозування розвитку оклюзій вен сітківки після кардіохірургічних втручань з використанням штучного кровообігу: заключне повідомлення
Авторы: Венедіктова О.А. (1), Могилевський С.Ю. (2), Путієнко О.О. (2), Туманова О.В. (2)
(1) - Київська міська клінічна офтальмологічна лікарня «Центр мікрохірургії ока», м. Київ, Україна
(2) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
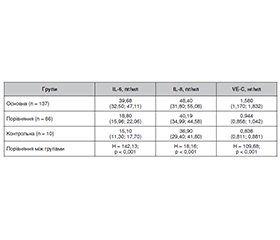
Актуальність. Серцево-судинні захворювання є одним з факторів ризику розвитку оклюзії вен сітківки (ОВС). Кардіохірургічні операції з використанням штучного кровообігу (ШК) можуть супроводжуватися періопераційними ускладненнями з боку органа зору, у тому числі оклюзіями судин сітківки. Визначення частоти виникнення оклюзій судин сітківки, особливостей клініки, факторів ризику, ролі маркерів запалення та ендотеліальної дисфункції при ОВС у пацієнтів із серцево-судинними захворюваннями після кардіохірургічних втручань із застосуванням штучного кровообігу є актуальним завданням сучасної офтальмології. Мета: дослідити нові фактори ризику і прогнозування розвитку оклюзій вен сітківки після кардіохірургічних втручань з використанням штучного кровообігу. Матеріали та методи. Під спостереженням знаходилися 394 пацієнти (638 очей), з них — 220 пацієнтів (405 очей) із серцево-судинними захворюваннями, яким виконувалися кардіохірургічні втручання із застосуванням ШК. У цих пацієнтів було вивчено характер, частоту й особливості розвитку і клінічного перебігу оклюзій вен сітківки після кардіохірургічних втручань із застосуванням штучного кровообігу в ранні та пізні терміни спостереження. Також проведені дослідження 174 пацієнтів (233 ока) із серцево-судинними захворюваннями, яким виконувалися кардіохірургічні втручання із застосуванням ШК і проводилося визначення рівня маркерів запалення (IL-6 та IL‑8) і ендотеліальної дисфункції (VE-кадгерину (VE-C)) у сироватці крові до проведення хірургічної операції та після неї залежно від терміну виникнення ОВС. Основна група — 126 пацієнтів (137 очей), у яких була діагностована оклюзія центральної вени сітківки (ЦВС) або її гілок після операції із ШК; група порівняння — 43 пацієнти (86 очей), які протягом усього терміну спостереження не мали оклюзій вен сітківки; група контролю — 5 пацієнтів (10 очей), які мали той самий ступінь і тривалість основного захворювання, показання до операції із ШК, але були обстежені до операції та протягом 180 діб після операції, у цих пацієнтів ОВС не було виявлено. Пацієнти оглядалися офтальмологом через 2, 7, 30, 60, 90 і 180 діб після кардіохірургічного втручання. Вміст IL-6, IL-8 і VE-C у сироватці крові визначали імуноферментним методом (Bender Medsystems, Австрія). Статистичну обробку даних проводили з використанням програми Statistica 10 (StatSoft Inc., USA), регресійний аналіз — з використанням програмного пакета GLZ. Результати. У результаті досліджень було встановлено, що частота оклюзій вен сітківки після кардіохірургічних втручань із застосуванням штучного кровообігу на 2-гу добу становила 0,99 %, на 7-му добу — 3,95 %, через 3 місяці — 10,2 %, через 6 місяців — 1,4 %. Проведений дискримінантний аналіз показав, що тип оклюзії визначали вік, нижча гострота зору і порядок оклюзії гілок ЦВС. Значення мало також і збільшення макулярного об’єму сітківки, що відображало розвиток макулярного набряку. Регресійна модель прогнозу типу оклюзії за гостротою зору, порядком оклюзії гілок ЦВС і віком мала точність прогнозу 82,5 %. Проведення кардіохірургічних операцій з використанням ШК викликало підвищення вмісту інтерлейкінів у ранньому періоді (IL-6 — на 2-гу і 7-му добу, IL-8 — до 30-ї доби), тоді як вміст VE-кадгерину був незначно підвищений протягом майже всього періоду спостереження. За наявності ОВС вміст IL-6 на всіх термінах виникнення оклюзії був значно вищим, вміст IL-6 — до 30-ї доби, а вміст VE-C — більшою мірою після 7-ї доби. Регресійний аналіз показав, що через 1–2 доби виникнення ОВС було прямо пов’язане з вмістом у крові IL-6 і IL-8, на 3-тю — 7-му добу — тільки IL-8, на 8-му — 30-ту добу — з усіма маркерами, а згодом — з вмістом IL-6 і VE-C. Точність прогнозу наявності або відсутності ОВС на відповідному терміні за розрахованими регресійними моделями становить не менше ніж 78 % (p < 0,001), що доводить вплив маркерів на розвиток ОВС. Висновки. Проведене дослідження показує значення гострого запалення й ендотеліальної дисфункції у виникненні ОВС при використанні ШК, що обґрунтовує застосування профілактичних засобів на ранніх термінах для обмеження активності запального процесу, а на пізніх — для запобігання розвитку ендотеліальної дисфункції.
Background. Cardiovascular diseases are one of the risk factors for the development of retinal vein occlusion (RVO). Cardiac interventions with artificial circulation (AC) can be associated with perioperative complications, including retinal vessel occlusion. The actual task of modern ophthalmology is to determine the frequency of retinal vessel occlusions, clinical features, risk factors, the role of markers of inflammation and endothelial dysfunction in RVO in patients with cardiovascular diseases after surgeries with artificial circulation. The purpose of the study was to investigate new risk factors and predict the development of retinal vein occlusions after cardiac surgeries using artificial circulation. Materials and methods. Three hundred and ninety-four patients (638 eyes) were under observation. Of them, 220 people (405 eyes) had cardiovascular diseases and underwent heart surgeries with the use of AC. In these patients, we determined the nature, frequency and features of the development and clinical course of RVO after cardiac surgery with AC in the early and late periods of observation (3 and 6 months). Also, a study was conducted of 174 patients (233 eyes) with cardiovascular diseases who underwent cardiac surgeries with AC, and the serum levels of markers of inflammation (IL-6 and IL-8) and endothelial dysfunction (VE-cadherin) were determined before and after operations depending on the time of RVO occurrence. The main group included 126 patients (137 eyes) who were diagnosed with occlusion of the central retinal vein (CRV) or its branches after surgery with AC; the comparison group — 43 patients (86 eyes) who did not have retinal vein occlusion during the entire observation period; the control group — 5 patients (10 eyes) who had the same degree and duration of the underlying disease, indications for surgery with AC, but were examined before the operation, and within 180 days after it, and did not have RVO. The patients were examined by an ophthalmologist 2, 7, 30, 60, 90 and 180 days after cardiac surgery. The content of IL-6, IL-8 and VE-cadherin in blood serum was determined by the enzyme immunoassay (Bender MedSystems, Austria). Statistical data were processed using the Statistica 10 program (StatSoft Inc., USA), regression analysis was performed with the help of the GLZ software package. Results. As a result of the research, it was found that the frequency of retinal vein occlusions after cardiac surgeries with the use of artificial circulation was 0.99 % on the 2nd day, 3.95 % on the 7th day, 10.2 % after 3 months, 1.4 % after 6 months. The conducted discriminant analysis showed that the type of occlusion was determined by age, lower visual acuity, and the order of occlusion of the CRV branches. An increase in the macular volume of the retina was also significant, reflecting the development of macular edema. The regression model for predicting the type of occlusion based on visual acuity, the order of occlusion of the CRV branches and age had a prediction accuracy of 82.5 %. Cardiac surgeries with the use of AC caused an increase in interleukin content in the early period (IL-6 on days 2 and 7, and IL-8 — up to day 30), while the content of VE-cadherin was slightly increased during almost the entire observation period. In the presence of RVO, IL-6 content was significantly higher at all stages of occlusion development, IL-8 content — up to 30 days, and VE-cadherin content — mostly after 7 days. Regression analysis showed that after 1–2 days, the occurrence of RVO was directly related to the content of IL-6 and IL-8 in the blood, on days 3–7 — to the content of only IL-8, on days 8–30 — to the content of all markers, and later — to the content of IL-6 and VE-cadherin. The prediction accuracy for the presence or absence of RVO in the corresponding term according to the calculated regression models is at least 78 % (p < 0.001), which proves the influence of markers on the development of RVO. Conclusions. The conducted study shows the importance of acute inflammation and endothelial dysfunction in the occurrence of RVO when using AC, which justifies the use of preventive measures in the early stages of limiting the activity of the inflammatory process, in the later stages — preventing the development of endothelial dysfunction.
оклюзія вен сітківки; штучний кровообіг; IL-6; IL-8; VE-кадгерин
retinal vein occlusion; artificial circulation; IL-6; IL-8; VE-cadherin
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Cugati S, Wang JJ, Rochtchina E, Mitchell P. Ten-year incidence of retinal vein occlusion in an older population: the Blue Mountains Eye Study. Arch Ophthalmol. 2006;124:726-732.
- Rogers SL, McIntosh RL, Lim L et al. Natural history of branch retinal vein occlusion: an evidence based systematic review. Ophthalmology. 2010;117(6):1094-1101.
- Астахов Ю.С., Тульцева С.Н. Окклюзии вен сетчатки: методические рекомендации. СПб.: Эко-Вектор, 2017. 82 с.
- The Eye Disease Case-Control Study Group. Risk factors for branch retinal vein occlusion. Am J Ophthalmol. 1993;116:286-296.
- 2013 ESC guidelines on the management of stable coronary artery disease: The Task Forceon the management of stable coronary artery disease of the European Society of Cardiology. European Heart Journal. 2013;34(38):2949-3003. https://doi.org/10.1093/eurheartj/eht296.
- Журба О.О. Операції аортокоронарного шунтування на працюючому серці в умовах штучного кровообігу [дисертація]. Нац. акад. мед. наук України, Держ. установа «Нац. ін-т серцево-судин. хірургії ім. М.М. Амосова НАМН України». Київ, 2019. 154 с.
- Аверина Т.Б. Искусственное кровообращение. Анналы хирургии. 2013. № 2. С. 5-12.
- Raphael J, Moss HE, Roth S. Perioperative Visual Loss in Cardiac Surgery. Journal of Cardiothoracic and Vascular Anesthesia. 2019;33(5):1420-1429. doi: http://doi.org/10.1053/j.jvca.2018.11.035.
- Paunel-Görgülü A, Wacker M., El Aita M, Hassan S, Schlachtenberger G, Deppe A et al. cfDNA correlates with endothelial damage after cardiac surgery with prolonged cardiopulmonary bypass and amplifies NETosis in an intracellular TLR9-independent manner. Scientific Reports. 2017;7(1). doi: http://doi.org/10.1038/s41598-017-17561-1.
- Nenekidis I, Pournaras C, Tsironi E, Tsilimingas N. Vision impairment during cardiac surgery and extracorporeal circulation: current understanding and the need for further investigation. Acta Ophthalmologica. 2012;90(3):168-172.
- Rainio A, Hautala N, Pelkonen O. Risk of retinal microembolism after off-pump and on-pump coronary artery bypass surgery. J Cardiovasc Surg (Torino). 2007;48:773-9.
- Kowalik MM, Lango R, Siondalski P, Chmara M, Brzeziński M, Lewandowski K et al. Clinical, biochemical and genetic risk factors for 30-day and 5-year mortality in 518 adult patients subjected to cardiopulmonary bypass during cardiac surgery — the INFLACOR study. Acta Biochim Pol. 2018;65(2):241-50. doi: 10.18388/abp.2017_2361.
- Warren OJ, Smith AJ, Alexiou C, Rogers PL, Jawad N, Vincent C, Darzi AW, Athanasiou T. The inflammatory response to cardiopulmonary bypass: part 1 — mechanisms of pathogenesis. J Cardiothorac Vasc Anesth. 2009 Apr;23(2):223-31. doi: 10.1053/j.jvca.2008.08.007.
- Venediktova O.A. Influence of acute inflammation and endothelial dysfunction on the retinal vein occlusion formation after cardio-surgical interferences with the use of cardiopulmonary bypass. Eureka: Health Sciences. 2020;2:32-39.
- Brettner F, Chappell D, Schwartz L, Lukasz A, Kümpers P, Becker BF et al. Vascular Endothelial Dysfunction during Cardiac Surgery: On-Pump versus Off-Pump Coronary Surgery. Eur Surg Res. 2017;58(5–6):354-68. doi: 10.1159/000480431.