Журнал «Медицина неотложных состояний» Том 21, №5, 2025
Вернуться к номеру
Прогестерон як маркер результату тяжкої черепно-мозкової травми
Авторы: Клигуненко О.М., Дзяк Л.А., Кравець О.В., Зозуля О.О., Єхалов В.В., Кріштафор Д.А., Станін Д.М.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
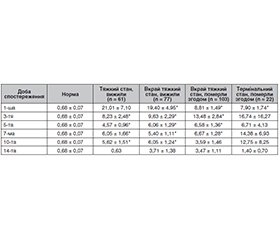
Актуальність. У статті детально висвітлена роль прогестерону (ПГН) як нейропротектора при тяжкій черепно-мозковій травмі (ТЧМТ) та доцільність використання його як біохімічного маркера прогнозу захворювання. Мета: на підставі аналізу змін концентрації ПГН у плазмі крові постраждалих довести доцільність використання його як біохімічного маркера прогнозу тяжкості перебігу та результату ТЧМТ. Матеріали та методи. Обстежено 280 осіб чоловічої статі із ТЧМТ, які отримували стандартизоване лікування з урахуванням сучасних доказових рекомендацій. Хворі були поділені на групи молодого (n = 165) та зрілого (n = 115) віку. За вихідною тяжкістю стану постраждалих розподілили на три групи. У I групу (тяжкий стан) увійшло 73 хворих. У ІІ групу (вкрай тяжкий стан) включили 180 хворих. ІІІ групу (термінальний стан) становили 27 постраждалих. За ступенем структурних ушкоджень головного мозку та лікворовмісних просторів обстежених розподілили на 4 клінічні групи. Група А
(n = 51) — хворі із забоєм головного мозку (ЗГМ) тяжкого ступеня. У групі Б (n = 112) ЗГМ тяжкого ступеня поєднувався із субарахноїдальним крововиливом (САК). Група В (n = 83) — ЗГМ тяжкого ступеня в поєднанні з гематомами різної локалізації. Група Г (n = 34) — ЗГМ тяжкого ступеня поєднувався із САК та внутрішньочерепними гематомами. Кожна з груп поділялася на тих, що вижили та померли на етапах лікування. Обстеження проводили у 1-шу, 3-тю, 5-ту, 7-му, 10-ту та 14-ту добу захворювання. Математичну обробку отриманих даних проводили за допомогою методів варіаційної статистики. Результати. Середня летальність серед обстежених становила 48,9 %. У тих, хто вижив, рівень ПГН вірогідно перевищував норму на 2737,6 % на 1-шу добу після травми. При несприятливому результаті ТЧМТ відзначалося вірогідно менше перевищення рівня гормону. В осіб молодого віку, що вижили, рівень ПГН вірогідно перевищував норму на 2779,4 %, зрілого віку — на 2513,2 %. У згодом померлих підйом ПГН в обох вікових категоріях був вірогідно меншим. У постраждалих, що вижили та при надходженні мали тяжкий або вкрай тяжкий стан, у 1-шу добу спостереження рівень ПГН був найвищим. У постраждалих, які надійшли у вкрай тяжкому або термінальному стані та померли згодом, зростання ПГН було меншим. Аналіз змін ПГН у клінічних групах показав вірогідне та незалежне від ступеня структурного ушкодження головного мозку зростання його на всіх етапах спостереження. Проте ступінь зростання зменшувався відповідно до обтяження структурними порушеннями. Висновки. В осіб чоловічої статі ТЧМТ супроводжується вірогідним та незалежним від результату ростом ПГН у сироватці крові. У тих, що вижили, ступінь підйому ПГН є вірогідно більшим та не залежить від віку і тяжкості загального стану при надходженні, що дозволяє віднести ПГН до маркерів прогнозу тяжкості перебігу та результату ТЧМТ.
Background. The article details the role of progesterone (PGN) as a neuroprotective agent in severe traumatic brain injury (STBI) and the feasibility of its use as a biochemical marker for disease prognosis. The purpose: based on the analysis of PGN changes in the blood plasma of victims, to prove the feasibility of using it as a biochemical marker for predicting the severity and outcomes of STBI. Materials and methods. A total of 280 male patients with STBI were examined who received standardized treatment taking into account modern evidence-based recommendations. They were divided into groups of young (n = 165) and mature (n = 115) age. According to the initial severity, victims were divided into three groups: group I (severe condition) included 73 patients; group II (extremely severe condition) — 180 people; group III (terminal condition) consisted of 27 victims. Based on the degree of structural damage to the brain and cerebrospinal fluid spaces, the patients were also divided into four clinical groups: group A (n = 51) — severe cerebral contusion; group B (n = 112) — severe cerebral contusion combined with subarachnoid hemorrhage (SAH); group C (n = 83) — severe cerebral contusion combined with hematomas of various location; group D (n = 34) — severe cerebral contusion combined with SAH and intracranial hematomas. Each group was divided into survivors and those who died during the treatment stages. Examinations were conducted on days 1, 3, 5, 7, 10, and 14 after the injury. Mathematical processing of the obtained data was carried out using methods of variational statistics. Results. The average mortality among the examined was 48.9 %. In survivors, the PGN level significantly exceeded the norm by 2,737.6 % on day 1 after the injury. In case of an unfavorable outcome of STBI, the hormone level exceeded the norm to a significantly lesser extent. In young survivors, the PGN level significantly exceeded the norm by 2,779.4 %, in mature ones — by 2,513.2 %. In those who died later, the rise in PGN in both age categories was significantly lower. Among survivors admitted in severe or extremely severe condition, the PGN level was the highest on the day 1 of observation. In victims who were admitted in extremely severe or terminal condition and died later, an increase in PGN was smaller. Analysis of PGN changes across clinical groups showed significant and independent increase in its level at all stages of observation, regardless of the degree of structural brain damage. However, the degree of a rise decreased in proportion to the severity of structural abnormalities. Conclusions. In males, STBI is accompanied by a significant increase in serum PGN independently of outcome. Among survivors, the degree of PGN rise is significantly higher and does not depend on age or severity upon admission, which allows us to attribute PGN to markers for predicting the severity and outcome of STBI.
прогестерон; тяжка черепно-мозкова травма; маркер; прогноз; результат
progesterone; severe traumatic brain injury; marker; prognosis; outcome
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Dewan M.C., Rattani A., Gupta S., et al. Estimating the global incidence of traumatic brain injury. J Neurosurg. 2018. Vol. 130(4). P. 1080-1097. doi: 10.3171/2017.10.JNS17352.
- Rao V., Lyketsos C. Neuropsychiatric sequelae of traumatic brain injury. Psychosomatics. 2000. Vol. 41(2). P. 95-103. doi: 10.1176/appi.psy.41.2.95.
- Zhong H., Feng Y., Shen J., et al. Global Burden of Traumatic Brain Injury in 204 Countries and Territories From 1990 to 2021. Am J Prev Med. 2025. Vol. 68(4). P. 754-763. doi: 10.1016/j.amepre.2025.01.001.
- Iaccarino C., Carretta A., Nicolosi F., Morselli C. Epidemiology of severe traumatic brain injury. J Neurosurg Sci. 2018. Vol. 62(5). P. 535-541. doi: 10.23736/S0390-5616.18.04532-0.
- Alves O.L., Bullock R. Excitotoxic damage in traumatic brain injury. In: Clark RS, Kochanek P (eds.). Brain injury. 2001. Boston: Kluwer Academic Publishers. P. 1-36. ISBN 978-0-7923-7532-6.
- Ng S.Y., Lee A.Y.W. Traumatic Brain Injuries: Pathophysio–logy and Potential Therapeutic Targets. Front Cell Neurosci. 2019. Vol. 13. P. 528. Published 2019 Nov 27. doi: 10.3389/fncel.2019.00528.
- Thapa K., Khan H., Singh T.G., Kaur A. Traumatic Brain Injury: Mechanistic Insight on Pathophysiology and Potential Therapeutic Targets. J Mol Neurosci. 2021. Vol. 71(9). P. 1725-1742. doi: 10.1007/s12031-021-01841-7.
- Bouzat P., Sala N., Payen J.F., Oddo M. Beyond intracranial pressure: optimization of cerebral blood flow, oxygen, and substrate delivery after traumatic brain injury. Ann Intensive Care. 2013. Vol. 3(1). P. 23. doi: 10.1186/2110-5820-3-23.
- Hill C.S., Coleman M.P., Menon D.K. Traumatic Axonal Injury: Mechanisms and Translational Opportunities. Trends Neurosci. 2016. Vol. 39(5). P. 311-324. doi: 10.1016/j.tins.2016.03.002.
- Kinoshita K. Traumatic brain injury: pathophysiology for neurocritical care. J Intensive Care. 2016. Vol. 4. P. 29. doi: 10.1186/s40560-016-0138-3.
- Werner C., Engelhard K. Pathophysiology of traumatic brain injury. Br J Anaesth. 2007. Vol. 99(1). P. 4-9. doi: 10.1093/bja/aem131.
- Zhao Q., Li H., Li H., Zhang J. Research progress on pleiotropic neuroprotective drugs for traumatic brain injury. Front Pharmacol. 2023. Vol. 14. Article No. 1185533. doi: 10.3389/fphar.2023.1185533.
- Stein D.G. Progesterone exerts neuroprotective effects after brain injury. Brain Res Rev. 2008. Vol. 57(2). P. 386-397. doi: 10.1016/j.brainresrev.2007.06.012.
- Stein D.G., Wright D.W. Progesterone in the clinical treatment of acute traumatic brain injury. Expert Opin Investig Drugs. 2010. Vol. 19(7). P. 847-857. doi: 10.1517/13543784.2010.489549.
- Amirkhosravi L., Khaksari M., Amiresmaili S., Sanjari M., Khorasani P, Hashemian M. Evaluating the neuroprotective effects of progesterone receptors on experimental traumatic brain injury: The PI3K/Akt pathway. Brain Behav. 2023. Vol. 13(11). P. e3244. doi: 10.1002/brb3.3244.
- Zhou Z., Li Y., Peng R., et al. Progesterone induces neuroprotection associated with immune/inflammatory modulation in experimental traumatic brain injury. Neuroreport. 2024. Vol. 35(6). P. 352-360. doi: 10.1097/WNR.0000000000002013.
- Yu P., Li S., Zhang Z., et al. Progesterone-mediated angiogenic activity of endothelial progenitor cell and angiogenesis in traumatic brain injury rats were antagonized by progesterone receptor antagonist. Cell Prolif. 2017. Vol. 50(5). P. e12362. doi: 10.1111/cpr.12362.
- Ghadiri T., Vakilzadeh G., Hajali V., Khodagholi F. Proge–sterone modulates post-traumatic epileptogenesis through regulation of BDNF-TrkB signaling and cell survival-related pathways in the rat hippocampus. Neurosci Lett. 2019. Vol. 709. P. 134384. doi: 10.1016/j.neulet.2019.134384.
- Fox L.C., Scholl J.L., Palmer G.M., Forster G.L., Watt M.J. Sex differences in the effects of mild traumatic brain injury and progesterone treatment on anxiety-like behavior and fear conditioning in rats. Exp Neurol. 2023. Vol. 365. Article No. 114415. doi: 10.1016/j.expneurol.2023.114415.
- Guennoun R. Progesterone in the Brain: Hormone, Neuro–steroid and Neuroprotectant. Int J Mol Sci. 2020. Vol. 21(15). P. 5271. doi: 10.3390/ijms21155271.
- Zheng C., Gong J., Zang L., et al. Mechanism of Progesterone in Treatment of Traumatic Brain Injury Based on Network Pharmacology and Molecular Docking Technology. Med Sci Monit. 2022. Vol. 28. Article No. e937564. doi: 10.12659/MSM.937564.
- Allitt B.J., Johnstone V.P.A., Richards K.L., Yan E.B., Rajan R. Progesterone Sharpens Temporal Response Profiles of Sensory Cortical Neurons in Animals Exposed to Traumatic Brain Injury. Cell Transplant. 2017. Vol. 26(7). P. 1202-1223. doi: 10.1177/0963689717714326.
- Bazgir R., Siahposht-Khachaki A., Akbari E., Farzin D. A Study of the Therapeutic Effects of Progesterone in Patients with Traumatic Brain Injury: A Systematic Review and Meta-analysis. Archives of Trauma Research. 2021. Vol. 10(2). P. 54-58. doi: 10.4103/atr.atr_106_19.
- Pan Z.Y., Zhao Y.H., Huang W.H., Xiao Z.Z., Li Z.Q. Effect of progesterone administration on the prognosis of patients with severe traumatic brain injury: a meta-analysis of randomized clinical trials. Drug Des Devel Ther. 2019. Vol. 13. P. 265-273. doi: 10.2147/DDDT.S192633.
- Zima L., Moore A.N., Smolen P., et al. The evolving pathophysiology of TBI and the advantages of temporally-guided combination therapies. Neurochem Int. 2024. Vol. 180. P. 105874. doi: 10.1016/j.neuint.2024.105874.
- Carney N., Totten A.M., O’Reilly C., et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 2017. Vol. 80(1). P. 6-15. doi: 10.1227/NEU.0000000000001432.
- Победьонний А.Л. Поширення та структура черепно-мозкової травми у великому промисловому регіоні. Український нейрохірургічний журнал. 2011. № 3. С. 32-35.