Вступ
Метаболічно-асоційована стеатотична хвороба печінки (МАСХП), що нещодавно замінила термін «неалкогольна жирова хвороба печінки», є провідною причиною хронічних захворювань печінки у світі, охоплюючи понад 25 % дорослого населення [1, 2]. Характерною ознакою МАСХП є накопичення жиру в гепатоцитах у поєднанні з метаболічною дисфункцією, яка супроводжується запаленням, оксидативним стресом і фіброзом [3, 4].
Встановлено, що ліпідна пероксидація відіграє ключову роль у патогенезі МАСХП [5]. У процесі перекисного окиснення поліненасичених жирних кислот (ПНЖК) утворюються токсичні сполуки, зокрема малоновий діальдегід (МДА) і 8-iso-PGF2α (8-ізопростан), які є маркерами оксидативного стресу та пошкодження клітин [6–8].
Особливо важливо, що 8-iso-PGF2α утворюються неферментативним шляхом з арахідонової кислоти (AA) і мають вазоактивні та запальні властивості, що посилює гепатоцелюлярну дисфункцію [9]. ПНЖК, зокрема n-6 лінолева (LA) та n-3 докозагексаєнова кислота (DHA), не лише виконують структурну функцію у мембранах клітин, але й беруть участь у регуляції запальних і антиоксидантних процесів. Сучасні дослідження демонструють зниження рівнів ПНЖК у плазмі крові пацієнтів з МАСХП, що асоціюється з більш тяжким перебігом хвороби та поглибленням ліпідного дисбалансу [10]. Крім того, надмірне накопичення продуктів ліпопероксидації, таких як 8-iso-PGF2α та МДА, активує фероптоз — форму залізозалежної клітинної загибелі, яка посилює прогресування стеатогепатиту. Таким чином, біомаркери перекисного окиснення ліпідів можуть слугувати як діагностичними індикаторами тяжкості МАСХП, так і мішенями для потенційної терапії [4, 5].
На сьогодні 8-iso-PGF2α та МДА розглядаються як найбільш чутливі та специфічні біомаркери in vivo оцінки перекисного окиснення ліпідів, гепатоцелюлярного ушкодження та фіброзу печінки [10, 11]. МДА є традиційним біохімічним маркером кінцевого етапу ліпопероксидації, що активно використовують у клінічних та експериментальних дослідженнях. За даними авторів, підвищений рівень МДА у крові пацієнтів із МАСХП вірогідно корелює з активністю амінотрансфераз та показниками жорсткості печінкової тканини за результатами еластографії (liver stiffness measurement — LSM) [2, 3]. Авторами зроблено припущення, що ці зміни зумовлені виснаженням ендогенного антиоксидантного захисту, зокрема дефіцитом глутатіону. Методика, яка заснована на реакції з тіобарбітуровою кислотою, широко використовується для кількісного визначення МДА, хоча її специфічність є обмеженою, що потребує додаткового підтвердження більш специфічними та чутливими методами.
ПНЖК відіграють ключову роль у регуляції запальних та антиоксидантних процесів при метаболічній патології печінки та виступають модифікаторами запалення при МАСХП. У роботах авторів [12, 13] наголошується, що омега-3 ПНЖК (α-ліноленова кислота (ALA), ейкозапентаєнова кислота (EPA)) чинять протизапальний ефект, індукують синтез резолвінів та збільшують чутливість до інсуліну. Водночас надмірне надходження омега-6 ПНЖК, зокрема лінолевої та арахідонової кислот, сприяє синтезу прозапальних ейкозаноїдів (через COX/LOX-шляхи), стимулює персистуюче запалення та прогресування стеатогепатиту [14, 15].
Огляд Le Zhang і Yang (Biocell, 2025) узагальнює дані щодо ролі мітохондріального джерела реактивних форм кисню (ROS) у розвитку МАСХП. Автори описують, що ключовими механізмами ушкодження є порушення β-окиснення, втрата цілісності кардіоліпіну, дисфункція ендоплазматичного ретикулуму. Ці процеси активують каскад окисного стресу, запалення та фіброгенезу. Крім того, доведено, що активація сигнальних шляхів Nrf2/NF-κB за рахунок антиоксидантної терапії (наприклад, введення N-ацетил-L-цистеїну) призводить до зниження рівнів 8-iso-PGF2α та МДА у крові [15]. Відповідно до сучасних концепцій МАСХП є мультисистемним захворюванням, що супроводжується ліпідним дисбалансом, оксидативним стресом, хронічним запаленням, інсулінорезистентністю та фіброзом [16].
Одним із провідних чинників у прогресуванні МАСХП є оксидативний стрес, який виникає внаслідок дисбалансу між продукуванням вільних радикалів та здатністю організму їх нейтралізувати. Надмірне утворення активних форм кисню (reactive oxygen species — ROS) ініціює перекисне окиснення ПНЖК, внаслідок чого генеруються біоактивні токсичні метаболіти — МДА та 8-iso-PGF2α [17]. Ці сполуки не лише є маркерами ліпопероксидації, а й безпосередньо беруть участь у пошкодженні клітинних мембран, активації прозапальних сигнальних шляхів та індукції фіброгенезу [18].
У пацієнтів із МАСХП спостерігається істотне зниження вмісту омега-3 ПНЖК (ALA, EPA, DHA) при паралельному надлишку фракцій омега-6 (лінолева та арахідонова кислоти), що призводить до порушення ПНЖК-балансу, посилення запалення, стимуляції синтезу прозапальних ейкозаноїдів [17].
Хоча роль оксидативного стресу у прогресуванні МАСХП не викликає сумнівів, актуальними є кілька важливих питань:
— які саме біомаркери перекисного окиснення ліпідів є показовими для оцінки перебігу/тяжкості МАСХП;
— чи корелюють зміни рівнів 8-iso-PGF2α та МДА з показниками жорсткості печінки та ліпідного обміну;
— наскільки ефективними є сучасні антиоксидантні підходи у терапії, спрямовані на корекцію цих показників.
Попри численні дослідження, все ще недостатньо вивченими залишаються питання комплексного впливу антиоксидантної терапії на спектр ПНЖК, рівень процесів перекисного окиснення ліпідів та функціональний стан печінки, показники жорсткості печінки та дисліпідемії. У цьому контексті особливу наукову та практичну цінність має вивчення динаміки маркерів оксидативного стресу (8-iso-PGF2α, МДА) та спектра ПНЖК у сироватці крові пацієнтів із МАСХП під впливом комплексного засобу Гепавіста Детокс як потенційного антиоксидантного та гепатопротекторного агента.
Мета дослідження: визначити вплив комбінованого засобу Гепавіста Детокс на динаміку маркерів оксидативного стресу та вміст поліненасичених жирних кислот у сироватці крові пацієнтів з МАСХП.
Матеріали та методи
Дослідження проведено у 45 хворих на МАСХП, які лікувались у ДУ «Інститут гастроентерології НАМН України», діагноз встановлювався за критеріями EASL 2023 року. Серед досліджених пацієнтів чоловіків було 25 (55,6 %), жінок — 20 (44,4 %), середній вік пацієнтів становив (51,53 ± 1,93) року. Для встановлення діагнозу МАСХП необхідна наявність у пацієнта стеатозу печінки та одного із 5 кардіометаболічних факторів ризику, які включають: збільшення індексу маси тіла або окружності талії; порушення метаболізму глюкози; артеріальну гіпертензію; високий рівень тригліцеридів та низький рівень холестерину ліпопротеїнів високої щільності.
До участі в дослідженні були залучені виключно пацієнти, які підписали інформовану згоду та повністю відповідали критеріям включення, при цьому не маючи жодного з критеріїв виключення.
Критерії включення: вік пацієнтів від 18 до 65 років; наявність МАСХП; ознаки стеатозу печінки за даними еластометрії та еластографії печінки; згода хворого на участь в обстеженні. Критерії виключення: конкуруючі захворювання печінки (вірусні, алкогольні, автоімунні, біліарні тощо); тяжкі ураження інших органів та систем; ендокринна патологія, включаючи інсулінозалежний та некомпенсований інсулінонезалежний цукровий діабет І та ІІ типу.
Усім залученим пацієнтам провели комплексне обстеження, що включало клінічний огляд, лабораторні аналізи та інструментальні дослідження як до, так і після прийому досліджуваного комплексного засобу. Для оцінки ступеня жирової дистрофії (стеатозу) печінки та визначення рівня фіброзу використовували транзієнтну еластографію та стеатометрію з визначенням контрольованого показника атенуації ультразвуку (controlled attenuation parameter — CAP). Ці вимірювання здійснювались за допомогою апарату FibroScan® 502 touch (Echosens, Paris, France) з обчисленням показника жорсткості печінки (LSM, кПа).
Пацієнти отримували комплексний засіб Гепавіста Детокс по 1 таблетці 2 рази на добу протягом 45 днів. Гепавіста Детокс — це дієтична добавка до раціону харчування, спрямована на нормалізацію функції печінки. Кожна таблетка Гепавіста Детокс містить 2 основні елементи: S-аденозилметіонін — 400 мг, глутатіон — 250 мг, а також допоміжні речовини: крохмаль, мікрокристалічну целюлозу, дикальцію фосфат, манітол, лактозу, повідон К-30, гідроксипропіл метилцелюлозу, магнію стеарат, тальк, натрію крохмаль гліколят, червоний оксид заліза. Виробник комплексного засобу Гепавіста Детокс — Eubion Corporation Sp.z.o.o., Польща. Рекомендований спосіб застосування — по 1 таблетці двічі на день за годину до або дві години після прийому їжі, запиваючи склянкою води (200 мл), тривалість становила 4–6 тижнів, потім проводились контрольні дослідження (клінічна оцінка, лабораторні та інструментальні дослідження).
Визначення концентрації 8-ізо-PGF2α у сироватці крові проводили методом ELISA за допомогою наборів-реагентів фірми MyBiosource, виробник Detection, США (діапазон вимірювання 15 625–1000 пг/мл). Цей метод ґрунтується на принципі конкурентного імуноферментного аналізу (ELISA). У цьому аналізі мікротитрова плашка попередньо сенсибілізована 8-ізо-PGF2α. У процесі інкубації 8-ізо-PGF2α, присутній в досліджуваному зразку або стандарті, конкурує з іммобілізованим 8-ізо-PGF2α на поверхні лунки за зв’язування з обмеженою кількістю біотинільованих антитіл, специфічних до 8-ізо-PGF2α.
Після стадії зв’язування надлишок незв’язаного кон’югату і компоненти зразка/стандарту видаляються шляхом промивання. Визначення концентрації 8-ізо-PGF2α у зразках здійснюється шляхом порівняння отриманих значень оптичної густини зі стандартною калібрувальною кривою. Контрольну групу становили 10 відносно здорових осіб.
У сироватці крові пацієнтів визначали вміст метильованих ефірів поліненасичених жирних кислот, які були розділені та ідентифіковані за допомогою газового хроматографа Chromatek-Crystal 5000, що прямо пропорційно відповідало вмісту відповідних жирних кислот у сироватці крові. Площі під піками були розраховані за допомогою програми-інтегратора Chromatеk, підключеної до газового хроматографа. Ідентифікацію кожного метилового ефіру жирної кислоти проводили шляхом порівняння їх часу утримування з часом їхнього відповідного стандарту. Використовували стандарти метилових ефірів жирних кислот фірми Rastek, США. Контрольну групу становили 16 відносно здорових осіб.
Стан системи перекисного окиснення ліпідів оцінювали за концентрацією вторинного продукту в крові — МДА. Вміст МДА у крові визначали за інтенсивністю забарвлення триметилового комплексу, який утворюється в кислому середовищі при реагуванні МДА з 2-тіобарбітуровою кислотою за методикою Л.М. Овсяннікової (2002). Контрольну групу становили 10 умовно здорових осіб з референтними значеннями від 2,7 до 7,9 мкмоль/л.
Дослідження проведено з дотриманням ключових біоетичних принципів, викладених у Конвенції Ради Європи про права людини та біомедицину (4 квітня 1997 р.) та Гельсінській декларації Всесвітньої медичної асоціації щодо етичних засад медичних досліджень за участю людини. Етичне схвалення дослідження підтверджено комісією з медичної та біологічної етики ДУ «Інститут гастроентерології НАМН України».
Статистичну обробку проводили за допомогою програмного забезпечення Statistica 6.1. Перевірка відповідності розподілу кількісних ознак нормальному закону проводилася за критерієм Шапіро — Уїлка, перевірка гіпотези про рівність дисперсій — за тестом Левена. За умов нормального розподілу даних для опису кількісних даних використовувалися середня арифметична (M), стандартна похибка середньої величини (m), стандартне відхилення (SD). За умов нормального розподілу та рівності дисперсій для порівняння безперервних даних у різних групах використовували критерій Стьюдента (t), у протилежному випадку — критерій Манна — Уїтні (U). Для порівняння кількісних показників до та після лікування використовували критерій Вілкоксона. Для оцінки парних якісних даних застосовували критерій Мак-Немара. Для аналізу взаємозв’язку між ознаками використовували кореляційний аналіз з розрахунком коефіцієнтів рангової кореляції Спірмена (r).
Результати дослідження
Важливим показником оксидативного стресу є 8-iso-PgF2α — ізомер простагландину F2, який вважається золотим стандартом для визначення оксидативного стресу in vivo. Вимірювання маркерів оксидативного стресу in vivo є складним завданням, оскільки більшість оксидантів є короткоживучими сполуками, що ускладнює їх ідентифікацію. Проте дослідження 8-iso-PgF2α дає змогу ефективно оцінювати ці процеси завдяки стабільності даного показника у сироватці крові [14].
Аналіз отриманих даних показав, що до початку лікування комплексним засобом Гепавіста Детокс середній рівень 8-iso-PgF2α становив (454,3 ± 48,0) пг/мл, що значно перевищувало показники контрольної групи (рис. 1).
Після застосування комплексного засобу рівень 8-iso-PgF2α статистично значно знизився до (209,9 ± 23,7) пг/мл (t = 5,3 для парних вибірок; р < 0,001). До початку лікування підвищений рівень 8-iso-PgF2α спостерігався у 39 (86,7 %) пацієнтів, тоді як після лікування кількість пацієнтів із підвищеним показником зменшилася до 23 (51,1 %) (р < 0,0001 за критерієм Мак-Немара). Позитивну динаміку у вигляді зниження цього показника було відзначено у 17 із 39 (43,6 %) пацієнтів, які мали підвищені значення цього показника до початку лікування.
Як відомо, МДА є кінцевим продуктом перекисного окиснення ліпідів, що ініціюється вільними радикалами, збільшення концентрації цього маркера свідчить про інтенсифікацію оксидативного стресу, який може спричинити пошкодження клітинних структур [13].
У пацієнтів, які брали участь у дослідженні, рівень МДА у крові до початку лікування становив (8,39 ± 0,37) мкмоль/л проти (6,53 ± 0,36) мкмоль/л після лікування (t = 7,2; р < 0,0001). Це підтверджує позитивний вплив лікування на інтенсивність оксидативного стресу у досліджуваних хворих (рис. 2).
До початку лікування підвищений рівень МДА (вище 7,9 мкмоль/л) спостерігався у 18 із 45 (40,0 %) пацієнтів. Після проведеної терапії кількість хворих із підвищеним показником МДА значно зменшилася, становлячи 7 з 45 (15,6 %) осіб. Позитивна динаміка, що виражалася у зниженні рівня МДА, була зафіксована у 12 з 18 (66,7 %) пацієнтів, які до лікування мали підвищені значення цього маркера.
Таким чином, отримані результати свідчать, що комплексний засіб Гепавіста Детокс має виражені протизапальні та антиоксидантні властивості. Зниження рівнів як МДА, так і 8-iso-PgF2α у сироватці крові вказує на багатофакторний вплив комплексного засобу, спрямований на ключові ланки патогенезу МАСХП, а саме на зниження інтенсивності оксидативного стресу. Це, ймовірно, сприяє зменшенню пошкодження гепатоцитів, поліпшенню функціонального стану печінки та потенційному уповільненню прогресування захворювання.
ПНЖК відіграють критично важливу роль у численних фізіологічних процесах, включаючи регуляцію запалення, імунної відповіді, ліпідного обміну та функціонування клітинних мембран. До основних ПНЖК належать: α-ліноленова кислота, ейкозапентаєнова кислота, докозагексаєнова кислота та омега-6 (лінолева кислота, арахідонова кислота) [15].
При МАСХП порушення ліпідного обміну призводять до накопичення тригліцеридів у гепатоцитах, індукції запалення та оксидативного стресу. Низькі рівні омега-3 ПНЖК та зміни рівня омега-6 ПНЖК у сироватці крові можуть посилювати ці патологічні процеси, сприяючи прогресуванню захворювання до стеатогепатиту та фіброзу. Через важливість ПНЖК для підтримки здоров’я печінки та системного метаболізму дослідження їхньої динаміки у процесі лікування є критично важливим для розуміння механізмів дії лікарських засобів [16].
Динаміку концентрацій окремих фракцій ПНЖК у сироватці крові до та після лікування подано у табл. 1.
Відповідно до отриманих даних виявлено, що середній вміст загальних ПНЖК до лікування становив (0,107 ± 0,030) мкг/мл, що було нижчим за середнє значення контрольної групи умовно здорових осіб (0,240 ± 0,016) мкг/мл. Після курсу лікування комплексним засобом Гепавіста Детокс спостерігалось статистичне підвищення концентрації суми ПНЖК у 1,5 раза до (0,160 ± 0,018) мкг/мл (p < 0,05).
Отримані результати підкреслюють той факт, що у пацієнтів з МАСХП до лікування спостерігається глибокий дефіцит вмісту ПНЖК у сироватці крові. Середні значення, близькі до нуля, були виявлені для деяких окремих ПНЖК, що є свідченням порушень у метаболізмі жирних кислот та/або недостатнього їх надходження з їжею, що часто асоціюється з патогенезом захворювання. Низькі рівні омега-3 ПНЖК у сироватці крові, зокрема ейкозапентаєнової та докозагексаєнової кислот, за даними дослідників, є критичним фактором ризику прогресування запалення та фіброзу печінки.
Серед омега-3 ПНЖК особливо значуще підвищення в 1,5 раза було відмічено для ейкозапентаєнової кислоти та в 2,9 раза для α-ліноленової кислоти (р < 0,05). Зростання концентрації омега-3 ПНЖК — α-ліноленової та ейкозапентаєнової кислоти — є особливо важливим діагностично позитивним фактором після проведеного лікування. Ці кислоти є потужними протизапальними агентами, що здатні зменшувати синтез прозапальних цитокінів, поліпшувати чутливість до інсуліну та запобігати стеатозу та фіброзу у печінці. Відновлення дефіциту цих кислот може мати прямий терапевтичний ефект на клітинному та молекулярному рівнях, знижуючи ліпотоксичність і запальну відповідь.
Серед омега-6 ПНЖК зростання концентрації спостерігалося для арахідонової кислоти в 1,6 раза порівняно з групою пацієнтів до лікування. Хоча деякі метаболіти омега-6 ПНЖК можуть мати прозапальну дію (наприклад, з арахідонової кислоти синтезуються прозапальні ейкозаноїди), баланс між омега-3 та омега-6 є ключовим. Підвищення концентрації α-ліноленової та ейкозатрієнової кислот, які є попередниками арахідонової кислоти, може вказувати на поліпшення загального метаболізму ПНЖК в організмі пацієнтів. Зокрема, арахідонова кислота важлива для імунної відповіді та функціонування клітинних мембран. Зростання її рівня разом зі зростанням омега-3 ПНЖК може свідчити про збалансовану модуляцію ліпідного профілю, а не про однобічне збільшення її концентрації у сироватці крові.
Отже, спостерігалося статистично значуще збільшення як загального пулу ПНЖК у сироватці крові, так і окремих фракцій омега-3 та омега-6 жирних кислот після курсу терапії комплексним засобом Гепавіста Детокс. Він, можливо, посилює ендогенний синтез ПНЖК (за умови того, що пацієнти не отримували додаткових джерел ПНЖК під час лікування) або поліпшує їх мобілізацію та розподіл в організмі. Загальне поліпшення спектра ПНЖК у сироватці крові після лікування Гепавіста Детокс корелює з можливими механізмами дії комплексного засобу, спрямованими на нормалізацію функцій гепатоцитів, поліпшення обміну ліпідів та зниження запального навантаження. Це підтверджує, що корекція ліпідного обміну є одним із важливих аспектів успішної терапії МАСХП.
Під час лікування відмічена позитивна динаміка зі зменшення рівня маркерів оксидативного стресу — МДА та 8-iso-PGF2α — у сироватці крові. Зниження МДА зафіксовано у 66,7 %, 8-iso-PGF2α — у 43,6 % хворих. Це свідчить про певні протизапальні властивості Гепавіста Детокс.
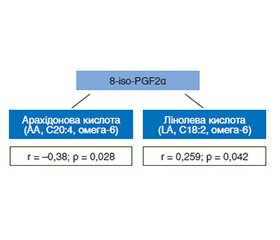
З метою поглибленого вивчення взаємозв’язку між інтенсивністю оксидативного стресу та рівнями окремих фракцій ПНЖК у пацієнтів із МАСХП було проведено кореляційний аналіз із розрахунком коефіцієнтів рангової кореляції Спірмена. Встановлено, що найбільш виражений статистично вірогідний зворотний зв’язок спостерігався між рівнем арахідонової кислоти (AA, C20:4, омега-6) та вмістом 8-iso-PGF2α у сироватці крові (r = –0,38; p = 0,028). Це може свідчити про зниження рівня субстрату (AA) на тлі його активного неферментативного перетворення на 8-iso-PGF2α за умов посиленого оксидативного стресу. Така взаємодія відповідає відомим механізмам неензиматичного циклопероксидування омега-6 ПНЖК у патогенезі МАСХП.
Як видно, простежено кореляцію між 8-iso-PGF2α у сироватці крові та показником жорсткості LSM (r = 0,54), яку подано на рис. 3.
Отримані результати підтверджують взаємозв’язок між інтенсивністю неферментативного перекисного окиснення ліпідів та певними фракціями омега-6 ПНЖК у сироватці крові.
Зокрема, арахідонова та лінолева кислоти у сироватці крові як ключовий субстрат у синтезі 8-iso-PGF2α виявилися чутливими індикаторами змін у профілі ліпопероксидації.
Обговорення
Отримані результати свідчать про суттєву роль дисбалансу ПНЖК та індукованого ним оксидативного стресу у патогенезі МАСХП. Виявлено статистично значуще зворотне кореляційне співвідношення між рівнями арахідонової кислоти, лінолевої кислоти (лінолева кислота, C18:2, омега-6) та 8-iso-PGF2α. За умов інтенсифікації неферментативного перекисного окиснення ліпідів арахідонова кислота активно трансформується в F2-ізопростани, які викликають гепатоцелюлярне ушкодження та стимулюють фіброгенез. Згідно з даними дослідників [15], арахідонова кислота є найбільш реакційно здатною серед омега-6 ПНЖК у контексті ліпопероксидації, а її окиснені похідні, зокрема 8-iso-PGF2α, активують прозапальні сигнальні шляхи, включаючи NF-κB.
У цьому контексті важливо, що зниження рівня 8-iso-PGF2α після лікування комплексним засобом Гепавіста Детокс супроводжувалося тенденцією до нормалізації вмісту ПНЖК, що може свідчити про опосередкований вплив комплексного засобу на баланс між омега-6 та омега-3 жирними кислотами. Це відповідає спостереженням F. Xu та співавт. [16], які показали, що терапевтична корекція ПНЖК-профілю з переважанням омега-3 може зменшити оксидативне навантаження та поліпшити метаболічний статус печінки. Особливу увагу слід звернути на зростання рівнів α-ліноленової та ейкозапентаєнової кислот у сироватці крові після курсу лікування, що потенційно пояснює зниження маркерів оксидативного стресу.
/46.jpg)
Водночас кореляційний аналіз МДА та ПНЖК виявився статистично незначущим. Це свідчить про те, що МДА як неспецифічний кінцевий продукт перекисного окиснення ліпідів менш чутливий до змін ПНЖК-профілю на ранніх етапах захворювання. Подібні вис–новки зроблено в дослідженні A. Hliwa та співавт. [17], які показали, що МДА демонструє кращу асоціацію з тяжкістю фіброзу, аніж із рівнями окремих ПНЖК. Водночас A. Seidita та співавт. [18] підкреслюють, що МДА бере участь у формуванні білково-ліпідних аддуктів, які спричиняють хронічне ушкодження гепатоцитів при МАСХП.
З огляду на загальну патофізіологію МАСХП комбінація зниження 8-iso-PGF2α, нормалізації ПНЖК-профілю та тенденції до зменшення МДА дозволяє розглядати запропоноване лікування комплексним засобом Гепавіста Детокс як потенційно ефективне для пригнічення ключових патологічних ланок прогресування захворювання. Зокрема, глутатіон та S-аденозилметіонін (SAMe) як складники комплексного засобу демонструють антиоксидантні, мембраностабілізуючі та метилдонорні властивості, що узгоджується з сучасними настановами щодо ведення пацієнтів із МАСХП [10, 11].
Подальші дослідження з більшими вибірками, вивченням динаміки сигнальних каскадів та рівнів ендогенних антиоксидантів (глутатіон (GSH), супероксиддисмутаза (SOD), глутатіонпероксидаза (GPx)), а також включенням генетичних маркерів чутливості до ліпопероксидації дозволять поглибити розуміння механізмів терапевтичної дії та персоналізувати підходи до лікування МАСХП.
Висновки
1. У пацієнтів із метаболічно-асоційованою стеатотичною хворобою печінки відзначено вірогідне підвищення рівнів маркерів оксидативного стресу — 8-iso-PGF2α та МДА — у крові, що свідчить про активацію процесів ліпопероксидації та наявність системного оксидативного стресу.
2. Після курсу терапії комплексним засобом Гепавіста Детокс, що містить S-аденозилметіонін та глутатіон, спостерігалося статистично значуще зниження рівня 8-iso-PGF2α у сироватці крові на 43,6 %.
3. За результатами кореляційного аналізу встановлено вірогідний зворотний зв’язок між рівнем 8-iso-PGF2α та вмістом арахідонової кислоти у сироватці крові (r = –0,33; p = 0,028), що вказує на специфічне перетворення омега-6 ПНЖК у неферментативному ізопростаногенезі.
4. На фоні застосування комплексного засобу Гепавіста Детокс відзначено збільшення загального вмісту ПНЖК у сироватці крові в 1,5 раза, зокрема α-ліноленової та ейкозапентаєнової кислот. Такі зміни можуть свідчити про відновлення гомеостазу жирних кислот та протизапальну, антиоксидантну дію комплексного засобу.
5. Отримані дані свідчать про доцільність визначення біомаркерів 8-iso-PGF2α, МДА, а також спектра ПНЖК у крові для системної оцінки ефективності антиоксидантної терапії при МАСХП та відкривають перспективи для персоналізованого підходу до моніторингу прогресування МАСХП.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Внесок авторів. Степанов Ю.М. — концепція та дизайн дослідження; Будзак І.Я. — аналіз та обговорення отриманих даних; Бочаров Г.І. — аналіз даних зсувно-хвильової еластографії; Кленіна І.А. — виконання та аналіз хроматографічних, біохімічних досліджень, оформлення статті; Татарчук О.М. — виконання та аналіз імуноферментативних досліджень; Кіслова Р.М. — виконання інструментальних досліджень; Горбунцова В.І. — клінічний відбір та ведення хворих; Петішко О.П. — створення електронної бази даних, статистична обробка матеріалу.
Отримано/Received 07.07.2025
Рецензовано/Revised 19.08.2025
Прийнято до друку/Accepted 25.08.2025
/45_2.jpg)
/46.jpg)

/44.jpg)
/45.jpg)