Газета «Новости медицины и фармации» Гастроэнтерология (313) 2010 (тематический номер)
Вернуться к номеру
Морфологическая диагностика неспецифического язвенного колита
Авторы: И.В. Василенко. Донецкий национальный медицинский университет им. М. Горького
Версия для печати
Наиболее частыми хроническими воспалительными заболеваниями кишечника являются неспецифический язвенный колит (НЯК) и болезнь Крона (БК), причина которых не ясна, что во многом определяет трудности их морфологической диагностики и дифференциальной диагностики, особенно на материале пункционных биопсий. Одним из основных отличий болезни Крона от неспецифического язвенного колита является глубина воспаления: при болезни Крона интенсивность воспаления возрастает от слизистой оболочки (СО) к подслизистому слою и характеризуется вовлечением и более глубоких слоев, при неспецифическом язвенном колите воспаление ограничивается поверхностными отделами стенки кишки, только слизистой оболочкой. Поэтому диагностика болезни Крона по материалу биопсий более трудная, чем НЯК.
Клинически эти заболевания протекают с обострениями, часто внезапными и непредсказуемыми, и ремиссиями, спонтанными или связанными с лечением.
Неспецифический язвенный колит хотя и является заболеванием с неизвестной этиологией, однако многочисленные исследования выявили ряд факторов, которые могут быть связаны с развитием язвенного колита. К таким факторам относятся инфекционные агенты, дисбактериоз в кишечнике, действие пищевого фактора (белки сои, молока), особенно с учетом генетически обусловленного дефекта слизистого барьера. Установлена генетическая предрасположенность к НЯК, связанная с определенными локусами системы HLA (CW-4, DR-5 и др.), группой крови и генетической регуляцией иммунной системы, аутоиммунной агрессии, а также с регуляцией воспалительной реакции нарушения микроциркуляции (Л.И. Аруин и соавт., 1998; В.А. Филин и соавт., 2000; Н.Ф. Дейнеко, 2001). Многообразие причинных факторов в их взаимосвязи может объяснить вариабельность клинического течения и морфологических проявлений НЯК, связанных с нарушениями иммуногенеза (О.И. Сергиенко, Н.Ф. Дейнеко, 2000), гибели и регенерации эпителия (А.Ю. Иоффе, Т.Д. Задорожная, 2005), нейроэндокринных клеток (С.В. Костюкевич и соавт., 2004), распространенность воспаления толстой кишки (Г.И. Воробьев и соавт., 2006).
Макроскопическая картина
Изменения, характерные для НЯК, начинаются в прямой кишке и распространяются проксимально, вовлекая различную длину ТК, вплоть до панколита, обрывающегося у илеоцекальной складки, лишь иногда вовлекая и подвздошную кишку (Г.И. Воробьев и соавт., 2006). Кроме дистальной формы НЯК (проктит, проктосигмоидит) и распространенного поражения толстой кишки, выделяют еще редкую (8,7 %) третью форму, характеризующуюся воспалением дистальных отделов толстой кишки и слепой кишки. Редко встречаются другие варианты локализации изменений: левостороннее поражение или вовлечение аппендикса. В тяжелых случаях могут вовлекаться в процесс и верхние отделы тонкой кишки (R. Valdez et al., 2000).
Макроскопические изменения в кишке варьируют в зависимости от активности процесса, но обычно ограничены слизистой оболочкой. В остром периоде слизистая оболочка влажная и блестящая, с наличием крови и слизи, с многочисленными точечными кровоизлияниями. Язвы могут быть разных размеров и формы — круглые или более неправильной формы, иногда как географическая карта, обычно мелкие, поверхностные, но могут становиться более протяженными, с подрытыми краями, образуя мосты слизистой оболочки над изъязвленной поверхностью. Множественные сливающиеся изъязвления могут вызывать оголение всей стенки толстой кишки. Со стороны серозы встречается полнокровие, часто большее по протяженности, чем язвы.
Последующее заживление язв ведет к образованию приподнятых красноватых сидячих узелков над плоской поверхностью — псевдополипов (они обычно мелкие и множественные, но могут быть и нитевидной формы) или длинных множественных полипов.
Псевдополипы часто встречаются в сигмовидной и нисходящей кишке, редко — в прямой, где преобладает повреждение СО.
В дальнейшем может появиться фиброзированое рубцевание (сужение) и укорочение толстой кишки. Во время ремиссии слизистая оболочка становится нормальной. В результате неравномерного заживления слизистая оболочка становится прерывистой, гетерогенной и НЯК можно спутать с болезнью Крона.
При тяжелых активных формах толстая кишка или ее сегмент (чаще в области поперечной ободочной кишки) могут расширяться — токсический мегаколон, воспаление проникает в подслизистый слой, стенка истончается и нередко происходит ее перфорация.
Микроскопические изменения в слизистой оболочке кишечника при неспецифическом язвенном колите
При НЯК все многообразие микроскопических изменений, обнаруживаемых при гистологическом изучении препаратов, окрашенных гематоксилином и эозином, при гистохимическом выявлении нейтрального муцина с помощью PAS-реакции, а также при иммуногистохимическом исследовании, можно сгруппировать в 3 категории:
К первой группе изменений относятся хорошо известные по данным литературы (Л.И. Аруин и соавт., 1998; А.Э. Дорофеев и соавт., 2009; K. Geboes) микроскопические признаки.
Язвенный колит характеризуется воспалительной клеточной инфильтрацией собственной пластинки, отличающейся от нормальной слизистой оболочки изменением степени выраженности, состава и распределения клеточного инфильтрата.
При НЯК усиливается интенсивность клеточной инфильтрации. Если в нормальной слизистой оболочке инфильтрат располагается преимущественно в верхней части СО, под эпителием, и такое распределение сохраняется при инфекционных колитах, то при НЯК инфильтрат распространяется диффузно, простираясь и в глубокую часть слизистой оболочки (рис. 1).
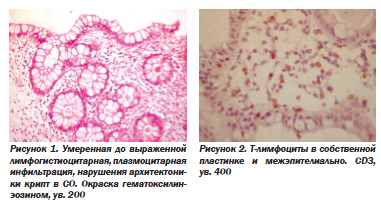
Иммуногистохимическое исследование позволило нам оценить качественный состав инфильтрата, использовав моноклональные антитела к Т-лимфоцитам (СD3), В-лимфоцитам (СD20), макрофагам (СD68). Рассеяные в собственной пластинке лимфоциты представлены в основном Т-клетками, но Т-лимфоциты могут локализоваться и межэпителиально (рис. 2).
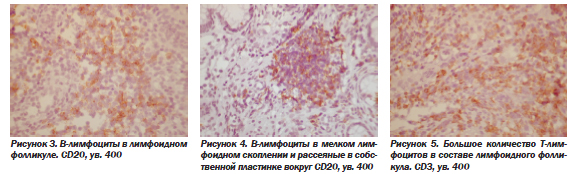
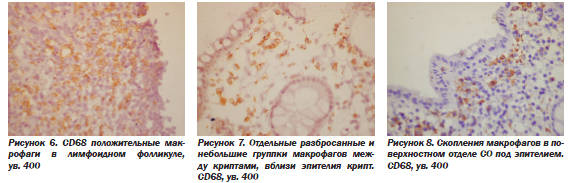
В-лимфоциты сосредоточены в лимфоидных фолликулах (рис. 3), но нередко и диффузно вокруг лимфоидных скоплений (рис. 4). В состав лимфоидных фолликулов, кроме В-лимфоцитов, входило также большое число Т-лимфоцитов (рис. 5), а также макрофагов (рис. 6). Кроме лимфоидных фолликулов, макрофаги также были рассеяны в инфильтрате (рис. 7), часто более густо располагаясь в поверхностном отделе СО, под эпителием (рис. 8).
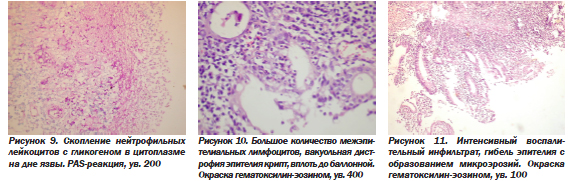
В состав инфильтрата в собственной пластинке входили и полиморфноядерные лейкоциты нейтрофилы и эозинофилы. Особенно много нейтрофилов обнаруживается в дне язвы, при PAS-реакции в них выявляется гликоген в цитоплазме (рис. 9). Наличие гликогена в нейтрофилах служит показателем особой остроты процесса. Как отмечают А.Н. Маянский и Д.Н. Маянский (1983), лейкоциты попадают в кровь из костного мозга с большим количеством гликогена в цитоплазме, в процессе воспаления в тканях происходит «респираторный взрыв» с выделением активных форм кислорода и расходованием (окислением) гликогена. Такие лейкоциты без гликогена могут осуществлять другие свои функции (фагоцитоз, внутриклеточный лизис и др.). Следовательно, присутствие гликогена в лейкоцитах служит показателем их способности к образованию активных форм кислорода и воздействия последних на клетки, т.е. высокой остроты, активности воспаления.
Клетки воспалительного инфильтрата, кроме локализации в основной пластинке, могут располагаться и межэпителиально, внутри пласта эпителия (рис. 10). При этом обнаруживаются повреждения клеток эпителия, появление вакуолей в их цитоплазме, т.е. вакуольная, вплоть до баллонной дистрофии, гибель и десквамация эпителия с образованием микроэрозий (рис. 11). Скопление клеток воспалительного инфильтрата межэпителиально в стенках крипт с последующим выходом их в просвет крип в результате лейкопедеза или частичной деструкции эпителия ведет к скоплению их в просвете с образованием так называемых крипт-абсцессов (рис. 12). Они являются характерным признаком активности язвенного колита. Хотя криптит и крипт-абцессы встречаются, по данным литературы, и при инфекционных колитах, и при болезни Крона, и при других колитах, все же они более часты при неспецифическом язвенном колите (41 % против 19 при болезни Крона — К. Geboes). В нашем материале они наблюдались в 40 % случаев. Клеточный состав при этом разнообразный, в просвете крипт скапливаются не только нейтрофилы, но и лимфоциты, и макрофаги (рис. 13).
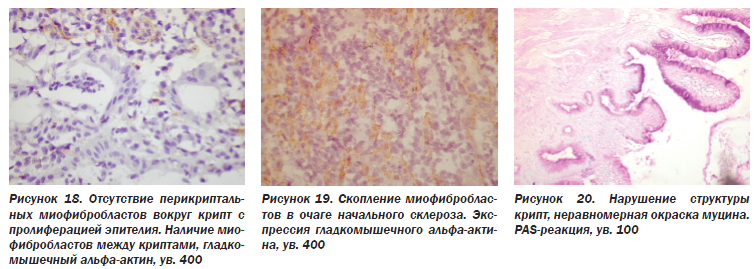
Случайно разбросаны в собственной пластинке фибробласты и слой перикриптальных фибробластов, тесно связанных с эпителиальной базальной мембраной. В последнее время установлено, что они являются миофибробластами, т.е. экспрессируют соединительнотканный маркер виментин и мышечный маркер гладкомышечный альфа-актин (иногда десмин и др.). При хроническом воспалении, заживлении ран, склерозе органов миофибробласты могут появляться в строме, продуцируя экстрацеллюлярный матрикс. Они способны также сокращаться (как мышечные клетки), что способствует стягиванию краев раны, делает рубец более эластичным, т.е. ведет к так называемому ремоделированию органов. В нашем материале встречались сохраненные перикриптальные миофибробласты (рис. 14), очаговое отсутствие их (рис. 15), а также скопление групп этих клеток в участках склероза (рис. 16).
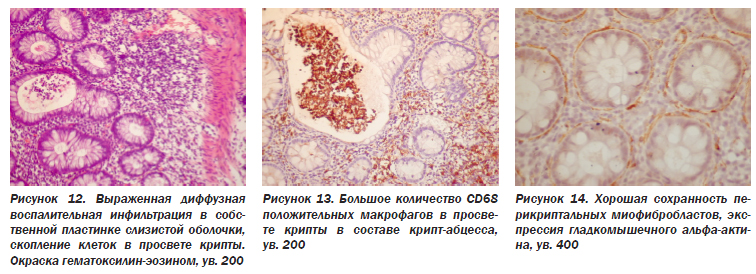
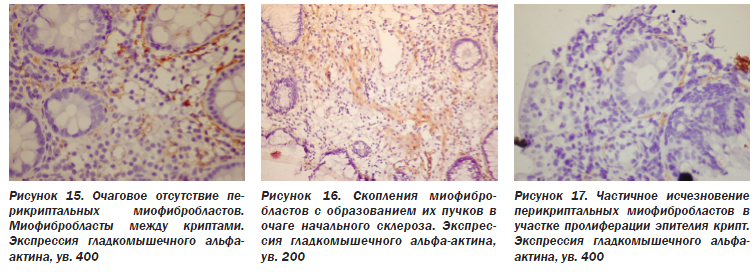
При НЯК в ответ на гибель эпителия крипт происходит его пролиферация, что показано в исследовании А.Ю. Иоффе, Т.Д. Задорожной (2005) с применением маркера пролиферации Ki-67. В пролиферирующих криптах с многоядерным, многослойным расположением клеток эпителия обнаруживается частичное (рис. 17) или полное (рис. 18) исчезновение перикриптальных миофибробластов с появлением их в собственной пластинке (рис. 15, 19). Такие изменения свидетельствуют о хроническом течении процесса, склерозе СО.
В результате гибели эпителия крипт с последующей его пролиферацией и ростом, не направляемым перикриптальными миофибробластами, изменяется архитектоника крипт. Если в нормальной СО толстой кишки железы располагаются вертикально, близко друг к другу, не ветвятся, их закругленные донные отделы находятся вблизи мышечной пластинки (Л.И. Аруин и соавт., 1998), то при НЯК крипты приобретают извитую форму, располагаются под углом друг к другу, ветвятся, имеют разные размеры и густоту расположения, не достигают мышечной пластинки СО (рис. 11). Изменение архитектоники крипт служит показателем хронического течения заболевания.
Характерной особенностью НЯК является угнетение секреции и изменение состава слизи, продуцируемой бокаловидными клетками. В толстой кишке количество слизьпродуцирующих клеток в криптах в 4 раза превышает количество всасывающих. В поверхностном эпителии встречаются лишь единичные бокаловидные клетки, а преобладают всасывающие. Зрелые бокаловидные клетки содержат крупную вакуоль с муцином, ядро оттеснено базально, мелкое, гиперхромное (Л.И. Аруин и соавт., 1998). Обычно муцин бокаловидных клеток дает интенсивную PAS-реакцию. При НЯК снижается число слизьпродуцирующих клеток, уменьшаются размеры вакуоли, заполненной муцином, в часто расположенных рядом криптах (рис. 20, 21), иногда при кажущемся нормальном числе и размере вакуолей резко снижается интенсивность PAS-реакции в слизи, часто окрашивается только контур слизистой вакуоли (рис. 22).
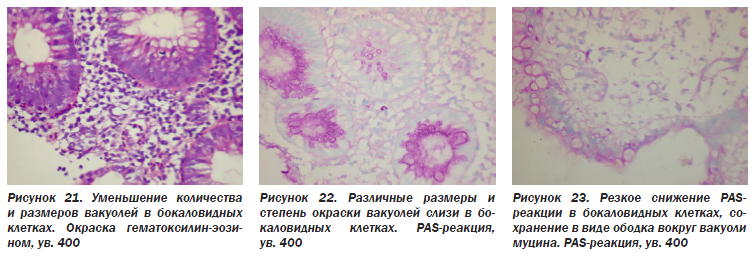
Все эти особенности свидетельствуют об изменении состава муцина при НЯК, что было подтверждено с использованием лектинной гистохимии (А.Э. Дорофеев, 2009). Считают, что генетически обусловленный дефект в слизистом барьере при НЯК играет роль в патогенезе заболевания через повышение кишечной проницаемости для антигенов, способствуя дисбактериозу через снижение поступления в просвет кишки муцина, создающего питательную среду для нормальной пристеночной микрофлоры (В.А. Филин и соавт., 2000). Уменьшение количества бокаловидных клеток, угнетение секреции слизи происходит в острой или активной фазе заболевания (Л.И. Аруин и соавт., 1998).
Таким образом, многочисленные морфологические признаки НЯК можно условно подразделить на являющиеся показателем остроты, активности воспаления и связанные с длительным хроническим течением воспаления.
Признаком обострения НЯК служит прежде всего появление эрозий и язв. Хотя этот признак выявляется обычно при эндоскопическом исследовании, но мелкие эрозии, микроэрозии часто выявляются только при микроскопическом исследовании.
Вторым важным микроскопическим признаком обострения является выраженная воспалительная инфильтрация с наличием полиморфноядерных лейкоцитов, часто с гликогеном в цитоплазме, наличием межэпителиальных клеток и часто крипт-абсцессы.
Наличие этих признаков позволяет оценить и тяжесть обострения как выраженную, в нашем материале таких случаев было около 40 %.
К обострениям умеренной тяжести относят случаи, когда один из этих признаков отсутствовал или был слабо выражен. Например, отсутствие эрозий или язв при наличии крипт-абцессов, выраженной (иногда очагово) клеточной инфильтрации с наличием ПЯЛ, межэпителиальной локализацией инфильтрата. Или наоборот, наличие эрозии, но умеренная клеточная инфильтрация, небольшие очаговые скопления нейтрофилов с гликогеном, отсутствие крипт-абцессов. Таких случаев в нашем материале было около 1/3.
К обострениям слабой степени тяжести относят случаи с отсутствием эрозий и язв, умеренной или умеренной и слабой клеточной инфильтрацией, с единичными нейтрофилами в инфильтратах или их отсутствием. Таких случаев было около 20 %.
Наконец, редко (около 10 % случаев) встречается биоптат в стадии ремиссии со слабой клеточной инфильтрацией, сохранностью эпителия.
Оценка степени тяжести обострения, конечно, вызывает трудности в случаях неравномерно выраженного процесса, иногда сомнительности наличия признака (небольшое количество клеток в просвете крипты можно ли расценивать как крипт-абцесс?), а также при оценке микроэрозий. Поэтому описательный ответ также помогает оценивать тяжесть обострения в каждом конкретном случае.
При микроскопическом исследовании материала пункционных биопсий при НЯК мы можем оценивать и хронический характер заболевания, что важно, учитывая его бессимптомное или малосимптомное клиническое начало в некоторых случаях.
Критериями определенной эволюции в течении НЯК может служить такой легко определяемый признак, как нарушение архитектоники крипт, наличие очагов склероза в собственной пластинке. Применение иммуногистохимического выявления гладкомышечного альфа-актина позволяет более детально оценить длительность и тяжесть стромальных изменений: полная или только частичная утрата перикриптальных миофибробластов. Количество миофибробластов в собственной пластинке позволяет оценивать и давность процесса, и тенденцию к развитию рубцевания на месте гибели крипт.
Наш материал для исследования мы подразделили на 3 группы: с признаками выраженной хронизации процесса — около 40 % случаев, умеренно выраженной — около 35 % случаев и слабой хронизации — 25 % случаев.
Таким образом, морфологическое исследование материала эндоскопических биопсий позволяет получить большой объем информации, касающейся характера изменений (диагноза), иногда и отдельных особенностей патогенеза, например преобладания иммунных механизмов или неспецифической резистентности, а также оценки остроты и тяжести заболевания, его хроничности и тенденции к заживлению, особенно при применении дополнительных современных методов морфологического исследования, в частности иммуногистохимических.
1. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. — М.: Триада-Х, 1998. — 496 с.
2. Воробьев Г.И., Халиф И.Л., Малохова Н.С., Капуллер Л.Л., Веселов В.В., Михайлова Т.Л. Эндоскопические и морфологические особенности слизистой оболочки толстой кишки при дистальной форме язвенного колита // РЖГГК. — 2006. — № 1. — С. 80-86.
3. Дейнеко Н.Ф. Клинико-морфологические критерии и базисная терапия неспецифического язвенного колита // Врачебная практика. — 2001. — № 3. — С. 40-42.
4. Диагностика и лечение заболеваний пищеварительного тракта: Учебное пособие / Под ред. проф. А.Э. Дорофеева. — Донецк: Норд-Пресс, 2009. — 366 с.
5. Иоффе А.Ю., Задорожная Т.Д. Иммуногистохимические особенности маркеров пролиферации и апоптоза при неспецифическом язвенном колите // Лабораторная диагностика. — 2005. — 1(31). — С. 50-53.
6. Костюкевич С.В., Аничков Н.М., Иванова В.Ф., Орешко Л.С., Кудряшова Г.П., Медведева О.А. Смирнова О.А. Эндокринные клетки эпителия прямой кишки в норме, при неспецифическом язвенном колите и синдроме раздраженной кишки без лечения и при лечении преднизолоном и салофальком // Архив патологии. — 2004. — № 4. — С. 23-27.
7. Линевский Ю.В., Линевская К.Ю., Воронин К.А. Болезнь Крона: практические аспекты проблемы // Новости медицины и фармации. — 2009. — № 304. — С. 43-50.
8. Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге. — Новосибирск: Наука, 1983. — 283 с.
9. Сергиенко Е.Н., Дейнеко Н.Ф. Особенности структурных изменений слизистой оболочки толстой кишки при обострении хронического колита // Рос. гастроэнтерол. — 2000. — № 4. — С. 146-147.
10. Филин В.А., Салмова В.С., Вартопетова Е.Е. Современные аспекты этиологии и патогенеза неспецифического язвенного колита // Педиатрия. — 2000. — № 6. — С. 95-99.
11. Geboes K., Riddell R., Ost A. et al. A reproducible grading scale for histological assessment of inflammation in ulcerative colitis // Gut. — 2000. — V. 47. — Р. 404-409.
12. Geboes K. Patholoqy of inflammatory bowel disease (IBD): variability with time and treatment // Colorectal. Dis. — 2001. — V. 3. — Р. 2-12.
13. Helits T., Halme L., Lappalahen M. et al. CARD 15/NOD 2 gene variants are associated with familially occurring and complicated forms of Crohn''s disease // Gut. — 2003. — V. 52. — Р. 558-562.
14. Lee F.D., Maguire C., Obeidat W. et al. Importance of cryptolytic lesions and pericryptal qranulomas in inflammatory bowel disease // Clin. Pathol. — 1997. — V. 50. — Р. 148-152.
15. Peeters M., Geypen B., Claus D. et al. Clustering of increased small intestinal permeability in families with Crohn''s disease // Gastroenterology. — 1997. — V. 113, № 3. — Р. 802-807.
16. Sheehan A.L., Warren B.F., Gear M.W.L. et al. Fat-wrapping in Crohn''s disease: patholoqical basis and relevance to surgical practice // Br. J. Surg. — 1992. — V. 79. — Р. 955-959.
17. Valdez R., Appelman H., Brouner M.P. et al. Diffuse duodenitis associated with ulcerative colitis // Amer. J. Surg. Patrol. — 2000. — V. 24. — P. 1407-1413.
