Международный эндокринологический журнал 1 (33) 2011
Вернуться к номеру
Онглиза™ (саксаглиптин) — ингибитор дипептидилпептидазы-4: «инкретиновый эффект» и клиническое применение
Авторы: Корпачев В.В., Гурина Н.М., ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», г. Киев
Рубрики: Эндокринология
Версия для печати
За последние десятилетия достигнуты существенные успехи в изучении патогенеза сахарного диабета (СД), раскрыты многие тонкие патофизиологические механизмы, лежащие в основе развития этого заболевания. Сегодня общепризнано, что СД 2-го типа обусловлен, с одной стороны, снижением чувствительности к инсулину периферических тканей (инсулинорезистентностью), а с другой — уменьшением секреции инсулина. Соответственно большинство существующих пероральных антидиабетических средств оказывают воздействие на одно из этих патогенетических звеньев: либо, как инсулиносенситайзеры, повышают чувствительность тканей к эндогенному инсулину, либо, как производные сульфонилмочевины, стимулируют секрецию инсулина b-клетками поджелудочной железы. Некоторые препараты обладают другим механизмом действия — уменьшают абсорбцию глюкозы в тонком кишечнике.
Ввиду того что в современном обществе число людей, страдающих СД 2-го типа, к сожалению, неуклонно возрастает, проблема повышения эффективности лечения этого заболевания и его осложнений становится все более актуальной. Огромный интерес представляет разработка противодиабетических препаратов, основанных на абсолютно новых принципах действия. Важнейшим требованием к таким препаратам, наряду с высокой терапевтической эффективностью, является более совершенный профиль безопасности, а также способность оказывать благоприятное влияние на сопутствующие факторы, способствующие дальнейшему прогрессированию сахарного диабета и развитию его осложнений.
Именно к таким средствам относится новый класс пероральных антидиабетических препаратов — так называемые ингибиторы дипептидилпептидазы 4-го типа (ДПП-4), создание которых вплотную приблизило ученых и клиницистов к возможности восстановления нарушенной функции островковых клеток поджелудочной железы. Механизм действия этих препаратов связан с ингибированием фермента ДПП-4, который расщепляет инкретины — естественные факторы, способствующие секреции инсулина в ответ на прием пищи и регулирующие уровень гликемии как натощак, так и постпрандиально. В условиях имеющего место при СД 2-го типа снижения образования инсулина в сочетании с резистентностью периферических тканей к его действию пролонгирование активности инкретинов с помощью ингибиторов ДПП-4 обеспечивает выработку инсулина исключительно в ответ на прием пищи c одновременным подавлением выделения «контринсулинового» гормона — глюкагона. Это воздействие ингибиторов ДПП-4 может помочь скорректировать характерное для СД 2-го типа нарушение секреции инсулина в ответ на прием пищи, т.е. сделать более физиологичным профиль инсулиновой секреции у больных. Ингибиторы ДПП-4, применяемые в виде монотерапии или в комбинации с другими сахароснижающими средствами, способствуют улучшению характеристик углеводного обмена, но это происходит без увеличения массы тела пациентов (как при комбинации с препаратами сульфонилмочевины или глитазонами) и без повышения риска развития гипогликемии (как при комбинации с препаратами сульфонилмочевины).
1. Что такое инкретины и «инкретиновый эффект»?
Инкретины являются пептидами, которые стимулируют глюкозозависимую секрецию инсулина и в последнее время вызывают значительный интерес вследствие их противодиабетического действия. Кроме стимулирования секреции инсулина, они усиливают все стадии биосинтеза инсулина и связаны с улучшением функции b-клеток. Доклинические исследования показали, что они защищают b-клетку, повышая дифференциацию и пролиферацию и уменьшая апоптоз; в моделях на животных установлена связь с повышением массы b-клеток [18].
Наиболее активными из инкретинов являются глюкагоноподобный пептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП). ГПП-1 является инкреторным гормоном, который, помимо стимуляции секреции инсулина, уменьшает секрецию глюкагона, угнетая таким образом эндогенное образование глюкозы, уменьшая колебания постпрандиального уровня глюкозы в крови. Кроме того, под влиянием ГПП-1 снижается аппетит, что приводит к меньшему потреблению пищи и снижению массы тела; ускоряется продвижение химуса по желудочно-кишечному тракту, может также наблюдаться положительное воздействие на сердечно-сосудистую систему [1, 31]. В то время как влияние на b-клетку является общим для обоих инкретинов, ГИП не угнетает секрецию глюкагона и не влияет на опорожнение желудка и потребление пищи [18]. Однако ГИП может играть роль в регуляции липидного обмена [8].
Изучение инкретинов началось еще в прошлом веке. В 1902 г. Baylis и Starling описали фактор, который вырабатывается в тонком кишечнике и стимулирует секрецию поджелудочной железы; термин «инкретин» впервые появился в 1932 г. ГИП — первый инкретин человека — был выделен в 1973 г.; в 1987 г. открыт человеческий ГПП-1.
В 1964 г. был впервые описан «инкретиновый эффект» в эксперименте, когда ответ со стороны секреции инсулина был более выраженным при пероральном применении глюкозы, чем при внутривенном ее введении [15, 35]. «Инкретиновый эффект» приводит к усиленной глюкозозависимой секреции инсулина b-клетками поджелудочной железы. Согласно оценкам M. Nauck et al., приблизительно 60 % инсулина, секретируемого в ответ на прием пищи, является следствием данного эффекта [30, 32]. В 1986 г. обнаружено снижение эффекта инкретина при СД 2-го типа [31].
ГПП-1 существует в виде двух биологически активных пептидных форм, производных предшественника пептида проглюкагона (препроглюкагон). Изоформа, включающая 30 аминокислотных остатков, ГПП-1(7-36)-амид, составляет около 80 % ГПП-1, обнаруживаемого в кровеносном русле [7, 12], являясь основной активной пептидной формой этого инкретина.
В 1995 г. показано, что в физиологических условиях циркулирующие ГПП-1 и ГИП расщепляются ферментом ДПП-4. Этот фермент отщепляет по два аминокислотных остатка от N-терминального конца интактных биологически активных форм инкретинов, что приводит к образованию укороченных фрагментов гормонов, почти полностью лишенных гормональной активности. Эти данные легли в основу идеи о том, что создание ингибиторов фермента ДПП-4 может стать эффективным средством физиологического контроля гликемии путем поддержания эффектов глюкагоноподобных пептидов.
Семейство ДПП-4 — это подсемейство полиоловых олигопептидаз, включающее 4 фермента: ДПП-4, белок активации фибробластов, ДПП-8, ДПП-9 и два белка без ферментативной активности: ДПП-4-подобный белок-6 и ДПП-10. ДПП-4 — наиболее широко распространенный фермент этой группы, представленный как в виде пептидазы, связанной на поверхностной мембране клетки, так и в растворимой форме, циркулирующей в плазме крови. У людей ДПП-4 экспрессируется в клетках эпителия, капиллярах эндотелия и в лимфоцитах. Это включает экспрессию в желудочно-кишечном тракте, желчных протоках, экзокринных панкреатических клетках, почках, тимусе, лимфатических протоках, мочевом пузыре, паротидных и молочных железах, печени, селезенке, легких, мозге. ДПП-4 состоит из 766 аминокислотных остатков и из двух доменов: N-концевого b-пропеллерного домена и С-концевого a-/b-гидролазного домена. ДПП-4 является каталитически активной в виде димера, а доступ к активному центру осуществляется путем открытия просвета между b-пропеллером и гидролазным доменом. Субстратами ДПП-4 являются различные нейропептиды, гормоны и хемокины. ГПП-1 и ГИП — эндогенные физиологические субстраты ДПП-4, концентрация которых в циркуляции invivo прямо связана с активностью ДПП-4 [26].
Физиологические эффекты инкретинов осуществляются путем связывания со специфическими рецепторами, которые располагаются во многих органах, включая поджелудочную железу и мозг [11]. В кровяном русле период полужизни ГПП-1 составляет от 60 до 90 секунд вследствие быстрого разрушения его ферментом ДПП-4 с образованием метаболитов, которые могут действовать как антагонисты рецепторов ГПП-1 [28].
Инкретины высвобождаются в кровеносное русло из клеток кишечника в течение всего дня, их уровни возрастают в ответ на прием пищи. ГИП секретируется К-клетками кишечника, а ГПП-1 — L-клетками, причем после приема пищи ГИП циркулирует в крови в концентрациях, в 10 раз превышающих концентрации ГПП-1. Оба инкретина имеют сходные инсулинотропные эффекты при концентрациях глюкозы до 108 мг/дл (6,0 ммоль/л), но при уровне глюкозы выше 140 мг/дл (7,8 ммоль/л) ГИП оказывает незначительное влияние на секрецию инсулина [22]. В отличие от ГПП-1 ГИП не подавляет секрецию глюкагона. Поскольку степень влияния ГПП-1 на секрецию инсулина зависит от концентрации глюкозы в плазме крови, то по мере приближения уровня гликемии к нормальным значениям стимуляция ГПП-1 секреции инсулина уменьшается.
Инсулинотропное действие ГПП-1
Функциональная связь в рамках гормональной регуляции «кишечник — поджелудочная железа» носит название энтероинсулярной оси. Проведены обширные экспериментальные исследования энтероинсулярной оси в норме и при таких патофизиологических состояниях, как ожирение и СД 2-го типа, в которых показано, что инкретины вызывают увеличение секреции инсулина как при нормальном уровне глюкозы, так и, в особенности, при гипергликемии.
Инсулинотропные эффекты ГПП-1 были подробно изучены в опытах на животных. Так, у мышей с нарушенной толерантностью к глюкозе ГПП-1 повышает способность b-клеток отвечать на гипергликемию [16]. Аналогичным образом при обработке ГПП-1 изолированных b-клеток поджелудочной железы крыс клетки становятся чувствительными к уровню глюкозы и отвечают секрецией инсулина [23]. Инфузия антагонистов ГПП-1 бабуинам и грызунам приводила к повышению концентрации глюкозы в плазме крови натощак и к снижению концентрации инсулина после перорального введения глюкозы [4]. Последнее наблюдение свидетельствует о том, что результатом нарушения действия ГПП-1 является снижение секреции инсулина и повышение уровня гликемии. Более того, помимо стимулирующего эффекта на процесс секреции инсулина, ГПП-1 также стимулирует биосинтез инсулина клеточными линиями островковых клеток invitro [4, 13].
Регуляция уровня глюкозы натощак и после приема пищи
Уровень гликемии определяется скоростью поступления и скоростью элиминации глюкозы из кровяного русла. В основном концентрация глюкозы натощак поддерживается в пределах нормального диапазона (70–100 мг/дл, 3,8–5,6 ммоль/л) путем поддержания баланса между скоростью продукции глюкозы печенью и скоростью захвата глюкозы периферическими тканями.
В ответ на снижение концентрации глюкозы в плазме крови, имеющее место при голодании, a-клетками поджелудочной железы синтезируется глюкагон. Это способствует повышению поступления глюкозы в кровь (глюкоза образуется в печени путем глюконеогенеза и гликогенолиза), что поддерживает концентрацию глюкозы в плазме крови в пределах узкого физиологического диапазона.
Секреция ГПП-1 начинается после приема пищи в ответ на нейрогуморальные сигналы и присутствие пищи в кишечнике. Прием пищи повышает концентрацию глюкозы в крови, что совместно с секрецией ГПП-1 и ГИП стимулирует b-клетки, которые отвечают одновременной секрецией двух пептидных гормонов, регулирующих уровень глюкозы, — инсулина и амилина. ГПП-1 вызывает глюкозозависимую секрецию инсулина. Инсулин регулирует постпрандиальный уровень глюкозы, стимулируя поглощение глюкозы инсулиночувствительными тканями (печень, мышцы, жировая ткань), и таким образом обеспечивает элиминацию глюкозы. Кроме того, секреция инсулина подавляет секрецию глюкагона, приводя к снижению отношения «инсулин/глюкагон» и снижая продукцию глюкозы печенью.
Таким образом, ГПП-1 способствует поддержанию гомеостаза глюкозы и выполняет функции регулятора потребления пищи и поддержания b-клеток в здоровом состоянии. Инсулинотропное действие ГПП-1 ослабевает по мере снижения уровня глюкозы и приближения его к нормальным значениям, снижая таким образом вероятность развития гипогликемии [17].
Подавление секреции глюкагона
ГПП-1 подавляет секрецию глюкагона a-клетками поджелудочной железы в зависимости от уровня глюкозы. Этот эффект ГПП, подавляя секрецию глюкагона, приводит к уменьшению выработки глюкозы печенью. После приема пищи секреция ГПП-1 усиливает секрецию инсулина и подавляет секрецию глюкагона поджелудочной железой, тем самым эффективно усиливая подавление секреции глюкагона инсулином. В целом комбинация эффектов ГПП-1, совместно со стимулированной питательными веществами секрецией инсулина, регулирует постпрандиальный уровень глюкозы плазмы крови. Концентрация глюкозы в плазме крови натощак определяется балансом между поступлением глюкозы, индуцируемым глюкагоном, и ее элиминацией, стимулируемой инсулином. Соотношение между секрецией глюкагона и инсулина вносит значительный вклад в поддержание гомеостаза глюкозы в организме.
Регуляция опорожнения желудка
Одной из важных функций ГПП-1 является воздействие на скорость опорожнения желудка, что, в свою очередь, влияет на колебания уровня постпрандиальной глюкозы [41]. Предполагается, что регуляция процесса опорожнения желудка под действием ГПП-1 осуществляется путем связывания ГПП-1 с рецепторами ГПП-1 в головном мозге, что ведет к парасимпатической стимуляции ветвями блуждающего нерва (n.vagus) и регуляции процесса опорожнения желудка.
Кроме того, ГПП-1 снижает продукцию соляной кислоты в желудке, таким путем гарантируя адекватное ее количество в ответ на прием твердых компонентов пищи. Таким образом, ГПП-1 способствует регуляции переваривания содержимого желудка и уменьшает объем внутреннего просвета желудка [39]. Общим результатом этого является ограничение постпрандиальных колебаний уровня глюкозы путем регулирования скорости поступления питательных веществ в тонкий кишечник.
Снижение потребления пищи и массы тела
ГПП-1 играет определенную роль в центральной регуляции потребления пищи.
С использованием различных моделей на животных было показано, что рецепторы ГПП-1, обнаруженные в различных отделах центральной нервной системы, в том числе в ядрах гипоталамуса и area postrema, вовлечены в процесс контроля потребления пищи.
Важно подчеркнуть, что для гипоталамических ядер и area postrema отсутствует гематоэнцефалический барьер, что позволяет ГПП-1 достигать этих областей из циркуляторного русла. Исследования показали, что введение ГПП-1 непосредственно в желудочки мозга грызунов приводит к дозозависимому снижению потребления пищи. Интравентрикулярное введение антагонистов ГПП-1, напротив, повышает потребление пищи, что приводит к увеличению массы тела [40].
Пролиферация и неогенез b-клеток поджелудочной железы
Интересным является тот факт, что ГПП-1 принимает участие в поддержании b-клеток поджелудочной железы в здоровом состоянии. Так, введение ГПП-1 здоровым крысам и мышам, а также старым глюкозотолерантным крысам приводило к усилению пролиферации и увеличению количества b-клеток в поджелудочной железе [33]. В моделях на животных как in vivo, так и in vitro показано, что, помимо стимуляции пролиферации b-клеток у животных, ГПП-1 способствует образованию функционально активных b-клеток из недифференцированных панкреатических клеток-предшественников [19].
Механизм действия ГИП на панкреатические b-клетки изучен на различных моделях (в изолированных b-клетках, в перфузируемой поджелудочной железе, на интактных лабораторных животных). Дальнейшие исследования проводятся с использованием клонированных рецепторов с целью выявления активного сайта молекулы ГИП и механизмов клеточной активации в норме и при патологии. Так, выявлен еще один механизм, посредством которого ГИП может участвовать в регуляции дифференциации и митогенеза островковых клеток. Наряду с общеизвестным фактом нарушения секреции инсулина при ожирении и СД 2-го типа выявлено также снижение экспрессии рецепторов ГИП в b-клетках поджелудочной железы и соответствующее подавление передачи инкретинового сигнала. Этот факт объясняет снижение чувствительности к инкретинам при СД 2-го типа [32].
Таким образом, имеющиеся данные об основных свойствах гормонов-инкретинов ГПП-1 и ГИП свидетельствуют о важной роли этих гормонов, выделяемых клетками кишечника в ответ на прием пищи. Их воздействие осуществляется частично путем влияния на соотношение двух ключевых гормонов, вырабатываемых островковыми клетками поджелудочной железы, — инсулина и глюкагона, а также с помощью регуляции потребления пищи, продвижения химуса, пролиферации и дифференциации b-клеток. Эти кумулятивные эффекты, направленные на поддержание баланса между процессами образования и потребления клетками глюкозы, играют определяющую роль в регуляции гомеостаза глюкозы в организме.
2. Лекарственные средства, усиливающие эффекты инкретинов, и их применение при сахарном диабете 2-го типа
Механизмы действия ингибиторов ДПП-4
При СД 2-го типа действие инкретина нарушается, но экзогенно введенный ГПП-1 может нормализовать концентрации как натощак, так и после еды [1–3, 32]. Показано, что ГПП-1 при длительном подкожном введении больным СД 2-го типа (в течение 6 недель) улучшал функцию b-клеток, снижал уровень глюкозы и гликозилированного гемоглобина (HbA1c), повышал периферическую инсулиночувствительность; кроме того, зафиксировано снижение массы тела [41].
Однако период циркуляции эндогенного или экзогенного ГПП-1 в крови, как уже отмечалось, чрезвычайно мал в связи с быстрой инактивацией инкретинов под действием фермента дипептидилпептидазы-4, отвечающего за начальный быстрый распад ГПП-1 и ГИП [1, 3].
Для обеспечения возможности практического использования нативного ГПП-1 как нового средства в терапии СД 2-го типа целесообразным является предотвращение быстрого распада ГПП-1 с применением ингибиторов ДПП-4. Реальность этого подхода доказана в ходе доклинических исследований ингибиторов ДПП-4 с использованием моделей инсулинорезистентности, СД 2-го типа, нарушенной толерантности к глюкозе на животных, в которых было показано, что рост концентрации интактного гормона инкретина сопровождается улучшением толерантности к глюкозе [3] (рис. 1).
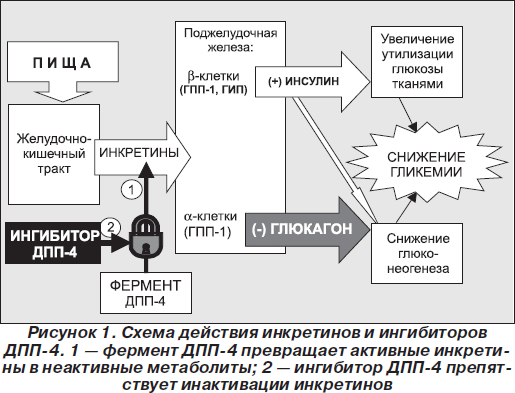
Использование ингибиторов ДПП-4, на фоне приема которых достигается повышение содержания ГПП-1, представляет собой действительно физиологический путь восстановления нарушенной глюкозозависимой секреции инсулина и коррекции повышенного уровня глюкагона — ключевых расстройств, которые характерны для сахарного диабета.
Кроме того, ингибиторы ДПП-4 проявляют в эксперименте противоопухолевую активность, действуя путем стимуляции продукции цитокинов и хемокинов на транскрипционном уровне. При этом в пределах новообразований и лимфатических узлов в системе регионарного оттока развиваются адаптивный и генетически предетерминированный варианты иммунного ответа, которые обусловливают мощный антинеопластический эффект в отношении ряда опухолевых моделей у мышей [8, 11].
Миметики инкретина
По механизму действия ингибиторы ДПП-4 имеют много общего с другим новым классом антидиабетических препаратов — так называемыми миметиками инкретина. Указанные средства также имитируют естественные физиологические механизмы обеспечения адекватного контроля гликемии. Первым средством этой группы стал препарат баета (Byetta). Действующим веществом этого препарата является экзенатид (синтетический экзендин-4). Баета была одобрена Управлением по контролю за продуктами и лекарствами (FDA) США в апреле 2005 г.
Экзенатид является синтетическим аналогом протеина, который содержится в слюне гигантской ящерицы Gila Monster, обитающей в юго-западных районах США. Это вещество помогает пресмыкающемуся, которое питается очень редко, но обильно, избегать резких перепадов концентрации глюкозы крови и поддерживать сравнительно стабильный ее уровень.
Как свидетельствуют результаты нескольких клинических исследований, парентеральное введение экзенатида обеспечивает надежный контроль гликемии (снижение содержания глюкозы в крови как натощак, так и после приема пищи) даже у тех пациентов с сахарным диабетом 2-го типа, у которых другие существующие пероральные антидиабетические средства оказываются недостаточно эффективными, даже в максимальных терапевтических дозах. Кроме того, на фоне применения препарата отмечается еще один благоприятный терапевтический эффект— дозозависимое снижение массы тела [10, 20, 25, 36]. Есть также основания полагать, что экзенатид является прямым стимулятором неогенеза b-клеток поджелудочной железы [18].
Разрабатываются и проходят испытания синтетические инъекционные аналоги ГПП-1, которые благодаря некоторым отличиям своей структуры от нативного ГПП-1 обладают более длительным периодом полужизни [10].
При создании ингибиторов ДПП-4 был использован другой путь: воздействуя на фермент, деградирующий ГПП-1, данные препараты повышают эндогенные уровни гормона ГПП-1, не прибегая к экзогенному введению синтетических инкретинов. Кроме того, в отличие от экзенатида, который вводится парентерально, ингибиторы ДПП-4 созданы в виде твердых лекарственных форм для приема внутрь.
Онглиза (саксаглиптин) — новый препарат из группы ингибиторов ДПП-4
В настоящее время для лечения СД 2-го типа одобрены несколько препаратов из группы ингибиторов ДПП-4. Ситаглиптин компании «Мерк» получил одобрение Управления по контролю за продуктами и лекарствами США в октябре 2006 года и Европейского агентства по лекарственным средствам в марте 2007 года, а вилдаглиптин компании «Новартис» был одобрен Европейским агентством по лекарственным средствам в июле 2007 года. Значительное число других компаний, включая «РОШ» и «НовоНордиск», проводят доклинические и клинические испытания потенциальных ингибиторов ДПП-4. В 2009 году вышел на рынок препарат Онглиза (саксаглиптин).
Онглиза (саксаглиптин) (BMS-477118; (S)-3-гидроксиадамантилглицин-L-cis-4,5-метанопролинни-трил) — нитрилсодержащий ингибитор ДПП-4 (рис. 2) с молекулярной формулой C18H27N3O3 и молекулярной массой 333,4. Это мощный селективный, обратимый конкурентный ингибитор ДПП-4 с константой ингибирования К = 0,6–1,3 нмоль/л, что отражает медленную связывающую способность. По данным фармакокинетического исследования полагают, что ингибирование ДПП-4 Онглизой (саксаглиптином) — двухэтапный процесс, включающий образование обратимого ковалентного комплекса «фермент — ингибитор» и диссоциацию ингибитора, в результате чего фермент медленно балансирует между активной и неактивной формой [8].
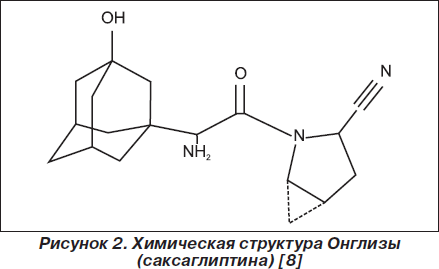
Онглиза (саксаглиптин) легко всасывается после перорального приема. Максимальный уровень в крови Онглизы (саксаглиптина) и его основного метаболита достигается через 2 и 4 часа соответственно. Одновременный с препаратом прием пищи слабо влияет на фармакокинетические показатели Онглизы (саксаглиптина). Связывания Онглизы (саксаглиптина) и его метаболитов с белками крови практически не наблюдается, поэтому изменение концентрации белков в плазме при некоторых состояниях (печеночная или почечная недостаточность) не оказывает влияния на распределение Онглизы (саксаглиптина).
Введение Онглизы (саксаглиптина) пациентам с СД 2-го типа вызывает ингибирование ДПП-4 в течение 24 часов. После нагрузки глюкозой это ведет к увеличению уровня активных циркулирующих инкретинов (в том числе ГПП-1 и ГИП) в 2–3 раза, в результате отмечается повышение концентраций инсулина и С-пептида и снижение уровня глюкагона.
Онглиза (саксаглиптин) метаболизируется in vitro до формы активного метаболита (BMS-510849), активность которого вдвое ниже, чем исходной молекулы. Эта биотрансформация происходит с участием системы цито-хрома Р450 3А4/5 (CYP3А4/5) в печени. При печеночной недостаточности концентрация метаболита в крови уменьшается (на 7–33 %). И Онглиза (саксаглиптин), и ее первичный метаболит являются сильными ингибиторами активности ДПП-4 в плазме крови мышей, крыс, собак, яванских макак, макак-резус и человека in vitro.
Онглиза (саксаглиптин) и ее метаболит выводится из организма как почками, так и печенью. Средний почечный клиренс Онглизы (саксаглиптина) (около 230 мл/мин) выше, чем обычный уровень почечной фильтрации (около 120мл/мин), что свидетельствует о ее активной экскреции почками. Около 22 % введенной меченной С14Онглизы (саксаглиптина) обнаруживалось в фекалиях, частично экскретируясь с желчью, а частично представляя собой неабсорбированный исходный продукт.
Результаты клинического исследования саксаглиптина в сочетании с другими сахароснижающими средствами
Комбинированная схема для первичного лечения Онглизой (саксаглиптином) и метформином была изучена в исследовании, которое длилось 24 недели и в которое были включены 1306 ранее не леченных пациентов с плохо контролируемым СД 2-го типа (исходный уровень HbA1c = 9,5 %) [24]. Пациенты были рандомизированы в группы монотерапии метформином или Онглизой (саксаглиптином) (10 мг) или комбинированной терапии Онглизой (саксаглиптином) (5 или 10 мг) и метформином (начиная с 500 мг в день с повышением до 2000 мг в день). Комбинированное лечение оказалось более эффективным, чем оба вида монотерапии: обе дозы Онглизы (саксаглиптина) в сочетании с метформином снижали уровень HbA1c на 2,5 % от исходного показателя, в то время как монотерапия Онглизой (саксаглиптином) — всего на 1,7 %, а метформином — на 2,0 %.
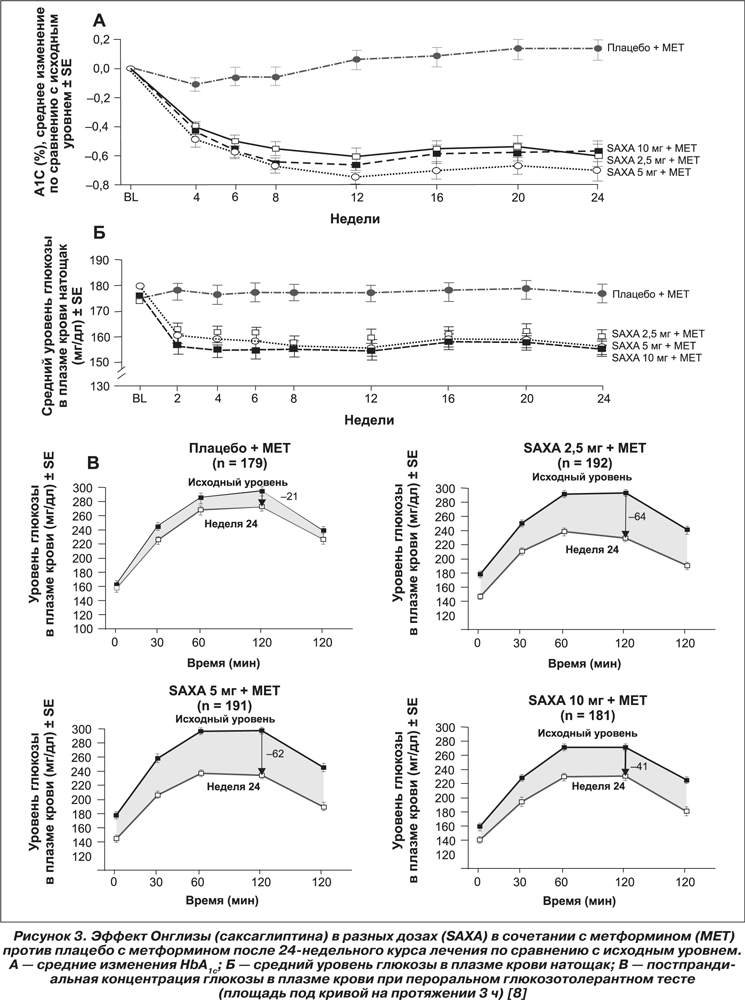
В рандомизированном плацебо-контролируемом двойном слепом исследовании с участием 743 пациентов с СД 2-го типа с неадекватным гликемическим контролем (HbA1c = 8 %), получавших монотерапию метформином (более 1500 мг/день), добавление Онглизы (саксаглиптина) как дополнительного лечения (курсом 24 недели в дозе 2,5; 5 или 10 мг/день) снижало уровень HbA1c на 0,7%; 0,8 % и 0,7% соответственно.
На рис. 3 наглядно представлены результаты этого исследования, которые демонстрируют дополнительные положительные эффекты при добавлении Онглизы (саксаглиптина) к лечению метформином: снижение уровня глюкозы натощак (на 1,33 ммоль/л по сравнению с плацебо) и постпрандиально, что привело к заметному снижению HbA1c; колебания постпрандиального уровня глюкозы были значительно реже. Не обнаружено статистически достоверного изменения массы тела пациентов после курса Онглизы (саксаглиптина), как и учащения проявлений гипогликемии по сравнению с группой плацебо [9].
В другом 24-недельном исследовании, включавшем 768 пациентов с СД 2-го типа с недостаточным контролем при помощи субмаксимальных доз глибенкламида (HbA1c=8,4%), после приема глибенкламида в течение 4 недель в дозе 7,5 мг в одной группе больных дополнительно назначалась Онглиза (саксаглиптин) (2,5 или 5,0мг/день), а в другой — увеличивалась доза глибенкламида до разрешенного максимума (15 мг/день). Онглиза (саксаглиптин) в обеих дозировках повышала эффективность лечения по сравнению с увеличенной дозой глибенкламида: HbA1c снижался на 0,5–0,6 % от исходного уровня, при этом примерно у 22 % пациентов был достигнут целевой уровень HbA1c (ниже 7 %) по сравнению с группой глибенкламида, в которой HbA1c повысился на 0,1 %. Добавление Онглизы (саксаглиптина), в отличие от повышения дозы глибенкламида, улучшило показатели гликемии натощак и после еды, а также увеличило реакцию b-клеток на глюкозу [37].
52-недельное исследование [40], в котором участвовало 858 взрослых больных СД 2-го типа, принимавших более 1500 мг/день метформина и имевших при этом уровень HbA1c более 6,5–10 %, показало, что добавление к этому лечению 5 мг/день Онглизы (саксаглиптина) привело к снижению HbA1c на 0,74 %, что сопоставимо со снижением HbA1c на 0,80 % в группе, в которой к монотерапии метформином добавляли глипизид в средней суточной дозе 14,7 мг/день. Межгрупповая разница составила 0,06% (95% доверительный интервал от –0,05 до 0,16 %). Дополнительное лечение Онглизой (саксаглиптином) сопровождалось снижением массы тела по сравнению с глипизидом (соответственно –1,1 кг и +1,1кг; p< 0,0001) и ощутимо меньшей частотой гипогликемий (3,0 vs. 36,3 %; p < 0,0001) без эпизодов тяжелой гипогликемии в группе Онглизы (саксаглиптина). Кроме случаев гипогликемии, частота других нежелательных эффектов, связанных с лечением, была значительно ниже у больных, получавших Онглизу (саксаглиптин) (9,8%), чем у принимавших глипизид (31,2 %).
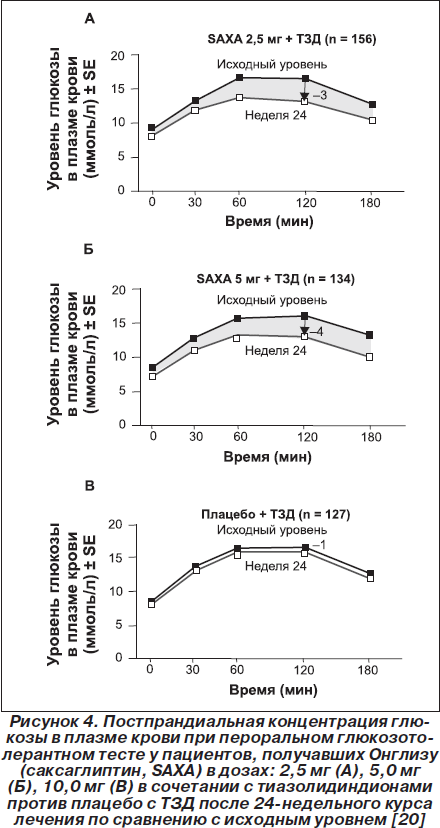
В исследовании [20] Онглизу (саксаглиптин) добавляли к лечению тиазолидиндионами (ТЗД) у 565 больных (исходный HbA1c = 8,3 %) при неадекватно контролируемой гипергликемии на фоне монотерапии стабильными дозами ТЗД (пиоглитазон — 30 или 45 мг, розиглитазон— 4 или 8 мг, курсом более 12 недель). Добавление 2,5 или 5,0мг/день Онглизы (саксаглиптина) через 24 недели привело к более выраженному снижению уровня HbA1c (–0,7 или –0,9 %) по сравнению с группой плацебо (–0,3%). Целевой уровень HbA1c был достигнут у 42% пациентов, получавших Онглизу (саксаглиптин), и только у 26 % в контрольной группе. Уровень гликемии натощак и постпрандиально (рис. 4), а также показатель НОМА-2 (оценка функции b-клеток) в группе Онглизы (саксаглиптина) улучшался, тогда как в группе сравнения не изменялся.
Недавно опубликованы результаты первого параллельного исследования [41], в котором проведено сравнение эффективности комбинации с метформином двух ингибиторов ДПП-4: Онглизы (саксаглиптина) и ситаглиптина в лечении пациентов с СД 2-го типа, у которых метформин не обеспечивал адекватного контроля гликемии. Пациенты с уровнем гликозилированного гемоглобина 6,5–10 % при постоянной дозе метформина 1500–3000 мг/сутки были рандомизированы на группы, которые получали дополнительно к метформину 5 мг Онглизы (саксаглиптина) (n=403) или 100 мг ситаглиптина (n = 398) 1 раз в день. Через 18 недель лечения разница исходных и конечных уровней HbA1c у больных, получавших Онглизу (саксаглиптин) или ситаглиптин, составила соответственно –0,52 и –0,62 % (межгрупповое различие 0,09%; 95% доверительный интервал — от 0,01 до 0,20%), что расценивается как сопоставимость результатов. Доля пациентов, достигших за время лечения терапевтического гликемического ответа (уровня HbA1c ≤ 6,5 %), была близкой в двух группах больных, составив 26,3 % при лечении Онглизой (саксаглиптином) и метформином и 29,1% при использовании ситаглиптина и метформина. Оба вида лечения хорошо переносились больными, частота и тяжесть нежелательных последствий были сравнимы в двух группах. Случаи гипогликемии, в основном легкой степени, отмечены примерно у 3 % пациентов каждой группы. Снижение массы тела в обеих группах составило около 0,4 кг. В группах, получавших Онглизу (саксаглиптин) или ситаглиптин, не выявлено различий в частоте проявления таких наиболее обычных явлений, как инфекции мочевого тракта (5,7 и 5,3 %), назофарингиты (4,0 и 4,0 %), диарея (2,5 и 2,5 %). Таким образом, исследование продемонстрировало сопоставимые результаты эффективности комплексного применения Онглизы (саксаглиптина) и ситаглиптина с метформином в плане улучшения гликемического контроля, безопасности и переносимости лечения. Следует подчеркнуть, что аналогичный терапевтический эффект достигался при дозе Онглизы (саксаглиптина) 5 мг и ситаглиптина 100 мг, что указывает на меньшую нагрузку ферментных и транспортных систем печени и почек при длительном приеме Онглизы (саксаглиптина) по сравнению с ситаглиптином. Следует отметить, что Онглизу (саксаглиптин) можно назначать в неизменной дозе 5 мг в сутки у пациентов с легкой и умеренной степенью печеночной недостаточности.
Онглиза (саксаглиптин) — единственный ингибитор ДПП-4, который можно назначать пациентам с умеренной и тяжелой степенью почечной недостаточности в дозе 2,5 мг в сутки. Применять другие ингибиторы ДПП-4, которые используются в рутинной клинической практике в настоящее время, не рекомендуется.
Безопасность и переносимость Онглизы (саксаглиптина)
Важным преимуществом антидиабетических средств из группы ингибиторов ДПП-4 является хороший профиль безопасности. Судя по данным клинических исследований, Онглиза (саксаглиптин) хорошо переносится пациентами. Не было отмечено нежелательных явлений после приема препарата, что подтверждено результатами лабораторных анализов после 2 недель приема Онглизы (саксаглиптина) в дозе до 40 мг; применение препарата также не отражалось на параметрах QT-интервала на электрокардиограмме [5].
Случаи гипогликемии встречались редко. В исследованиях с применением различных доз препарата не было отмечено явных дозозависимых побочных эффектов. Частота и спектр нежелательных явлений сходны с таковыми в контрольных группах (плацебо). Наиболее часто встречались: головная боль, инфекции верхних дыхательных путей и органов мочевыделения, назофарингиты. Не отмечено влияния на количество лимфоцитов или конкретно нейтрофилов, негативного влияния на иммунитет. В результатах прочих лабораторных исследований, включая проверку функции печени, отклонения не обнаружены [38].
Онглиза (саксаглиптин) также хорошо переносится в составе комбинированной терапии. Не обнаружено достоверных отличий в частоте и характере нежелательных явлений при использовании Онглизы (саксаглиптина) в комбинации с метформином, глибенкламидом и ТЗД по сравнению с контрольными группами больных [21, 24, 37].
Гипогликемия
При терапевтических дозировках Онглизы (саксаглиптина) до 10 мг в проведенных исследованиях не отмечено повышения частоты гипогликемии по сравнению с плацебо. При монотерапии симптомы гипогликемии проявлялись у 6,3 % пациентов, принимавших Онглизу (саксаглиптин) в малых дозах (2,5–40,0 мг), против 1,5 % пациентов группы плацебо и 13,6 % лиц, принимавших высокие дозы Онглизы (саксаглиптина) (100 мг) [38].
При комбинации Онглизы (саксаглиптина) с глибенкламидом гипогликемия встречалась у 14 % пациентов, что сравнимо с результатами группы при восходящем титровании глибенкламида (10 %) [37]. Низкая частота гипогликемии отмечена при сочетании Онглизы (саксаглиптина) с ТЗД (4,1 и 2,7 % для доз 2,5 и 5,0 мг соответственно) по сравнению с 3,8 % при монотерапии ТЗД, и только один случай гипогликемии подтвержден в группе Онглизы (саксаглиптина) 2,5 мг [21].
Таким образом, появление новых антидиабетических препаратов, действие которых основано на усилении эффекта эндогенных инкретинов, открывает новые перспективы в лечении СД 2-го типа. Несмотря на то что 2 класса этих препаратов (ингибиторы ДПП-1 и аналоги ГПП) относятся к химически различным и структурно независимым соединениям, они имеют сходный механизм действия, заключающийся в регулировании гомеостаза глюкозы путем воздействия на процессы глюкозозависимого синтеза инсулина и глюкагона, влияния на потребление пищи и продвижение химуса, на пролиферацию и дифференциацию b-клеток поджелудочной железы. Существенным преимуществом ингибиторов ДПП-4 является возможность их использования в таблетированной форме в отличие от инъекционных аналогов ГПП. Важно также то, что ингибиторы ДПП-4не вызывают существенных побочных эффектов, не повышают частоту гипогликемии и не приводят к увеличению массы тела. Ингибиторы ДПП-4 эффективны как в виде монотерапии, так и в сочетании с метформином, производными сульфонилмочевины, ТЗД. В большинстве проведенных исследований добавление ингибитора ДПП-4 Онглизы (саксаглиптина) обеспечивало дополнительное снижение уровня гликозилированного гемоглобина, сопоставимое с использованием дополнительных сахароснижающих средств других групп. Это особенно актуально в случаях, когда максимально возможные дозы сахароснижающих препаратов не обеспечивают адекватного контроля гликемии у пациента. Проведение новых широких исследований возможностей применения ингибиторов ДПП-4 поможет этому классу препаратов занять стабильное место в стратегии лечения СД 2-го типа.
1. Ahren B. New strategy in type 2 diabetes tested in clinical trials. Glucagon-like peptide 1 (GLP-1) affects basic caused of the disease// Lakartidningen. — 2005. — 102 (8). — 545-549.
2. Ahren B., Pacini G., Foley J., Schweizer A. Improved meal-related (beta)-cell function and insulin sensitivity by the dipeptidyl peptidase-iv inhibitor vildagliptin in metformin-treated patients with type 2 diabetes over 1 year // Diabetes Care. — 2005. — 28 (8). — 1936-1940.
3. Ahren B., Schmitz O. GLP-1 receptor agonists and DPP-4 inhibitors in the treatment of type 2 diabetes // Horm. Metab. Res. — 2004. — 36 (11–12). — 867-876.
4. Baggio L., Kieffer T., Drucker D. Glucagon-like peptide-1, but not glucose-dependent insulinotropic peptide, regulates fasting glicemia and nonenteral glucose clearance in mice // Endocrinology.— 2000.— 141. — 3703-3709.
5. Boulton D., Grealdes M. Safety, tolerability, pharmacokinetics and pharmacodynamics of once-daily oral doses of saxagliptin in type 2 diabetic and healthy subjects // Diabetes. — 2007. — 56 (S1). — A161.
6. Brandt I., Joossens J., Chen X. et al. Inhibition of dipeptidyl-peptidase IV catalyzed peptid truncation by Vildagliptin ((2S)-(((3-hydroxyadamantan-1-yl)amino) acetyl)-pyrrolidine-2-carbonitrile)// Biochem. Pharmacol. — 2005. — 70 (1).— 134-143.
7. Chang X., Keller D., Bjorn S., Led J. Structure and folding of glucagon-like peptide-1-(7-36)-amide in trifluoroethanol studied by NMR // Mag. Reson. Chem. — 2001. — 39. — 477.
8. Deacon C., Holst J. Saxagliptin: a new dipeptidil peptidase-4 inhibitor for the treatment of type 2 diabetes // Adv. Ther. — 2009. — 26 (5). — 488-499.
9. DeFronzo R., Hissa M., Blauvet M., Chen R. Saxagliptin added to metformin improves glicemic control in patients with type 2 diabetes // Diabetes. — 2007. — 56 (S1). — A74.
10. DeFronzo R., Ratner R., Han J. et al. Effects of exenatide (exendin-4) on glycemic control and weight over 30 weeks in metformin-treated patients with type 2 diabetes // Diabetes Care. — 2005. — 28 (5). — 1092-1100.
11. Drucker D. Glucagon-like peptides: regulators of cell proliferation, differentiation, and apoptosis // Mol. Endocrinol. — 2003.— 17. — 161-171.
12. Drucker D. Minireview: The glucagon-like peptides // Endocrinology. — 2001. — 142. — 521-527.
13. Drucker D., Philippe J., Mojsov S. et al. Glucagon-like peptide-1 stimulates insulin gene expression and increases cyclic FMP levels in a rat islet cell line // Proc. Natl Acad. Sci. USA. — 1987.— 84. — 3434-3438.
14. Duttaroy A., Voelker F., Merriam K. et al. The DPP-4 inhibitor vildagliptin increases pancreatic beta cell neogenesis and decreases apoptosis // Program and abstracts of the 65th Scientific Sessions of the American Diabetes Association; June 10–14, 2005; SanDiego, California. Abstract 572-P.
15. Elrick H., Stimmler L., Hlad C., Arai Y. Plasma insulin response to oral and intravenous glucose administration // J. Clin. Endocrinol. Metab. — 1964. — 24. — 1076-1082.
16. Flamez D., Van Breusengem A., Scrocchi L. et al. Mouse pancreatic beta-cells exhibit preserved glucose competence after disruption of the GLP-1 glucagon-like peptide-1 receptor gene // Diabetes. — 1988. — 47. — 646-652.
17. Goke R., Wagner B., Fehmann H., Goke B. Glucosodependency of the insulin stimulatory effect on glucagon-like peptide-1(7-36)amide on the rat pancreas // Res. Exp. Med. (Berl.).— 1993. — 193.— 97-103.
18. Hansen P., Corbett J. Incretin hormones and insulin sensiti-vity // Trends Endoc. Metab. — 2005. — 16(4). — 135-136.
19. Henry J., Han R. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in sulfonylurea-treated patients with type 2 diabetes // Diabetes Care. — 2004. — 27 (11). — 2628-2635.
20. Hollander P., Allen E., Chen J. Saxagliptin added to thiazolidindione improves glicemic control in patients with type 2 diabetes inadequate control on thiasolidinedione alone // J. Clin. Endocr. Metab. — 2009. — 94 (12). — 4810-4819.
21. Holst J., Gromada J. Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans // Am. J. Phisiol. Endocrinol. Metab. — 2004. — 287. — E199-E206.
22. Holz G., Kuhtreiber W., Habener J. Pancreatic beta-cells are rendered glucose-competent by the insulinotropic hormone glucagon-like peptide-1 (7-37) // Nature. — 1993. — 361. — 646-652.
23. Jadinsky M., Pfutzner A., Paz-Pacheco E. Saxagliptin given in combination with metformin in patients with type 2 diabetes, compared with either monotherapy: a randomised controlled trial // Diabetes Obes. Metab. — 2009. — 10. — 110-115.
24. Keating G. Exenatide // Drugs. — 2005. — 65 (12). — 1681-1692.
25. Kendall D., Riddle M., Rosenstock J. et al. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea // Diabetes Care. — 2005. — 28(5). — 1083-1091.
26. Kirby M., Yu D., O’Connor S., Gorrell M. Inhibitor selectivity in the clinical application of dipeptidyl peptidase-4 inhibition //Clin. Sci. — 2010. — 118. — 31-41.
27. Mari A., Sallas W., He Y. et al. Vildagliptin, a dipeptidyl peptidase-4 inhibitor, improves model-assessed (beta)-cell function in patients with type 2 diabetes // J. Clin. Endocrinol. Metab. — 2005. — 90 (8). — 4888-4894.
28. Nauck M., Heimesaat M., Orskov C. et al. Preserved incretin activity of glucagon-like peptide-1 [7-36]amide but not not synthetic human gastric inhibitory polypeptide in patients with type 2 diabetes mellitus // J. Clin. Invest. — 1993. — 91. — 301-307.
29. Nauck M., Homberger F., Siegel E. et al. Incretin effects of increasing glucose loаds in man calculated from venous insulin and C-peptide responses // J. Clin. Endocrinol. Metab. — 1986. — 63.— 492-498.
30. Nauck M., Meier J. Glucagon-like peptide 1 and its derivates in the treatment of diabetes // Regul. Pept. — 2005 Jun 15. — 128(2).— 135-48.
31. Perfetti R., Zhou J., Doyle M., Egan J. Glucagon-like peptide-1 induces cell proliferation and pancreatic-duodenum homeobox-1 expression and increases endocrine cell mass in the pancreas of old, glucose-tolerant rats // Endocrinology. — 2000. — 141. — 4600-4605.
32. Perley M., Kipins D. Plasma insulin responces to oral and intravenous glucose: studies in normal and diabetic subjects // J. Clin. Invest. — 1967. — 46. — 1954-1962.
33. Poon T., Nelson P., Shen L. et al. Exenatide improves glycemic control and reduces body weight in subjects with type 2 diabetes: a dose-ranging study // Diabetes Technol. Ther. — 2005. — 7 (3).— 467 -477.
34. Ravichandran S., Chacra A., Tan G. et al. // Diabetologia.— 2008. — 51 (S1). — S342.
35. Rosenstock J., Aguilar-Salinas C., Klein E. et al. Once-daily saxagliptin monotherapy improves glycemic in drug-naive patients with type 2 diabetes // Diabetes Obes. Metab. — 2008. –10. — 376-386.
36. Schjoldager B., Mortensen P., Christiansen J. et al. GLP-1 (glucagon-like peptide-1) and truncated GLP-1, fragments of human proglucation, inhibit gastric acid secretion in humans // Dig. Dis. Sci.— 1989. — 34. — 703-708.
37. Turton M., O’Shea D., Gunn I. et al. A role of glucagon-like peptide-1 in the central regulation of feeding // Nature. — 1996. — 379. — 69-72.
38. Young A., Gedulin B., Rink T. Dose-responces for slowing of gastric emptying in a rodent model by glucagon-like peptide (7-36)NH2, amilin, cholecystokinin, and other possible regulators of nutrient uptake // Metabolism. — 1996. — 45. — 1-3.
39. Zander M., Madsbad S., Madsen J., Holst J. Effect of 6-week course of glucagon-like peptide-1 on glicaemic control, insulin sensitivity, and beta-cell function in type 2 diabetes: a parallel-group study// Lancet. — 2002. — 359. — 824-830.
40. Gцke B., Gallwitz B., Eriksson J., Hellqvist A., Gause-Nilsson I. Saxagliptin is non-inferior to glipizide in patients with type 2 diabetes inadequately controlled on metformin alone: a 52-week randomized controlled trial // J. Clin. Pract. — 2010. — 64 (12). — 1619-1631.
41. Sheen A.J., Charpentier C.J., Ostgren A.H., Gause-NilssonI. Efficacy and safety of saxagliptin in combination with metformin compared with sitagliptin in combination with metformin in adult patients with type 2 diabetes mellitus // Diab. Metab. Res. Rev. — 2010. — 26 (7). – 540-549.