Международный эндокринологический журнал 1 (33) 2011
Вернуться к номеру
Клинические особенности течения подострого тиреоидита и современные методы его лечения
Авторы: Аль-Джадри Мохамед Яхья, Государственное образовательное учреждение дополнительного профессионального образования «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию», Россия
Рубрики: Эндокринология
Версия для печати
Введение
Несмотря на значительные достижения в области тиреоидологии, на протяжении последних лет отмечается неуклонный рост числа больных, страдающих различными заболеваниями щитовидной железы (ЩЖ), в том числе подострым тиреоидитом (ПТ). Распространенность подострого тиреоидита в общей популяции, по оценкам различных авторов, варьирует в широких пределах и составляет от 1 до 15 % [1]. По данным T.F. Nikolai (1991), 1 случай подострого тиреоидита приходится на 5 случаев диффузного токсического зоба или 15–20 случаев аутоиммунного тиреоидита (АИТ). Среди всех обращений больных по поводу различных заболеваний ЩЖ около 5% приходится на пациентов, страдающих подострым тиреоидитом.
Анализ накопленных данных свидетельствует о наличии ряда нерешенных задач в отношении ведения больных с подострым тиреоидитом. Имеются сведения о тяжелых, рецидивирующих формах заболевания, а также формах со стертой клинической картиной, которые в 0,3–1,7 % случаев являются причиной ошибочной резекции ЩЖ [2].
До настоящего времени основным методом лечения подострого тиреоидита остается использование синтетических аналогов глюкокортикоидных гормонов. Препараты этой группы обладают выраженным противовоспалительным действием, быстро купируют боль и явления интоксикации. Их противовоспалительный эффект проявляется в стабилизации биологических мембран, подавлении активности фибробластов и синтеза цитокинов, уменьшении проницаемости капилляров [3].
Некоторыми исследователями показано, что подобная терапия не предотвращает развития дисфункции ЩЖ, и у 5–15 % больных может развиваться гипотиреоз, что связано с развитием соединительной ткани в очаге воспаления. У 8–9 % больных, чаще при рецидивирующей форме подострого тиреоидита, транзиторный гипотиреоз трансформируется в постоянный, требующий проведения заместительной терапии [4].
По мнению большинства авторов, больные с легкой формой заболевания должны использовать только нестероидные противовоспалительные препараты, а синтетические аналоги глюкокортикоидных гормонов более эффективны для устранения болевого синдрома и лихорадки при более тяжелом течении подострого тиреоидита [5].
В связи с тем что подострый тиреоидит склонен к рецидивированию и длительность применения синтетических аналогов глюкокортикоидных гормонов может существенно увеличиваться, вследствие чего могут возникать побочные явления, до сих пор продолжается поиск других методов лечения.
В последние годы для лечения подострого тиреоидита все более широкое распространение получают методы местного воздействия, способствующие более быстрому купированию воспалительного процесса в ЩЖ. В работах некоторых авторов показана высокая биологическая активность низкоэнергетического лазерного излучения, в основе терапевтических эффектов которого лежит трофикостимулирующее, противовоспалительное, десенсибилизирующее, болеутоляющее, противоотечное действие, а также стимуляция иммунитета и естественной резистентности организма, обменных и регенеративных процессов.
Цель работы — изучить клинические особенности течения подострого тиреоидита и провести сравнительный анализ различных методов его лечения в зависимости от тяжести заболевания.
Материалы и методы исследования
Для решения поставленных в работе задач были обследованы 120 больных подострым тиреоидитом (ПТ): 100 женщин и 20 мужчин в возрасте от 20 до 70 лет, средний возраст составил 43,7 ± 1,7 года. Диагноз верифицировался на основании данных клинического, гормонального и ультразвукового обследования больных.
У части пациентов были получены анамнестические данные, указывающие на наличие патологического процесса в ЩЖ в прошлом. У 2 человек в анамнезе имелось указание на перенесенный ПТ, у 1 пациента в анамнезе был узловой нетоксический зоб.
Отягощенная наследственность в отношении заболеваний ЩЖ имела место у 55 больных (45,8 %). У 50 пациентов (41,7 %) наследственность была отягощена по эутиреоидному зобу и АИТ. В 3 случаях в семье больных ПТ были обнаружены злокачественные заболевания ЩЖ, в 2 случаях выявлен диффузный токсический зоб (ДТЗ).
Тяжесть течения ПТ мы оценивали по следующим критериям. У больных с легким течением заболевания отмечались умеренные боли в одной из долей ЩЖ, незначительная слабость, повышение температуры тела до 37,0°С, увеличение скорости оседания эритроцитов (СОЭ) не более чем до 35 мм в час.
У больных со среднетяжелой формой ПТ наблюдались выраженные боли, чаще в одной из долей ЩЖ, с иррадиацией в ухо на стороне поражения, общая слабость, периодические артралгии и миалгии, повышение температуры тела до 38,0 °С, увеличение СОЭ до 50 мм в час.
При тяжелом течении ПТ больные предъявляли жалобы на интенсивные боли, чаще в обеих долях ЩЖ, с иррадиацией в нижнюю челюсть и уши. Боли усиливались при глотании, иногда наблюдалась дисфагия. Отмечались генерализованные миалгии и артралгии, выраженная слабость, увеличение СОЭ более 50 мм в час, повышение температуры тела выше 38,0 °С. У ряда больных выявлялись симптомы легкого тиреотоксикоза.
В зависимости от тяжести заболевания больные были разделены на 4 группы.
В 1-ю группу вошел 31 человек (3 мужчин и 28 женщин, средний возраст составил 43,70 ± 1,73 года) со средней и тяжелой формой заболевания. ПТ средней степени тяжести был у 14 пациентов (45,2 %), тяжелый ПТ — у 17 пациентов (54,8 %). 2 пациента с тяжелым течением заболевания страдали гипертонической болезнью 2-й ст., 2 больных — гиперацидным гастритом в стадии ремиссии, 1 больной — эрозивным гастритом в стадии ремиссии, 1 больной — хроническим гепатитом в неактивной стадии, 1 больной — бронхиальной астмой в фазе стойкой ремиссии, 2 больных — компенсированным сахарным диабетом (СД) 2-го типа. Наличие у пациентов данных сопутствующих заболеваний ограничивало назначение им синтетических аналогов глюкокортикоидных гормонов по традиционной схеме. 22 пациента 1-й группы не имели сопутствующей патологии.
2-ю группу составили 32 человека (9 мужчин и 23 женщины, средний возраст — 42,50 ± 1,26 года) с легкой степенью ПТ. У 4 больных имелся компенсированный сахарный диабет 2-го типа, у 3 пациентов — язвенная болезнь двенадцатиперстной кишки в стадии ремиссии, у 2 пациенток — постменопаузальный остеопороз. У 23 пациентов 2-й группы сопутствующей патологии не было.
У 26 человек (5 мужчин и 21 женщина в возрасте 47,8± 1,1 года) 3-й группы был ПТ средней степени тяжести. В эту группу включались лица без сопутствующей патологии.
4-ю группу составил 31 человек (3 мужчин и 28 женщин, средний возраст — 46,20 ± 1,49 года) со средней и тяжелой формой ПТ без сопутствующей патологии. Среднетяжелая форма ПТ была у 18 (57,7 %) пациентов, тяжелая форма заболевания — у 13 (42,3 %) пациентов.
Соотношение больных со средней и тяжелой степенью тяжести ПТ в 1-й и 4-й группах было сопоставимо.
Для лечения больных была использована методика, разработанная д.м.н., профессором Э.Г. Гаспарян (СПбМАПО), к.м.н., доцентом З.В. Крючковой (СПбМАПО), к.м.н. Аговым Б.С. (СПбГМА им.И.И.Мечникова), — «Способ лечения подострого тиреоидита» (патент № 2056871, 27.03.1996). Проводилось воздействие на патологический очаг в ЩЖ гелиево-неоновым лазером с плотностью мощности 0,25ватт, временем экспозиции 2–3 минуты, длиной шага 0,632нм. Длительность курса лечения во всех группах пациентов составила 20 дней. При необходимости проводились повторные курсы лечения.
Больным 1-й группы со среднетяжелым и тяжелым течением ПТ проводили лечение малыми дозами синтетических аналогов глюкокортикоидных гормонов (преднизолон по 10 мг в сутки) в сочетании с курсом ЛТ на область ЩЖ с последующим постепенным снижением дозы глюкокортикоидов до полной отмены.
Больные 2-й группы с легкой степенью тяжести ПТ получали 2 курса ЛТ на область ЩЖ по 20 процедур с 10-дневным перерывом.
У больных 3-й группы со средней степенью тяжести ПТ прием нестероидных противовоспалительных препаратов (индометацин по 75 мг в сутки) сочетали с курсом ЛТ на область ЩЖ.
Больным 4-й группы со среднетяжелым и тяжелым течением ПТ проводилось традиционное лечение с использованием синтетических аналогов глюкокортикоидных гормонов (преднизолон по 20–30 мг в сутки) с последующим постепенным снижением дозы глюкокортикоидов до полной отмены.
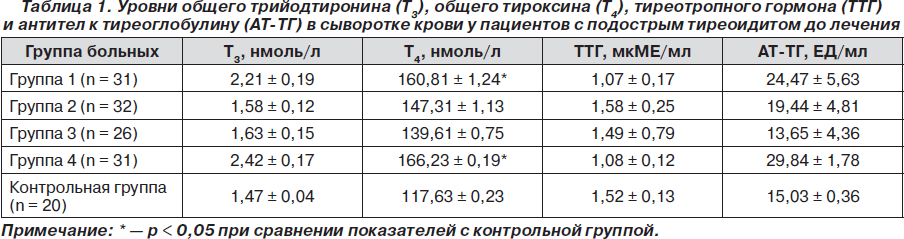
Всем больным проводили общеклиническое обследование, включающее в себя пальпацию ЩЖ (степень увеличения ЩЖ оценивалась по классификации ВОЗ, 1994г.), аускультацию сердца и сосудов, ультразвуковое исследование (УЗИ) ЩЖ в режиме реального времени при помощи датчика 7,5–10 мГц, определение в сыворотке крови натощак уровней трийодтиронина (Т3), тироксина (Т4), тиреотропного гормона (ТТГ), антител к тиреоглобулину (АТ-ТГ) до лечения, а также через 4 и 12 месяцев наблюдения.
Гормональные показатели системы гипофиз — ЩЖ сопоставляли со средними показателями контрольной группы. Контрольную группу составили здоровые лица (2 мужчин и 18 женщин, средний возраст — 41,2 ± 1,77 года) с неотягощенной наследственностью по заболеваниям ЩЖ.
Статистическая обработка данных осуществлялась с помощью программы Statistica 5.5 на персональном компьютере. Для сравнения показателей между группами использовался критерий Стьюдента. Сравнение частот качественных показателей между группами проводилось с помощью критерия c2. Сравнение количественных показателей в одной и той же группе в динамике осуществлялось с помощью критерия Вилкоксона.
Результаты исследования и их обсуждение
В нашем исследовании ПТ достоверно чаще (p<0,001) выявлялся у женщин (83,3 %), чем у мужчин (16,7 %). Соотношение мужчин и женщин составило 1 : 5, что соответствовало данным других исследователей [4].
Средний возраст больных в группах статистически значимо не отличался.
У 55,8 % больных был продромальный период, который характеризовался генерализованными миалгиями, артралгиями, субфебрилитетом и слабостью после перенесенной вирусной или бактериальной инфекции. У 22,5% пациентов заболевание характеризовалось острым началом без продромального периода.
Болевой синдром наблюдался у всех больных, но выраженность и локализация боли в ЩЖ были различными. 77 пациентов (64,2 %) предъявляли жалобы на боли в области передней поверхности шеи, преимущественно с одной стороны, нередко с иррадиацией в нижнюю челюсть, в ухо на стороне поражения, 43 пациента (35,8 %) отмечали боли в области обеих долей ЩЖ с характерной иррадиацией, усиливающиеся при глотании, поворотах головы.
При пальпаторном обследовании у 89 больных (74,2%) определялась неровная, плотная, болезненная ЩЖ. У 31 человека (25,8 %) поверхность ЩЖ была неровная, плотная, с болезненными узлами без четких контуров. При пальпации у всех пациентов наблюдалось увеличение размеров ЩЖ. 99 пациентов (82,5 %) имели 2-ю степень зоба, 21 пациент (17,5 %) — 1-ю степень зоба.
Для уточнения характера патологических изменений в ЩЖ, выявленных при физикальном обследовании, использовалось УЗИ. Согласно международным нормативам, при использовании УЗИ у взрослых лиц мы диагностировали зоб, если объем железы у женщин превышал 18 мл, у мужчин — 25 мл. Средние значения объема ЩЖ в 4 группах больных не имели статистически значимых различий. В то же время средний объем ЩЖ у больных 4-й группы превышал аналогичный показатель у больных других групп. Средний объем ЩЖ в 4-й группе был 47,6±2,3 мл по сравнению с 44,44 ± 1,60 мл, 36,71±1,80мл и 41,03 ± 1,8 мл в 1, 2 и 3-й группах соответственно (p > 0,05 для всех сравнений).
По результатам УЗИ в исследуемой когорте больных у 71 пациента (59,2 %) были выявлены гипоэхогенные участки в ткани ЩЖ. Эхоструктура ткани железы не имела признаков, характерных для АИТ. При сравнении частоты выявления гипоэхогенных участков в ткани ЩЖ по группам больных статистически значимых различий обнаружено не было.
У всех обследованных больных с ПТ в начале заболевания наблюдалось повышение температуры тела до субфебрильных цифр, при этом у пациентов 2-й и 3-й групп показатели средней температуры тела были ниже, чем у пациентов 1-й и 4-й групп, хотя статистически значимых различий между группами мы не выявили.
Во всех группах обследованных больных с ПТ в начале заболевания отмечались умеренное увеличение частоты сердечных сокращений (ЧСС) и повышение систолического артериального давления (АД), однако значимых различий между группами не было получено.
Патогномоничным для ПТ является повышение скорости оседания эритроцитов до 50–60 мм в час при отсутствии лейкоцитоза. Нами выявлена диссоциация повышенной СОЭ и нормального содержания лейкоцитов у всех больных, при этом средние значения СОЭ у больных 1-й и 4-й групп превышали данный показатель у больных 2-й и 3-й групп.
По данным некоторых авторов, острая фаза ПТ приблизительно у 50 % больных сопровождается развитием деструктивного тиреотоксикоза, длительность которого составляет обычно 3–6 недель. В нашем исследовании частота тиреотоксикоза составила 15,8 % у больных 1-й и 4-й групп.
Содержание Т3 в сыворотке крови у больных ПТ достоверно не отличалось от показателей здоровых лиц. Статистически значимых различий в содержании Т3 между группами мы не обнаружили. Выявлено статистически значимое повышение среднего уровня Т4 в сыворотке крови у больных 1-й и 4-й групп (p < 0,05) по сравнению с аналогичным показателем у здоровых лиц. У больных 1-й и 4-й групп средний уровень ТТГ в сыворотке крови был ниже, чем в контрольной группе, однако предела статистической значимости снижение его содержания в крови не достигло. Средний уровень АТ-ТГ в сыворотке крови статистически значимо не отличался от средних показателей у здоровых лиц (табл. 1).
По данным разных исследователей, общая продолжительность лечения легкой формы ПТ с использованием нестероидных противовоспалительных препаратов (НПВП), а также тяжелой формы заболевания с применением синтетических аналогов глюкокортикоидных гормонов составляет в среднем 3 месяца.
По мнению большинства авторов, прогноз заболевания благоприятный и почти в 95 % случаев оно заканчивается полным выздоровлением. Гипотиреоз, требующий проведения заместительной терапии, развивается у 8–9% больных и чаще при рецидивирующей форме ПТ.
В нашем исследовании в результате проведенной терапии у пациентов всех групп ЩЖ уменьшилась в объеме, отмечалось исчезновение местных и общих признаков воспаления, клинических симптомов нарушения функции ЩЖ, в большинстве случаев нормализовалось АД. К концу курса лечения все больные находились в эутиреоидном состоянии.
Субъективное улучшение состояния у больных 1-й группы со среднетяжелой и тяжелой формой ПТ, получавших комбинированную терапию синтетическими аналогами глюкокортикоидов (преднизолон 10–12,5 мг в сутки) в сочетании с ЛТ на область ЩЖ, наблюдалось на 3-й день лечения. Болевой синдром полностью исчезал на 7–8-й день лечения. Через 5–7 дней наблюдалась нормализация СОЭ. Через 10–14 дней после начала лечения проводили постепенное снижение дозы преднизолона: первоначально по 2,5 мг, затем по 1,25 мг 1 раз в 5–7 дней до полной отмены. Продолжительность курса лечения составила 45–50 дней. У 29 пациентов (93,5 %) к концу курса терапии структура ЩЖ практически не отличалась от нормы. У 2 пациентов наблюдалось замедленное купирование болевого синдрома, что потребовало увеличения дозы преднизолона с 10 до 15 мг в сутки и дополнительного назначения 10 процедур ЛТ. После проведенного курса лечения у 2 пациентов отмечалось обострение хронического гастрита, потребовавшее назначения антацидных препаратов и Н2-гистаминоблокаторов.
Больные 2-й группы с легкой степенью тяжести ПТ получали курс ЛТ на область ЩЖ в виде монотерапии. На 5–6-й день лечения у 25 пациентов (78,1 %) отмечалась нормализация температуры тела, уменьшение болезненности ЩЖ при пальпации. На 10-й день лечения 30 пациентов (93,8 %) отмечали улучшение общего состояния, исчезновение боли в ЩЖ. Через 7–10 дней в клиническом анализе крови наблюдалась нормализация СОЭ. Продолжительность курса лечения составила 20 дней. Через 10 дней всем больным 2-й группы проводили повторный 20-дневный курс ЛТ на область ЩЖ. Побочных эффектов выявлено не было.
Больным 3-й группы со средней степенью тяжести ПТ проводилась ЛТ на область ЩЖ в сочетании с пероральным приемом нестероидных противовоспалительных препаратов (индометацин по 75 мг в сутки). У 20 больных (76,9 %) на 6-й день лечения наблюдалось улучшение общего самочувствия, уменьшение местных признаков воспаления. Полное исчезновение болевого синдрома произошло на 8–10-й день лечения. Через 7–10 дней в клиническом анализе крови наблюдалась нормализация СОЭ. Продолжительность курса лечения составила 45–50 дней. 6 пациентам 3-й группы из-за отсутствия положительного эффекта к концу первой недели лечения потребовалось отменить индометацин и назначить преднизолон в дозе 10 мг в сутки (с последующей его постепенной отменой) и дополнительно провести 10 сеансов ЛТ на область ЩЖ. После проведенного курса лечения отмечалась положительная динамика: устранение местных симптомов воспаления и улучшение общего состояния. Побочных эффектов не было.
Больным 4-й группы со среднетяжелым и тяжелым течением ПТ проводилось лечение преднизолоном по общепринятой методике. Средняя доза преднизолона составила 20–30 мг в сутки. Субъективное улучшение состояния пациентов наблюдалось на 2–3-й день лечения. Снижение температуры тела, уменьшение проявлений основных симптомов тиреотоксикоза наступало на 4–5-й день лечения. У всех пациентов этой группы болевой синдром полностью исчезал через 24–72 часа (тест Крайля), через 5–7 дней наблюдалась нормализация уровня СОЭ. Через 1–3 недели от начала лечения дозу преднизолона снижали на 5 мг, далее на 2,5 мг в неделю до полной отмены. Общая продолжительность курса лечения составила 70–95 дней. Побочных эффектов отмечено не было.
Следует отметить, что гелиево-неоновое лазерное облучение в комбинации с пероральным приемом синтетических аналогов глюкокортикоидных гормонов у больных со среднетяжелым и тяжелым течением ПТ позволило снизить дозу глюкокортикоидных гормонов, сократить сроки лечения, уменьшить количество побочных эффектов.
Рядом авторов показано, что наступившая под влиянием терапии эутиреоидная фаза заболевания продолжается несколько недель, у 30–50 % больных она трансформируется в стадию транзиторного гипотиреоза, постепенно переходящую в фазу эутиреоидного состояния. Фаза выздоровления обычно наступает значительно позже. Нормализация функциональных показателей ЩЖ, а также ее морфологической структуры, по данным УЗИ, наступает только к 4–6-му месяцу.
После завершения курса лечения клиническое наблюдение за больными проводили каждый месяц. Повторную оценку содержания периферических гормонов ЩЖ (Т3 и Т4), уровня ТТГ и АТ-ТГ в сыворотке крови, УЗИ ЩЖ проводили через 4 месяца и через 1 год после начала заболевания.
Через 4 месяца наблюдения у всех пациентов сохранялось эутиреоидное состояние. Общее количество пациентов, предъявляющих различные жалобы, составило 55 чел. (45,8 %). 9 пациентов (7,5 %) предъявляли жалобы на боли в области ЩЖ, что свидетельствовало о рецидиве ПТ. 12 пациентов (10 %) жаловались на периодические головные боли, у 19 пациентов (15,8 %) отмечалась прибавка веса, у 20 пациентов (16,7 %) — общая слабость. Это были преимущественно пациенты из 1-й и 4-й групп.
При объективном осмотре через 4 месяца наблюдения во всех группах больных выявлено достоверное (р <0,001) уменьшение ЧСС и уровня диастолического АД (р < 0,05) по сравнению с исходными показателями. Кроме того, наблюдалось снижение систолического АД, статистически незначимое по сравнению с показателем до начала лечения. Во всех группах у больных нормализовались температура тела и СОЭ.
При анализе данных, полученных после проведения контрольного УЗИ ЩЖ через 4 месяца наблюдения, выявлено статистически значимое уменьшение (р < 0,001) среднего объема ЩЖ по сравнению с исходными данными во всех группах больных. У больных 4-й группы средний объем ЩЖ превышал, но недостоверно, соответствующий показатель у больных остальных групп.
Во всех группах больных частота выявления гипоэхогенных участков в ткани ЩЖ была статистически значимо меньше (р < 0,001), чем до лечения. У больных 4-й группы частота выявления гипоэхогенной структуры ЩЖ была выше, чем у больных других групп.
Через 4 месяца наблюдения уровни Т3, Т4, ТТГ и АТ-ТГ в сыворотке крови нормализовались у всех пациентов. Статистически значимых изменений средних уровней этих показателей по сравнению с исходными не было выявлено.
У 14 больных (45,2 %) из 4-й группы наблюдались различные побочные эффекты, связанные с приемом синтетических аналогов глюкокортикоидных гормонов по традиционной схеме. У 1 больного развился эрозивный гастрит, у 2 больных — артериальная гипертензия, у 11 больных — ожирение 1-й степени. Частота побочных эффектов у больных 4-й группы была достоверно выше (p<0,001), чем у больных других групп.
По данным различных авторов, частота рецидивов ПТ с обострением всех симптомов, увеличивавших общую продолжительность заболевания до 1 года и более, может колебаться от 11 до 47 %. В нашем исследовании рецидивы заболевания, которые проявлялись болевым синдромом в области ЩЖ, повышением температуры тела до субфебрильных цифр и увеличением СОЭ, были отмечены в 7,5 % случаев. Рецидивы заболевания были только у больных с тяжелой формой заболевания через 4 месяца наблюдения: у 4 пациентов из 1-й группы и 5 пациентов из 4-й группы. У всех больных рецидивы ПТ были средней степени тяжести, что подтверждалось клиническими и лабораторными данными. При выявлении рецидива ПТ проводилось лечение синтетическими аналогами глюкокортикоидов (преднизолон) в малых дозах (15 мг в сутки) в сочетании с ЛТ на область ЩЖ в течение 20 дней с последующим снижением дозы глюкокортикоидных гормонов.
Через 1 год после ПТ у 88 пациентов (73,3 %) общее состояние оставалось удовлетворительным, у 32 пациентов (26,7 %) были выявлены различные жалобы. Наибольшее количество жалоб предъявляли пациенты 4-й группы, получавшие 1 год назад по поводу ПТ синтетические аналоги глюкокортикоидных гормонов по традиционной схеме. У 6 больных наблюдались головные боли, у 9 пациентов — прибавка веса, у 9 пациентов — общая слабость. Необходимо отметить, что общее количество больных, предъявлявших различные жалобы, сократилось с 45,8 % через 4 месяца наблюдения до 26,7 % через 1 год.
К концу 1-го года наблюдения во всех группах больных сохранялась положительная динамика средних показателей ЧСС, систолического и диастолического АД, которые достоверно не отличались от показателей, полученных через 4 месяца после начала заболевания. Подобная закономерность наблюдалась у пациентов всех групп в отношении температуры тела, СОЭ и среднего объема ЩЖ.
По данным клинического и гормонального обследования через 1 год наблюдения у всех больных сохранялось эутиреоидное состояние.
Рецидивов заболевания через 1 год наблюдения не было отмечено ни в одной группе больных.
Таким образом, рецидивы ПТ были отмечены только через 4 месяца наблюдения у 9 (7,5 %) больных с тяжелыми формами ПТ: у 4 больных из 1-й группы и у 5 больных из 4-й группы. После проведенного лечения аналогами глюкокортикоидных гормонов в малых дозах (15 мг в день) в комбинации с курсом ЛТ на область ЩЖ (20 процедур) с дальнейшим снижением дозы препаратов повторные рецидивы через 1 год наблюдения отмечены не были.
Использование ЛТ при ПТ позволяет сократить средние сроки лечения до 45–50 дней. Этот метод лечения может использоваться как монотерпия при легких формах заболевания. При лечении среднетяжелых и тяжелых форм ПТ облучение ЩЖ гелиево-неоновым лазером используется как дополнительный метод в комбинации с нестероидными противовоспалительными препаратами или синтетическими аналогами глюкокортикоидных гормонов. Комбинированная терапия, кроме сокращения сроков лечения с 3 месяцев до 50 дней, позволяет использовать более низкие дозы глюкокортикоидных гормонов, что особенно актуально у больных с сопутствующей патологией. При более коротких сроках приема глюкокортикоидных гормонов уменьшается количество побочных эффектов. Количество рецидивов ПТ было одинаково в группах больных, получавших традиционную терапию и комбинированное лечение.
Выводы
1. В зависимости от особенностей клинического течения подострого тиреоидита у больных выделено 3 степени тяжести заболевания: легкая, средняя и тяжелая. Легкий тиреотоксикоз был диагностирован у 15,8 % больных с тяжелым течением подострого тиреоидита.
2. При легком течении подострого тиреоидита в качестве самостоятельного метода у больных целесообразно применять лечение гелиево-неоновым лазером на область щитовидной железы.
3. Гелиево-неоновое лазерное облучение в комбинации с пероральным приемом нестероидных противовоспалительных препаратов или синтетических аналогов глюкокортикоидных гормонов у больных подострым тиреоидитом со среднетяжелым и тяжелым течением заболевания позволяет снизить дозу используемых препаратов, сократить сроки лечения и уменьшить количество побочных эффектов.
4. Через 1 год после проведенного курса облучения гелиево-неоновым лазером на область щитовидной железы в качестве монотерапии, а также в сочетании с лечением нестероидными противовоспалительными препаратами или малыми дозами глюкортикоидных гормонов у больных подострым тиреоидитом отмечено сохранение эутиреоидного состояния, отсутствие рецидивов заболевания
1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тироидология. — М.: ОАО «Издательство «Медицина», 2007. — 816 с.
2. Международный опыт изучения заболеваний щитовидной железы (по материалам журнала «Thyroid International») / Перевод, комментарии и редакция В.В. Фадеева. — М.: РКИ Соверо Пресс, 2004. — 296 с.
3. Ворохобина Н.В., Аль-Джадри М.Я., Крючкова З.В., Волкова Е.А., Кузьмина В.А. Клинические особенности подострого тиреоидита и методы его лечения // Казанский медицинский журнал. — 2007. — Т. 88, № 6. — С. 544-547.
4. Подзолков А.В., Фадеев В.В. Гипотиреоз, субклинический гипотиреоз, высоконормальный уровень ТТГ // Клиническая и экспериментальная эндокринология. — 2009. — т. 5, № 2. — С.4-9.
5. Александрова Г.Ф., Трошина Е.А., Абдулхабирова Ф.М. Особенности течения и терапии гипотиреоза у пациентов с ишемической болезнью сердца // Лечащий врач. — 2008. — №6.— С. 34-38.