Международный эндокринологический журнал 3 (35) 2011
Вернуться к номеру
Зависимость здоровья новорожденных от степени компенсации болезни Грейвса у беременных в условиях тяжелого йодного дефицита Республики Узбекистан
Авторы: Нугманова Л.Б., Муратова Ш.Т., РСНПМЦ эндокринологии МЗ РУз, Ташкент, Узбекистан
Рубрики: Эндокринология
Версия для печати
Сравнительный анализ здоровья 58 новорожденных в зависимости от степени компенсации болезни Грейвса у матери в период гестации в условиях тяжелого йодного дефицита Узбекистана выявил, что адекватная компенсация тиреоидного статуса беременной в 2–5 раз уменьшает рождение детей с врожденными аномалиями, внутриутробной задержкой развития, способствует лучшей адаптации к условиям внеутробной жизни. Некомпенсированный тиреотоксикоз беременных в 33,6 % случаев осложняется развитием неонатального транзиторного гипертиреоза, в 2–3 раза чаще приводит к рождению детей в состоянии гипотрофии, в 7 раз больше осложняется ранней анемией новорожденных, удлиняет период физиологической желтухи. Гипертиреоз беременных приводит к рождению детей с симптомами недостаточной минерализации костной ткани, очагами остеомаляции костей. Установлена прямая зависимость частоты и тяжести остеопении новорожденных от тяжести тиреотоксикоза матери.
Щитовидная железа, новорожденные, тиреотоксикоз, остеопения.
Существует тесная связь между функцией щитовидной железы (ЩЖ) матери и здоровьем новорожденного [1]. Декомпенсация тиреотоксикоза во время беременности приводит к невынашиванию, фетоплацентарной недостаточности, повышению риска антенатальной гибели плода, хромосомных аномалий, пороков развития головного мозга, сердечно-сосудистой системы, половых органов, задержки внутриутробного развития плода, рождения ребенка с дефицитом массы тела и неонатального тиреотоксикоза [2, 3].
Среди беременных, проживающих в условиях тяжелого йодного дефицита Республики Узбекистан, болезнь Грейвса (БГ) встречается в 4,8 % случаев [4]. Антитела матери, стимулирующие рецепторы тиреотропного гормона (ТТГ) плода, проходящие через плаценту, вызывают в 1–3 % случаев транзиторный тиреотоксикоз плода [5, 6]. Имеется прямая корреляция между тяжестью заболевания матери, неонатальным тиреотоксикозом и уровнем АТ-рТТГ в крови матери и ребенка [7, 8]. Сохранение высокого титра АТ-рТТГ в 20 нед. беременности свидетельствует о высоком риске развития тиреотоксикоза у плода [9].
При применении высоких доз тиреостатических препаратов матерью (≥ 150 мг пропилтиоурацила в день или ≥ 15 мг тиамазола в день) повышается риск развития неонатального гипотиреоза [10].
Цель: сравнение перинатальных исходов, тиреоидного и костного статуса, психомоторного развития новорожденных от здоровых женщин и женщин с болезнью Грейвса, проживающих в условиях тяжелого йодного дефицита Республики Узбекистан, в зависимости от степени компенсации тиреотоксикоза в период гестации.
Материалы и методы исследования
На базах клиники РСНПМЦ эндокринологии МЗ РУз и РСНПМЦ акушерства и гинекологии МЗ РУз обследовано 58 новорожденных, из которых 36 — от женщин с БГ и 22 — от женщин без патологии ЩЖ (контрольная группа). Диагноз женщинам устанавливали на основании клинических данных (осмотр, пальпация), лабораторных исследований (радиоиммунный анализ уровня ТТГ, Т3, Т4, АТ-ТПО), тонкоигольной аспирационной биопсии ЩЖ, УЗИ ЩЖ. Все женщины с БГ в процессе гестации получали адекватную тиреостатическую терапию, матери контрольной группы принимали весь период беременности препараты калия йодида по 200 мкг/сутки.

Оценка раннего неонатального периода проводилась неонатологами, психоэмоциональное состояние на первой неделе жизни оценивалось детским психоневрологом по количественной методике Л.Т. Журбы и Е.М. Мастюковой (1981):
— 27–29 баллов — вариант возрастной нормы;
— 23–26 баллов означают, что дети относятся к безусловной группе риска;
— ниже 22 баллов — четкое свидетельство задержки развития.
Определение содержания гемоглобина и эритроцитов проводили в цельной крови, взятой из пуповины.
Анализ тиреоидного статуса новорожденных проводился на 3-и — 4-е (у доношенных детей) и на 8–10-е (у недоношенных) сутки после рождения путем определения уровня ТТГ, T3, и T4 в сыворотке крови радиоиммунным методом с применением наборов Immunotech, Чехия; содержание кальция и щелочной фосфатазы (ЩФ) в сыворотке крови наборами Сypress Diagnostics, Бельгия.
УЗИ головного мозга новорожденных проводилось с помощью сонографа Siemens Sonolaer Versa Pro с конвексными датчиками 5,5–7,5 мГц (Германия).
Результаты исследования и их обсуждение
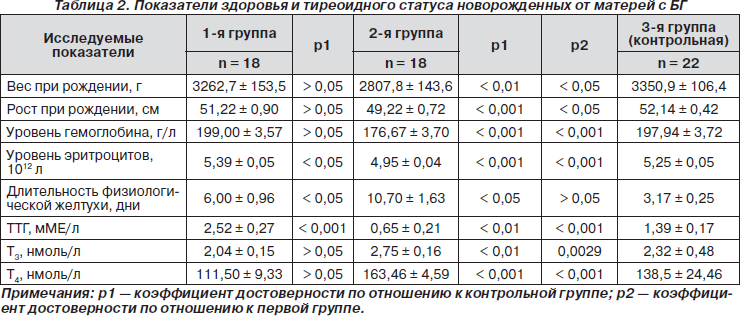
При анализе особенностей состояния 58 новорожденных детей (36 родились у матерей с БГ,) следует отметить, что вес новорожденных при рождении в первой группе в среднем выше, но в пределах нормы, чем во второй группе, где число новорожденных с гипотрофией было в 2 раза больше, — 33,3 и 66,7 % соответственно (табл. 2). Средние значения роста новорожденных первой группы были выше таковых во второй группе, в которой у 16,7 % (3) новорожденных диагностирована задержка внутриутробного развития (табл. 2).
Ранняя анемия новорожденных в первой группе выявлена у 5,6 % (1), в то время как во 2-й группе — у 38,9 % (7) с достоверно низким уровнем гемоглобина и эритроцитов в пуповинной крови по сравнению с показателями первой и контрольной групп, что объясняется более тяжелым течением анемии при некомпенсированном тиреотоксикозе (табл. 2). Длительность физиологической желтухи была выше у детей второй группы и наблюдалась у 38,9 % (7) новорожденных, однако и у первой группы она была достоверно выше в сравнении с контрольной группой, что, по-видимому, связано с гепатотоксичным действием тиреостатической терапии и ингибирующим влиянием материнских антител на систему глюкуронилтрансферазы ребенка (табл. 2). На фоне проводимой стандартной терапии у большинства этих новорожденных ранний неонатальный период протекал относительно благоприятно, что позволило их выписать на 4–9-е сутки жизни.
Средние значения тиреоидного статуса группы новорожденных от матерей с компенсированной БГ были приближены к норме (при норме ТТГ 2,2–4,5 мМе/л, Т3 — 1,2–3,5 нмоль/л и Т4 — 60–137 нмоль/л), не зарегистрировано ни единого случая неонатального транзиторного тиреотоксикоза (НТТ), только у одного новорожденного (5,6 %) зафиксировано изолированное повышение Т4 и Т3 при нормальном уровне ТТГ. В группе новорожденных от не получавших лечение матерей с БГ показатели тиреоидного статуса имели достоверные различия в сравнении с показателями первой группы (табл. 2), НТТ диагностирован у 33,6 % (6) новорожденных, транзиторный неонатальный гипотиреоз — у 5,6 % (1). Функция ЩЖ детей с НТТ восстанавливалась в среднем к концу первого месяца жизни без тиреостатической терапии, двум детям (11,2 %) из-за развившейся тахикардии (выше 150–152 ударов в минуту) был рекомендован пропранолол per os в дозе 2 мг/кг/сут в течение одной недели, завершившейся нормализацией ЧСС. В контрольной группе рождения детей с НТГ и НТТ не обнаружено.
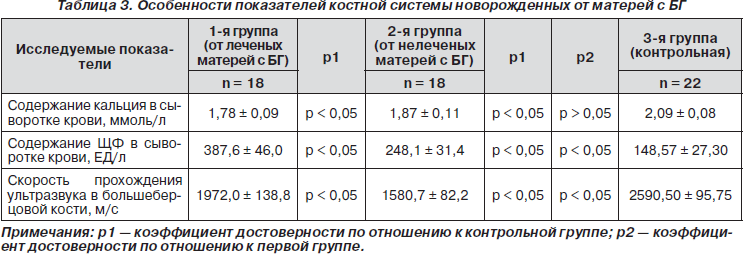
Нарушения минерального обмена во время беременности сказываются не только на костной ткани женщины, но и на развивающемся плоде [11], что приводит к рождению детей с симптомами недостаточной минерализации костной ткани, очагами остеомаляции костей. Материнские тиреоидные гормоны оказывают прямое действие на костную систему плода. Среднее содержание кальция в сыворотке крови в первой и второй группах достоверно не отличалось, в обеих группах обнаружены новорожденные с особенно низким уровнем кальция в крови (в первой — 11,2 % (2), во второй — 33,3 % (6)). Активность ЩФ, которая является маркером костного образования, достоверно увеличена у детей первой и второй групп (табл. 3). Метод ультразвуковой остеометрии показал достоверное снижение прохождения скорости в большеберцовой кости во 2-й группе обследуемых детей (табл. 3), что свидетельствует о выраженной остеопении (снижение минеральной плотности костной ткани). При тиреотоксикозе плода и новорожденного ускорены рост и дифференцирование скелета, снижена плотность костной ткани, установлена прямая зависимость частоты и тяжести остеопении и остеопороза от тяжести тиреотоксикоза. Остеопения новорожденных, т.е. изначально низкая костная масса при рождении, является фактором риска развития остеопороза на протяжении последующих периодов жизни [12].
При клинической оценке общего здоровья новорожденных во второй группе выявлено 16,8 % (3) случаев врожденной дисплазии тазобедренного сустава, 11,2 % (2) — краниостеноза, 5,6 % (1) — кривошеи, у 30 % (6) новорожденных отмечены признаки рахита. В первой группе диагностирован один случай рождения ребенка с расщелиной верхней губы и твердого неба III степени. В контрольной группе детей с аномалиями развития костной системы выявлено не было.
Выводы
1. Некомпенсированный в период гестации тиреотоксикоз в 33,6 % случаев осложняется развитием неонатального транзиторного гипертиреоза, что в 6 раз больше, чем у новорожденных от матерей с компенсированной БГ.
2. Нелеченый тиреотоксикоз беременных с БГ в 2–3 раза чаще приводит к рождению детей в состоянии гипотрофии, с задержкой внутриутробного развития, в 7 раз больше осложняется ранней анемией новорожденных и пролонгирует физиологическую желтуху в неонатальный период.
3. Установлена прямая зависимость частоты и тяжести остеопении новорожденных от тяжести тиреотоксикоза матери. Гипертиреоз беременных приводит к рождению детей с симптомами недостаточной минерализации костной ткани, очагами остеомаляции костей.
1. Нугманова Л.Б., Ашурова Л.З., Муратова Ш.Т. // Проблемы биологии и медицины. — 2007. — № 4(50). — С. 11-13.
2. Brand F., Liйgeois P., Langer B. One Case of Fetal and Neonatal Variable Thyroid Dysfunction in the Context of Graves’ Disease // Fetal Diagn. Ther. — 2005. — Vol. 20. — P. 12-15.
3. Dallas J.S. // Autoimmunity. — 2003. — Vol. 36(6–7). — P. 339-350.
4. Убайдуллаева Н.Б. Гипотиреоз у беременных в условиях йоддефицита Республики Узбекистан, способы его коррекции: Автореф. дис... канд. мед. наук. — Ташкент, 2004.
5. Lazaruz J. // Thyroid International. — 1996. — Vol. 5. — P. 1-12.
6. Шидловская Н.В., Башакин Н.Ф., Бурумкулова Ф.Ф., Троицкая М.В. // Актуальные вопросы акушерства и гинекологии. — 2006. — № 2. — C. 86-89.
7. Nicaise C., Gire C., Bremond V. et al. Neonatal hyperthyroidism screening for thyroid disease in pregnancy // J. Clin. Pathol. — 2005. — Vol. 58. — P. 449-452.
8. Zimmerman D. Fetal and neonatal hyperthyroidism // Thyroid. — 1999. — Vol. 9. — P. 727-733.
9. Smith C., Thomsett M., Choong C. et al. // Clin. Endocrinol. — 2001. — Vol. 54. — P. 371-376.
10. Luton D., Gac I., Vuillard E. et al. Managament of Graves’ disease during pregnancy: the key role of fetal thyroid gland monitoring // J. Clin. Endocrinol. Мetab. — 2005. — Vol. 90. — P. 6093-6098.
11. Щербавская Э.А., Гельцер Б.И. Кальций-фосфорный обмен у беременных женщин и новорожденных // Педиатрия. — 2003. — № 1. — С. 15-19.
12. Щеплягина Л.А., Моисеева Т.Ю. Снижение минеральной плотности кости у детей // Леч. врач. — 2002. — № 9. — С. 9-11.