Международный эндокринологический журнал 5 (37) 2011
Вернуться к номеру
Противоречие между необходимостью достижения компенсации и риском гипогликемии при сахарном диабете типа 2: терапия, опосредованная инкретинами, — возможная перспектива решения проблемы
Авторы: Смирнов И.И., Журавлева Л.В., Харьковский национальный медицинский университет
Рубрики: Эндокринология
Версия для печати
В то время как взгляды разных ассоциаций врачей могут отличаться тактическими подходами к решению проблем, всех практикующих клиницистов постоянно объединяет общая ответственность в противостоянии нарастающему распространению эпидемии сахарного диабета типа 2 (СД 2). В настоящее время не вызывает сомнений прогрессирующее течение заболевания [1]. Снижение функции бета-клеток ведет к устойчивой гипергликемии. У многих пациентов метаболические расстройства вызывают развитие хронических осложнений. К счастью, эффективное сахароснижающее лечение часто способно предупредить появление микрососудистых осложнений у значительной части больных. Чем раньше достигается компенсация, тем лучше прогнозы [2]. Что означает «раннее эффективное сахароснижающее лечение» при СД 2? Имеются убедительные данные о том, что ко времени установления диагноза у многих пациентов болезнь уже имеет достаточно длительный анамнез. Функция бета-клеток к этому моменту может быть снижена фактически наполовину [1]. Обратившись к результатам исследования UKPDS, можно увидеть, что каждый пятый больной узнал о диабете, уже имея развившуюся к тому времени ретинопатию той или иной степени [3]. В сопутствующем исследовании авторы, применив оценку методом линейной регрессии, обнаружили, что повреждение сетчатки, вызванное гипергликемией, могло начаться между 4 и 7 годами до того, как пациент впервые получил какое-либо сахароснижающее лечение [4]. Поскольку известно, что гипергликемия может иметь место за 5 лет до развития ретинопатии, нельзя исключить существование недиагностированного СД 2 в течение периода от 9 до 12 лет [4, 5].
С другой стороны, даже при наличии признаков повреждения тканей-мишеней ко времени установления диагноза важно восстановить и поддерживать в дальнейшем эффективный гликемический контроль. Имеются доказательства, что снижение уровня гликозилированного гемоглобина (HbA1c) на 1 % приводит к снижению риска развития хронических микрососудистых осложнений на 35 % [6].
Лечение СД 2 в общем случае начинается с диеты, увеличения физической активности и пероральных антидиабетических препаратов [2, 7]. Однако из-за естественного прогрессирующего ухудшения функции бета-клеток в дальнейшем необходимо постоянное внимание к степени компенсации углеводного обмена, чтобы не пропустить момент необходимости перехода к инъекционным лекарственным средствам для эффективного результата сахароснижающей терапии.
Организм взрослого человека, каждого из нас, состоит в среднем приблизительно из 100 триллионов клеток. Здоровье зависит от постоянного устойчивого координированного обмена информацией между ними. С накоплением знаний в области физиологии парадоксально яснее становится тот факт, что система, управляющая этими информационными потоками, гораздо сложнее, чем это представлялось еще недавно. Одним из ярких примеров являются гормоны-инкретины. Масштабные исследования инкретинов, начатые и продолжающиеся по всему миру, призваны пролить свет на их роль в норме и при патологии и уже сегодня вынуждают многих врачей переосмысливать процесс, лежащий в основе метаболизма глюкозы при СД 2.
Интригующим открытием в диабетологии стало понимание того, что секреторный ответ бета-клеток на стимуляцию глюкозой при одинаковом уровне гликемии заметно интенсивнее при естественном пероральном поступлении ее в организм, чем при введении внутривенно [8–11]. Таким образом, не вызывает сомнений, что кишечник играет важную роль в регуляции содержания сахара в крови. Определенное значение может иметь целый ряд гормонов. В центре внимания исследователей находятся два из них — глюкагоноподобный пептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП). Эти гормоны известны как инкретины, а вызванную приемом пищи стимуляцию секреции инсулина назвали инкретиновым эффектом. ГПП-1 представляет собой, возможно, наиболее активно изучаемую тему в диабетологии. Предшественником ГПП-1 является проглюкагон, секретируемый L-клетками дистальных отделов подвздошной и ободочной кишки уже через несколько минут после начала энтерального приема пищи. Локализация L-клеток в дистальных отделах кишечника свидетельствует о том, что могут иметь место эндокринные и нервные сигналы, связанные с употреблением еды, имеющие большее значение для стимуляции выработки ГПП-1, чем непосредственный контакт пищи с кишечной стенкой [11]. Рецепторы к ГПП-1 обнаружены во многих органах и тканях, включая печень, поджелудочную железу, мышцы, желудок, тонкий кишечник, жировую ткань, сердце, почки, центральную нервную систему, в том числе головной мозг. Можно утверждать, что этот инкретин оказывает много различных эффектов, регулирующих пищеварение и уровень гликемии, не все из которых пока изучены.
ГПП-1 влияет на уровень глюкозы в крови после приема пищи посредством нескольких разных механизмов. Было продемонстрировано, что фармакологические концентрации ГПП-1 тормозят опорожнение желудка, замедляют расщепление и всасывание углеводов [12–14]. Другие исследования показали, что ГПП-1 может воздействовать на гипоталамус, способствуя развитию чувства насыщения [15–18]. ГПП-1 также оказывает влияние на клетки островков Лангерганса. Он подавляет секрецию глюкагона альфа-клетками, что, в свою очередь, тормозит высвобождение глюкозы из гликогена в печени [19–21]. А на фоне повышения гликемии — способствует усилению секреции инсулина, что, возможно, опосредовано повышением чувствительности бета-клеток к глюкозе [22–24]. Эти эффекты имеют четкую дозовую зависимость: снижение гликемии влечет за собой уменьшение влияния ГПП-1 на выработку глюкагона и инсулина. Имеются также данные (экспериментальные животные и культуры человеческих клеток in vitro), свидетельствующие о способности ГПП-1 стимулировать пролиферацию бета-клеток и тормозить их апоптоз [25–30]. Если клинические исследования подтвердят эти эффекты у людей, не исключено потенциальное восстановление массы бета-клеток, сниженной при диабете [27, 30].
Нарушение секреции инсулина часто рассматривается как ключевой патогенетический механизм при СД 2, однако нарушение постпрандиальной секреции ГПП-1 также играет немаловажную роль [8, 31]. Лечебное вмешательство, направленное на восстановление эффективного уровня ГПП-1, является новым и многообещающим подходом к улучшению результатов сахароснижающей терапии.
Управлять СД 2 означает больше, чем только нормализовать гликемию. Имеют значение также иные факторы риска, например такие, как избыточная масса тела, функция эндотелия. ГПП-1 обладает целым рядом полезных с этой точки зрения физиологических эффектов для восстановления многих функций, нарушенных при СД 2. Восстановление активности ГПП-1 может обладать важным лечебным потенциалом.
В ответ на стимуляцию приемом пищи ГПП-1 стимулирует секрецию инсулина и подавляет — глюкагона, что, в свою очередь, угнетает высвобождение депонированной глюкозы из печени. При СД 2 постпрандиальные ответы ГПП-1 и инсулина снижены и секреция глюкагона усиливается [8, 31, 32]. Нормализация уровня ГПП-1 может улучшить регуляцию гликемии после приема пищи. Этот эффект является глюкозозависимым, и механизм высвобождения глюкагона вследствие гипогликемии не нарушается [20, 31, 33]. Таким образом, изолированное повышение уровня ГПП-1 практически не может быть причиной гипогликемии.
В дополнение ГПП-1 имеет ряд положительных свойств вне зависимости от снижения гликемии. Большинство исследований еще не завершено, но некоторые установленные сердечно-сосудистые эффекты уже заслуживают внимания. У экспериментальных крыс постоянная инфузия ГПП-1 улучшала эндотелиальную функцию и препятствовала появлению артериальной гипертонии, возможно благодаря стимуляции экскреции натрия [34]. Кроме того, был продемонстрирован цитопротективный эффект при ишемии миокарда [35]. У собак с дилатационной кардиомиопатией длительная инфузия ГПП-1 улучшила целый ряд важных показателей, включая сократительную способность миокарда и захват глюкозы миокардиоцитами [36]. Пилотные клинические исследования также выявили положительные сердечно-сосудистые эффекты. 72-часовая инфузия ГПП-1 улучшила сократительную способность миокарда у больных с систолической дисфункцией после ангиопластики по поводу острого инфаркта миокарда вне зависимости от наличия у них сахарного диабета [37]. 2-часовая инфузия ГПП-1 улучшила эндотелиальную функцию у больных со стабильной стенокардией на фоне СД 2 [38]. Эти открытия могут иметь важное значение, поскольку эндотелиальная дисфункция является одним из предположительных причинных факторов развития хронических диабетических осложнений.
Гликемический контроль и сердечно-сосудистый риск тесно связаны с наличием избыточной массы тела. По этой причине снижение массы тела — одна из целей в лечении пациентов с СД на фоне ожирения [39]. ГПП-1 способствует возникновению ощущения сытости и в высоких дозах — замедлению опорожнения желудка [12–18]. Оба эти эффекта могут снижать массу тела. Было также показано, что на фоне инфузии ГПП-1 уменьшились как количество, так и калорийность потребляемой пациентами пищи [12, 15–17].
Таким образом, лечение препаратами ГПП-1 или ГИП могло бы помочь заполнить брешь в сегодняшнем спектре антидиабетических средств, решить ряд сохраняющихся терапевтических проблем. Однако применение нативных инкретинов затруднено по причине быстрого разрушения последних в крови ферментом дипептидилпептидазой-IV (ДПП-IV) [40]. Период полужизни ГПП-1 (Т1/2) составляет всего 1,5–2 минуты, что определяет его ограниченную клиническую ценность [41]. В этих условиях появилась необходимость создания препарата, действующего аналогично ГПП-1, но обладающего при этом длительным действием. Не мог не привлечь внимания ученых и другой, альтернативный путь к достижению инкретин-опосредованных эффектов — создание препаратов, селективно блокирующих ДПП-IV и таким образом пролонгирующих циркуляцию эндогенных инкретинов. Сегодня созданы и проходят клинические испытания либо уже вошли в практику как агонист ГПП-1 рецепторов эксенатид, так и ряд аналогов человеческого ГПП-1, а также несколько ДПП-IV-блокаторов. Новая группа препаратов с различными механизмами действия, объединенная общим влиянием на патогенетическое звено метаболических расстройств при СД, составляет сегодня целое направление в клинической диабетологии, названное incretin based therapy, что можно перевести как «лечение, опосредованное инкретинами».
Применение ДПП-IV-блокаторов позволяет создать в организме физиологический уровень инкретинов. Агонисты и аналоги ГПП-1 создают в крови фармакологическую концентрацию действующего вещества [42], что позволяет рассчитывать на восстановление полноценного инсулинового ответа. Как известно, у больных СД инсулиновый ответ на физиологические концентрации инкретинов может быть недостаточным [31, 43]. Следовательно, агонисты и аналоги ГПП-1 обладают более значимым потенциалом по сравнению с ДПП-IV-блокаторами [44]. Однако при этом решающим преимуществом последних является возможность перорального приема, в то время как агонисты и аналоги ГПП-1 созданы исключительно в инъекционной форме, которая, во-первых, ассоциируется у больных с переходом к инсулинотерапии, а во-вторых — объективно ухудшает качество жизни. Кроме того, ДПП-IV-блокаторы заметно дешевле. Изложенные преимущества делают ДПП-IV-блокаторы более привлекательными в лечении, опосредованном инкретинами.
Каково отношение к новой лечебной возможности у специалистов, работающих в области СД? Во всем мире алгоритмы и протоколы сахароснижающей терапии при СД 2, как международные, так и национальные, регулярно обновляются. Новые результаты широкомасштабных многоцентровых рандомизированных исследований, меняющие представления о целевых значениях в терапии СД и способах их достижения, появление новых групп сахароснижающих препаратов и их внедрение в клиническую практику, а также выявление серьезных ограничений в отношении ранее использовавшихся средств постоянно вынуждают менять стандарты лечебного подхода.
Одним из наиболее авторитетных международных алгоритмов лечения СД 2 является совместный алгоритм ADA (Американской диабетической ассоциации) и EASD (Европейской ассоциации по изучению сахарного диабета), предложенный в 2006 году и измененный в 2009 году [45, 46]. В этом документе рассматриваются два вида терапии: терапия первого ряда — с наиболее доказанным терапевтическим эффектом и терапия второго ряда — с меньшим уровнем доказательности. Терапия первого ряда включает последовательное назначение метформина, затем, при отсутствии эффекта, — производного сульфонилмочевины либо базального инсулина, а при сохранении/возобновлении со временем декомпенсации — интенсифицированной инсулинотерапии. Лечение, опосредованное инкретинами, наряду с тиазолидиндионом (пиоглитазоном) в дополнение к метформину отнесено ко второму ряду. Целью сахароснижающей терапии является достижение и поддержание уровня HbA1c менее 7 %. Отдавая должное стремлению авторов предложенной модели лечения использовать только проверенные временем данные доказательной медицины, необходимо отметить, что некоторые позиции этого базового алгоритма быстро устаревают.
К важнейшим недостаткам предложенного протокола можно отнести отсутствие персонифицированного подхода к цели лечения и неверное, с нашей точки зрения, место препаратов для лечения, опосредованного инкретинами. Целевые показатели сахароснижающей терапии должны быть различными в зависимости от возраста и степени сердечно-сосудистого риска пациента, что прежде всего связано с разной степенью опасности гипогликемии. Нет сомнений в том, что чем ниже уровень HbA1c, тем выше риск гипогликемии. Недавно завершившиеся крупные исследования ACCORD [47], ADVANCE [48] и VADT [49] убедительно продемонстрировали важность выбора индивидуальных целей гликемического контроля для каждого пациента в зависимости от возраста, длительности СД, наличия сердечно-сосудистых осложнений. Что касается лечения, опосредованного инкретинами, очевидно, что только недостаточный опыт клинического применения не позволил препаратам этой группы попасть на передовые позиции в протоколе. Важно отметить, что лечение, опосредованное инкретинами, которое сопряжено с низким потенциальным риском гипогликемий, помогает в решении обоих проблемных вопросов.
В значительной степени недостатки алгоритма ADA/EASD учтены в опубликованном в октябре 2009 года совместном алгоритме Американской ассоциации клинических эндокринологов и Американского колледжа эндокринологии (ААСЕ/АСЕ) [50], а также в проекте Консенсуса совета экспертов Российской ассоциации эндокринологов (РАЭ) по инициации и интенсификации сахароснижающей терапии СД 2 (январь 2011 года) [51]. В этих новых рекомендациях уже имеют место индивидуализация целевых показателей лечения, использование всех зарегистрированных классов сахароснижающих препаратов, определен приоритет эффективности и безопасности лечения над стоимостью и опытом использования в клинической практике.
Внимание к исследованиям различных аспектов применения ДПП-IV-блокаторов сегодня трудно переоценить [52–66]. Имеются данные о положительном влиянии монотерапии [52], комбинации с метформином [52, 53, 57, 58], производными сульфонилмочевины [59, 60], производными сульфонилмочевины и метформином [60, 61], с пиоглитазоном [62], инсулинотерапией [63]. Продемонстрированы сравнимые либо лучшие показатели контроля метаболических расстройств на фоне применения ДПП-IV-блокаторов в сравнении с производным сульфонилмочевины [61, 64, 65], пиоглитазоном [66]. Имеются данные о преимуществах ранней комбинированной терапии метформином и ДПП-IV-блокатором ситаглиптином [52].
Сегодня у авторов нет сомнений в том, что ДПП-IV-блокаторы способны улучшать уровень HbA1c. В нашей работе мы стремились определить, есть ли различия в гликемическом профиле на фоне применения ДПП-IV-блокаторов в сравнении с другими сахароснижающими при добавлении их к базовому лечению метформином при условии достижения подобного уровня HbA1c.
HbA1c отражает средний уровень глюкозы в крови в течение трех предшествовавших исследованию месяцев. Убедительно доказана тесная связь между уровнем HbA1c и риском развития специфических микрососудистых осложнений СД. Сохраняются сомнения по поводу положительного влияния агрессивного сахароснижающего лечения при СД 2 на аналогичные риски в пожилом возрасте, особенно на риски, обусловливающие появление и прогрессирование макрососудистых осложнений. Опасность развития гипогликемии может иметь большее негативное влияние на основные прогнозы у людей старшего возраста, чем даже сама болезнь. Следовательно, важно понимать, какой ценой достигнут приемлемо низкий уровень HbA1c. Если средний показатель невысок, необходимо иметь гарантии небольшой амплитуды колебаний гликемии, чтобы быть уверенным, что риск гипогликемии не перечеркивает выгоды близкого к нормальному гликемического уровня.
Исследование заключалось в определении вариабельности гликемии на фоне различных вариантов сахароснижающей терапии при СД 2. Пока нет убедительных данных на этот счет, но можно предполагать, что при сравнении больных с одинаковым уровнем усредненного показателя HbA1c минимальные колебания гликемии в течение суток соответствуют самому низкому риску гипогликемии. А следовательно, наименьшая вариабельность гликемии соответствует самому безопасному варианту сахароснижающей терапии.
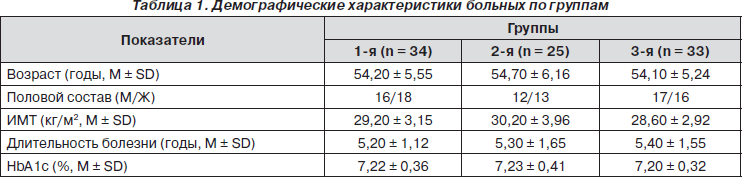
Для проведения исследования отобрано 92 больных СД 2, получающих метформин в дозе не менее 2,0 г в сутки. У всех пациентов монотерапия метформином была недостаточной для достижения удовлетворительной компенсации, и потребовалась дополнительная сахароснижающая терапия. Время от ее начала варьировало от трех до семи месяцев. В зависимости от варианта дополнительной терапии пациентов разделили на три группы: в 1-й группе (n = 34) к метформину были добавлены производные сульфонилмочевины (гликлазид или глимепирид), во 2-й (n = 25) — ДПП-IV-блокатор ситаглиптин, в 3-й (n = 33) — базальный инсулин.
Группы не отличались по половому составу, возрасту, индексу массы тела (ИМТ), длительности течения и степени компенсации СД. Основные демографические характеристики пациентов суммированы в табл. 1.
Вариабельность гликемии на фоне различных вариантов сахароснижающего лечения в группах оценивали при помощи постоянного мониторирования (CGMS Gold Medtronic) в течение трех суток. Верхний допустимый предел устанавливался на уровне 9,0 ммоль/л, нижний — на уровне 4,0 ммоль/л.
Средняя продолжительность мониторирования составила около 72 часов, статистически значимых различий между группами по количеству записанных показаний сенсора отмечено не было. Амплитуда колебаний гликемии в абсолютных значениях составила 2,7–11,9 ммоль/л в 1-й группе, 3,4–11,4 ммоль/л — во 2-й и 2,2–14,2 ммоль/л — в 3-й группе. В табл. 2 представлены результаты проведенного мониторирования.
Таким образом, вариабельность гликемии у больных со сравнимым уровнем HbA1c может заметно отличаться в зависимости от варианта сахароснижающего лечения. Минимальные колебания гликемии выявлены у пациентов, получавших метформин в сочетании с ситаглиптином. Важно отметить, что более выраженной была разница между продолжительностью гликемии ниже нижнего предела, в опасной близости к гипогликемическому состоянию. Можно предполагать, что причиной этого явления послужила глюкозозависимая стимуляция бета-клеток на фоне лечения, опосредованного инкретинами, в то время как гиперинсулинемия вследствие инсулинотерапии или применения секретагогов инсулина была сопряжена с повышенным риском упомянутого осложнения терапии.
Авторы уверены в значительных перспективах лечения, опосредованного инкретинами. Особенно трудно переоценить преимущества лечебного подхода, основанного на этом патогенетическом механизме, у пациентов пожилого возраста с высоким сердечно-сосудистым риском. Для окончательных выводов в будущем еще потребуется немало исследований в области клинического использования инкретинов. Однако мы готовы предположить, что в будущих профессиональных рекомендациях лечение, опосредованное инкретинами, займет достойное, следующее за назначением метформина, место.
1. Lebovitz H.E. Insulin secretagogues: old and new // Diabetes Rev. — 1999. — Vol. 7 (3). — P. 139-153.
2. Nathan D.M., Buse J.B., Davidson M.B. et al. Management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy // Diabetes Care. — 2006. — Vol. 29 (8). — P. 1963-1972.
3. United Kingdom Prospective Diabetes Study Group. UK Prospective Diabetes Study (UKPDS) VIII: study design, progress and performance // Diabetologia. — 1991. — Vol. 34 (12). — P. 877-890.
4. Harris M.I., Klein R., Welborn T.A., Knuiman M.W. Onset of NIDDM occurs at least 4–7 yr before clinical diagnosis // Diabetes Care. — 1992. — Vol. 15 (7). — P. 815-819.
5. Jarrett R.J. Duration of non-insulin-dependent diabetes and development of retinopathy: analysis of possible risk factors // Diabet Med. — 1986. — Vol. 3. — P. 261-263.
6. American Diabetes Association. Implications of the United Kingdom Prospective Diabetes Study // Diabetes Care. — 2002. — Vol. 25 (suppl. 1). — S28-S32.
7. Rodbard H.W., Blonde L., Braithwaite S.S. et al. AACE Diabetes Mellitus Clinical Practice Task Force. American Association of Clinical Endocrinologists medical guidelines for clinical practice for the management of diabetes mellitus // Endocr. Pract. — 2007. — Vol. 13 (suppl. 1). — P. 3-68.
8. Nauck M., Stockmann F., Ebert R., Creutzfeldt W. Reduced incretin effect in type 2 (non-insulin-dependent) diabetes // Diabetologia. — 1986. — Vol. 29 (1). — P. 46-52.
9. Eirick H., Stimmler L., Hlad C.J., Arai Y. Plasma insulin responses to oral and intravenous glucose administration // J. Clin. Endocrinol. Metab. — 1964. — Vol. 24. — P. 1076-1082.
10. Mclntyre N., Holdsworth C.D., Turner D.S. Intestinal factors in the control of insulin secretion // J. Clin. Endocrinol. Metab. — 1965. — Vol. 25 (10). — P. 1317-1324.
11. Drucker D.J., Nauck M.A. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes // Lancet. — 2006. — Vol. 368 (9548). — P. 1696-1705.
12. Chelikani P.K., Haver A.C., Reidelberger R.D. Intravenous infusion of glucagon-like peptide-1 potently inhibits food intake, sham feeding, and gastric emptying in rats // Am. J. Physiol. Regul. Integr. Comp. Physiol. — 2005. — Vol. 288 (6). — R1695-R1706.
13. Little T.J., Pilichiewicz A.N., Russo A. et al. Effects of intravenous glucagon-like peptide-1 on gastric emptying and intragastric distribution in healthy subjects: relationships with postprandial glycemic and insulinemic responses // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91 (5). — P. 1916-1923.
14. Willms B., Werner J., Holst J.J. et al. Gastric emptying, glucose responses, and insulin secretion after a liquid test meal: effects of exogenous glucagonlike peptide-1 (GLP-1)-(7-36) amide in type 2 (non-insulin-dependent) diabetic patients // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81 (1). — P. 327-332.
15. Flint A., Raben A., Astrup A., Holst J.J. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans // J. Clin. Invest. — 1998. — Vol. 101 (3). — P. 515-520.
16. Gutzwiller J.P., Drewe J., Goke B. et al. Glucagon-like peptide-1 promotes satiety and reduces food intake in patients with diabetes mellitus type 2 // Am. J. Physiol. — 1999. — Vol. 276 (5, pt 2). — R1541-R1544.
17. Toft-Nielsen M.B., Madsbad S., Holst J.J. Continuous subcutaneous infusion of glucagon-like peptide 1 lowers plasma glucose and reduces appetite in type 2 diabetic patients // Diabetes Care. — 1999. — Vol. 22 (7). — P.1137-1143.
18. Naslund E., Gutniak M., Skogar S., Hellstrom P.M. Glucagon-like peptide 1 increases the period of postprandial satiety and slows gastric emptying in obese men // Am. J. Clin. Nutr. — 1998. — Vol. 68 (3). — P. 525-530.
19. Creutzfeldt W.O., Kleine N., Willms B. et al. Glucagonostatic actions and reduction of fasting hyperglycemia by exogenous glucagon-like peptide 1(7-36) amide in type 1 diabetic patients // Diabetes Care. — 1996. — Vol. 19 (6). — P. 580-586.
20. Nauck M.A., Heimesaat M.M., Orskov C. et al. Preserved incretin activity of glucagon-like peptide 1 [7-36 amide] but not of synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus // J. Clin. Invest. — 1993. — Vol. 91 (1). — P. 301-307.
21. Nauck M.A., Kleine N., Orskov C. et al. Normalization of fasting hyperglycaemia by exogenous glucagon-like peptide 1 (7-36 amide) in type 2 (non-insulin-dependent) diabetic patients // Diabetologia. — 1993. — Vol. 36 (8). — P. 741-744.
22. Hargrove D.M., Nardone N.A., Persson L.M. et al. Glucose-dependent action of glucagon-like peptide 1 (7-37) in vivo during short- or long-term administration // Metabolism. — 1995. — Vol. 44 (9). — P. 1231-1237.
23. Quddusi S., Vahl T.P., Hanson K. et al. Differential effects of acute and extended infusions of glucagon-like peptide-1 on first- and second-phase insulin secretion in diabetic and nondiabetic humans // Diabetes Care. — 2003. — Vol. 26 (3). — P. 791-798.
24. Rachman J., Barrow B.A., Levy J.C., Turner R.C. Near-normalization of diurnal glucose concentrations by continuous administration of glucagon-like peptide-1 (GLP-1) in subjects with NIDDM // Diabetologia. — 1997. — Vol. 40 (2). — P. 205-211.
25. Buteau J. GLP-1 receptor signaling: effects on pancreatic beta-cell proliferation and survival // Diabetes Metab. — 2008. — Vol. 34 (suppl. 2). — S73-S77.
26. Abraham E.J., Leech C.A., Lin J.C. et al. Insulinotropic hormone glucagon-like peptide-1 differentiation of human pancreatic islet-derived progenitor cells into insulin-producing cells // Endocrinology. — 2002. — Vol. 143 (8). — P. 3152-3161.
27. Drucker D.J. Glucagon-like peptide-1 and the islet beta-cell: augmentation of cell proliferation and inhibition of apoptosis // Endocrinology. — 2003. — Vol. 144 (12). — P. 5145-5148.
28. Li Y., Hansotia T., Yusta B. et al. Glucagon-like peptide-1 receptor signaling modulates beta cell apoptosis // J. Biol. Chem. — 2003. — Vol. 278 (1). — P. 471-478.
29. Hui H., Nourparvar A., Zhao X., Perfetti R. Glucagon-like peptide-1 inhibits apoptosis of insulin-secreting cells via a cyclic 5’-adenosine monophosphate-dependent protein kinase A and a phosphatidylinositol 3-kinase-dependent pathway // Endocrinology. — 2003. — Vol. 144 (4). — P. 1444-1455.
30. Farilla L., Bulotta A., Hirshberg B. et al. Glucagon-like peptide1 inhibits cell apoptosis and improves glucose responsiveness of freshly isolated human islets // Endocrinology. — 2003. — Vol. 144 (12). — P. 5149-5158.
31. Toft-Nielsen M.B., Damholt M.B., Madsbad S. et al. Determinants of the impared secretion of glucagon-like peptide-1 in type 2 diabetic patients // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86 (8). — P. 3717-3723.
32. Polonsky K.S., Given B.D., Hirsch L.J. et al. Abnormal patterns of insulin secretion in non-insulin-dependent diabetes mellitus // N. Engl. J. Med. — 1988. — Vol. 318 (19). — P. 1231-1239.
33. Nauck M.A., Heimesaat M.M., Bhele K. et al. Effects of glucagon-like peptide 1 on counterregulatory hormone responses, cognitive functions, and insulin secretion during hyperinsulinemic, stepped hypoglycemic clamp experiments in healthy volunteers // J. Clin. Endocrinol. Metab. — 2002. — Vol. 87 (3). — P. 1239-1246.
34. Yu M., Moreno C., Hoagland K.M. et al. Antihypertensive effect of glucagon-like peptide 1 in Dahl salt-sensitive rats // J. Hypertens. — 2003. — Vol. 21 (6). — P. 1125-1135.
35. Bose A.K., Mocanu M.M., Carr R.D. et al. Glucagon-like peptide 1 can directly protect the heart against ischemia/reperfusion injury // Diabetes. — 2005. — Vol. 54 (1). — P. 146-151.
36. Nikolaidis L.A., Elahi D., Hentosz T. et al. Recombinant glucagon-like peptide-1 increases myocardial glucose uptake and improves left ventricular performance in conscious dogs with pacing-induced dilated cardiomyopathy // Circulation. — 2004. — Vol. 110 (8). — P. 966-961.
37. Nikolaidis L.A., Mankad S., Sokos G.G. et al. Effects of glucagon-like peptide-1 in patients with acute myocardial infarction and left ventricular dysfunction after successful reperfusion // Circulation. — 2004. — Vol. 109 (8). — P. 962-965.
38. Nystrom T., Gutniak M.K., Zhang Q. et al. Effects of glucagon-like peptide-1 on endothelial function in type 2 diabetes patients with stable coronary artery disease // Am. J. Physiol. Endocrinol. Metab. — 2004. — Vol. 287 (6). — E1209-E1215.
39. Klein S., Sheard N.F., Pi-Sunyer X. et al. American Diabetes Association; North American Association for the Study of Obesity; American Society for Clinical Nutrition. Weight management through lifestyle modification for the prevention and management of type 2 diabetes: rationale and strategies // Diabetes Care. — 2004. — Vol. 27 (8). — P. 2067-2073.
40. Hansen et al. // Endocrinology. — 1999. — Vol. 140. — P. 5356-5363.
41. Vilsboll T. et al. // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — P. 220-224.
42. Mari et al. // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90. — P. 4888-4894.
43. Vilsboll et al. // Diabetologia. — 2002. — Vol. 45. — P. 1111-1119.
44. Pratley et al. Liraglutide compared to sitagliptin, both in combination with metformin, in subjects with type 2 diabetes: a 26-week, randomized, parallel group, open-label trial // Lancet. — 2010. — Vol. 375. — P. 1447-1456.
45. Nathan D.M., Buse J.B., Davidson M.B. et al. Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. — 2006. — Vol. 29. — P. 1963-1972.
46. Nathan D.M., Buse J.B., Davidson M.B. et al. American Diabetes Association; European Association for the Study of Diabetes. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy. A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. — 2009. — Vol. 32. — P. 193-203.
47. Miller M.E., Byington R.P., Goff D.C.J. et al. (Action to Control Cardiovascular Risk in Diabetes Study Group). Effects of intensive glucose lowering in type 2 diabetes // N. Engl. J. Med. — 2008. — Vol. 358. — P. 2545-2559.
48. Patel A., MacMahon S., Chalmers J. et al. (ADVANCE Collaborative Group). Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N. Engl. J. Med. — 2008. — Vol. 358. — P. 2560-2572.
49. Duckworth W., Abraira C., Moritz T. et al. (VADT Investigators). Glucose control and vascular complications in veterans with type 2 diabetes // N. Engl. J. Med. — 2009. — Vol. 361. — P. 1024-1025.
50. Rodbard H.W., Jellinger P.S., Davidson J.A. еt al. Statement by an American Association of Clinical Endocrinologists / American College of Endocrinology Consensus Panel on Type 2 Diabetes Mellitus: An Algorithm for Glycemic Control // Endocr. Pract. — 2009. — Vol. 15 (6). — P. 540-559.
51. Дедов И.И., Шестакова М.В., Аметов А.С. и др. Проект «Консенсус совета экспертов Российской ассоциации эндокринологов (РАЭ) по инициации и интенсификации сахароснижающей терапии сахарного диабета 2 типа» // Сахарный диабет. — 2011. — № 1. — C. 95-105.
52. Williams-Herman D., Johnson J., Teng R. et al. Efficacy and safety of sitagliptin and metformin as initial combination therapy and as monotherapy over 2 years in patients with type 2 diabetes // Diab. Obes. Metab. — 2010. — Vol. 12 (5). — P. 442-451.
53. Nauck M.A., Ellis G.C., Fleck P.R. et al. Efficacy and safety of adding the dipeptidyl peptidase-4 inhibitor alogliptin to metformin therapy in patients with type 2 diabetes inadequately controlled with metformin monotherapy: a multicentre, randomized, double-blind, placebo-controlled study // Int. J. Clin. Pract. — 2009. — Vol. 63. — P. 46-55.
54. Deacon C.F., Holst J.J. Dipeptidyl peptidase IV inhibitors: a promising new therapeutic approach for the management of type 2 diabetes // Int. J. Biochem. — 2006. — Vol. 38. — P. 831-844.
55. Deacon C.F., Carr R.D., Holst J.J. DPP-4 inhibitor therapy: new directions in the treatment of type 2 diabetes // Front. Biosci. — 2008. — Vol. 13. — P. 1780-1794.
56. Feng J., Zhang Z., Wallace M.B. et al. Discovery of alogliptin: a potent, selective, bioavailable, and efficacious inhibitor of dipeptidyl peptidase IV // J. Med. Chem. — 2007. — Vol. 50. — P. 2297-2300.
57. Charbonnel B., Karasik A., Liu J. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing metformin therapy in patients with type 2 diabetes inadequately controlled with metformin alone // Diabetes Care. — 2006. — Vol. 29. — P. 2638-2643.
58. Scott R., Loeys T., Davies M.J., Engell S.S. Efficacy and safety of sitagliptin when added to ongoing metformin therapy in patients with type 2 diabetes // Diab. Obes. Metab. — 2008. — Vol. 10. — P. 959-969.
59. Garber A.J., Foley J.E., Banerji M.A. et al. Effects of vildagliptin on glucose control in patients with type 2 diabetes inadequately controlled with a sulphonylurea // Diab. Obes. Metab. — 2008. — Vol. 10. — P. 1047-1056.
60. Hermansen K., Kipnes M., Luo E. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, in patients with type 2 diabetes mellitus inadequately controlled on glimepiride alone or on glimepiride and metformin // Diab. Obes. Metab. — 2007. — Vol. 9. — P. 733-745.
61. Pratley R.E., Kipnes M.S., Fleck P.R. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type 2 diabetes inadequately controlled by glyburide monotherapy // Diab. Obes. Metab. — 2009. — Vol. 11. — P. 167-176.
62. Rosenstock J., Brazg R., Andryuk P.J. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing pioglitazone therapy in patients with type 2 diabetes: a 24-week, multicenter, randomized, double-blind, placebo-controlled, parallel-group study // Clin. Ther. — 2006. — Vol. 28. — P. 1556-1568.
63. Vilsboll T., Rosenstock J., Yki-Jarvinen H. et al. Efficacy and safety of sitagliptin when added to insulin therapy in patients with type 2 diabetes // Diab. Obes. Metab. — 2010. — Vol. 12 (2). — P. 167-177.
64. Nauck M.A., Meininger G., Sheng D. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, compared with the sulfonylurea, glipizide, in patients with type 2 diabetes inadequately controlled on metformin alone: a randomized, non-inferiority trial // Diab. Obes. Metab. — 2007. — Vol. 9. — P. 194-205.
65. Ferrannini E., Fonseca V., Zinman B. et al. Fifty-two-week efficacy and safety of vildagliptin vs. glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin monotherapy // Diab. Obes. Metab. — 2009. — Vol. 11. — P. 157-166.
66. Bolli G., Datta F., Rochotte E., Cohen S.E. Efficacy and tolerability of vildagliptin vs. pioglitazone when added to metformin: a 24-week, randomized, double-blind study // Diab. Obes. Metab. — 2008. — Vol. 10. — P. 82-90.