Международный эндокринологический журнал 5 (37) 2011
Вернуться к номеру
Послеабортный метаболический синдром: профилактика и лечение
Авторы: Завалко А.Ф., Кафедра акушерства и гинекологии НОУ ВПО «Самарский медицинский институт «Реавиз», РФ
Рубрики: Эндокринология
Версия для печати
Введение
В клинической практике нарушения менструальной и репродуктивной функции у женщин очень часто сопровождаются комплексом метаболических расстройств [1]. В гинекологии они формулируются такими диагнозами, как: синдром поликистозных яичников, нейрообменно-эндокринный синдром, связанный и не связанный с беременностью, гиперпролактинемические состояния, климактерический и предменструальный синдромы [2]. Для таких пациенток характерна анамнестическая привязанность к какому-либо жизненному событию, которое является пусковым в реализации имеющихся нарушений. Это может быть становление или угасание репродуктивной функции, начало половой жизни, вступление в брак или развод, роды, тяжелые заболевания, смена места жительства, длительно текущие стрессы или семейные конфликты. Как правило, имеется сочетание нескольких причин, которые могут усиливать негативное действие друг друга [3].
Одной из таких причин, ведущих к метаболическим нарушениям и дисфункции репродуктивной системы, является искусственное прерывание беременности [4]. Негативное влияние аборта на эндокринную функцию общеизвестно. В то же время экотоксиканты, техногенные факторы, ослабление защитных сил организма и психоэмоциональные перегрузки, которые сопровождают жизнь каждой женщины, ухудшают течение восстановительного периода после артифициального аборта, приводя к срыву адаптации и росту числа осложнений как воспалительного, так и эндокринного характера [5].
На сегодняшний день имеется много работ по описанию медикаментозного лечения и физиотерапии осложнений после артифициального аборта, в том числе и метаболического характера. Однако методы профилактики развития метаболического синдрома (МС) после искусственного прерывания беременности представлены в ограниченном количестве, при этом разноречиво описание факторов, предрасполагающих к развитию нейрообменно-эндокринной патологии, а также не дана количественная оценка значимости каждого из них. Остается открытым вопрос коррекции метаболических нарушений. Рекомендуемые схемы лечения МС включают редукционную диету, разработку комплекса физических упражнений, поведенческую терапию, медикаментозное лечение, физиотерапевтические процедуры. Тем не менее регуляция веса, уровня липидов крови, функции диэнцефальных структур по-прежнему остается актуальной. Отдаленная эффективность используемых методов лечения составляет от 20 до 45 %, а прогрессирование МС в дальнейшем приводит к сахарному диабету (СД), атеросклеротическому повреждению интимы сосудов и росту числа таких заболеваний, как инфаркт миокарда и инсульт. Поэтому поиск новых путей профилактики и коррекции метаболических нарушений является актуальным.
Одним из современных методов физиотерапевтического воздействия является лазеротерапия. Много-гранность механизмов действия, неинвазивность выполнения процедур на фоне незначительных побочных эффектов позволяют выделить этот метод как перспективный для использования в комплексной реабилитации женщин после прерывания беременности.
Целью настоящего исследования явилась разработка комплекса мероприятий, направленных на снижение отдаленных осложнений в виде метаболических нарушений и сохранение репродуктивной функции женщин, осуществляющих искусственное прерывание беременности.
Материалы и методы исследования
В ходе работы нами было обследовано 570 женщин в возрасте от 18 до 42 лет. Исследование включало 2 этапа. 1-й этап — ретроспективное исследование. Данный этап основывался на анализе анатомо-биологических, антропометрических показателей, социального статуса, анамнеза жизни, медицинского анамнеза женщин, паритета, клинических данных и результатов дополнительных методов обследования женщин, перенесших в анамнезе искусственное прерывание беременности на сроке 5–12 нед. Из всех пациентов, прервавших беременность в период с 2002 по 2004 гг. и территориально прикрепленных к женским консультациям г. Самары, методом случайных чисел были выделены 150 человек с наличием МС и 120 человек, у которых МС отсутствовал. Нами проведен анализ полученных анамнестических факторов (всего 113 показателей) с выделением из них прогностически значимых для развития обменных нарушений после прерывания беременности. В результате обработки материала была создана математическая модель прогнозирования МС.
2-й этап включал обследование 300 здоровых беременных женщин, поступивших на артифициальный хирургический аборт, из которых на основании расчетов по созданной математической модели 209 пациенток вошли в группу высокого риска развития МС и 91 — в группу низкого риска. В ходе исследования сравнивались изучаемые клинико-лабораторные показатели, как между группами, так и внутри группы, в динамике: до и через 12–18 месяцев после прерывания беременности. С учетом полученных данных о реализации МС в наблюдаемых группах была осуществлена клиническая оценка эффективности работы предложенной математической модели.
С целью предупреждения развития МС у женщин высокого риска использовался метод магнитолазеротерапии и его сочетание с традиционными методами коррекции метаболических нарушений. Распределение женщин осуществлялось путем слепой скрининговой компьютерной диагностики, при которой определялась принадлежность женщин к группе высокого или низкого риска реализации МС. В дальнейшем их распределили на 5 групп методом случайных чисел с присвоением каждой группе определенного кода-пароля. Полное раскодирование групп осуществлялось по окончании обработки результатов.
На основании проведенного проспективного исследования и с опорой на данные медицинской литературы, был разработан алгоритм ведения пациенток, позволяющий снизить частоту послеабортных осложнений и сохранить репродуктивную функцию женщин.
Критерии исключения из исследования: наличие сомнительных параметров диагностики МС; пациенты с нейроэндокринными нарушениями до беременности, а также с ИМТ более 30 кг/м2; женщины, страдающие системными, эндокринными заболеваниями, тяжелой и декомпенсированной экстрагенитальной патологией; пациентки с эндометриозом, миомой матки, опухолями яичников, пороками развития половых органов, острыми воспалительными заболеваниями. В группы наблюдения не вошли вновь забеременевшие женщины, а также пациенты, которым за анализируемый период осуществлялись хирургические или гинекологические операции и вмешательства.
Общая соматическая и гинекологическая заболеваемость в основной и контрольной группах была идентична (p > 0,1). Диагноз МС выставлялся согласно критериям, предложенным Международной диабетической федерацией (IDF), 2005: центральное ожирение, определяемое по окружности талии ≥ 80 в сочетании с любыми 2 из нижеперечисленных факторов: повышенный уровень триглицеридов ≥ 1,7 ммоль/л; сниженный уровень липопротеинов высокой плотности (ЛПВП) < 1,29 ммоль/л; повышенное АД: систолическое ≥ 130 мм рт.ст. или диастолическое ≥ 85 мм рт.ст.; уровень гликемии натощак ≥ 5,6 ммоль/л или 100 мг/дл либо диагностированный ранее СД 2-го типа.
Также принимались во внимание критерии МС, предложенные группой экспертов по диагностике и лечению высокого уровня холестерина в крови у взрослых (on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III, 2004)): абдоминальное ожирение (объем талии более 88 см); гипертриглицеридемия (уровень ТГ более 1,7 ммоль/л); снижение уровня холестерина ЛПВП (менее 1,3 ммоль/л у женщин); артериальная гипертензия (АД более 130/85 мм рт.ст.); гипергликемия натощак (более 6,0 ммоль/л). Наличие любых трех факторов позволяет констатировать МС. В сомнительных случаях осуществлялся расчет модели оценки гомеостаза для инсулинорезистентности (ИР), так называемого индекса HOMA. Значение HOMA больше 2,27 расценивали как наличие ИР.
В процессе исследования отмечалось только наличие или отсутствие МС без оценки тяжести его проявления.
Методы исследования. Клинические: сбор жалоб, оценка анамнеза, анализ амбулаторной медицинской документации и карт прерывания беременности. В процессе исследования нами выделены следующие показатели. Ановуляторные циклы определялись путем проведения тестов функциональной диагностики на протяжении трех менструальных циклов и определения гормонов крови. Характеристика менструального цикла: частота, интенсивность, продолжительность менструаций, а также наличие сопутствующей клинической симптоматики в дни menses. Степень оволосения оценивалась с использованием шкалы D. Ferriman, J. Galway (1961). Определение диэнцефальных расстройств осуществлялось путем проведения всем женщинам диэнцефальных проб (оценка объема выпитой и выделенной жидкости, волдырная проба Олдрича, суточный мониторинг температуры тела и артериального давления, температурная проба Щербака, выявлялись симптомы полифагии, полидипсии, головные боли, нарушение сна и бодрствования, перепады настроения). Предложены и оформлены в виде рационализаторских предложений методы оценки субъективно констатируемых и объективно выявляемых диэнцефальных расстройств (ДР).
Диагностика уровня ситуативной и личностной тревожности осуществлялась путем тестового контроля по методике Ч.Д. Спилбергера в модификации Ю.Л. Ханина.
Клинико-лабораторные и дополнительные методы исследования. Всем наблюдаемым пациентам проводилось ультразвуковое исследование (УЗИ) органов малого таза на аппаратуре фирмы Siemens, из них 145 женщинам — дважды и более в процессе динамического наблюдения. При обследовании учитывались основные эхографические критерии поликистоза яичников (ПКЯ), характерные для МС.
Для подтверждения диагноза 21 женщине произведена гистероскопия (эндоскопическая оптика фирмы Оlympus) с последующим диагностическим выскабливанием полости матки или биопсией слизистой оболочки. Оценивались биохимические показатели крови — индикаторы нарушений обмена веществ (общий белок и белковые фракции, холестерин, ЛПВП, липопротеины низкой плотности (ЛПНП), триглицериды, мочевина, креатинин, билирубин, глюкоза крови натощак, стандартный глюкозотолерантный тест). Определение лабораторных показателей осуществлялось рутинным методом. Биохимические показатели крови определялись с использованием полуавтоматической аналитической системы ФП-901-М фирмы Labsystems (Финляндия) с использованием стандартного набора реактивов.
Определение активности каталазы сыворотки крови осуществлялось по методике М.А. Королюка с соавт. Для оценки активности сывороточной супероксиддисмутазы использовался адренохромовый метод, предложенный H. Mistra и I. Fridovich. Определение содержания малонового диальдегида и диеновых конъюгатов осуществлялось с помощью тиобарбитуровой кислоты по методике, описанной И.Д. Стальной и Т.Г. Гаришвили.
Гормональные методы исследования. Определение фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, эстрадиола, прогестерона, тестостерона, кортизола и дегидроэпиандростерона проводилось на 20–23-й день менструального цикла.
Математическую обработку и статистический анализ полученных данных осуществляли с помощью пакета компьютерных программ Epi Info, версия 5 и Epi InfoTM для Windows, версия 3.3. С целью обработки и описания результатов исследования были использованы методы описательной статистики и корреляционного анализа. Для определения наиболее значимых признаков из всех, выделенных нами, был использован многофакторный анализ. Результаты представляли в виде M ± m для непрерывных переменных и как долю (в процентах) для категориальных переменных. Сравнение средних (М) значений осуществляли с использованием t-критерия Стьюдента и Н-критерия Крускала — Уоллиса в зависимости от характера распределения исследуемого признака. Для выявления статистически значимых различий между долями совокупности использовали критерий хи-квадрат (c2) К. Пирсона с поправкой на непрерывность Йейтса. За критический уровень значимости при проверке статистических гипотез принимали р < 0,05 с учетом числа степеней свободы и достоверной вероятностью p ≥ 0,95.
Методика магнитолазеротерапии. В ходе исследования использовался низкоэнергетический лазер на полупроводниковой основе, генерируемый с помощью аппаратов МИЛТА-Ф-8-01 и «Исток». Режимы лазеротерапии, направленные на профилактику МС, включали:
1. Внутривенное облучение крови с мощностью излучения 1,0-2,0 Вт (с частотой импульсов 5–50 Гц), экспозиция 10–30 мин, кратность процедур — ежедневно или через день на курс 12–20 сеансов (гелий-неоновый лазер).
2. Воздействие на крупные нервные и сосудистые пучки на шее, VII шейный позвонок, передневисочные области с помощью зеркальной или магнитной насадки. Использовалось инфракрасное излучение с импульсной мощностью 4,0–4,5 Вт при частоте импульсов 80 и 1500 Гц, длительность экспозиции 15–30 с на каждую точку; ежедневно или через день на курс 12–20 сеансов.
3. Интраназальное лазерное облучение на глубину 2–5 см в нижний носовой ход с использованием гелий-неонового лазера. Доза излучения по 0,02 Дж/см2 с каждой стороны, частота следования импульсов 80 Гц, продолжительность сеанса 10 мин. Курс лечения 5–8 сеансов, ежедневно.
В процессе лазеротерапии одновременно осуществлялось воздействие постоянным магнитным полем (ПМП 5–10 мТл) на крупные нервные и сосудистые пучки на шее, VII шейный позвонок, передневисочные области и на переднюю брюшную стенку в подвздошных областях. Всего было проведено 4 курса по 20 дней каждый: в течение месяца после аборта, через 3, 6 и 12–18 месяцев после прерывания беременности. Традиционная терапия, направленная на профилактику развития МС у женщин II группы, включала контроль энергетической насыщенности и баланса микронутриентов в питании с учетом вида деятельности и подсчетом суточного количества употребляемых калорий; увеличение физической активности, сопровождающееся усилением аэробного типа дыхания (бассейн); физиопроцедуры (эндоназальный электрофорез с витаминами В1, В6, электрофорез на низ живота, гальванизация области малого таза); комплекс поливитаминов и микроэлементов (центрум). Гормональные препараты, аноректики, термоиндукторы не назначались ввиду профилактической направленности проводимого лечения.
Результаты исследования и их обсуждение
Прогнозирование реализации метаболического синдрома после искусственного прерывания беременности (ретроспективное исследование). Проведенный анализ 113 признаков позволил выделить различия в основной и контрольной группах. По социально-бытовым факторам в основной группе превалируют пациенты молодого (до 20 лет) и более старшего возраста (31–35 лет). Чаще встречаются психоэмоциональные перегрузки. Существенно влияют на риск реализации МС эпидемический паротит, черепно-мозговая травма в анамнезе.
Вегетососудистая дистония, избыточная масса встречались на 22 и 18 % соответственно чаще у женщин с МС, чем у здоровых. Нейроциркуляторная дистония при МС протекала, как правило, по гипертоническому типу, а избыток массы тела констатировался с детского или пубертатного возраста. Для женщин основной группы были свойственны изменения в гепатобилиарной системе и заболевания лимфоидной ткани (аппендэктомия: 52,67 ± 4,08 и 31,67 ± 4,25 %; хронический тонзиллит: 42,67 ± 4,04 и 17,50 ± 3,47 % в основной и контрольной группах соответственно).
Из специального анамнеза выявлено: замедленное установление регулярного менструального цикла до 1,5–2 лет при МС. Все эти женщины отмечают периодические сбои циклов, их зависимость от стрессовых или других факторов, таких как роды, аборты. В основной группе велика частота бесплодия, преимущественно вторичного генеза (6,67 ± 2,04 % против 1,67 ± 1,17 % в контроле). В группе женщин с МС в 2 раза чаще встречаются невынашивание и осложненное течение беременности, родов и послеродового периода.
По данным дополнительных методов обследования, в основной группе чаще встречались ретенционные образования яичников (по УЗИ) и бoльшие цифры среднего объема яичников. При оценке гормонов крови чаще выявлялся гормональный дисбаланс, сопровождающийся снижением ФСГ и ростом ЛГ, повышением адренокортикотропного гормона, кортизола и тестостерона.
Проведение канонического корреляционного анализа с оценкой глубины связей всего множества входящих факторов-параметров и выходных признаков (развития МС) позволило выявить 77 показателей, которые оказывают существенное влияние на формирование нейроэндокринной патологии. Установлено, что наиболее значимыми и повышающими риск реализации МС показателями являются симптомы, характеризующие менструальный цикл. Высока также роль таких параметров, как паритет, избыточный вес, возраст, стрессы, наличие гирсутизма и стрий.
Полученные нами данные позволили произвести расчет математической модели своевременной диагностики развития МС после искусственного прерывания беременности. Теоретическая достоверность предлагаемой методики задана с R = 98,63 %. Разброс разностей наблюдаемых значений и модельных величин незначителен, что позволяет констатировать наличие линейной зависимости степени доверия к обрабатываемым результатам. При 95% регрессии это означает, что линейная связь между признаками сильная, и в анализируемом случае можно говорить о надежности представленной методики проведения экспериментальных вычислений.
Формула модели:
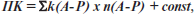
где ПК — прогностический коэффициент, k — коэффициент модели рассчитываемого параметра, n — шифр выбранного варианта прогностического параметра; const = 0,999243.
При ПК ≤ 1,5 пациентка относится к группе высокого риска реализации МС. При ПК > 1,5 пациентка относится к группе низкого риска реализации МС.
Последовательность определения степени риска реализации МС включает:
1. Сбор данных, используемых для расчета математической модели (на основании опроса и объективного осмотра женщины).
2. Выбор цифрового значения зарегистрированного параметра.
3. Ввод полученных цифровых значений в рассчитанную оригинальную математическую модель и подсчет итогового прогностического коэффициента.
4. Сравнение полученного коэффициента с константой (равной 1,5) и причисление пациентки к группе высокого или низкого риска реализации МС после прерывания беременности.
Для облегчения расчета созданная математическая модель представлена в электронном варианте в виде программы для PC. В дальнейшем, при выполнении проспективного этапа исследования, была выполнена реальная оценка прогностической ценности предлагаемой математической модели. Она составила: чувствительность 95,7 %, специфичность 82,2 %, прогностическая ценность положительного результата 89,3 %, прогностическая ценность отрицательного результата 92,5 %. Установлена высокая эффективность использования модели по таким параметрам, как чувствительность, прогностическая ценность положительного и отрицательного результата и хорошие параметры по специфичности предлагаемой математической модели. Внедрение математической модели в практику даст возможность выделять женщин высокого риска развития МС в отдаленном периоде после аборта и проводить им комплекс превентивных лечебно-профилактических мероприятий.
При ретроспективном виде анализа результатов можно оценить только малый объем информации, отраженный в медицинской документации. При этом обследование не унифицировано, проведено в различных медицинских учреждениях, разными врачами-специалистами на аппаратуре с разной разрешающей способностью. Для сравнения изучаемых показателей между группами, а также анализа динамики изучаемых параметров проведено наблюдение за 115 женщинами, из которых 75 вошли в группу высокого риска развития МС, а 40 — в группу низкого риска. Через 12–18 мес. после аборта МС был диагностирован у 67 женщин из 75 высокого риска и у 3 из 40 низкого риска его реализации.
Полученные результаты свидетельствуют о том, что динамика клинико-лабораторных показателей у женщин высокого и низкого риска развития МС после искусственного прерывания беременности разная, хотя исходно, до аборта, статистически значимых отличий не выявлялось. Также установлено, что внутри изучаемых групп степень выраженности изменений каждого анализируемого показателя по сравнению с исходными значениями (до аборта) также различна. Статистически значимых отклонений показателей в группе низкого риска в динамике не было. Более того, частота жалоб на нарушение менструального цикла и дискомфорта в дни menses уменьшилась на 40 % (12,5 % до аборта и 7,5 % после). В контрольной группе на 11 % (с 4,90 ± 1,12 до 5,44 ± 1,01 сут.) возросла продолжительность менструаций, что может быть связано с клиническими проявлениями формирующейся миомы и/или эндометриоза и на 7 % (с 11,33 ± 5,05 до 12,12 ± 4,01 %) увеличилось количество объективно регистрируемых диэнцефальных расстройств. В группе женщин высокого риска реализации МС изменения показателей за наблюдаемый период были существенны. На 225 и 203 % увеличились диагностируемые диэнцефальные расстройства. Так, частота объективно диагностируемых расстройств выросла с 18,40 ± 9,45 до 59,96 ± 11,46 %, а субъективных жалоб — с 1,20 ± 0,16 до 3,64 балла (p < 0,01). Таким образом, область гипоталамуса у пациенток высокого риска МС наиболее ранима и первой реагирует на стрессовое воздействие. Значительно возрастает частота нарушений менструального цикла. Пациентки группы высокого риска почти в 2,5 раза чаще начинают предъявлять жалобы на цикл (38,7 до и 92,0 % через 12–18 мес. после аборта). Менструации становятся болезненными, появляется негативная симптоматика накануне и в дни менструаций. Присоединяются характерные проявления гипоменструального синдрома: цикл становится на 44,2 % более длительным (28,5 ± 5,4 до и 41,1 ± 8,5 сут. после аборта), продолжительность менструаций на 41,5 % короче (с 4,80 ± 1,20 до 2,81 ± 0,92 сут.), на 38,1 % уменьшается количество теряемой крови (с 49,4 ± 5,3 до 30,6 ± 7,4 мл).
У женщин основной группы за 12–18 мес. отмечается рост ИМТ на 35,1 % от исходного (с 23,1 ± 4,6 до 31,2 ± 4,5 кг/м2), гирсутное число (ГЧ) возросло с 10,39 ± 0,50 до 13,01 ± 0,93 (рост на 25,2 %), увеличение толщины М-эхо при УЗИ составило 26 % (с 0,96 ± 0,11 до 1,21 ± 0,12 см). Учитывая относительное постоянство перечисленных показателей (за исключением М-эхо), их изменение на 25–35 % следует признать как существенное, а изменение множества показателей свидетельствует о глубоких патогенетических механизмах происходящих нарушений. Выявленные различия носят статистически значимый характер с p < 0,05 как по отношению к контрольной группе, так и к исходно определяемым показателям до прерывания беременности.
Описанная динамика показателей в своей основе имеет гуморальные сдвиги. В ходе исследования у женщин высокого риска МС по сравнению с контролем через 12–18 месяцев после аборта диагностировано увеличение уровня ФСГ, пролактина, дегидроэпиандростерона. Выявлено уменьшение ЛГ, эстрадиола, прогестерона. Указанные различия носят достоверный характер с p < 0,05, а по ЛГ и эстрадиолу — с p < 0,01. Эти данные наряду с тестами функциональной диагностики свидетельствуют об ановуляции, которая имеет место у 96,0 % женщин группы высокого риска МС (у 7,5 % — в группе низкого риска МС). Происходящие изменения гормонального гомеостаза специфичны для последующего формирования ПКЯ центрального генеза. В научной литературе описаны многочисленные исследования, свидетельствующие о взаимосвязи снижения уровня эстрадиола и развития инсулинорезистентности. Важную роль в генезе метаболических нарушений играет повышение уровня кортизола, которое наблюдалось у каждой третьей пациентки основной группы. В основной группе уровень кортизола через 12–18 мес. после аборта составил 411,6 ± 48,4 нмоль/мл, в контрольной — 342,4 ± 41,6 нмоль/мл (p < 0,05). Оценка биохимических показателей в динамике наблюдения установила наибольшие изменения в показателях углеводного и липидного обмена.
За период наблюдения значительно вырос уровень ЛПНП в группе женщин высокого риска развития МС (на 89 %) и составил 2,09 ± 0,07 ммоль/л до и 3,95 ± 0,15 ммоль/мл через 12–18 мес. после аборта (p = 0,009). Триглицериды в основной группе выросли на 30 % (с 1,60 ± 0,10 до 2,08 ± 0,21 ммоль/мл; p = 0,031), холестерин — на 16 % (c 4,22 ± 0,11 до 4,91 ± 0,20 ммоль/л; p = 0,009). Уровень глюкозы натощак за период наблюдения вырос на 18 % (с 4,49 ± 0,48 до 5,31 ± 0,64 ммоль/л; р = 0,029), а после глюкозотолерантного теста рост глюкозы сыворотки крови составил 37,4 % (с 6,71 ± 0,99 до 9,22 ± 1,34 ммоль/л; р = 0,012). В то же время снизился уровень ЛПВП на 13,2 % (с 1,44 ± 0,10 до 1,25 ± ± 0,14 ммоль/л; р = 0,040). Изменения показателей белкового обмена в основной группе также имели место, но были менее выражены. Выявлено снижение общего белка на 15,6 % (р = 0,038), среднего уровня мочевины (р = 0,031) и некоторое изменение соотношения «альбумины/глобулины» в пользу последних.
Происходящие изменения типичны для клиники МС. Гипопротеинемию можно объяснить микроальбуминурией, увеличение уровня мочевины связано с усиленным катаболизмом белка и активизацией глюконеогенеза, а увеличение содержания холестерина и триглицеридов является одним из основных диагностических критериев МС.
Беременность является особенным физиологическим состоянием, когда происходят специфические изменения в организме. Формирование доминанты беременности сопровождается изменением обмена веществ и гормональной перестройкой организма в виде угасания цикличности выработки половых гормонов и доминирования прогестерона, ЛГ и пролактина. Позже в организме перестраиваются биохимические регуляторные механизмы, обеспечивая гиповолемию и сопровождающую ее гипопротеинемию. Однако путем активизации регуляторных механизмов уровень глюкозы, холестерина и триглицеридов остается на прежних значениях, обеспечивая развивающемуся эмбриону адекватное поступление питательных веществ. Прерывание беременности приводит к дисбалансу гормонопродуцирующей функции, который в целом отражается на регуляции биохимических процессов в организме.
Другим вариантом возможной реализации МС после аборта может быть дисфункция гипоталамических структур. Известно, что гипоталамус является одной из важных структур, регулирующих пищевое поведение, терморегуляцию, психоэмоциональное состояние (мотивацию к двигательной активности). В гипоталамусе локализуются вазотономоторные центры, на уровне центральных нейротрансмиттеров регулируются основной обмен, водно-солевой и углеводный, белковый и жировой балансы и ряд других функций. При наличии совокупности факторов, предрасполагающих к МС, любое стрессовое воздействие может привести к дисбалансу регуляторных механизмов гипоталамуса и последующей реализации первоначально лабораторных симптомов, в дальнейшем — клинических проявлений и на заключительном этапе — к органной патологии.
Искусственный аборт следует отнести к одному из сильных стрессовых факторов, так как он сопровождается не только хирургической и психологической травмой, но и срывом филогенетически детерминированных механизмов обеспечения роста плода и прогрессирования беременности.
Оценка ситуативной и личностной тревожности у наблюдаемых женщин в динамике проспективного исследования. Незапланированное наступление беременности вызывает психоэмоциональные перегрузки как у самой женщины, так и у людей из ее близкого окружения. Перед супругами остро встает вопрос выбора: сохранить или прервать беременность. Ситуация осложняется ограниченностью в сроках решения вопроса. В этот период чаще всего обостряются «дремлющие» семейные конфликты, осложняются отношения с родителями, с коллегами и руководителем на работе. Как показывают многочисленные исследования, практически все женщины рассматривают вопрос возможного сохранения беременности — чему способствует природный инстинкт деторождения и продолжения человеческого рода. Однако в принятие решения включаются экономические, социальные, психологические факторы. Возникает проблема выбора, которая у нерешительных женщин может продолжаться довольно долго, затягивая состояние хронического стресса. Кроме сомнений при принятии решения об исходе беременности, в случае решения об аборте женщину начинает беспокоить страх перед предстоящей операцией, ее болезненности, возникают опасения по поводу адекватности обезболивания, осложнений во время выполнения операции, возможности наступления беременности в дальнейшем и т.п. Психоэмоциональные переживания женщин, поступивших на искусственное прерывание беременности, в настоящее время очень хорошо изучены.
Анализ данных анкетного исследования, проведенного накануне прерывания беременности, показал высокий уровень как ситуативной, так и личностной тревожности в обеих группах женщин. Разумеется, в этих цифрах нашли отражение переживания, сопровождающие принятие решения о прерывании беременности, и опасения за саму манипуляцию. Несмотря на то что уровень личностной тревожности является устойчивым и отражает степень предрасположенности субъекта к тревоге, в такой стрессовой ситуации, которой является аборт, ее балльные значения возрастают, как и значения ситуативной тревожности (СТ). Особенно высокий уровень личностной тревожности (ЛТ) был диагностирован у женщин высокого риска МС (53,1 ± 6,5 против 46,3 ± 5,4 балла в контроле; p < 0,05). В отдаленном периоде (после прерывания беременности и устранения стресса) показатели личностной и ситуативной тревожности снижаются и устанавливаются на постоянных, свойственных каждой пациентке значениях. В частности, диагностировано снижение ситуативной тревожности в обеих группах до равных значений в 30–36 баллов. В то же время на фоне общего значительного снижения уровня ЛТ по сравнению с исходными данными (p < 0,05) абсолютные значения у пациенток низкого риска МС на 12–18-м месяце были существенно ниже (29,9 ± 5,0 балла), чем в группе высокого риска (39,0 ± 5,9 балла; p < 0,05). Таким образом, если у здоровых женщин уровень ЛТ интерпретировался как низкий (снизился на 35,4 % от исходного), то у женщин с МС он твердо соответствовал средним значениям (снизился только на 26,6 %).
Полученные данные свидетельствуют о том, что у пациенток, склонных к реализации МС, имеется повышенный уровень ЛТ, они с большим негативом воспринимают окружающую действительность, предрасположены к раздражительности и переживаниям. У этих пациенток легко меняется настроение, отмечаются немотивированные волнения и ожидание неудачи. Таким женщинам менее свойственны чувство уверенности в себе, выдержка и уравновешенность. Перечисленные выше клинические характеристики отражают баланс взаимодействия нейротрансмиттеров в диэнцефальных структурах. Эмоциональные переживания, сопровождающиеся высоким уровнем ситуативной тревожности и ЛТ во время артифициального аборта, являются тем раздражителем, который вызывает сбой в регуляции нейрофизиологических механизмов в гипоталамусе и провоцирует развитие метаболических нарушений. Следовательно, одним из путей предупреждения нейроэндокринных нарушений после артифициального аборта является использование психотерапевтического и медикаментозного воздействия на пациентку, направленного на стабилизацию ее психоэмоциональной сферы.
У женщин, поступивших на прерывание беременности, активизируются как процессы перекисного окисления липидов (ПОЛ), так и антиоксидантная защита. Причем указанные изменения характерны для пациенток и высокого, и низкого риска развития МС. Через 12–18 месяцев после выполнения артифициального аборта в контрольной группе женщин уровень продуктов ПОЛ снижался (p < 0,05): малоновый диальдегид с 0,23 ± 0,08 до 0,14 ± 0,09 нмоль/мл, а диеновые конъюгаты — с 4,69 ± 1,52 до 3,00 ± 1,09 нмоль/мл. Диагностируемые показатели соответствовали аналогичным у здоровых небеременных женщин. У пациенток высокого риска развития МС уровень продуктов ПОЛ остался на прежнем уровне (малоновый диальдегид 0,28 ± ± 0,11 нмоль/л) или несколько увеличился (диеновые конъюгаты 5,40 ± 1,48 нмоль/мл) и был существенно выше, чем в контрольной группе (p < 0,05 и p < 0,01 соответственно). Определение уровня ферментов «защиты» от окислительных процессов выявило восстановление уровня каталазы и супероксиддисмутазы сыворотки крови женщин контрольной группы до уровня небеременных женщин. У женщин группы высокого риска развития МС уровень ферментов несколько (статистически в пределах погрешности) снизился, несмотря на рост продуктов ПОЛ. Так, каталаза снизилась с 62,03 ± ± 16,99 до 53,30 ± 16,81 нмоль/мл мин, а супероксиддисмутаза — с 1,55 ± 0,31 до 1,35 ± 0,29 усл.ед./мл. Установлено, что у пациенток группы высокого риска развития МС через 12–18 мес. после аборта не происходит полного восстановления показателей свободнорадикального окисления. Активность каталазы и супероксиддисмутазы у них аналогична обеим контрольным группам, а уровень продуктов окислительных реакций значительно больше.
В результате сравнения анализируемых показателей у женщин высокого и низкого риска реализации МС можно заключить, что реактивность организма женщин высокого риска реализации МС в ответ на прерывание беременности существенно отличается от реактивности здоровых пациенток. Реализация предрасположенности к метаболическим нарушениям в клиническую симптоматику и в системные нарушения происходит не всегда, а только при достаточно сильном воздействии одного или нескольких раздражителей при наличии сочетания наиболее значимых для реализации МС факторов. В этом плане артифициальный аборт, как стресс, занимает особое место.
Влияние прерывания беременности можно разбить на несколько составляющих. К ним относятся хирургическая травма, нейровегетативный стресс, гормональный стресс и оксидативный стресс. Одномоментное сочетание нескольких триггеров, сопровождающих артифициальный аборт, потенцирует свои негативные воздействия на организм пациентки. «Внешний» стресс организм «нейтрализует», исходя из особенностей адаптационных механизмов. При наличии у женщины нескольких взаимно отягощающих факторов, являющихся прогностически значимыми для реализации МС и описанных выше, происходит срыв адаптации. При их малочисленности или полном отсутствии можно прогнозировать благоприятное течение восстановительного послеабортного периода. Принимая во внимание, что аборт в этой ситуации является ведущим триггером метаболических дисфункций, сформировавшийся метаболический синдром после прерывания беременности можно назвать послеабортным метаболическим синдромом.
Опираясь на полученные результаты, следует сделать вывод, что для предупреждения реализации МС после аборта необходимо выделять группу женщин высокого риска развития МС, проводить им комплекс мероприятий, позволяющих снизить негативное воздействие стресса, а также принимать меры, повышающие устойчивость женщины к влиянию неблагоприятных факторов.
Анализ эффективности использования магнитолазеротерапии с целью профилактики развития метаболического синдрома после искусственного прерывания беременности. В настоящее время важная роль в лечении и реабилитации женщин, страдающих МС, отводится физиотерапевтическим методам, поскольку эффективность изолированной медикаментозной терапии ограничена, а использование поведенческой терапии требует больших эмоционально-волевых усилий. Физиотерапевтические методы производят непосредственный лечебный эффект, позволяют улучшить эмоциональный настрой, укрепить доминанту пищевого поведения и физически активного образа жизни. Одним из современных эффективных и неинвазивных методов является лазеротерапия. Многогранность механизмов действия, физиологичность на фоне незначительных побочных эффектов позволяют выделить этот метод как потенциально возможный при лечении больных с диэнцефальными нарушениями. Проведенное нами рандомизированное исследование позволило получить результаты, свидетельствующие о возможности практического применения метода в комплексной терапии.
Оценка эффективности изолированной магнитолазеротерапии в общей профилактике развития МС осуществлялась путем сравнения полученных показателей в группе высокого риска (между I и III группами), а также ее сочетания с комплексной терапией (между II и III группами). Для изучения степени влияния проводимого лечения на женщин группы низкого риска развития МС анализировались показатели IV и V групп. Изучаемые параметры регистрировались до и через 12–18 мес. после искусственного прерывания беременности. Установлено положительное влияние низкоэнергетического лазерного излучения (НИЛИ) на основной показатель «регулярность менструального цикла». Пациентки высокого риска развития МС, без профилактического лечения, на 53,3 % чаще стали отмечать нарушение менструального цикла после аборта (38,7 % женщин до и 92,0 % после аборта), на фоне изолированной магнитолазеротерапии подобные жалобы возросли только на 24,6 % (с 32,3 до 56,9 %), а у женщин, получавших комплекс профилактических мероприятий, нарушения менструального цикла возросли только на 11,6 % (с 36,2 до 47,8 %). Нами установлено, что через 12–18 мес. после аборта при использовании магнитолазеротерапии нарушения цикла беспокоят женщин на 38,2 % меньше, чем без лечения, а при комплексном лечении — на 48,0 %. На фоне проводимого лечения отмечается установление 28–30-дневного цикла, усреднение показателей продолжительности менструаций и нормализация объема теряемой при menses крови.
Терапевтический эффект магнитолазеротерапии выражен преимущественно при наличии исходно измененных диэнцефальных показателей, в частности, изменение показателей ДР в ходе лазеротерапии у женщин низкого риска МС было только на 12,1 и 1,7 %. Эффективность коррекции эмоционально-поведенческой сферы НИЛИ наглядна при анализе изменения показателей ситуативной и личностной тревожности. Установлено, что изолированная магнитолазеротерапия на 16,8 % уменьшает уровень СТ (30,2 ± 6,8 балла в I и 36,3 ± 7,1 балла в III группе, в то время как ее сочетание с традиционным лечением увеличивает СТ на 15,7 % по сравнению с III группой (42,0 ± 7,9 и 36,3 ± 7,1 балла во II и III группах соответственно), то есть магнитолазеротерапия более эффективно (p < 0,05) снижает уровень СТ, чем комплексное лечение. Рост перманентного уровня тревожности у пациенток II группы может быть вызван необходимостью длительного соблюдения диеты, обедненной углеводами и жирами, которая вызывает снижение базового уровня эндорфинов и энкефалинов и способствует невротическим расстройствам. Уровень ЛТ более стабилен, он менее подвержен влиянию изолированной лазеротерапии, а на фоне ее сочетания с редукционной диетой также отмечается тенденция к его возрастанию (40,1 ± 6,9 балла в I группе, 44,7 ± 7,2 — во II, 39,0 ± 5,9 — в III, 34,8 ± 6,2 — в IV, 29,9 ± 5,0 балла в V группе).
Положительное влияние магнитолазеротерапии на психоэмоциональную сферу видно на примере групп низкого риска развития МС. Нами установлено снижение СТ и ЛТ в IV группе на 7 и 7,5 % соответственно по сравнению с V группой. Полученные данные свидетельствуют о наличии выраженного суггестивного и опосредованного через нейромедиаторы воздействия НИЛИ на психику женщин.
Анализ лабораторных показателей позволил выявить снижение пролактина, ДЭА-S, повышение эстрадиола и прогестерона у женщин I группы (p < 0,05). Аналогичная, но более выраженная динамика выявлялась у женщин II группы. Различия между II и III группами по таким показателям, как ФСГ, ЛГ, пролактин, кортизол, дегидроэпиандростерон, выявлялись с p < 0,05; а по эстрадиолу и прогестерону — с p < 0,01. В гормональном профиле пациенток, получавших изолированную магнитолазеротерапию, в отличие от контрольных групп, имело место некоторое снижение эстрадиола и прогестерона (значительно меньшее, чем у женщин III группы), а показатели половых гормонов женщин, получавших комплексную профилактическую терапию, были аналогичными показателям пациентов низкого риска развития МС (IV и V группы). Полученные результаты свидетельствуют о том, что магнитолазеротерапия обладает выраженным фолликулопротективным воздействием, которое проявляется в росте уровня эстрадиола не только у женщин высокого риска развития МС, но и в контроле. Выраженность гормональных нарушений у пациенток наблюдаемых групп коррелирует с частотой диагностики ановуляции. Было установлено снижение частоты ановуляции с 96 % в III группе до 38,5 % в I группе и до 24,6 % во II группе, что является хорошим показателем, характеризующим положительное влияние магнитолазеротерапии на эндокринную функцию пациенток.
Резюмируя полученные данные и опираясь на описанные в научной литературе свойства лазера, следует выделить основные механизмы лечебного воздействия НИЛИ: улучшение микроциркуляции, нормализация уровня углеводов и липидов сыворотки крови, регуляция уровня половых гормонов крови, усиление основного обмена, активизация антиоксидантной ферментативной активности, устранение нейровегетативных расстройств и суггестивное воздействие.
В настоящее время осуществляется дальнейшее изучение лечебного воздействия данного физиотерапевтического метода, результатом которого является неуклонное расширение показаний для его использования. Проведенная по диагностическим критериям оценка клинической симптоматики позволила из всех наблюдаемых групп выделить пациенток, у которых сформировался МС после искусственного прерывания беременности. Нами установлено, что в III группе (группа высокого риска) МС развился на 12–18-м месяце у 67 из 75 пациенток (89,3 %). При использовании только магнитолазеротерапии (в I группе) из 65 человек патология выявлена у 39 (60,0 %), а на фоне комплексной профилактики (во II группе) — из 69 у 37 (53,6 %). В группе низкого риска метаболические нарушения развились только в 3 случаях, причем 1 — на фоне магнитолазеротерапии. Таким образом, использование магнитолазеротерапии позволяет почти на 1/3 снизить частоту реализации МС в послеабортном периоде (до 18 мес. наблюдения). Наиболее выраженный эффект отмечается при сочетании магнитолазеротерапии с традиционными мероприятиями, используемыми для лечения МС.
Комплексная программа прогнозирования и профилактики метаболических нарушений у женщин, осуществляющих искусственное прерывание беременности. На основании полученных результатов, подтверждающих влияние психического и оксидативного стресса на формирование послеабортных осложнений, и данных научной литературы нами предложен алгоритм ведения женщин, поступивших на прерывание беременности. Он предусматривает несколько этапов. Первоначально при обращении женщины в медицинское учреждение с целью прерывания беременности необходимо проведение консультации медицинского психолога. Как показывает зарубежный опыт, в 20–35 % случаев пациентки решают сохранить незапланированную беременность. Вторым этапом является беседа с акушером-гинекологом, в ходе которой собирается анамнез, осуществляется физикальное и клинико-лабораторное обследование, после чего пациентка относится к одной из групп риска:
1. Группа высокого риска развития воспалительных заболеваний.
В литературе описаны основные критерии, позволяющие отнести женщину к этой группе: в первую очередь это наличие очагов хронических инфекций, острых бактериальных и вирусных инфекций, заболеваний, передающихся половым путем, высокого инфекционного индекса, а также частых хирургических вмешательств и т.п.
2. Группа высокого риска развития нейроэндокринных нарушений.
Принадлежность пациенток к данной группе определяется по предложенной оригинальной математической модели (возможно использование компьютерной техники).
3. Группа низкой степени риска.
С учетом принципиальной роли микробного фактора и психического стресса перед операцией все пациентки проходят курс прединвазивной антибиотикопрофилактики в виде санации влагалища, седатации и психотерапии.
После выполнения артифициального аборта женщинам низкого риска развития осложнений осуществляются стандартные мероприятия в виде орального приема кровоостанавливающих средств (отвар крапивы), препаратов кальция, назначения оральных контрацептивов. Пациентам высокого риска развития воспалительных заболеваний органов малого таза (ВЗОМТ) кроме стандартных мероприятий рекомендуют принимать антибактериальные и противомикробные средства в течение 5–6 суток. Женщинам высокого риска развития метаболических и нейроэндокринных нарушений назначается комплексная профилактическая терапия, включающая в себя магнитолазеротерапию, прием седативных препаратов, антиоксидантов, редукционную диету, адекватный нагрузочный режим и поведенческую терапию. Если курс профилактических мероприятий по поводу ВЗОМТ можно ограничить ближайшим послеабортным периодом, после чего перевести женщин на традиционный режим диспансерного наблюдения, то профилактика метаболических нарушений должна осуществляться длительно, на протяжении 1–2 лет. На 12–24-м месяце наблюдения за пациентами необходимо выполнение им глюкозотолерантного теста, как наиболее показательного, недорогого и доступного метода диагностики МС. Если у женщин после прерывания беременности констатируются нарушения менструального цикла или прогрессивный набор веса, то сахарную нагрузку можно выполнить ранее 12 месяцев. При нормальных значениях глюкозы крови и отсутствии клинической симптоматики пациентка переводится на обычный режим диспансерного наблюдения, поскольку вероятность развития послеабортного МС через 1–2 года у нее снижается. При повышении уровня глюкозы, при наличии какой-либо другой клинической симптоматики следует более тщательно обследовать женщину, включая консультацию эндокринолога, для уточнения диагноза и выработки тактики ведения пациентки. Таким образом, использование предлагаемого алгоритма позволяет своевременно выявлять пациентов группы высокого риска, проводить им курсы профилактической терапии, что дает возможность предупреждать развитие как воспалительных заболеваний гениталий, так и манифестных форм МС после искусственного прерывания беременности.
Выводы
1. Проведенное ретроспективное клинико-статистическое исследование из 4 групп факторов (социально-бытовые, данные общего и акушерско-гинекологического анамнезов, результаты дополнительного обследования) позволяет выделить 77 параметров, имеющих существенное значение для развития МС после искусственного прерывания беременности. Многофакторный корреляционный анализ признаков, влияющих на реализацию предрасположенности к метаболическим нарушениям после артифициального аборта, свидетельствует об их неоднозначной диагностической ценности. Максимальный уровень значимости характерен для таких параметров, как нарушение менструальной функции до наступления беременности, изменения менструального цикла после родов, повышение уровня ЛГ, гирсутизм, количество родов больше 2, возраст менархе, инфекционные осложнения после родов, снижение уровня ФСГ, перенесенные операции, полосы растяжения.
2. Разработанная на основании ретроспективного исследования математическая модель дает возможность прогнозировать развитие МС. На основании проспективного наблюдения за женщинами высокого и низкого риска развития МС в течение 12–18 месяцев после аборта определена разнонаправленная динамика их клинико-лабораторных показателей. Установлено, что метаболические нарушения появляются только при наличии наследственно обусловленных и онтогенетически приобретенных предпосылок к их развитию.
3. Перед искусственным прерыванием беременности одинаково возрастает уровень СТ и ЛТ у пациенток как высокого, так и низкого риска развития МС. Для женщин высокого риска реализации МС характерно сохранение повышенного уровня личностной тревожности (на 10,9 балла больше группы низкого риска) в отдаленном периоде после прерывания беременности.
4. Использование магнитолазеротерапии по предлагаемой нами методике предупреждает развитие МС после искусственного прерывания беременности у 29,3 % женщин высокого риска его реализации. Сочетание магнитолазеротерапии с диетическим питанием, увеличением физической активности, приемом поливитаминов (антиоксидантов) и микроэлементов, а также другими физиопроцедурами предупреждает развитие метаболических нарушений после артифициального аборта у 35,7 % женщин высокого риска развития МС.
5. Предлагаемая алгоритмизация ведения женщин, поступивших на прерывание беременности, позволяет своевременно выявлять пациенток высокого риска развития осложнений после искусственного прерывания беременности, осуществлять динамическое наблюдение за ними, а также проводить адекватную профилактику с использованием преформированных физических факторов с целью снижения частоты реализации метаболических нарушений.
1. Макаров О.В. Артериальная гипертония у беременных. Только ли гестоз? / О.В. Макаров, Н.Н. Николаев, Е.В. Волкова. — М.: ГЭОТАР-Медиа, 2006. — 176 с.
2. Ушкалова Е.А. Лечение артериальной гипертонии во время беременности / Е.А. Ушкалова // Фарматека. — 2003. — № 11. — С. 27-32.
3. Гурьева В.М. Суточный мониторинг артериального давления и частоты сердечных сокращений при диагностике гестоза / В.М. Гурьева, Л.С. Логутова, В.А. Петрухин, Ю.Б. Котов // Российский вестник акушера-гинеколога. — 2003. — Т. 3, № 1. — С. 4-9.
4. Sibai B.M. Diagnosis and management of gestational hypertension and preeclampsia / B.M. Sibai // Obstet. Gynecol. — 2003. — Vol. 102. — P. 181-192.
5. Vigil-De Gracia P. Pregnancy and severe chronic hypertension: maternal outcome / P. Vigil-De Gracia, C. Montufar-Reuda, A. Smith // Hypertension Pregnancy. — 2004. — Vol. 23, № 3. — P. 285-293.
