Международный эндокринологический журнал 6 (38) 2011
Вернуться к номеру
Состояние сексуальной функции у молодых мужчин с гипотиреозом на фоне терапии L-тироксином
Авторы: Минухин А.С., Спивак Ж.С.1, Бондаренко В.А., Мирошниченко А.В.1, ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины», г. Харьков, 1КУ «Областной клинический перинатальный центр», г. Сумы
Рубрики: Эндокринология
Версия для печати
Изучено состояние сексуальной функции у молодых мужчин с гипотиреозом под влиянием терапии L-тироксином — препаратом, нормализующим тиреоидный статус, в течение шести месяцев. Показано, что данная терапия на фоне полной нормализации тиреоидного статуса и улучшения андрогенного статуса в большинстве случаев приводит к нормализации состояния сексуальной функции.
Сексуальная функция, гипотиреоз, L-тироксин, тиреоидный и андрогенный статус.
Проблема изучения мультиморбидной (коморбидной, сочетанной) патологии на сегодняшний день является одной из приоритетных в современной медицине. Под данным термином понимается сосуществование у одного человека двух и более заболеваний [1]. Ключевыми составляющими конструкта коморбидности являются пол и возраст [2].
По нашему мнению, недостаточно изученной проблемой медицины на сегодня являются сочетанные эндокринные и сексуальные расстройства у мужчин. Сложная организация сексуальной функции (СФ), обеспечение которой представляет собой систему комплексного взаимодействия психической, нервной, эндокринной и сосудистой системы, обусловливает необходимость всестороннего детального изучения ее состояния под влиянием, в частности, терапевтических схем.
Одной из форм эндокринопатий, являющихся причиной формирования сексуальных расстройств у мужчин, является гипотиреоз, который возникает вследствие частичной или полной потери функции щитовидной железы (ЩЖ) и действия тиреоидных гормонов (ТГ) на организм [3, 4].
По одной из известных типологий коморбидности данную форму взаимодействия можно представить как осложненную, т.е. возникновение сексуальной дисфункции (СД) у мужчин происходит преимущественно вследствие гипотиреоза [5].
Патогенетической основой клинических проявлений гипотиреоза является нарушение энергетического обмена вследствие недостаточности ТГ, что приводит к снижению основного обмена [3]. Распространенность манифестного гипотиреоза, характеризующегося специфическими клиническими и лабораторными проявлениями, а именно увеличением содержания в крови тиреотропного гормона (ТТГ) и снижением свободного тироксина (Т4своб.), в популяции составляет 0,2–2 % [6].
В то же время известно, что определенную роль в процессах дифференцировки клеток Лейдига, поддержании стероидогенеза и метаболических процессах, протекающих в яичках, играют ТГ, а гипотиреоз часто сочетается с гипоандрогенемией [7, 8]. В свою очередь, снижение уровней тестостерона, играющего ключевую роль в обеспечении СФ у мужчин, может приводить к формированию сексуальных расстройств [9].
Это подтверждается результатами проведенных многоцентровых исследований, в которых было показано, что более чем у половины мужчин с гипотиреозом отмечается СД [4].
Наши предыдущие исследования показали, что применение L-тироксина (левотироксина натрия) — препарата, нормализующего состояние тиреоидного статуса (ТС), в течение трех месяцев у мужчин с гипотиреозом приводит не только к его компенсации, но и способствует значительной активации инкреторной и сперматогенной функции яичек [10].
С учетом всего вышесказанного нами была поставлена цель: изучить динамику состояния СФ у мужчин с гипотиреозом под влиянием терапии L-тироксином на протяжении шести месяцев.
Материалы и методы
Под нашим наблюдением находились 20 мужчин в возрасте 21–38 лет с диагнозом «первичный гипотиреоз легкой и средней степени тяжести», которые в течение 6 месяцев получали терапию L-тироксином в дозе 50–75 мкг в сутки. Дозировка препарата во время лечения корректировалась в зависимости от компенсации ТС.
Для исключения сопутствующей патологии, приводящей к нарушению метаболизма тестостерона и формированию СД, нами был изучен андрологический статус по общепринятой методике [11].
До терапии и через 6 месяцев лечения мы исследовали состояние СФ на основании изученного анамнеза, жалоб, а также анализа полученных результатов опрос-ника «Международный индекс эректильной функции» (МИЭФ-15) [12]. Также была изучена динамика изменения уровней ТТГ, Т4своб и тестостерона в крови, которые определялись при помощи наборов для иммунофер-ментного анализа.
В качестве контрольной группы было обследовано 11 мужчин такой же возрастной группы с нормальным состоянием ТС.
Статистическую обработку полученных данных проводили с использованием t-критерия Стьюдента, корреляции Пирсона и метода c2.
Результаты исследования и их обсуждение
Проведенное клиническое исследование не выявило у пациентов гипогонадизма, травматических, воспалительных поражений половых органов, варикоцеле, сопутствующей соматической патологии, они не принимали известные лекарственные препараты, которые могли бы привести к нарушению метаболизма тестостерона [13]. Следует также отметить, что у мужчин не были обнаружены патология со стороны центральной нервной системы, психические заболевания, а также они не принимали лекарственные препараты, обладающие известным негативным влиянием на либидо и эректильную функцию (ЭФ) [14, 15].
Изучение динамики гормонального статуса на фоне терапии в течение шести месяцев позволило установить достоверную частоту нормализации уровней тестостерона (c2 = 10,23; р < 0,01). У 17 мужчин они соответствовали показателям нормы (> 12,0 нмоль/л), а у троих — пограничным величинам (8,0–12,0 нмоль/л), однако на данном этапе терапии были достоверно ниже, чем в контроле. Следует отметить, что данные изменения отмечались на фоне полной нормализации ТС и существенно не отличались от показателей контроля (табл. 1).
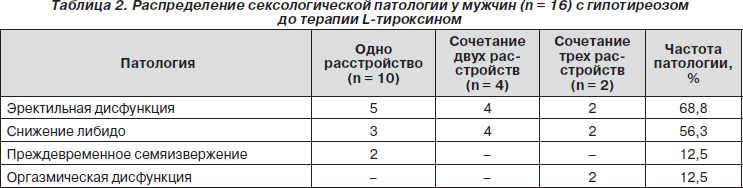
До терапии жалобы на наличие одного или нескольких сексуальных расстройств (эректильная дисфункция, снижение либидо (СЛ), прежде- временное семяизвержение (ПС) и оргазмическая дисфункция (ОД)) предъявляли 14 мужчин. Однако данные МИЭФ-15 и изучение продолжительности полового акта позволили установить ее еще у 2. Только одно расстройство отмечалось у 10 мужчин (у 5 была ЭД, у 3 — СЛ и у 2 — ПС). У 4 отмечалось сочетание ЭД и СЛ, еще у 2 — ЭД, СЛ и ОД (табл. 2).
Результаты, полученные с применением опрос-ника МИЭФ-15, позволили установить у 11 мужчин ту или иную степень ЭД (которую определяют как неспособность достигать и/или поддерживать эрекцию, достаточную для проведения полового акта, в том случае, если это расстройство наблюдается по крайней мере в течение 3 месяцев [16]), в зависимости от суммы баллов (1–5) и 15 вопросов: у 3 — легко-среднюю, у 7 — среднюю и у 1 — тяжелую. Следует отметить, что средняя и тяжелая форма расстройства отмечалась только в случае сочетания ее с другим(-ими) расстройством. СЛ (сумма баллов по двум соответствующим вопросам составила от 1 до 4) выступало как монопатология в трех случаях, а в 6 — сочеталось с другими расстройствами. ОД, которая проявлялась в виде задержанной эякуляции или полного ее отсутствия, оценивалась по результатам 9-го и 10-го вопросов, была выявлена у двоих мужчин, что отмечалось только в случаях сочетания трех расстройств и, по-видимому, свидетельствовало о более глубоком нарушении андрогенного обеспечения СФ, характерном, в частности, для мужчин с гипогонадизмом. Следует также отметить, что по результатам МИЭФ-15 у всех мужчин отсутствовало общее сексуальное удовлетворение и удовлетворение от полового акта (вопросы 13–14 и 6–8 соответственно).
Продолжительность полового акта менее одной минуты, что является диагностическим критерием ПС [17], отмечалась у двух мужчин как монопатология.
В контрольной группе у всех мужчин сумма баллов, характеризующих состояние ЭФ, была более 26, а являющихся оценочными для состояния либидо, оргазмической функции, удовлетворения от полового акта и общего сексуального удовлетворения — соответствовала показателям нормы.
В контрольной группе ни у одного из мужчин не отмечалось изменения продолжительности полового акта, и она составила 5–7 минут.
Спустя шесть месяцев после начала терапии полная нормализация состояния СФ отмечалась у 13 обследуемых (81,3 %), что подтвердилось результатами МИЭФ-15. У 3 мужчин (у двух из которых отмечалось сочетание трех расстройств) сохранились жалобы на ЭД, а у одного — на ПС, что, по-видимому, свидетельствует о наличии у них других причин формирования данных расстройств.
Результаты проведенного корреляционного анализа позволили установить следующие закономерности. Положительная корреляция отмечалась между суммой баллов МИЭФ-15 и уровнями тестостерона и Т4своб. (r = 0,54 и r = 0,49 соответственно; р < 0,05), а также тестостерона и Т4своб. (r = 0,72; р < 0,05). Обратная корреляция наблюдалась между показателем МИЭФ-15 и уровнем ТТГ (r = –0,61; р < 0,05), а также между уровнями тестостерона Т и Т4своб., тестостерона и ТТГ (r = –0,72 и r = –0,79 соответственно; р < 0,05).
Таким образом, проведенное исследование позволило сделать следующие выводы:
1. У большинства мужчин с гипотиреозом на фоне гипоандрогенемии отмечается одно или несколько сексуальных расстройств.
2. В большинстве случаев терапия L-тироксином, направленная на компенсацию тиреоидного статуса, приводит к нормализации состояния сексуальной функции у мужчин с гипотиреозом на фоне существенного улучшения состояния андрогенизации организма.
3. Необходимо дальнейшее изучение сексуальных расстройств у мужчин с учетом возможного влияния преимущественно бессимптомного течения субклинического гипотиреоза на состояние сексуальной функции у мужчин.
1. Van den Akker M., Buntinx F., Roos S. et al. Comorbidity or multimorbidity: what’s in a name? A review of the literature // Eur. J. Gen. Pract. — 1996. — Vol. 2. — P. 65-70.
2. Valderas J.S., Starfield B., Sibbald B. et al. Defining Comorbidity: Implications for Understanding Health and Health Services // Ann. Fam. Med. — 2009. — Vol. 7. — P. 357-363.
3. Ендокринологія / За ред. проф. П.М. Боднара. — Вінниця: Нова Книга, 2010. — 464 с.: іл.
4. Carani C., Isidori A.M., Granata A. et al. Multicenter study on the prevalence of sexual symptoms in male hypo- and hyperthyroid patients // J. Clin. Endocr. Metab. — 2005. — Vol. 90, № 12. — P. 6472-6479.
5. Белялов Ф.И. Двенадцать тезисов коморбидности // Клиническая медицина. — 2009. — № 12. — C. 69-71.
6. Фадеев В.В., Мельниченко Г.А. Гипотиреоз. Руководство для врачей. — М.: РКИ Соверо пресс, 2002. — 216 с.
7. Wagner M.S., Wajner S.M., Maia A.L. The role of thyroid hormone in testicular development and function // J. Endocrinol. — 2008. — Vol. 199, № 3. — P. 351-365.
8. Kumar A., Chaturvedi P.K., Mohanty B.P. Hypoandrogenaemia is associated with subclinical hypothyroidism in men // Int. J. Androl. — 2007. — Vol. 30, Issue 1. — P. 14-20.
9. Минухин А.С. Роль андрогенов в обеспечении сексуальной функции у мужчин // Пробл. эндокрин. патол. — 2010. — № 1. — С. 99-106.
10. Бондаренко В.А., Спивак Ж.С., Зубко М.И., Мирошниченко А.В. Особенности изменения инкреторной и сперматогенной функции семенников у мужчин, больных гипотиреозом, под влиянием терапии L-тироксином // Пробл. эндокрин. патол. — 2010. — № 2. — С. 55-58.
11. Демченко А.Н. Клиническая диагностика и терапия мужского препубертатного гипогонадизма: Метод. рекомендации. — Харьков, 2000. — 16 с.
12. Rosen R.C., Riley A., Wagner G. et al. The international index of erectile function (IIEF): a multidimensional scale for assessment of erectile dysfunction // Urology. — 1997. — Vol. 49. — P. 822-830.
13. Slag M., Morley J., Elson M. et al. Impotence in medical clinic outpatients // JAMA. — 1983. — Vol. 249, № 13. — P. 1736-1740.
14. Kandeel F.R., Koussa K.T., Swerdloff R.S. Male sexual function and its disorders: physiology, pathophysiology, clinical investigation and treatment // Endocr. Rev.— 2001.— Vol. 22, № 3.— P. 342-388.
15. Thomas J.A. Pharmacological Aspects of Erectile Dysfunction // Jpn J. Pharmacol. — 2002. — Vol. 89, № 2. — P. 101-112.
16. NIH Consensus development panel on impotence // JAMA. — 1993. — Vol. 270, № 1. — P. 83–90.
17. McMahon C.G., Althof S., Waldinger M.D. et al. Premature Ejaculation // BJU Int. — 2008. — Vol. 102, № 3. — P. 338-350.