Международный эндокринологический журнал 6 (38) 2011
Вернуться к номеру
Предикторная информативность депрессивной симптоматики при сахарном диабете и кардиоваскулярные последствия ее коррекции с помощью а-липоевой кислоты
Авторы: Колядич М.И., Кафедра пропедевтики внутренних болезней с курсом введения в клиническую медицину государственного образовательного учреждения высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию», Россия
Рубрики: Эндокринология
Версия для печати
Введение
Сахарный диабет (СД) относится к числу наиболее распространенных хронических неинфекционных заболеваний и характеризуется угрожающей тенденцией к непрерывному увеличению числа больных [1]. Медико-социальная значимость проблемы СД обусловлена прогредиентным течением этого заболевания и неизбежным развитием его поздних осложнений, носящих полиорганный характер и обусловливающих полиморбидность и высокую смертность пациентов [2].
К числу наиболее часто встречающихся поздних осложнений СД относятся диабетические нейро- и ангиопатии [3], которые тесно связаны с поражениями сердечно-сосудистой системы (ССС), особенно при СД 2-го типа. Невзирая на непрерывный прогресс подходов к лечению кардиоваскулярной патологии при СД, данная проблема далека от удовлетворительного решения [4]. Это свидетельствует о необходимости изыскания новых подходов к раннему выявлению и последующей эффективной коррекции кардиоваскулярных осложнений СД и сопутствующих ему заболеваний.
Одним из таких подходов может явиться дифференцированная оценка аффективного статуса пациентов, расстройства которого у больных СД встречаются значительно чаще, чем в общей популяции. Известно, что интегральные показатели тяжести СД-ассоциированной депрессии нарастают по мере развития макроангиопатических осложнений основного заболевания. Необходимо добавить, что депрессивные расстройства при СД зачастую не достигают психопатологической завершенности и носят субсиндромальный характер [5], что не позволяет сформулировать соответствующий диагноз по критериям МКБ-10 и DSM-IV, тогда как их частота может достигать 66–81 %.
Дифференцированный анализ депрессивной симптоматики у больных СД может оказаться информативным подходом к выявлению не только кардиоваскулярной патологии, но и поражений других органов и систем. Известно, что само по себе развитие СД не связано с риском депрессии. Однако постепенное формирование разнородных поздних осложнений этого заболевания закономерно влечет за собой развитие аффективных расстройств. Данная закономерность иллюстрирует перспективу рассмотрения отдельных симптомов депрессии в качестве предикторов поздних осложнений СД и сопутствующих ему заболеваний.
Необходимо отметить, что депрессивные расстройства при СД во многом развиваются в рамках нежелательных побочных действий комплексного лечения этого заболевания. Особенно ярко это положение проявляется при инсулинотерапии СД 2-го типа. Установлено, что препараты инсулина в условиях инсулинорезистентности у больных СД 2-го типа способствуют эскалации аффективных и когнитивных расстройств. Кроме того, лекарственные средства (ЛС), широко применяемые для лечения сердечно-сосудистых осложнений СД (b-адреноблокаторы, антагонисты кальция, статины), также способствуют развитию депрессивных расстройств. Данное обстоятельство иллюстрирует целесообразность совершенствования схем комплексного лечения СД за счет использования ЛС, одновременно обладающих позитивными органотропным и тимоаналептическим эффектами.
К числу таких ЛС относятся препараты a-липоевой кислоты (a-ЛК), продемонстрировавшие свою высокую эффективность в лечении нейропатических осложнений СД. Заслуживают внимания также данные экспериментальных исследований, которые продемонстрировали способность a-ЛК корригировать нарушения аффективного статуса и метаболизма у лабораторных животных с аллоксановым диабетом. Не исключено, что курсовое применение a-ЛК с использованием общепринятой разовой дозировки 600 мг может оказаться эффективным подходом к одновременной коррекции аффективного статуса, метаболизма и состояния ССС у больных СД. Справедливость такой постановки вопроса иллюстрируется общеизвестной связью между расстройствами эмоционального статуса и нарушениями вегетативной регуляции ССС.
Таким образом, анализ данных современной литературы, касающихся проблемы СД-коморбидной депрессии и подходов к ее медикаментозной коррекции, иллюстрирует целесообразность детального анализа предикторной информативности депрессивной симптоматики в отношении конкретных форм органной патологии при СД. Первоочередного внимания заслуживает посимптомный анализ динамики депрессивных расстройств в сопоставлении с выраженностью клинических проявлений поздних осложнений СД в процессе лечения a-ЛК.
Цель исследования: изучить предикторную информативность проявлений депрессии у больных СД в отношении висцеральной патологии и кардиоваскулярных расстройств, а также оценить возможности их коррекции с помощью a-липоевой кислоты в сопоставлении с особенностями влияния этого лекарственного средства на депрессивную симптоматику.
Материалы и методы исследования
Выполненное исследование характеризовалось двухкомпонентным дизайном. На первом этапе, соответствующем дизайну срезового исследования, проводилось сопоставление клинических, лабораторных, инструментальных и аффектологических характеристик больных СД со значимой депрессивной симптоматикой и без нее по типу «случай — контроль» (Р. Флетчер и др., 1998). Второй этап работы был выполнен по дизайну краткосрочного проспективного рандомизированного плацебо-контролируемого простого слепого исследования влияния a-ЛК на структуру депрессивной симптоматики, состояние углеводного и липидного обмена, систему «перекисное окисление липидов — антиоксидантная защита» (ПОЛ — АОЗ), структурно-функциональные характеристики сердца и вегетологический статус больных СД.
a-ЛК применялась в дозах, рекомендуемых для использования в неврологической, кардиологической и диабетологической практике. Суточная и курсовая дозы составляли 600 мг и 8400 мг соответственно. Длительность курсового применения — 14 дней.
В исследование было включено 92 больных СД. Отбор больных для исследования осуществлялся в соответствии с клиническими критериями включения и исключения.
Критерии включения: СД 1-го типа — E10; СД 2-го типа — E11.
Критерии исключения: беременность; острые осложнения СД; острые инфекционные заболевания; острый коронарный синдром; острые нарушения церебрального кровообращения; ишемическая форма синдрома диабетической стопы; диабетическая нефропатия с хронической почечной недостаточностью (ХПН); лечение препаратами ацетилцистеина и токоферола.
В соответствии с двухкомпонентным дизайном исследования на первом этапе, соответствующем дизайну срезового исследования, пациентов распределяли на две группы в зависимости от наличия клинически значимой депрессивной симптоматики, с изучением основных клинико-анамнестических показателей (по данным медицинской документации), структурно-функциональных характеристик сердечной деятельности, состояния вегетативной регуляции ССС, выраженности тревоги и клинико-лабораторных параметров углеводного и липидного обмена, а также состояния системы ПОЛ — АОЗ в каждой группе, с последующим межгрупповым сопоставлением полученных данных. На втором этапе исследования на основе случайного отбора, осуществляемого с помощью процедуры динамической (альтернативной) рандомизации пациентов, больные были распределены на группы, сопоставимые по возрасту, клинико-анамнестическим и гендерным характеристикам, показателям аффективного статуса, а также по частоте назначения средств базисной терапии. В процессе выполнения второго этапа работы из исследования выбыли четверо пациентов, оставшиеся 88 больных СД завершили второй этап и были включены в анализ эффективности ЛС.
Больным 1-й группы дополнительно к препаратам базисной терапии проводили ежедневное внутривенное капельное введение 200 мл поляризующей смеси (10 мл 4% раствора калия хлорида, 10 мл раствора панангина, 4 единицы инсулина в 200 мл 5% раствора глюкозы). Данное воздействие рассматривалось как активная плацебо-терапия. Больным 2-й группы ежедневно вводили 600 мг a-ЛК, разведенной в 200 мл 0,9% раствора хлорида натрия. Длительность инфузионной терапии во всех группах составила 14 дней.
На первом этапе исследования (за день до начала лечения) и по истечении 14 дней (в завершение второго этапа работы) у больных проводили квантифицированную оценку выраженности тревоги, депрессии и ее отдельных симптомов, метаболических показателей компенсации СД, липидемии и состояния системы ПОЛ — АОЗ, вегетологического статуса и структурно-функциональных характеристик сердечной деятельности.
Изучение аффективных расстройств проводили с помощью опросника депрессии Бека (ОДБ) (А.Н. Белова, О.Н. Щепетова, 2002). В соответствии с рекомендациями R.R. Rubin et al. (2005) критерием развития депрессии считали суммарный балл по ОДБ ≥ 11. Выраженность тревоги оценивали с помощью шкалы самооценки тревоги Цунга (ШТЦ) (А.Н. Белова, О.Н. Щепетова, 2002).
Уровень метаболической компенсации СД оценивали по содержанию гликозилированного гемоглобина и циркулирующего фруктозамина, отражающих интенсивность неферментативного гликозилирования белков (В.В. Меньшиков и др., 1987), а также по показателям суточного профиля гликемии с регистрацией сахара крови в 8.00, 11.00, 13.00, 15.00, 18.00, 20.00, 22.00 и в 7.00 утра следующего дня.
О состоянии липидного обмена судили по содержанию общего холестерина (ОХС) и триглицеридов в сыворотке крови, а также по унифицированным показателям липопротеинового распределения холестерина (холестерин липопротеинов высокой плотности (ХС ЛПВП), холестерин липопротеинов низкой плотности (ХС ЛПНП), холестерин липопротеинов очень низкой плотности) и величине индекса атерогенности [(ОХС – ХС ЛПВП) / ХС ЛПВП] (А.Н. Климов, Н.Г. Никульчева, 1995).
Уровень продуктов ПОЛ в сыворотке крови определяли спектрофотометрически с раздельной регистрацией липопероксидов в гептановой и изопропанольной фазах липидного экстракта (И.А. Волчегорский и др., 1989). Результаты выражали в единицах индексов окисления — E232/E220 (относительное содержание диеновых конъюгат) и E278/E220 (уровень кетодиенов и сопряженных триенов).
О состоянии АОЗ судили по содержанию a-токоферола (a-ТК) и церулоплазмина (ЦП) в сыворотке крови. Концентрацию a-ТК определяли с использованием реактива Эмери — Энгеля и поправкой на оптическое поглощение каротинов (В.В. Спиричев и др., 1979). Уровень ЦП регистрировали модифицированным методом Ревина (В.Г. Колб, В.С. Камышников, 1976).
Структурно-функциональные показатели деятельности сердца регистрировали с помощью ЭКГ (с количественной оценкой изучаемых параметров во втором стандартном отведении) и эхокардиографического исследования (ЭхоКГ) с измерениями в двумерном и М-режимах из левого парастернального и верхушечного доступов. Состояние вегетативной регуляции ССС оценивали в соответствии с рекомендациями согласительного консенсуса конференции в Сан-Антонио (American Diabetes Association: Proceedings of a consensus development conference on standardized measures in diabetic neuropathy, 1992). О выраженности парасимпатических (вагусных) влияний на сердце судили по вариабельности сердечного ритма (СР) при выполнении пробы с заданным ритмом дыхания (6 дыханий в минуту). Результат выражали в виде отношения наибольшего значения интервала R-R на выдохе к его наименьшей величине на вдохе (E/I). Вариабельность СР оценивали сразу после активного перехода из горизонтального положения в вертикальное. Результат выражали в виде соотношения длительности 30-го и 15-го интервалов R-R (отношение 30/15). Для квантификации парасимпатического компонента кардиоваскулярной автономной дисфункции (КАД) использовали порядковую шкалу G. Jermendy et al. (1994), в соответствии с которой нормальные показатели E/I (≥ 1,21), 30/15 (≥ 1,04) оценивали 0 баллов, пограничные значения E/I (1,10–1,20), 30/15 (1,00–1,03) — 1 баллом, а патологические величины E/I (< 1,10) и 30/15 (< 1,00) — 2 баллами (G. Jermendy et al., 1994). Аналогичный подход применялся для квантификации симпатического компонента КАД, о выраженности которого судили по снижению систолического и диастолического артериального давления (САД и ДАД соответственно) в течение 3 минут после перехода в вертикальное положение тела при проведении пробы Шеллонга. Постуральное падение САД и ДАД менее чем на 10 мм рт.ст. оценивали 0 баллов, пограничное снижение САД (10–29 мм рт.ст.) — 1 баллом, проявления ортостатической гипотензии по уменьшению САД ≥ 30 мм рт.ст. или ДАД ≥ 10 мм рт.ст. — 2 баллами (А. Vinik et al., 2003). Одновременное снижение САД и ДАД до уровня гипотензии оценивали 4 баллами. C целью интегральной самооценки вегетативного статуса пациенты применяли опросник вегетативных расстройств (ОПВР) (А.М. Вейн, 2001).
Статистический анализ полученных данных проводился с использованием пакета прикладных программ SPSS-13.0. На первом этапе исследования сопоставлялись группы пациентов в зависимости от наличия клинически значимой депрессивной симптоматики. Межгрупповые сопоставления по качественным (номинальным) показателям выполнялись с помощью точного критерия Фишера (ТКФ). Анализ предикторной информативности депрессивной симптоматики осуществляли путем расчета отношения правдоподобия (ОП) и его 95% доверительного интервала (95% ДИ). Количественные (интервальные) и порядковые (ординальные) данные обработаны методами дескриптивной статистики и представлены в виде средней арифметической и ее стандартной ошибки (M ± m). Межгрупповые сопоставления проводили с помощью U-критерия Манна — Уитни. В начале второго этапа исследования изучалась исходная сопоставимость групп, сформированных с помощью процедуры динамической рандомизации для плацебо-контролируемого изучения терапевтической эффективности a-ЛК. Исходную сопоставимость групп по номинальным показателям оценивали с помощью c2-критерия Пирсона. Для изучения межгрупповых различий на заключительном этапе исследования применяли ТКФ. Для оценки исходной сопоставимости сформированных групп по интервальным и ординальным показателям применяли критерий множественных сравнений Краскела — Уоллиса. Анализ динамики изучаемых показателей в каждой группе проводился с помощью парного критерия Вилкоксона, предназначенного для суждения о значимости различий в связанных выборках. О достоверности межгрупповых различий на заключительном этапе исследования судили по U-критерию Манна — Уитни. Изучение статистических взаимосвязей проводили путем расчета коэффициентов корреляции Спирмена (rs). Проверка статистических гипотез выполнялась при критическом уровне p = 0,05.
Результаты исследования и их обсуждение
Все пациенты, включенные в исследование, страдали дистальной симметричной сенсомоторной полинейропатией, которая в большинстве случаев сопровождалась энцефалопатией смешанного (дисциркуляторно-метаболического) типа, артериальной гипертензией (АГ) и катарактой.
В результате проведенного исследования было установлено, что практически 3/4 больных, включенных в исследование, характеризовались наличием значимых депрессивных расстройств (ОДБ ≥ 11), выраженность которых в 47,8 % случаев укладывалась в диапазон от среднетяжелой до тяжелой депрессии (ОДБ ≥ 17) (R.R. Rubin et al., 2004). Наиболее частое развитие СД-коморбидной депрессии отмечалось у женщин, 85 % которых характеризовалось наличием значимой депрессивной симптоматики. Соответствующий показатель у пациентов мужского пола оказался в 1,7 раза ниже и составил 50 % (р = 0,001). Наиболее часто проявления депрессии отмечались у больных СД 2-го типа (81 %). Данный показатель превышал соответствующую величину для больных СД 1-го типа (55 %) в 1,47 раза (р = 0,013). Наличие значимых проявлений депрессии существенно зависело от возраста пациентов и длительности течения СД. Средний возраст больных с оценкой по ОДБ ≥ 11 составил 58,6 ± 1,4 года, что достоверно превысило соответствующий показатель больных с ОДБ < 11 (51,6 ± 2,5 года; р = 0,006). Продолжительность СД у пациентов с проявлениями депрессии составила 14,2 ± 1,0 года и была достоверно выше длительности этого заболевания при отсутствии депрессии (9,8 ± 1,2 года; р = 0,014).
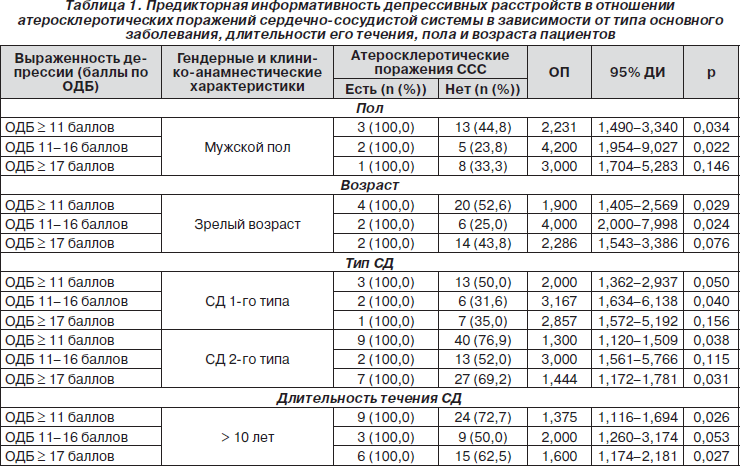
В процессе сравнительного анализа частоты встречаемости поздних осложнений СД и сопутствующих заболеваний у пациентов с оценкой по ОДБ ≥ 11 и больных без депрессии была выявлена достоверная взаимосвязь между наличием клинически значимой депрессивной симптоматики и признаками атеросклеротического поражения ССС. Атеросклеротические поражения периферических сосудов и клапанов сердца были выявлены у 12 пациентов (18,5 % случаев) с признаками депрессии и не наблюдались при показателях ОДБ < 11 (р = 0,032). Частота встречаемости остальных осложнений СД и сопутствующих заболеваний в интегральной совокупности больных, включенных в исследование, не зависела от оценки по ОДБ. С учетом известных особенностей клинического течения СД у больных в зависимости от их возраста, типа основного заболевания и длительности его течения нами было проведено целенаправленное изучение связи депрессивной симптоматики с наличием поздних осложнений СД и сопутствующих заболеваний у пациентов с различными гендерными и клинико-анамнестическими характеристиками (табл. 1).
Данный раздел анализа позволил установить, что депрессию следует рассматривать как клинический предиктор атеросклеротического процесса в первую очередь у пациентов мужского пола, зрелых возрастных групп, страдающих преимущественно СД 1-го типа.
Использованный в исследовании инструмент квантифицированного учета депрессивной симптоматики (ОДБ) наряду с общим показателем тяжести аффективных расстройств позволяет проводить раздельную оценку выраженности 21 категории симптомов и жалоб, наиболее важных для клинической характеристики депрессивных расстройств. В процессе анализа полученных данных было установлено, что предикторная информативность аффективных расстройств в отношении атеросклеротических поражений ССС при СД обусловлена наличием таких симптомов депрессии, как неудовлетворенность, идеи самообвинения, утрата работоспособности и охваченность телесными ощущениями.
Самым информативным оказался показатель идеи самообвинения, для которого было установлено наиболее высокое значение ОП в отношении атеросклеротических поражений ССС.
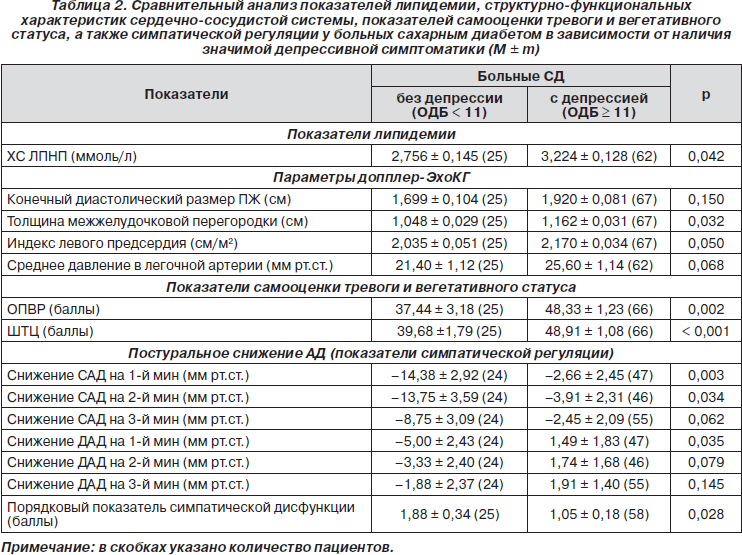
Отдельного внимания заслуживает детальный анализ структурно-функциональных особенностей ССС, ее вегетативной регуляции, а также показателей липидемии у больных с СД-коморбидной депрессией (табл. 2). Анализ полученных данных позволил выявить признаки ремоделирования миокарда у больных СД с клинически значимой депрессивной симптоматикой. Это проявилось достоверным увеличением толщины межжелудочковой перегородки с одновременным нарастанием индекса левого предсердия (ИЛП). Стоит добавить, что в подгруппе из 44 больных со среднетяжелой и тяжелой депрессией (ОДБ ≥ 17) наряду с увеличением ИЛП до 2,197 ± 0,045 см/м2 (р = 0,035) был отмечен значимый прирост давления в легочной артерии (ЛА) до 26,750 ± 1,379 мм рт.ст. (р = 0,021) с одновременным нарастанием показателя конечного диастолического размера правого желудочка (ПЖ) до 2,038 ± 0,101 см (р = 0,046) по сравнению с аналогичными показателями больных без депрессии (табл. 2).
Совокупность отмеченных сдвигов позволяет считать, что нарастание тяжести депрессии отражает субклиническое формирование диастолической дисфункции, ранние этапы развития которой связаны с увеличением размера левого предсердия и последующими нарушениями транспульмонального кровотока. Такие сдвиги характерны для диабетической кардиомиопатии, вызывающей ремоделирование миокарда и застойную сердечную недостаточность даже при отсутствии АГ и ишемической болезни сердца (ИБС) (S. Hayat et al., 2004).
Отдельного внимания заслуживает анализ взаимосвязей между значимой депрессивной симптоматикой и проявлениями КАД. Невзирая на отсутствие межгрупповых различий по параметрам вагусной регуляции СР, наличие депрессии существенно отразилось на выраженности симпатического компонента КАД. Как видно из табл. 2, постуральное снижение артериального давления у пациентов без депрессии соответствовало диапазону пограничных значений и свидетельствовало о склонности к ортостатической гипотензии. Показатели ортостатического снижения АД у больных с депрессией, наоборот, соответствовали норме. Кроме того, была выявлена отрицательная корреляция между выраженностью депрессивной симптоматики и порядковым показателем симпатического компонента КАД (rs = -0,233; р = 0,034). Вполне возможно, что нарастание тревоги на фоне депрессии у больных СД способствует усилению симпатических вазоконстрикторных влияний и за счет этого уменьшает постуральное снижение АД, о чем свидетельствует прямая корреляция показателей тревоги по ШТЦ с величинами ДАД (rs = 0,240; р = 0,027) в интегральной совокупности обследованных пациентов. Полученные результаты иллюстрируют определенную компенсаторную роль аффективных нарушений, препятствующих прогрессированию симпатической дисфункции и за счет этого снижающих риск ортостатической гипотензии у больных СД.
Межгрупповые сопоставления по клинико-биохимическим параметрам позволили выявить единственную особенность у больных СД с сопутствующей депрессией. Это касалось большей выраженности дислипидемических расстройств и проявилось значимым нарастанием уровня ХС ЛПНП. Установленный факт хорошо согласуется с ранее установленной предикторной информативностью СД-ассоциированной депрессии в отношении атеросклеротических поражений ССС.
Таким образом, значимая депрессивная симптоматика у больных СД связана с наличием атерогенных дислипидемических расстройств, ремоделированием миокарда и бессимптомным формированием диастолической дисфункции. Одновременно проявления СД-коморбидной депрессии свидетельствуют об устойчивости пациентов к развитию ортостатической гипотензии.
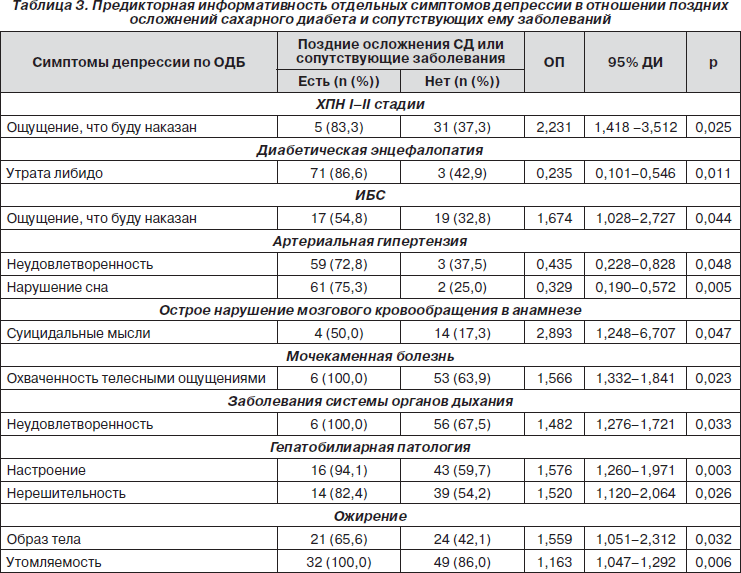
Особого внимания заслуживает анализ предикторной информативности отдельных симптомов депрессии безотносительно к ее тяжести и синдромальной завершенности у больных СД. Как видно из табл. 3, наличие ощущения, что буду наказан, свидетельствовало об ИБС и ХПН I–II стадий. Гипотимия и нерешительность оказались достоверными предикторами гепатобилиарной патологии. Искаженное восприятие образа тела и утомляемость были прямо связаны с наличием ожирения. Охваченность телесными ощущениями сопутствовала мочекаменной болезни, а проявления неудовлетворенности отмечались при заболеваниях органов системы дыхания. В ряде случаев достоверная взаимосвязь между симптомами депрессии и СД-ассоциированной патологией характеризовалась достоверным ОП отрицательного результата < 1. Это следует расценивать как проявление прямой связи между депрессивной симптоматикой и полиорганными расстройствами у больных СД. Такая связь была обнаружена между неудовлетворенностью и нарушением сна при артериальной гипертензии, а также между утратой либидо и диабетической энцефалопатией. Полученные результаты свидетельствуют о том, что детальный анализ отдельных симптомов депрессии является более информативным подходом к выявлению СД-коморбидных заболеваний и поздних осложнений СД в сравнении с анализом тяжести депрессии по интегральному показателю ОДБ.
Дифференцированный скрининг депрессивных расстройств в зависимости от пола и возраста пациентов, а также типа СД и его длительности позволяет получить дополнительную детализированную информацию о наличии сопутствующих заболеваний. Клинически значимая депрессивная симптоматика у больных зрелого возраста, страдающих СД 1-го типа, отражает высокую вероятность заболеваний системы органов дыхания. Проявления депрессии у пациентов мужского пола с длительностью течения СД не более 10 лет отражают высокую вероятность остеохондроза позвоночника.
Полученные результаты иллюстрируют целесообразность динамической оценки аффективного статуса больных СД с помощью ОДБ. Такое расширение стандарта обследования может оказаться полезным для выбора оптимальной тактики инструментального и лабораторного выявления наиболее вероятных поздних осложнений СД и сопутствующих ему заболеваний.
Нами было проведено изучение влияния a-ЛК на показатели аффективного статуса, состояние ССС, параметры компенсации СД, липидемию и состояние системы ПОЛ — АОЗ. По данным М.Н. Алексеева (2009), a-ЛК проявляет статистически незначимую тенденцию к уменьшению тяжести СД-ассоциированной депрессии. У экспериментальных животных с аллоксановым диабетом a-ЛК оказывает отчетливое антидепрессивное действие (И.А. Волчегорский и др., 2009, 2010).
В процессе анализа влияния a-ЛК на динамику квантифицированных проявлений депрессии в группе активной плацебо-терапии было установлено снижение интегрального показателя ОДБ от исходного уровня (р = 0,012).
Детальный анализ динамики отдельных симптомов депрессии показал, что улучшение аффективного статуса больных было обусловлено значимым изменением всего двух составляющих шкалы ОДБ — нарушения настроения (р = 0,020) и утраты аппетита (р = 0,034). Анализ динамики проявлений тревоги в группе активной плацебо-терапии продемонстрировал существенную редукцию всех параметров ШТЦ. Это касалось интегрального показателя ШТЦ (р < 0,001), проявлений психической (р = 0,001) и соматической (р = 0,001) тревоги. Полученные данные являются наглядной иллюстрацией клинической эффективности базисного лечения пациентов, проведенного в соответствии с действующим федеральным стандартом.
Для оценки влияния 14-дневного курса лечения a-ЛК (600 мг/сут в/в) на динамику проявлений депрессии использовался подход, рекомендованный A. Ametov (2003) и D. Zeigler (2006), который основывается на анализе величины сдвига квантифицированных показателей симптомов по сравнению с исходным уровнем. В результате было установлено, что использование a-ЛК оказало отчетливое позитивное влияние на динамику чувства вины.
Известная роль аффективных расстройств в развитии структурно-функциональных нарушений ССС позволяет предположить, что позитивное влияние a-ЛК на динамику симптомов депрессии может привести к снижению выраженности кардиоваскулярных расстройств у больных СД. Нами было установлено, что уменьшение депрессивного чувства вины под действием a-ЛК связано с равновыраженным уменьшением длительности интервала QTn.
Применение a-ЛК дополнительно продемонстрировало способность уменьшать склонность пациентов к постуральной гипотензии. Это проявилось значимым уменьшением порядкового показателя симпатической дисфункции (0,68 ± 0,24 балла) как по сравнению с исходным показателем в соответствующей группе (1,16 ± 0,32 балла; р = 0,047), так и относительно конечного значения в группе активной плацебо-терапии (1,480 ± 0,294 балла; р = 0,023).
a-ЛК дополнительно корригировала проявления диастолической дисфункции миокарда и способствовала нормализации транспульмонального кровотока. Это проявилось снижением давления в ЛА и нарастанием конечного диастолического размера ПЖ. Установленные факты свидетельствуют об увеличении диастолической релаксации ПЖ под действием a-ЛК, что способствует оптимизации транспульмонального кровотока, проявляющейся снижением давления в ЛА. Справедливость этого положения иллюстрирует отрицательная корреляция величин давления в ЛА с показателями конечного диастолического размера ПЖ в интегральной совокупности больных на заключительном этапе исследования (rs = -0,233; р = 0,036). Кроме того, двухнедельное применение a-ЛК способствовало снижению гликемии в одной из точек суточного профиля (на 13.00), значения которой (6,65 ± 0,62 ммоль/л) оказались существенно ниже исходных величин (8,74 ± 0,59 ммоль/л; р = 0,035) и соответствующих значений в группе активной плацебо-терапии на заключительном этапе исследования (7,87 ± 0,36 ммоль/л; р = 0,05).
В целом полученные результаты свидетельствуют о том, что особенности влияния a-ЛК на динамику отдельных проявлений депрессии связаны с избирательностью корригирующего влияния этого ЛС на состояние ССС, особенности вегетативной регуляции и метаболические расстройства при СД.
Целесообразно включить в стандарты оказания помощи больным сахарным диабетом динамическую квантифицированную оценку симптомов депрессии с помощью шкалы депрессии Бека, использование которой не требует специальной предварительной подготовки и может быть осуществлено терапевтом, кардиологом или эндокринологом без привлечения психиатра. Подобное расширение существующего стандарта позволяет получить дополнительную детализированную информацию о наличии поздних осложнений сахарного диабета и сопутствующих ему заболеваний. Кроме того, целесообразно включить в схему комплексного лечения больных сахарным диабетом курсовое двухнедельное применение a-ЛК (600 мг/сут). Такая модификация действующего стандарта терапии позволяет рассчитывать на снижение депрессивного чувства вины с параллельным уменьшением длительности интервала QTn, уменьшение склонности пациентов к постуральной гипотензии и коррекцию проявлений диастолической дисфункции миокарда с нормализацией транспульмонального кровотока.
Выводы
1. Депрессивные расстройства, сопутствующие сахарному диабету, наиболее часто развиваются у больных пожилого и старческого возраста, преимущественно женского пола, при 2-м типе основного заболевания и его длительности свыше 10 лет.
2. В недифференцированной по возрасту, полу, типу и длительности сахарного диабета совокупности больных значимая депрессивная симптоматика отражает повышенную вероятность атеросклеротических поражений периферических артерий и клапанов сердца. Данная закономерность наиболее ярко проявляется при сахарном диабете 1-го типа у пациентов зрелого возраста, преимущественно мужского пола. Предикторная информативность аффективных расстройств в отношении атеросклеротических поражений сердечно-сосудистой системы при сахарном диабете обусловлена наличием таких симптомов депрессии, как неудовлетворенность, идеи самообвинения, утрата работоспособности и охваченность телесными ощущениями.
3. Значимая депрессивная симптоматика у больных сахарным диабетом связана с наличием атерогенных дислипидемических расстройств, ремоделированием миокарда и бессимптомным формированием диастолической дисфункции. Одновременно проявления депрессии, коморбидной сахарному диабету, свидетельствуют об устойчивости пациентов к развитию ортостатической гипотензии.
4. Безотносительно к синдромальной завершенности и тяжести депрессии ее отдельные симптомы являются значимыми предикторами поздних осложнений сахарного диабета и сопутствующих ему заболеваний. Это касается предчувствия наказания при ишемической болезни сердца и хронической почечной недостаточности I–II стадии; утомляемости и искаженного образа тела при ожирении; утраты либидо при диабетической энцефалопатии; неудовлетворенности и нарушений сна при артериальной гипертензии; охваченности телесными ощущениями при мочекаменной болезни; а также гипотимии и нерешительности при гепатобилиарной патологии (желчнокаменной болезни, хроническом холецистите, жировом гепатозе, стеатогепатите).
5. Двухнедельное курсовое применение a-липоевой кислоты (600 мг/сут в/в) в рамках комплексного лечения больных сахарным диабетом приводит к равновыраженному снижению депрессивного чувства вины.
6. Позитивное влияние a-липоевой кислоты на динамику депрессивного чувства вины связано с равновыраженным уменьшением длительности интервала QTn, a-липоевая кислота корригирует проявления диастолической дисфункции миокарда, способствует нормализации транспульмонального кровотока и уменьшает гликемию в одной из точек суточного профиля (на 13.00).
1. Singh U., Jialal I. Alpha-lipoic acid supplementation and diabetes // Nutr. Rev. — 2008. — Vol. 66, № 11. — P. 646-657.
2. Волчегорский И.А., Алексеев М.Н., Волчегорская М.И., Рассохина Л.М. Влияние a-липоевой кислоты и мексидола на нейро- и аффективный статус больных с начальными стадиями синдрома диабетической стопы // Клиническая медицина. — 2008. — № 10. — С. 52-59.
3. Колядич М.И., Шапошник И.И. Кардиоваскулярные и метаболические расстройства у больных сахарным диабетом с сопутствующей депрессией // Клиническая медицина. — 2011. — № 2. — С. 35-40.
4. Salinthone S., Yadav V., Bourdette D.N., Carr D.W. Lipoic acid: a novel therapeutic approach for multiple sclerosis and other chronic inflammatory diseases of the CNS // Endocr. Metab. Immune Disord. Drug Targets. — 2008. — Vol. 8, № 2. — P. 132-142.
5. Maczurek A., Hager K., Kenklies M. et al. Lipoic acid as an anti-inflammatory and neuroprotective treatment for Alzheimer’ disease // Adv. Drug Deliv. Rev. — 2008. — Vol. 60, № 13–14. — P. 1463-1470.