Международный эндокринологический журнал 7 (39) 2011
Вернуться к номеру
Роль сочетанного применения витаминов-антиоксидантов с каберголином в нормализации про- и антиоксидантной системы у больных с неактивной аденомой гипофиза
Авторы: Исмаилов С.И., Халимова З.Ю., Холова Д.Ш., Специализированный научно-практический медицинский центр эндокринологии Республики Узбекистан, г. Ташкент
Рубрики: Эндокринология
Версия для печати
У обследованных 64 больных неактивной аденомой гипофиза с интраселлярным ростом установлено, что антиоксиданты триовит и аевит повышают фармакотерапевтический эффект каберголина, назначаемого в дозах от 0,25 до 0,5 мг/сут 2 раза в неделю курсом до 60 суток.
Неактивная аденома гипофиза, каберголин, про- и антиоксидантная система, витамины-антиоксиданты.
Введение
Патогенез, ранняя доклиническая диагностика, прогнозирование и лечение неактивной аденомы гипофиза (НАГ) остаются нерешенными проблемами в современной нейроэндокринологии [8, 11]. НАГ чаще встречается у больных с микропролактинемией (МП), которая, по данным ряда авторов, составляет в общей популяции 0,1–0,2 % [4, 20]. При этом у 10 % здоровых людей с МП томографически определяются аденомы гипофиза [5, 13, 17]. Доброкачественные опухоли аденогипофиза составляют 15 % от всех внутричерепных новообразований. На аутопсии аденомы гипофиза обнаруживают у 10–20 % умерших от не связанных с поражением гипофиза болезней. А диагноз НАГ верифицируется в 25–30 % случаев всех опухолей гипофиза [6, 8].
Важную роль в развитии аденом гипофиза, как показывает литература последних лет, играют такие местные ростовые факторы, как сосудистый эндотелиальный ростовой фактор (СЭРФ), эпидермальный фактор роста (ЭФР), провоспалительные цитокины — интерлейкин-1, интерлейкин-6 [13, 17]. Есть мнение, что влияние ростовых факторов на клетки осуществляется через трансмембранные рецепторы [1]. Факторы роста конт-ролируют генную экспрессию, детерминацию и пролиферацию клеток гипофиза. Гиперэкспрессия ростовых факторов может приводить к неконтролируемому размножению кортикотрофов и одновременно снижать продукцию и функциональную активность антипролиферативных факторов (кортикотропинингибирующий фактор, соматостатин и дофамин) [19].
Важное место СЭРФ занимает в повышении проницаемости сосудов за счет их расширения (активируя NO-синтазу в эндотелии), способствует миграции клеток и угнетает апоптоз эндотелия [1, 16]. Вместе с тем аналогичными и даже более агрессивными свойствами обладают биологически активные соединения, образующиеся в результате интенсификации свободнорадикального окисления (СРО). С усилением СРО связано повреждение белков, липидов, ДНК, развитие мутагенеза и новообразований, гормональных нарушений и многих эндокринных заболеваний [7, 14]. Интенсификация СРО является важным условием инициации процессов перекисного окисления липидов (ПОЛ) и связанного с этим повреждения мембран, их проницаемости, снижения чувствительности рецепторных мембран, ферментативной инактивации медиаторов и нарушения способности рецепторов связывать биологически активные вещества и фармакологические препараты, что приводит к развитию толерантности к их лечебному действию [9]. Активация СРО и ПОЛ является следствием усиленного образования активных форм кислорода — супероксидного анион-радикала (О2–) и оксида азота (NO–), а также потенциальных эндогенных прооксидантов (таких как пероксид водорода — Н2О2, гипохлорная кислота — HCClO, пероксинитрит — ONOO–, гидроперикись липида — LOOH) и органических свободных радикалов (прежде всего радикалов ненасыщенных липидов — L–, LO2–, LO–) [10]. В тканях организма этим процессам противостоит многокомпонентная антиоксидантная система (АОС), ограничивающая возможность их неблагоприятных эффектов [9,10]. К числу наиболее важных звеньев АОС относят ферменты: супероксиддисмутазу (СОД), детоксицирующий супероксид-анион, каталазу (КТ) — гемсодержащий фермент, катализирующий реакцию разложения Н2О2, глутатионпероксидазу (ГП), также участвующий в разложении Н2О2 и других гидроперекисей посредством окисления глутатиона (GSH), глутатионредуктазу (ГР) — фермент, который катализирует восстановление ГП [2, 16].
Для повышения антиоксидантной активности назначают витамины-антиоксиданты, чаще всего a-токоферол (витамин E), b-каротин (провитамин А) и аскорбиновую кислоту (витамин C). В последние годы широкое применение приобрел комплексный препарат триовит фирмы KRKA (Словения), включающий витамины-антиоксиданты Е, С, А, а также антиоксидантный элемент селен [3, 9, 12]. Влияние витаминов-антиоксидантов на процессы ПОЛ — АОС при лечении больных НАГ практически не изучено. При лечении НАГ препаратом выбора является агонист дофамина — каберголин (достинекс) [8, 17]. Эффективность лечебного эффекта каберголина может достигать 80 % и значительно зависит от дозы препарата. При увеличении дозы каберголина увеличивается развитие токсических и побочных эффектов, что является важным фактором снижения эффективности лечения и проведения терапии другими препаратами, которые также обладают этими свойствами [6, 18]. Все это обусловливает поиск новых подходов к решению проблемы лечения больных НАГ.
Исходя из вышеизложенного, целью настоящей работы была попытка оценить особенности изменения системы ПОЛ — АОС в крови при терапии больных НАГ каберголином в комплексе с витаминами-антиоксидантами.
Материалы и методы
В обследование включено 64 больных с МРТ-подтвержденной микроаденомой гипофиза (26 мужчин и 38 женщин) в возрасте от 20 до 55 лет (средний возраст 43,60 ± 3,84 года). Длительность заболевания с момента установления диагноза составляет от 1 до 15 лет (медиана 9,3 ± 1,6 года). В первую группу вошли 22 больных НАГ, которым назначали в курс лечения в начальной дозе 0,25 мг дважды в неделю, а затем 0,5 мг 2 раза в неделю в течение 60 суток препарат каберголин; во вторую — 21 больной, которому наряду с каберголином назначали препарат аевит, содержащий витамины А и Е, по 1–2 капсулы в сутки в течение 30 дней с перерывом 10 дней и повторным приемом его в течение 20 суток; третью группу составил 21 больной НАГ, получавший препарат каберголин в комбинации с препаратом триовит по 1–2 капсулы в сутки в течение 30 дней с перерывом 10 дней и повторным приемом его в течение 20 суток. Сроки проведения курса лечения до 50–60 суток обусловлены тем, что каберголин в дозах 0,25 и 0,5 мг/сут 2 раза в неделю курсом до 60 суток является наиболее оптимальным сроком для уменьшения объема опухоли и снижения уровня пролактина.
Объектом исследования служила сыворотка крови, взятая у больных натощак при поступлении и после завершения курса лечения. В сыворотке крови определяли уровень гормонов: пролактина (ПРЛ), лютеинизирующего (ЛГ), фолликулостимулирующего (ФСГ), которые определяли радиоиммунным методом на радиометре Rabbita (Австрия) с использованием стандартных коммерческих наборов фирмы Immunotech (Чехия). Одно- временно в сыворотке крови определяли состояние СРО и ПОЛ по содержанию продуктов хемилюминесценции (ХЛ) на хемилюминометре ХЛМ1Ц-01 по П.В. Серге-еву и соавт. (1982), диенокитонов (ДК232) и малонового диальдегида (МДА) — по Ю.А. Владимирову и А.И. Арчакову (1972). Активность АОС оценивали по ферментам СОД — по Е.Е. Дубининой и соавт. (1983), КТ — по М.А. Королюк и соавт. (1988), ГП и ГР — по Э.М. Микаелян и соавт. (1979). Для сравнения биохимических параметров крови нами проведены исследования у 20 практически здоровых лиц сопоставимого возраста (медиана 42,60 ± 2,93) — 10 мужчин и 10 женщин (дали устное согласие на проведение обследования), у которых при МРТ-исследовании отсутствовали изменения со стороны гипоталамо-гипофизарной области, а при оценке уровня ПРЛ крови его содержание было в пределах границ нормы.
Полученные данные обрабатывали статистически на персональном компьютере с помощью программного пакета Microsoft Office Excel-2003, включая использование встроенных функций статистической обработки. Использовались методы вариационной параметрической и непараметрической статистики с расчетом средней арифметической изучаемого показателя (M), среднего квадратического отклонения (s), стандартной ошибки среднего (m), относительных величин (частота, %); статистическая значимость полученных измерений при сравнении средних величин определялась по критерию c2 и Стьюдента (t) с вычислением вероятности ошибки (Р) при проверке нормальности распределения (по критерию эксцесса) и равенства генеральных дисперсий (F — критерий Фишера). За статистически значимые изменения принимали уровень достоверности р < 0,05, силу связи между показателями и ее направленность выражали через коэффициент ранговой корреляции Спирмена.
Результаты исследования и их обсуждение
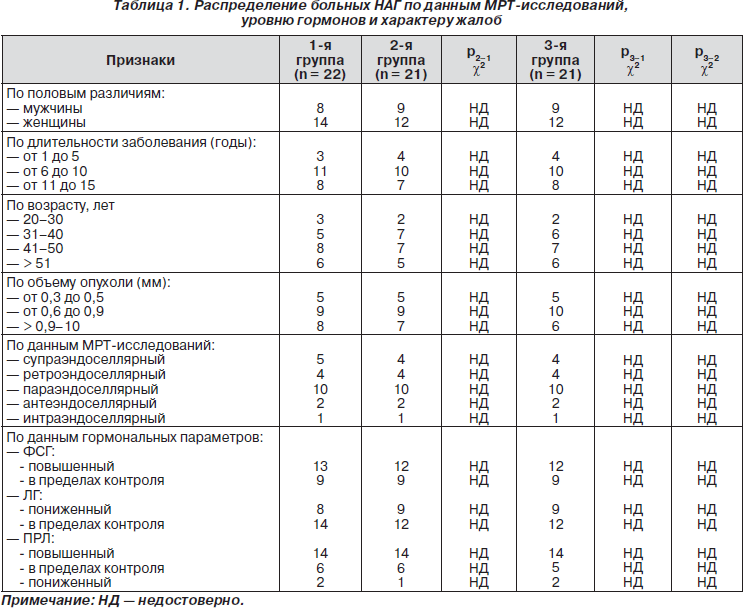
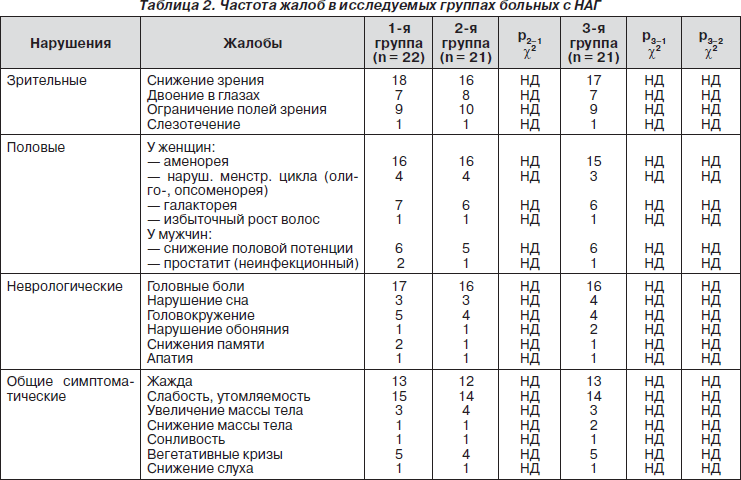
Основываясь на МРТ-исследованиях, у всех 64 больных НАГ выявлены эндоселлярные микроаденомы размером до 1 см, в том числе у 15 (23,4 %) — от 0,3 до 0,5 мм, у 28 (43,7 %) — от 0,6 до 0,9 мм и у 21 (32,8 %) — от 0,9 до 10 мм. Супра- и ретроселлярный рост выявлен в основном у мужчин — 23 случая (35,9 %) и у 2 женщин (3,1 %), параселлярный — у 30 (46,9 %), в том числе у 2 мужчин и 28 женщин, интраселлярный рост НАГ отмечен у 9 (14,1 %) женщин. При анализе гормональных параметров установлено, что повышенный уровень ПРЛ был выявлен у 42 (65,6 %) пациентов, на уровне конт-рольных значений — у 17 (26,6 %) и пониженный — у 5 (7,8 %). Уровень ФСГ был повышен у 37 (57,8 %) пациентов, в пределах контроля — у 27 (42,2 %), ЛГ пониженный — у 26 (40,6 %), в пределах контроля — у 38 (59,4 %) (табл. 1). Важные клинические признаки были связаны со зрительными, половыми, неврологическими и общими симптомами заболевания НАГ (табл. 2). Из приведенных данных в табл. 1 и 2 следует, что группы больных были сформированы методом случайного отбора, по данным МРТ-исследований и идентичных жалоб.
Исследования показали, что до проводимой терапии средние показатели гормонов при оценке уровня их в крови превышали данные в контроле: ФСГ — на 83,3 %, ПРЛ — на 111 %, ЛГ — на 6,2 % (р < 0,05). До проводимой терапии у больных НАГ отмечается высокий уровень первичных, вторичных и конечных продуктов ПОЛ. Так, концентрация ХЛ в крови больных НАГ превышала контроль в среднем на 47,2 %, ДК232 — на 44,3 %, МДА — на 48,1 %. Одновременно были повышены показатели АОС крови. Так, активность СОД превышала контрольные данные на 37,3 %, КТ — на 43,7 %, ГП и ГР — на 33,6 и 41,8 % соответственно.
Таким образом, проведенные исследования показали, что в крови больных НАГ наряду с гормональными нарушениями отмечаются существенные сдвиги в активности систем ПОЛ — АОС. Выявленное повышение активности ферментов АОС в крови больных НАГ нами расценивается как адекватная реакция этой системы на интенсификацию ПОЛ, вместе с тем интенсификация ПОЛ и высокая активность ферментов АОС — как состояние напряжения в окислительно-восстановительных системах, что может стать основной причиной срыва компенсаторных механизмов, особенно в органах-мишенях, поврежденных патологическим процессом.
Следует отметить, что высокое напряжение в системах ПОЛ — АОС является главной причиной дестабилизации мембран, мембраносвязанных ферментативных комплексов, участвующих в синтетических процессах, в том числе гормонов. В связи с этим можно предположить, что высокое напряжение в системе ПОЛ — АОС может быть одним из ключевых факторов увеличения в крови больных НАГ стероидных гормонов, в том числе ФСГ и ПРЛ. Чтобы подтвердить данную гипотезу, нами проведен корреляционный анализ между гормональными показателями и параметрами ПОЛ — АОС. Установлено, что только параметры ПОЛ — ХЛ, ДК232 и МДА были напрямую связаны с показателем ПРЛ: r = 0,86; 0,75 и 0,91 (р < 0,001; р < 0,01 и р < 0,001).
Следовательно, можно полагать, что среди важных причин нарушений гормонального баланса в организме больных НАГ является интенсификация ПОЛ. Все это послужило основанием для введения в курс общепринятой терапии больным с НАГ витаминов-антиоксидантов.
Как показали результаты исследований, витамины-антиоксиданты повышают эффективность традиционной терапии, что характеризовалось наряду с улучшением зрительных, половых, неврологических и общих симптоматических функций в первой группе у 13 (59,1 %) лиц, во второй и третьей группах — соответственно у 15 (71,4 %) и 20 (95,2 %) пациентов позитивными сдвигами в гормональном статусе больных с НАГ. При оценке показателей ПОЛ — АОС имелась тенденция к их улучшению в первой и второй группах, а в третьей они почти полностью соответствовали контрольным данным. Следует указать, что снижение показателя ПРЛ и параметров ПОЛ, скорее всего, было основной причиной улучшения клинического течения заболевания, о чем свидетельствует отсутствие корреляции (r = 0,13-0,17) между ними в конце курса лечения. Важно подчеркнуть, что во второй группе отчетливое снижение интенсивности ПОЛ в основном происходило за счет позитивных сдвигов ферментов АОС — СОД и КТ, тогда как в третьей группе за счет всех изучаемых ее звеньев — СОД, КТ, ГП и ГР.
Следовательно, комплексный препарат триовит способствует максимальной мобилизации компенсаторных антиоксидантных систем организма и, как следствие, снижению интенсивности ПОЛ в организме больных НАГ. С этим, вероятно, связано более выраженное исчезновение симптомов и жалоб заболевания, нормализация гормональных показателей крови.
Выводы
1. У больных НАГ важными факторами развития клинических симптомов заболевания и жалоб являются некомпенсированная высокая активность ферментов АОС — СОД, КТ, ГП и ГР, интенсификация ПОЛ.
2. Интенсификация ПОЛ, обусловленная параметрами ХЛ, ДК232 и МДА, коррелирует с высоким показателем гормона ПРЛ.
3. Полная компенсация интенсивности процессов ПОЛ, активности ферментов АОС, повышение эффективности лечения наблюдаются лишь в группе больных НАГ, которым в терапию наряду с каберголином назначали препарат триовит.
1. Бабичев В.Н., Марова Е.И., Федотчева Т.А., Шимановский Н.Л. // Пробл. эндокринол. — 2009. — Т. 55, № 4. — С. 34-36.
2. Голиков А.П., Бойцов А.П., Михин В.П. и др. // Лечащий врач. — 2003. — № 4. — С. 70-73.
3. Гончарова Е.В., Говорин А.В. // Клин. мед. — 2008. — № 2. — С. 26-30.
4. Губина Е.В., Шипилов А.А. // Пробл. эндокринол. — 2008. — Т. 54, № 1. — С. 20-23.
5. Дедов И.И., Мельниченко С.А., Романцева Т.И. Синдром гиперпролактинемии. — М., 2004.
6. Дзеранова Л.К., Гончаров Н.П., Добрачева А.Д. и др. // Пробл. эндокринол. — 2008. — Т. 54, № 1. — С. 24-28.
7. Зенков Н.К., Ланкин В.З., Меньщикова Е.Б. Окислительный стресс. Биохимические и патофизиологические аспекты. — М., 2001.
8. Кадашев Б.А. Аденомы гипофиза. Клиника, диагностика, лечение. — М., 2007.
9. Ланкин В.З., Тихазе А.К., Коновалова Г.Г. и др. // Тер. арх. — 2004. — № 8. — С. 10-15.
10. Ланкин В.З., Тихазе А.К., Каминский А.И., Беленков Ю.Н. // Патогенез. — 2004. — Т. 2, № 1. — С. 71-86.
11. Лапшина А.М., Абросимов А.Ю., Марова Е.И. // Пробл. эндокринол. — 2008. — Т. 54, № 4. — С. 49-54.
12. Лебедев А.Г. // Акуш. и гинекол. — 2004. — № 1. — С. 16-20.
13. Марова Е.И., Дзеранова Л.К., Воронцов А.В. и др. // Пробл. эндокринол. — 2008. — Т. 54, № 5. — С. 20-26.
14. Петухов В.И., Павлов Б.Н. // Тер.арх. — 2002. — № 12. — С. 100-104.
15. Amadori P., Dilberis C., Marcolla A. // Eur. J. Endocrinol. — 2003. — Vol. 150. — P. 1-3.
16. Fukai T., Folz P.I., Landmesser U., Harison D.G. // Cardio-vasc. Res. — 2002. — Vol. 55. — P. 239-249.
17.Glezer A., D’Alva C.B., Salgado L.R. // Clin. Endocrinol. (Oxford). — 2002. — Vol. 57. — P. 135-139.
18. Marcello D., Shlomo M. // Arq. Brasil. Endocrinol. Metab. — 2005. — Vol. 49, № 5. — P. 135-139.
19. Moreno-Fernanser J., Vazques-Maetines R., Duran-Prado M. et al. // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91, № 6. — P. 2225-2231.
20.Yuen Y.P., Lai J.P., Au K.M. et al. // Hong Kong Med. J. — 2003. — Vol. 9. — P. 119-121.