Международный эндокринологический журнал 7 (39) 2011
Вернуться к номеру
Акромегалия: особенности клинической картины, осложнений, эффективность различных методов лечения
Авторы: Молитвословова Н.Н., ФГУ Эндокринологический научный центр Минздравсоцразвития РФ
Рубрики: Эндокринология
Версия для печати
Введение
Акромегалия является тяжелым нейроэндокринным заболеванием, обусловленным хронической гиперпродукцией соматотропного гормона (СТГ) у лиц с завершенным физиологическим ростом, и проявляется патологическим диспропорциональным периостальным ростом костносуставного аппарата, мягких тканей, внутренних органов, а также нарушением функционального состояния сердечнососудистой, легочной системы, различных видов метаболизма, периферических эндокринных желез. Причиной заболевания в подавляющем большинстве случаев является гормональноактивная опухоль гипофиза (соматотропинома) [1]. При отсутствии своевременного и адекватного лечения прогрессирование заболевания приводит к стойкой инвалидизации и значительному сокращению продолжительности жизни. Смертность среди больных с акромегалией в 10 раз выше, чем в общей популяции, и около половины пациентов, которым не оказана своевременная медицинская помощь, умирают, не дожив до 50 лет. Основными причинами, приводящими к такому исходу, являются поражения сердечнососудистой системы и различных видов метаболизма [2]. В связи с этим всем пациентам с верифицированным диагнозом, даже в случаях мягкого проявления данного заболевания, необходимо назначение максимально раннего и активного (по международной терминологии — «агрессивного») лечения. Это предполагает устранение клинических симптомов заболевания, нормализацию секреции СТГ и инсулиноподобного ростового фактора 1го типа (ИРФ1), ликвидацию источника избыточной продукции СТГ. Главные цели лечения — достижение стойкой ремиссии заболевания и контроль над размерами опухоли гипофиза. Важными условиями адекватного лечения являются максимальная безопасность и комфортность для пациента. Конечным итогом проводимого лечения становится оптимизация качества жизни больного.
За последнее десятилетие во многих странах мира были сформированы и сейчас успешно поддерживаются национальные регистры больных различными социально значимыми заболеваниями, в частности акромегалией, позволяющие обеспечить доступность квалифицированной медицинской помощи для всех пациентов, независимо от их материального положения и удаленности места проживания [3]. В России в 2003 году было положено начало созданию Московского регистра больных акромегалией. С января 2005 года начал работу Единый российский регистр. Однако до настоящего времени отсутствует комплексный анализ созданного регистра, в частности данные о распространенности акромегалии на территории Российской Федерации, демографических и клиникогормональных характеристиках выявленных пациентов, сведения о доступности современных методов обследования и лечения.
Введение в 2000 году в практику строгих международных критериев ремиссии заболевания показало, что задача радикального лечения акромегалии до сих пор полностью не решена. В большинстве работ, посвященных изучению факторов неблагоприятного прогноза после транссфеноидальной аденомэктомии, к их числу относят размер, характер роста и инвазию опухоли, оцениваемые с помощью МРТ либо непосредственно во время удаления аденомы (A. Kazunori, 2010). Однако только дополнительное иммуногистохимическое исследование удаленной опухолевой ткани в комплексе с гормональными показателями может дать полную информацию о прогнозе биологического поведения опухоли, что, в свою очередь, позволит определить оптимальную тактику ведения больных акромегалией после транссфеноидальной аденомэктомии.
Несмотря на большое количество работ, посвященных оценке результатов различных видов лучевой терапии, отсутствуют данные об эффективности такого вида узкофокусированного метода, как протонотерапия, при длительных сроках наблюдения за больными (до 20 лет) и использовании его в качестве метода первичной терапии.
В связи с необходимостью проведения дополнительной терапии с целью достижения полной ремиссии заболевания после хирургического и/или лучевого лечения, а также наличием немалого количества больных, для которых невозможно осуществление данных видов лечения ввиду наличия абсолютных либо относительных противопоказаний, все большее значение приобретает медикаментозная терапия акромегалии. Исследования последних лет направлены на разработку патогенетической медикаментозной терапии, определение показаний к применению последней в качестве средства первичной терапии.
В последние годы при лечении акромегалии активно используются длительно действующие аналоги соматостатина [4, 5]. Несмотря на достаточно длительный период применения этих препаратов за рубежом, в России отсутствует анализ эффективности и безопасности длительно действующих аналогов соматостатина при продолжительном назначении, не разработаны оптимальные дозы и сроки терапии. Не определены возможности применения данных препаратов в качестве средств первичной терапии, когда имеются противопоказания к хирургическому и лучевому лечению. Остаются неизвестными механизмы антипролиферативного эффекта данной группы препаратов в отношении опухоли гипофиза.
Таким образом, комплексное изучение распространенности данного заболевания, особенностей клинических проявлений, факторов риска развития различных осложнений акромегалии, а также оценка эффективности различных методов лечения и выявление прогностических факторов позволят разработать оптимальный алгоритм ведения больных с данной тяжелой патологией.
Цель исследования: оценка особенностей клинических проявлений акромегалии, эффективности и безопас ности различных методов лечения на основе комплексного клиникогормонального и инструментального обследования, включая иммуногистохимический и морфологический анализ опухолей гипофиза, изучение факторов, определяющих послеоперационный прогноз; разработка оптимального лечебного алгоритма.
Материалы и методы исследования
Объект исследования: 733 больных акромегалией женщин и мужчин в активной стадии заболевания, а также 2480 регистрационных карт больных.
Физикальное обследование: анализ жалоб, анамнеза заболевания и жизни, клинический осмотр, антропометрия, осмотр специалистами (офтальмолог с осмотром глазного дна и периметрией, кардиолог, гинеколог/андролог, невролог).
Лабораторное обследование:
1. Исследование в крови уровней гипофизарных гормонов (СТГ на фоне ОГТТ, ЛГ, ФСГ, ТТГ, ПРЛ), ИРФ1, эстрадиола, общего тестостерона, св. Т4 с помощью метода усиленной люминесценции (автоматический анализатор Vitros фирмы Jonson and Jonson), с использованием систем Delfia. Концентрации ИРИ и Спептида в сыворотке определялись радиоиммунологическим методом. Уровень лептина сыворотки определялся высокочувствительным иммуноферментным набором DSL1023100.
2. Исследование ткани удаленных аденом с помощью рутинного гистологического и иммуногистохимического метода на парафиновых срезах с применением авидинстрептавидинпероксидазной системы визуализации, не содержащей биотин, с использованием поликлональных антител к СТГ, ПРЛ, а также моноклональных антител к ЛГ, ФСГ, маркеру пролиферации Ki67, факторам ангиогенеза CD31 и VEGF.
Инструментальное обследование: ЭКГ, суточное мониторирование ЭКГ (по Холтеру) и АД (СМАД), эхокардиография.
ЭКГ покоя регистрировалась в 12 стандартных отведениях и трех корригированных ортогональных отведениях по Франку с построением ВКГ и дипольной электрокардиотопограммы. Суточное мониторирование ЭКГ проводилось прибором ИКАР21.
СМАД проводилось аппаратами системы SpaseLabs Medical (модель 90207). Артериальная гипертензия (АГ) по данным СМАД диагностировалась в случае, если хотя бы одно из средних значений АД у больного превышало следующие цифры: АДд ≥ 140/90 мм рт.ст., АДн ≥ 125/75 мм рт.ст., АД24 ≥ 135/85 мм рт.ст., где АДд, АДн и АД24 — уровни АД за дневной, ночной и суточный периоды соответственно.
Суточный ритм АД оценивался по показателю степени ночного снижения АД (СНС АД, %) для САД и ДАД, который рассчитывался по формуле: СНС АД = (АДд – –АДн)/АДд • 100 %, где АДд и АДн — уровни САД и ДАД за дневной и ночной периоды соответственно.
Эхокардиографическое исследование выполнялось на аппарате Acuson 128 XP/10М (США). Протокол обследования включал в себя сканирование сердца в двумерном, Ммодальном, допплеровском импульсном, постоянноволновом и цветном режимах. Измерение толщины стенок и размеров полостей сердца в фазы систолы и диастолы проводилось согласно рекомендациям Американского комитета экспертов по эхокардиографии.
Масса миокарда левого желудочка (ММЛЖ, г) рассчитывалась по формуле Devereux R.B.: ММЛЖ = = 1,04 • ((КДР + ТЗСЛЖ + ТМЖП)3 – (КДР)3) – 13,6, где КДР — конечнодиастолический размер ЛЖ, ТЗСЛЖ — толщина задней стенки ЛЖ, ТМЖП — толщина межжелудочковой перегородки. Индекс массы миокарда левого желудочка (ИММЛЖ, г/м2) определялся по формуле: ИММЛЖ = ММЛЖ/S, где S (м2) — площадь поверхности тела, рассчитанная по формуле: S = рост (м)0,725 вес (кг)0,425 • 0,0071841. Критериями гипертрофии ЛЖ считали значения ИММЛЖ > 134 г/м2 для мужчин и > 110 г/м2 для женщин (по данным Фрамингемского исследования). Для характеристики особенностей геометрии ЛЖ при акромегалии мы рассчитывали индекс относительной толщины стенок ЛЖ и показатель симметричности ЛЖ. Индекс относительной толщины стенок ЛЖ (ИОТ) рассчитывался по формуле Devereux R.B.: ИОТ = (ТМЖП + ТЗСЛЖ)/КДРЛЖ. ИОТ характеризует соответствие толщины стенок ЛЖ размеру его полости. Показатель симметричности (ПС) ЛЖ представляет собой отношение толщины межжелудочковой перегородки (см) к толщине задней стенки ЛЖ (см): ПС ЛЖ = ТМЖП/ТЗСЛЖ. Показатель симметричности ЛЖ при значении его > 1,5 считается критерием асимметричной ГЛЖ.
Диастолическая функция ЛЖ оценивалась по показателям трансмитрального кровотока в допплеровском цветном, импульсном и постоянноволновом режимах.
Обследование включало также проведение боковой рентгенограммы черепа, рентгенографии придаточных пазух носа, магнитнорезонансной томографии головного мозга (МРТ) с/без контрастного усиления. МРТ проводилась с помощью магнитнорезонансного томографа Siemens Magnetom Impact напряженностью магнитного поля 1 Тл с использованием поверхностной катушки для головы. Контрастное усиление проводилось с помощью внутривенного введения 0,1 мл/кг магневиста (фирма «Шеринг», Германия). Объем аденомы гипофиза рассчитывался по формуле G. DiChiro и K.B. Nelson: V = 0,5LWT, где L — высота аденомы, W — ширина, Т — переднезадний размер, выраженные в миллиметрах.
УЗИ щитовидной железы, печени, желчного пузыря проводилось в отделении функциональной диагностики ФГУ ЭНЦ. Объем щитовидной железы вычислялся по формуле J. Brunn: V ЩЖ = ((Ш пр. • Д пр. • Т пр.) + + (Ш л. • Д л. • Т л.)) • 0,479, где Ш, Д, Т — соответственно длина, ширина и толщина каждой доли; 0,479 — коэффициент поправки на эллипсоидность.
Тонкоигольная пункционная биопсия узлов щитовидной железы осуществлялась под УЗИконтролем специалистами отделения хирургии ФГУ ЭНЦ.
Статистическая обработка полученных результатов проведена с помощью пакета программ Statistica, версия 6,0. Описание данных представлено в виде медианы и квартилей (25й и 75й процентили), а также в виде средних арифметических значений и стандартных отклонений от среднего в случае количественных признаков и в виде долей в случае качественных признаков. Сравнение групп по количественному признаку проводилось с помощью критерия Манна — Уитни в независимых выборках и критерия Вилкоксона в зависимых выборках; по качественному признаку с использованием критерия c2 с поправкой Йетса. Различия между группами статистически значимы при уровне значимости p ≤ 0,05. Зависимость между признаками была определена с помощью коэффициента ранговой корреляции Спирмена. Корреляция статистически значима при уровне значимости p ≤ 0,05.
Результаты исследования и их обсуждение
Данные Российского регистра больных акромегалией о распространенности заболевания, состоянии медицинской помощи
Цель создания регистра и анализа полученной базы данных — выявление и динамическое наблюдение за больными, осуществление высокотехнологичной медицинской помощи в необходимом объеме.
С января 2005 года начал работать Единый российский регистр больных акромегалией. Каждый пациент зарегистрирован в специальной электронной базе данных по следующим параметрам: демографические данные, симптомы заболевания, развернутый диагноз, размеры и характер распространения опухоли гипофиза, гормональные показатели, зрительные и неврологические расстройства, примененные методы лечения (нейрохирургический, медикаментозный, лучевой, их различные сочетания), осложнения, полученным из специально разработанной карты регистрации.
Как показали полученные данные, распространенность акромегалии в каждом конкретном федеральном округе (ФО) не зависит от численности населения входящих в него субъектов Федерации, а скорее всего, обусловлена недостаточным охватом всех больных ввиду как низкой обращаемости, так и недостаточно четкой работы регистра на местах.
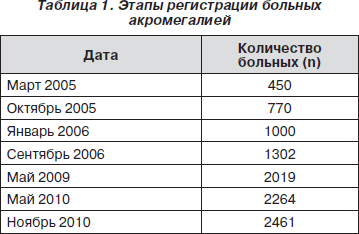
Несмотря на неполную выявляемость всех имеющихся в России к настоящему времени больных акромегалией, благодаря пятилетней работе регистра отмечена значительная положительная динамика в количестве зарегистрированных пациентов (табл. 1).
Среди выявленных пациентов мужчин — 693 человека, женщин — 1768 человек (соотношение 1 : 2,55). Преобладание женщин среди больных акромегалией, вероятнее всего, обусловлено следующими причинами: преобладанием женского населения во всех субъектах Федерации, а также низкой обращаемостью мужчин к врачу, и в частности к эндокринологу.
Как показали наши исследования, акромегалия может возникнуть в любом возрасте, начиная с детского и заканчивая старческим (табл. 2).
В возрастной группе больных от 11 до 20 лет преобладающее большинство составляли пациенты в возрасте от 16 до 20 лет (96 %). Медиана периода от момента первых симптомов заболевания до постановки диагноза составила 5 лет (25 % — 2; 75 % — 9).
Клиническая картина заболевания, как следует из анализа представленных анкет, характеризовалась разнообразием проявлений и косвенно указывала на вовлечение в патологический процесс различных органов и систем. Среди жалоб на состояние здоровья преобладали такие: головная боль — 87,7 %, изменение внешности — 85,8 %, боли в суставах — 61,5 %, мышечная слабость — 56,7 %, потливость — 51,5 %. Среди основных объективных симптомов заболевания преобладали: артериальная гипертензия (37 %), сахарный диабет (26,8 %) и зрительные нарушения (22,1 %). Интересно отметить, что отсутствовала связь длительности течения заболевания с наличием как артериальной гипертензии, так и сахарного диабета. Зрительные нарушения, а именно сужение полей зрения и атрофия дисков зрительных нервов, регистрировались у больных в возрастной категории от 31 до 40 лет с длительностью заболевания до 5 лет.
Как свидетельствует анализ гормональных показателей (СТГ, СТГ/ОГТТ, ИРФ1), большинство пациентов (60,8 %) имеет активную стадию заболевания и требует специального лечения — высокотехнологичных видов медицинской помощи (транссфеноидальная аденомэктомия и/или медикаментозная терапия длительно действующими аналогами соматостатина. Неполная ремиссия заболевания зарегистрирована у 15,3 % пациентов и только у 23,9 % — полная ремиссия акромегалии.
По данным магнитнорезонансной томографии (МРТ), у большинства больных имеется макроаденома гипофиза — 1783 чел. (88 %) с преобладанием аденом диаметром 16– 25 мм (1142 чел.), что говорит о поздней диагностике заболевания и уменьшает шансы радикального лечения.
За годы работы регистра произошла положительная динамика в вопросах оптимизации лечения больных акромегалией.
В частности, увеличилась доступность нейрохирургического вмешательства, проведенного в специализированных, высококвалифицированных учреждениях РФ. Данный вид лечения оказан 866 больным.
Увеличилась доля больных, получающих консервативную (медикаментозную) терапию, составляющая в настоящее время 1473 человека, что произошло в основном за счет когорты, находящейся на терапии длительно действующими аналогами соматостатина, — 840 человек (790 больных — сандостатин ЛАР, в комбинации с агонистами дофамина — 286 пациентов). Монотерапию агонистами дофамина получают 324 больных.
Особенности клинической картины акромегалии: поражение сердечно сосудистой системы, углеводного и липидного обмена, щитовидной железы
Поражение сердечнососудистой системы занимает первое место в структуре летальности при акромегалии, что послужило поводом для проведения комплексного исследования ее состояния с использованием современных инструментальных методов и определением возможной взаимосвязи с сопутствующими метаболическими нарушениями.
Мы обследовали 11 мужчин и 45 женщин с акромегалией в возрасте от 26 до 68 лет (средний возраст 47,6 ± 9,7 года), с длительностью заболевания от 4 месяцев до 21 года (медиана 8,0 (5,0;15,0) года). Средний уровень ИРФ1 составил 683,9 ± 232,9 нг/мл, СТГ/ОГТТ — от 8 до 30 нг/мл (норма < 1 нг/мл), что подтверждало наличие активной стадии заболевания.
Оценка морфологических и функциональных показателей левого желудочка (ЛЖ) методом ЭхоКГ (эхокардиография) была одной из основных задач нашей работы. В результате проведенного исследования гипертрофия левого желудочка (ГЛЖ) (на основании Фрамингемских критериев) была выявлена у 66 % больных, причем у 32 % отмечалась концентрическая ГЛЖ — наиболее прогностически неблагоприятный тип геометрии ЛЖ.
Установлено, что лица с ГЛЖ отличались от пациентов без ГЛЖ большей активностью заболевания (более высоким уровнем ИРФ1), а также более высокими значениями индекса массы тела (ИМТ), иммунореактивного инсулина (ИРИ) натощак и постпрандиальной гликемии. С целью устранения влияния на анализ крайних значений переменных (уменьшение ошибки среднего) сравнение групп по некоторым параметрам проводилось с использованием логарифмически преобразованных переменных.
Нами установлено, что наличие ГЛЖ не является только следствием АГ. В частности, в нашем исследовании ГЛЖ отмечалась у 82 % пациентов с АГ и у 52 % лиц с нормальным АД (c2 = 4,28, число степеней свободы = 1, р = 0,04).
Результаты множественного пошагового регрессионного анализа показали, что главными предикторами основных морфологических параметров ЛЖ (ММЛЖ и ИММЛЖ) у обследованных больных были уровень ночного систолического артериального давления (САД) и сагиттальный диаметр грудной клетки.
На морфологические параметры ЛЖ оказывали также влияние масса тела больных, возраст, показатели углеводного обмена. При простом регрессионном анализе было установлено, что величины ММЛЖ, ИММЛЖ и толщины стенок ЛЖ у обследованных больных положительно коррелировали с ИМТ (соответственно р = 0,0002; р = 0,01; р = 0,0006 и р = 0,0002), возрастом (соответственно р = 0,02; р = 0,008; р = 0,005; р = 0,02), ТМЖП — с тощаковой гликемией (р = 0,02) и уровнем Спептида (р = 0,04), а ТЗСЛЖ — с постпрандиальной гликемией (р = 0,05) и не зависели от длительности и активности акромегалии.
Диастолическая дисфункция ЛЖ была выявлена у 48 % обследованных, причем в большинстве случаев (44 %) регистрировалось нарушение ДФЛЖ по I типу.
Простой регрессионный анализ показал, что нарушения ДФЛЖ у обследованных нами лиц зависели от уровня гликемии, содержания в крови атерогенных липидов и возраста больных.
По данным множественного регрессионного пошагового анализа, главным предиктором нарушения ДФЛЖ по II (наиболее неблагоприятному) типу была длительность акромегалии (коэффициент регрессии = = –0,35; р = 0,02).
Главные показатели систолической функции ЛЖ — фракция выброса ЛЖ (ФВЛЖ) и фракция укорочения ЛЖ (ФУЛЖ) статистически значимо отрицательно коррелировали с длительностью акромегалии (r = –0,36, р = 0,006 и r = –0,34, р = 0,01 соответственно). По данным множественного пошагового регрессионного анализа, длительность акромегалии была главным предиктором снижения фракции выброса ЛЖ (коэффициент регрессии = –0,43; р = 0,004) и фракции укорочения ЛЖ (коэффициент регрессии = –0,34; р = 0,004).
Дилатации камер сердца были выявлены у 50 % (28/56) обследованных больных независимо от наличия у пациентов АГ и статуса толерантности к глюкозе.
Результаты множественного пошагового регрессионного анализа выявили, что главным предиктором размера полости левого предсердия является сагиттальный диаметр грудной клетки (коэффициент регрессии = 0,1; р = 0,0001), ЛЖ — сагиттальный диаметр грудной клетки и уровень ночного САД (соответственно коэффициент регрессии = 0,05, p = 0,01 и коэффициент регрессии = = 0,01, р = 0,04); правого желудочка — ИМТ (коэффициент регрессии = 0,03; р = 0,0005).
При углубленном анализе результатов ЭКГ покоя (12 стандартных отведений и трех корригированных ортогональных отведений по Франку с построением ВКГ (векторкардиограммы) и ДЭКТГ (дипольной электрокардиотопограммы)), которые были выполнены всем 56 больным акромегалией, абсолютно нормальная ЭКГ была зарегистрирована только у 20 % больных, явно патологическая — у 54 % обследованных лиц.
Суточное мониторирование ЭКГ по Холтеру (СМЭКГ) показало высокие средние значения ЧСС, преобладающей в дневное и ночное время (ПрЧСС), то есть регистрировалась дневная тахикардия и отсутствие компенсаторной ночной брадикардии. Результаты простого регрессионного анализа показали, что практически все показатели ЧСС у наших больных статистически значимо положительно коррелировали с активностью заболевания (уровнем ИРФ1 в крови).
На основании результатов СМАД (было выполнено 55 из 56 обследованных нами больных) АГ была выявлена у 49 % (27 из 55) обследованных против 66 % при рутинном измерении АД в клинической обстановке.
Согласно нашим результатам больные акромегалией, имеющие нормальное АД и АГ, не отличались друг от друга по длительности и активности заболевания, величине ИМТ, концентрациям Спептида, ИРИ. Нарушения суточного ритма АД были самой частой патологией, обнаруженной при СМАД у обследованных нами больных.
У 60 % наших пациентов независимо от статуса толерантности к глюкозе и уровня амбулаторного АД был выявлен патологический характер суточной кривой АД. В результате исследования были выявлены следующие нарушения суточного профиля САД и ДАД: по типу недостаточного ночного снижения АД (нондипперы) для САД — 45 %, для ДАД — 27 % и ночной гипертонии (найтпикеры) для САД — 11 %, для ДАД — 2 %; а также по типу избыточного снижения АД в ночное время (овердипперы): для САД — 4 %, для ДАД — 29 %). Интересно отметить, что частота различных нарушений суточного профиля САД и ДАД статистически значимо не отличалась в группах больных акромегалией с АГ и нормальными показателями АД.
При изучении функционального состояния поджелудочной железы ни у одного больного не было выявлено низких концентраций Спептида, то есть признаков абсолютной недостаточности инсулина. Более того, отмечалось повышенное содержание Спептида и/или ИРИ натощак у пациентов как с нарушенным (71 %), так и с нормальным углеводным обменом (52 %; р = 0,33). Полученные данные свидетельствуют о том, что инсулинсекреторная функция островков поджелудочной железы, вероятно, не является решающей в формировании статуса толерантности к глюкозе у больных акромегалией.
Степень гиперинсулинемии положительно коррелировала с уровнем ИРФ1 (r = 0,51; p = 0007) и СТГ (r = 0,29; p < 0,05), то есть со степенью активности заболевания.
Нами проведено сравнение больных акромегалией (n = 45) со здоровыми лицами (n = 10) по содержанию Спептида, ИРИ натощак и чувствительности к инсулину (с поправкой на возраст и массу тела). Результаты показали, что больные акромегалией с нарушенным углеводным обменом характеризовались более высокими значениями ИРИ (p = 0,005) и Спептида (р = 0,03) натощак, самыми высокими значениями индекса инсулинорезистентности (15,3 ± 2,3) по сравнению с пациентами с нормальным углеводным обменом (5,2 ± 0,6; p < 0,0001) и здоровыми лицами (3,2 ± 0,4; p < 0,0001).
Средний объем щитовидной железы у больных акромегалией был значительно больше, чем в группе контроля (53,0 ± 1,9 мл против 17,3 ± 2,0 мл; p < 0,05). Прямая корреляция была выявлена между длительностью заболевания и объемом щитовидной железы (r = 0,49; p < 0,001) и слабая корреляция — между уровнем СТГ и объемом щитовидной железы (r = 0,29; 0,05 < p < 0,01). Гистологический анализ операционного материала, а также пунктатов зобов выявил преобладание многоузлового кистозного коллоидного, в разной степени пролиферирующего зоба (69 %). Не было выявлено ни одного случая злокачественного новообразования щитовидной железы.
Эффективность различных методов лечения акромегалии
Эффективность транссфеноидальной аденомэктомии
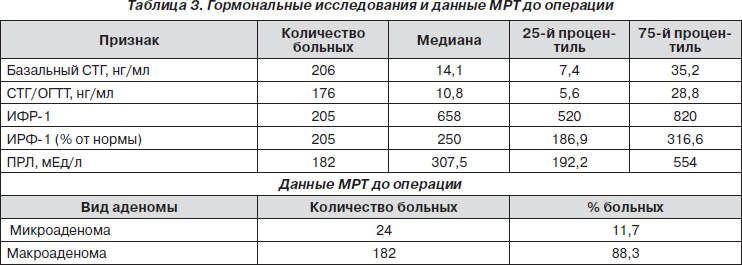
Нами проанализированы ранние и отдаленные результаты хирургического лечения СТГ и СТГ + ПРЛсек ретирующих аденом гипофиза у 206 больных, оперированных с 2004 по 2009 год. Из них женщин было 135 (65,5 %) и мужчин — 71 (34,5 %). Соотношение женщин и мужчин составило 2 : 1. Преобладали пациенты в возрасте от 34 до 58 лет (75 %). Средний возраст составил 47,00 ± ± 10,09 года. Все пациенты к моменту операции имели активную стадию заболевания, подтвержденную высоким базальным уровнем СТГ, отсутствием его подавления ниже 1 нг/мл в ходе ОГТТ (проба не проводилась больным, имеющим инсулинозависимый сахарный диабет), а также наличием уровней ИРФ1, превышающих нормальные значения для данного пола и возраста (табл. 3).
Нами установлена достоверная отрицательная корреляция между возрастом больных, гормональными показателями и исходными размерами аденомы. Так, молодой возраст ассоциирован с более высокими уровнями базального СТГ, СТГ/ОГТТ до операции; ИРФ1 (% от нормы) до операции, размерами аденомы.
Кроме того, была установлена отрицательная корреляция между возрастом пациентов и уровнем СТГ в раннем послеоперационном периоде: коэффициент Спирмена –0,14; р = 0,048.
Все пациенты были подвергнуты трансназальной транссфеноидальной аденомэктомии на базе отделения нейрохирургии ФГУ ЭНЦ с применением эндоскопа.
Уровень СТГ, значимо снижаясь сразу после операции, выходит на плато, сохраняясь таким и через 12 месяцев после аденомэктомии (по критерию Фридмана: p = 0,00002 (p < 0,05)).
Аналогичный результат получен и в отношении показателей ИРФ1. При этом в отличие от уровней СТГ через 6 месяцев после операции отмечено дальнейшее значимое снижение показателей ИРФ1 (по критерию Фридмана: p = 0,0000 (p < 0,05)).
На основании полученных результатов гормональных исследований в различные временные точки от момента проведения операции произведена оценка степени нормализации маркеров активности заболевания.
Нами оценены результаты аденомэктомии отдельно в группах больных с макро и микроаденомами в раннем п/о периоде (5–7е сутки), а также через 6, 12, 24 месяца с целью определения влияния размеров опухоли гипофиза на исход оперативного вмешательства.
Оптимальный результат (полная ремиссия заболевания) получен при удалении микроаденом гипофиза, регистрировался в раннем послеоперационном периоде, а также через год после аденомэктомии. При этом через 24 месяца после операции количество больных, достигших полной ремиссии заболевания, составило ноль за счет повышенного уровня ИРФ1, хотя у половины больных имелись нормальные показатели базального уровня СТГ и его реакции в ответ на нагрузку глюкозой. Расхождения результатов СТГ и ИРФ1 указываются в литературе без установления их точных причин. Одной из них может быть сохранение повышенной секреции СТГ, обусловленное наличием высокой пролиферативной и инвазивной активности аденомы, несмотря на ее малые размеры, и не улавливаемое не только определением базального уровня данного гормона, но и в ходе ОГТТ. Ряд исследователей в такой ситуации рекомендуют более частое определение уровня СТГ в течение суток.
Нами также проведено исследование возможных прогностических факторов, влияющих на показатели послеоперационной ремиссии в различные временные интервалы от момента аденомэктомии путем сравнения групп пациентов в зависимости от достижения нормализации основных маркеров ремиссии заболевания.
Результаты исследования указывают, что основными прогностическими показателями успешности хирургического лечения в раннем послеоперационном периоде (5–7е сутки) являются объем опухоли гипофиза (р = 0,0002), возраст больных (р = 0,048), показатели уровня СТГ и СТГ/ОГТТ до операции (соответственно р = 0,014 и р = 0,04). В отдаленном послеоперационном периоде таковыми маркерами являются: степень исходной гормональной активности аденомы, то есть уровни СТГ и СТГ/ОГТТ до операции: р = 0,005 и р = 0,002 соответственно; а также уровни СТГ, СТГ/ОГТТ и ИРФ1, полученные в раннем послеоперационном периоде (5–7е сутки после операции), соответственно р = 0,01, р = 0,02 и р = 0,03.
Кроме того, нами также установлено, что степень инвазии опухоли в окружающие структуры, определяемая по данным МРТ и в ходе оперативного вмешательства (при визуализации с помощью эндоскопа) достоверно влияет на исход оперативного вмешательства.
Не было найдено достоверной разницы (p > 0,05) между группами пациентов в ремиссии и с отсутствием таковой по следующим показателям: длительность заболевания, наличие солидного характера структуры опухоли и митозов.
Помимо оценки гормональных показателей, размеров опухоли гипофиза, ее структуры и наличия в ней митозов проведена также оценка в качестве возможных прогностических факторов ряда морфологических свойств удаленных аденом. В частности, исследована иммуноэкспрессия маркера клеточной пролиферации Ki67, маркеров ангиогенеза CD31 и VEGF, а также маркера злокачественного потенциала галектина3 в 39 соматотропиномах.
Установлено, что большой объем аденомы ассоциируется с повышенной экспрессией Ki67, уровнем пролактина (ПРЛ), а также с более высоким уровнем базального СТГ, измеренного через 12 и более месяцев после операции. Более того, было установлено, что маркер пролиферации Ki67 и маркер гормональной активности ПРЛ экспрессируются только вместе (по двустороннему критерию Фишера p < 0,0001). Экспрессия Ki67 и ПРЛ в удаленных аденомах ассоциировалась с наличием латероселлярного роста аденомы гипофиза (по двустороннему критерию Фишера p = 0,0262).
Полученные результаты послужили поводом для более детального изучения показателя пролиферации Ki67 как возможного прогностического фактора послеоперационной ремиссии в раннем и позднем послеоперационном периоде. В связи с чем дополнительно в 52 соматотропиномах была определена иммуноэкспрессия данного маркера. Медиана (Q25–75) показателя пролиферации составила 3 (2,0–5,9), минимальное значение — 0,4, максимальное — 20,2.
Как показали результаты однофакторного анализа, высокий показатель пролиферации Ki67 является маркером неблагоприятного исхода хирургического лечения в раннем послеоперационном периоде: HR — 3,10; 95% ДИ — 1,33–7,21; р = 0,009, где HR — относительный риск, ДИ — доверительный интервал. Сходные результаты были получены при проведении многофакторного анализа: HR — 2,83; 95% ДИ — 1,13–7,09; р = 0,026.
Дальнейшее исследование влияния данного показателя на достижение ремиссии в отдаленном послеоперационном периоде с помощью однофакторного и многофакторного регрессионного анализа подтвердило прогностическую значимость Ki67: HR — 3,62; 95% ДИ — 1,31–10,02; р = 0,013. Более того, согласно результатам многофакторного анализа, показатель опухолевой пролиферации Ki67 явился единственным фактором, определяющим отдаленный послеоперационный прогноз.
Нами также была выявлена связь между экспрессией маркера злокачественного потенциала галектина3 и экспрессией маркера ангиогенеза CD31 с базальным уровнем СТГ до операции. Кроме того, в группе больных с экспрессией CD31 отмечался достоверно более высокий уровень СТГ/ОГТТ.
Была выявлена также очень сильная связь между экспрессией CD31 и экспрессией другого маркера ангиогенеза — VEGF. Последний определялся только совместно с CD31 (по двустороннему критерию Фишера p < 0,0001). При этом связи VEGF c другими признаками найдено не было.
Эффективность медикаментозной терапии
В ФГУ ЭНЦ получен собственный опыт оценки эффективности и безопасности терапии длительно действующими аналогами соматостатина у 228 больных акромегалией. Эффективность соматулина оценена у 36 пациентов, получавших данную терапию в качестве предоперационной подготовки (10 человек), первичной и дополнительной терапии (26 человек) с длительностью лечения от 2 до 12 месяцев. Надо отметить, что положительная динамика клинических симптомов была отмечена уже через 7 дней от момента первой инъекции препарата и значительно прогрессировала по мере продолжения терапии.
Прогрессирующая положительная динамика клинических симптомов заболевания сопровождалась достоверным снижением гормональных показателей.
Установлено, что доля больных, у которых достигнуты целевые значения уровня СТГ и ИРФ1, увеличивается вместе с продолжительностью лечения.
Так, прогрессирующее снижение уровней СТГ и ИРФ1 через 6 и 12 месяцев применения препарата привело к увеличению количества больных с безопасным уровнем СТГ до 36,4 и 42,8 %, а с нормальным уровнем ИРФ1 — до 66,6 и 80,0 % соответственно в I (первичная терапия) и во II (дополнительная терапия) группах.
Более того, исследование сравнительной эффективности препаратов в группах пациентов первичной и дополнительной терапии показало сходную эффективность, что наглядно продемонстрировано в отношении сандостатина ЛАР.
Статистически значимых различий в показателях уровней СТГ и ИРФ1 между группами выявлено не было: соответственно p = 0,518 и p = 0,762 по критерию Манна — Уитни.
Всем пациентам, получавшим терапию длительно действующими аналогами соматостатина, была проведена МРТ головного мозга и области гипофиза до назначения данного лечения, а также через 2, 6, 12 месяцев после начала терапии с целью динамического определения объема аденомы гипофиза. Как следует из полученных результатов, одним из наиболее важных эффектов терапии длительно действующими аналогами соматостатина является способность вызывать уменьшение размеров опухоли гипофиза, что у наших больных в целом достигнуто в 21–48,3 % случаев со степенью уменьшения объема аденомы от 13 до 85 % от исходных показателей. В частности, на фоне терапии соматулином антипролиферативный эффект выявлен у 22 % больных со степенью уменьшения объема опухоли от 18 до 85 % от исходного; на фоне терапии сандостатином ЛАР — у 48,3 % лиц, от 13 до 73 % от исходных параметров; лечение октреотидомдепо вызвало уменьшение объема опухоли у 21 % пациентов, от 16,7 до 39 % от исходных показателей объема аденомы.
С целью выяснения возможного механизма антипролиферативного действия длительно действующих аналогов соматостатина были изучены маркеры опухолевой прогрессии в соматотропиномах, удаленных у больных, предварительно получавших терапию данными препаратами. Результаты были сравнены с таковыми в аденомах больных, не получавших в предоперационном периоде лечения аналогами соматостатина.
Исследование показало, что предоперационная терапия длительно действующими аналогами соматостатина вызвала значительное уменьшение количества сосудов в аденомах, измеренных с помощью маркера ангиогенеза CD31 (p = 0,006), что указывает на подавление ангиогенеза в аденомах под влиянием этих препаратов.
При этом не было выявлено значимых различий между группами в иммуноэкспрессии другого фактора ангиогенеза — сосудистого фактора роста эндотелия — VEGF. Не было также обнаружено статистически значимых изменений в пролиферативной активности соматотропином, измеренной с помощью маркера Ki67, на фоне терапии длительно действующими аналогами соматостатина (р = 0,18).
Эффективность лучевой терапии в лечении акромегалии
К настоящему моменту за период с 1979 по 2009 год протонотерапия произведена 112 больным акромегалией в возрасте от 27 до 64 лет, из них 26 мужчинам и 86 женщинам. У 12 человек — повторно в связи с отсутствием ремиссии заболевания и у 7 больных — фракционным методом в связи с особенностями расположения аденомы. Всем больным лучевая терапия проводилась в качестве первичного метода лечения. До проведения лучевой терапии все больные имели активную стадию заболевания, подтвержденную результатами клиникогормонального обследования. Доза лучевой терапии составляла от 30 до 74,6 Грей с преобладанием дозы 55– 60 Грей, полем коллиматора диаметром 12 и 15 мм или овальным сечением 10 15 мм и 8 12 мм, что зависело от размеров аденомы и формы турецкого седла.
При сроках наблюдения до 20 лет клиническое улучшение с положительной динамикой гормональных показателей отмечено у 52 больных (46 %), ремиссия заболевания — у 49 (44 %) пациентов. У 11 человек протонотерапия не вызвала положительной динамики ни клинических, ни гормональных показателей.
Как показал катамнестический анализ, количество больных, достигших ремиссии заболевания, постепенно возрастало по мере увеличения периода времени от момента проведения сеанса протонотерапии.
Медленное развитие ремиссии обусловлено постепенным супрессивным воздействием пучка протонов на секрецию СТГ и ИРФ1, что наглядно демонстрируют показатели медианы уровней СТГ и ИРФ1 в течение периода от момента проведения облучения до конечной точки наблюдения.
Учитывая отдаленность во времени достижения ремиссии заболевания, с целью минимизации осложнений акромегалии всем больным сразу после проведения сеанса лучевой терапии назначалась дополнительная медикаментозная терапия агонистами дофамина в максимальной дозе 20 мг в сутки, а с появлением длительно действующих аналогов соматостатина — сандостатин ЛАР в дозе 20–30 мг в/м 1 раз в 28 дней до достижения ремиссии заболевания.
Выводы
1. Распространенность акромегалии на территории Российской Федерации, установленная на основании анализа регистра, носит неравномерный характер, прямо не зависит от численности населения различных регионов и составляет от 7,2 до 21,2 человека на 1 млн населения. Среди выявленных больных преобладают женщины (ж/м = 2,57/1) в возрасте 41–50 лет, а также пациенты в активной стадии заболевания (60,8 %).
2. Акромегалия характеризуется генерализованным системным характером поражений. Установлена высокая распространенность и разнообразие поражений сердечнососудистой системы, включая ГЛЖ (66 %), дилатацию камер сердца (50 %) с диастолической дисфункцией (48 %), артериальную гипертензию (50 %) с нарушением суточного ритма АД (60 %), изменения ЭКГ (80 %), коррелирующие со степенью нарушения углеводного обмена. По сравнению с пациентами с нормальной толерантностью к глюкозе у них регистрировались более высокие средние уровни ДАД, большая продолжительность АГ в течение суток (индекс времени), большая вариабельность ДАД, большая распространенность гипертрофии левого и правого желудочков и более выраженные нарушения диастолической функции ЛЖ.
3. Нарушения углеводного обмена, включая сахарный диабет, НТГ и нарушение гликемии натощак, выявлены у 34 % больных, не зависящие от пола, возраста, длительности и степени активности акромегалии, сочетающиеся с гиперинсулинемией и гиперСпептидемией соответственно в 44 и 42 % случаев, а также с достоверным повышением индекса инсулинорезистентности у больных как с нарушенным, так и с нормальным углеводным обменом по сравнению с группой здоровых лиц. Высокая частота поражения щитовидной железы при акромегалии (97 %) характеризуется развитием в большинстве случаев (69 %) коллоидного пролиферирующего зоба с низкой частотой новообразований (2,9 %).
4. При микроаденомах гипофиза самым эффективным методом лечения акромегалии, позволяющим достичь ремиссии заболевания соответственно в 76 % случаев (ранний послеоперационный период) и 67 % случаев (отдаленный послеоперационный период), является транссфеноидальная аденомэктомия. Основными прогностическими гормональными показателями успешности хирургического лечения являются: степень исходной гормональной активности аденомы, то есть уровни СТГ и СТГ/ОГТТ до операции; а также уровни СТГ и ИРФ1, полученные в раннем послеоперационном периоде (5–7е сутки после операции). Факторами менее благоприятного послеоперационного прогноза являются молодой возраст, высокая исходная гормональная активность опухоли гипофиза, большой объем аденомы. Прогностически наименее благоприятными являются смешанные СТГ/ПРЛсекретирующие макроаденомы гипофиза с латероселлярным ростом и высоким индексом пролиферации Ki67.
5. Препараты длительно действующих аналогов соматостатина — соматулин, сандостатин ЛАР, октреотиддепо являются высокоэффективными и безопасными медикаментозными средствами лечения акромегалии, позволяющими купировать основные клинические симптомы заболевания у 88 % больных, нормализовать уровни СТГ и ИРФ1 соответственно до 58 и 80 % случаев. Данные медикаментозные средства можно рекомендовать в качестве первичной длительной медикаментозной терапии лицам, имеющим противопоказания к хирургическому лечению (тяжелые изменения со стороны сердечнососудистой, легочной системы, необходимость сохранения нормального функционального состояния гипофиза в случае планирования беременности, психические нарушения, старческий возраст больного).
6. Препараты аналогов соматостатина обладают мощным антипролиферативным эффектом, характеризующимся уменьшением объема аденомы гипофиза до 85 % от исходных показателей. Одним из механизмов противоопухолевого эффекта является подавление ангиогенеза (по данным маркера CD31), что является показанием к их назначению в качестве средств предоперационной подготовки с целью оптимизации исхода транссфеноидальной аденомэктомии.
7. Катамнестический анализ показал, что применение протонотерапии в качестве первичного метода лечения акромегалии не оправдано в связи с низким показателем ремиссии (39 %), значительной отдаленностью эффекта во времени (до 20 лет), необходимостью назначения дополнительной медикаментозной терапии на длительный срок и высокой частотой осложнений (20,3 % ранних и 63 — поздних).
1. Патология сердечнососудистой системы при акромегалии (обзор литературы) / Белова Ю.Ю., Молитвослово ва Н.Н., Марова Е.И. // Проблемы эндокринологии. — 2004. — T. 50, № 2. — С. 3947.
2. Роль аналога соматостатина, соматулина, в лечении акромегалии / Молитвословова Н.Н. // Фарматека. — 2005. — № 12. — С. 3642.
3. Акромегалия: клиническое течение в зависимости от пола и возраста / Пронин В.С., Мельниченко Г.А., Молитвословова Н.Н. и др. // Клиницист. — 2006. — № 3. — С. 1624.
4. Особенности клинического течения акромегалии и лечебной тактики в зависимости от возраста пациентов при начале заболевания / Пронин В.С., Молитвословова Н.Н., Агаджанян С.Э. и др. // Проблемы эндокринологии. — 2006. — Т. 52, № 3. — С. 3340.
5. Акромегалия: современные достижения в диагностике и лечении. Обзор литературы / Молитвословова Н.Н. // Проблемы эндокринологии. — 2011. — № 1. — С. 4659.