Международный эндокринологический журнал 7 (39) 2011
Вернуться к номеру
Механизмы действия, безопасность и переносимость глиптинов — нового класса противодиабетических препаратов с инкретиновым эффектом
Авторы: Корпачев В.В., Гурина Н.М., ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», г. Киев
Рубрики: Эндокринология
Версия для печати
Проблема лечения сахарного диабета (СД) 2-го типа и его осложнений приобретает все большую актуальность в современном обществе, поскольку число людей, страдающих этим заболеванием, постоянно возрастает. Однако при помощи существующих сахароснижающих средств и их комбинаций не всегда удается добиться адекватного контроля уровня гликемии — ключевого патогенетического фактора при СД 2-го типа, являющегося причиной развития макро- и микроваскулярных осложнений, полинейропатии и энцефалопатии. Кроме того, отсутствие у современных сахароснижающих средств глюкозозависимого эффекта увеличивает риск развития гипогликемических состояний, а использование стимуляторов секреции инсулина ведет к истощению инсулярного аппарата. Поэтому для обеспечения эффективности и безопасности противодиабетической терапии требуется многосторонний подход, т.е. воздействие на различные звенья патогенеза СД 2-го типа как комплексного гормонально-метаболического нарушения. Исходя из этого, большой интерес представляет разработка препаратов, основанных на новых принципах действия [1, 2]. Важнейшим требованием к таким препаратам наряду с высокой терапевтической эффективностью является и более совершенный профиль безопасности, а также способность оказывать благоприятное влияние на факторы, способствующие дальнейшему прогрессированию сахарного диабета и развитию его осложнений, что в конечном счете определяет возможность продления жизни пациента и улучшения ее качества.
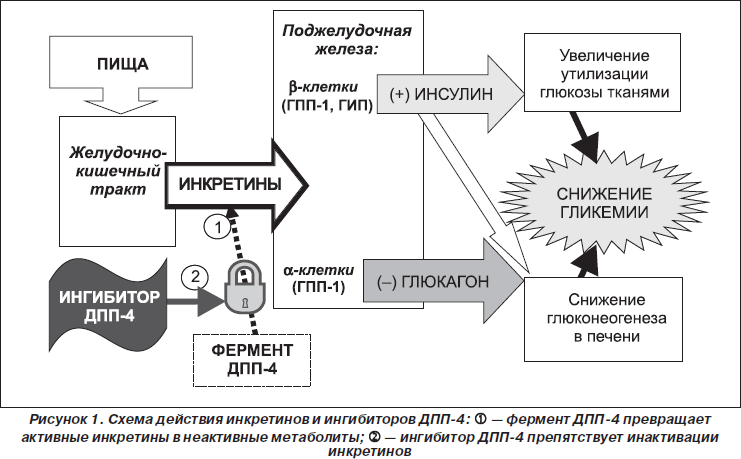
В последнее время внимание исследователей и клиницистов привлекает новый класс пероральных антидиабетических препаратов — глиптины, или ингибиторы дипептидилпептидазы 4-го типа (ДПП-4), которые дают возможность нормализовать естественную регуляцию уровня глюкозы, воздействуя на секреторную функцию островковых клеток поджелудочной железы [3]. Механизм действия этого класса препаратов связан с пролонгированием эффекта инкретинов — естественных гастроинтестинальных гормональных факторов, участвующих в физиологической регуляции уровня гликемии. В обычных условиях инкретины, выделяемые в кровь клетками кишечника в ответ на прием пищи, подвергаются быстрому расщеплению ферментом ДПП-4. Сохранение активности инкретинов с помощью ингибиторов ДПП-4 обеспечивает глюкозозависимую выработку инсулина c одновременным подавлением выделения «контринсулинового» гормона — глюкагона, устраняя функциональный дисбаланс a- и b-клеток поджелудочной железы. Это воздействие ингибиторов ДПП-4 может помочь скорректировать характерное для СД 2-го типа снижение 2-й фазы секреции инсулина, т.е. сделать профиль инсулиновой секреции у больных более физиологичным.
Кроме стимулирования глюкозозависимой секреции инсулина, инкретины обеспечивают оптимизацию биосинтеза и физиологический контроль секреции инсулина. Показано, что инкретины защищают b-клетку, повышая дифференциацию и пролиферацию и уменьшая апоптоз; в моделях на животных установлена связь уровня инкретинов с повышением массы b-клеток [9].
Изучение инкретинов началось еще в прошлом веке. В 1902 г. Baylis и Starling описали фактор, который вырабатывается в тонком кишечнике и стимулирует секрецию поджелудочной железы. В 1964 г. был впервые описан инкретиновый эффект в эксперименте, когда ответная секреция инсулина была более выраженной в случае, если глюкоза вводилась перорально, а не при внутривенном ее введении [6]. Инкретиновый эффект приводит к усилению глюкозозависимой секреции инсулина b-клетками поджелудочной железы, причем приблизительно 60 % инсулина, секретируемого в ответ на прием пищи, является следствием данного эффекта [13, 14].
В 1986 г. обнаружено снижение эффектов инкретина при СД 2-го типа [15]. В 1995 г. показано, что в физиологических условиях циркулирующие глюкагоноподобный пептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП) расщепляются ферментом ДПП-4. Эти данные легли в основу идеи о том, что создание ингибиторов фермента ДПП-4 может стать эффективным средством физиологического контроля гликемии путем поддержания эффектов глюкагоноподобных пептидов.
Наиболее активными из инкретинов являются ГПП-1 и ГИП. ГПП-1 является инкреторным гормоном, который, помимо стимуляции секреции инсулина, уменьшает секрецию глюкагона, угнетая таким образом эндогенное образование глюкозы, уменьшая колебания постпрандиального уровня глюкозы в крови. Кроме того, под влиянием ГПП-1 снижается аппетит, что приводит к меньшему потреблению пищи и уменьшению массы тела; замедляется продвижение химуса по желудочно-кишечному тракту, установлены определенные положительное эффекты воздействия на сердечно-сосудистую систему [1, 14, 15]. В то время как влияние на b-клетку является общим для обоих инкретинов, ГИП не угнетает секрецию глюкагона и не влияет на опорожнение желудка и потребление пищи [9]. Однако ГИП может играть важную роль в регуляции липидного обмена.
Инкретины высвобождаются в кровеносное русло из клеток кишечника в течение всего дня, их уровни возрастают в ответ на прием пищи. ГИП секретируется К-клетками кишечника, а ГПП-1 — L-клетками, причем после приема пищи ГИП циркулирует в крови в концентрациях, в 10 раз превышающих концентрации ГПП-1. Физиологические эффекты инкретинов осуществляются путем связывания ГПП-1 со специфическими рецепторами, которые располагаются во многих органах, включая поджелудочную железу и мозг [5, 4, 7, 10]. В кровяном русле период полужизни ГПП-1 составляет от 60 до 90 секунд вследствие быстрого разрушения его ферментом ДПП-4 с образованием метаболитов, которые могут действовать как антагонисты рецепторов ГПП-1 [14].
Оба инкретина имеют сходные инсулинотропные эффекты при концентрациях глюкозы до 108 мг/дл, но при уровне глюкозы выше 140 мг/дл ГИП оказывает незначительное влияние на секрецию инсулина [8, 12]. В отличие от ГПП-1 ГИП не подавляет секрецию глюкагона. Поскольку степень влияния ГПП-1 на секрецию инсулина зависит от концентрации глюкозы в плазме крови, то по мере приближения уровня гликемии к нормальным значениям стимуляция ГПП-1 секреции инсулина уменьшается [11].
Таким образом, имеющиеся данные об основных свойствах гормонов-инкретинов ГПП-1 и ГИП свидетельствуют о важной роли этих гормонов, выделяемых клетками кишечника в ответ на прием пищи. Их воздействие осуществляется частично путем влияния на соотношение двух ключевых гормонов, вырабатываемых островковыми клетками поджелудочной железы, — инсулина и глюкагона, а также с помощью регуляции потребления пищи, продвижения химуса, пролиферации и дифференциации b-клеток. Эти кумулятивные эффекты, направленные на поддержание баланса между процессами образования и потребления клетками глюкозы, играют определяющую роль в регуляции гомеостаза глюкозы в организме.
При СД 2-го типа действие инкретинов нарушается, но экзогенно введенный ГПП-1 может нормализовать концентрации глюкозы в крови как натощак, так и после еды. Показано, что ГПП-1 при длительном подкожном введении больным СД 2-го типа (в течение 6 недель) улучшал функцию b-клеток, снижал уровень глюкозы и гликозилированного гемоглобина (HbA1c), повышал периферическую инсулиночувствительность; кроме того, зафиксировано снижение массы тела пациентов [1–3, 13].
Однако, как уже отмечалось, период циркуляции эндогенного или экзогенного ГПП-1 в крови чрезвычайно мал в связи с быстрой инактивацией инкретинов под действием фермента дипептидилпептидазы-4 [1, 3].
Для обеспечения возможности практического использования нативного ГПП-1 как нового средства в терапии СД 2-го типа целесообразным является предотвращение быстрого распада ГПП-1 с применением ингибиторов ДПП-4. Реальность этого подхода доказана в ходе доклинических исследований ингибиторов ДПП-4 с использованием моделей инсулинорезистентности (ИР), СД 2-го типа, нарушенной толерантности к глюкозе на животных, в которых было показано, что рост концентрации интактного гормона инкретина сопровождается улучшением толерантности к глюкозе [3].
Использование ингибиторов ДПП-4, на фоне приема которых достигается повышение содержания ГПП-1, представляет собой действительно физиологический путь восстановления нарушенной продукции инсулина и коррекции повышенного уровня глюкагона — ключевых расстройств, которые характерны для сахарного диабета (рис. 1).
Данные литературы свидетельствуют, что появление новых антидиабетических препаратов, действие которых основано на усилении эффекта эндогенных инкретинов, открывает новые перспективы в лечении СД 2-го типа. Несмотря на то что 2 класса этих препаратов (ингибиторы ДПП-1 и аналоги ГПП) относятся к химически различным и структурно независимым соединениям, они имеют сходный механизм действия, состоящий в регулировании гомеостаза глюкозы путем воздействия на процессы глюкозозависимого синтеза инсулина и глюкагона, влияния на потребление пищи и продвижение химуса, на пролиферацию и дифференциацию b-клеток поджелудочной железы. Существенным преимуществом ингибиторов ДПП-4 является возможность их использования в таблетированной форме в отличие от инъекционных аналогов ГПП. Важно также то, что ингибиторы ДПП-4 не вызывают существенных побочных эффектов, не повышают частоту гипогликемии и не приводят к увеличению массы тела. Ингибиторы ДПП-4 эффективны как в виде монотерапии, так и в сочетании с метформином, производными сульфонилмочевины, глитазонами. Это особенно актуально в случаях, когда максимально возможные дозы сахароснижающих препаратов не обеспечивают адекватного контроля гликемии у пациента.
В настоящее время накоплен значительный клинический опыт применения ингибиторов ДПП-4 для лечения СД 2-го типа и продолжают проводиться исследования их эффективности и безопасности [3, 12]. Эти работы показали, что важной отличительной особенностью противодиабетических препаратов из группы ингибиторов ДПП-4 является исключительно благоприятный профиль безопасности. Из препаратов данного класса ситаглиптин (Янувия, MSD) обладает наибольшей доказательной базой в отношении эффективности и безопасности применения (уже представлены данные 380 исследований).
Из недавних можно отметить проведенное в 2008 г. мультинациональное рандомизированное плацебо-контролируемое двойное слепое исследование с параллельными группами длительностью 30 недель, целью которого было определение эффективности и безопасности ситаглиптина у 190 пациентов с СД 2-го типа с гипергликемией умеренной тяжести (HbA1c ≥ 8,0 %), которая не поддавалась контролю путем приема метформина. В дополнение к стабильной дозе метформина пациентам назначалось по 100 мг в день ситаглиптина или плацебо. Первичными конечными точками контроля эффективности были уровень HbA1c на 18-й неделе лечения, вторичными — изменения тощакового (fasting plasma glucose — FPG) и постпрандиального (postprandial plasma glucose — PPG) уровней глюкозы плазмы и HbA1c через 30 недель. Дополнительно оценивали уровни инсулина, С-пептида, проинсулина, отношение «инсулин/глюкоза», а также степень инсулинорезистентности и функцию b-клеток согласно моделям НОМА и QUICKI. Безопасность и переносимость оценивали путем сравнения частоты нежелательных специфических клинических побочных явлений (ПЯ) в рандомизированных группах больных, получавших ситаглиптин или плацебо.
Результаты показали, что ситаглиптин в отличие от плацебо обеспечил статистически достоверное и клинически значимое снижение уровня HbA1c (–1,0 %), наблюдаемое как через 18, так и через 30 недель лечения. Целевой уровень HbA1c (< 7,0 %) был достигнут у значительно большего количества больных, получавших ситаглиптин, чем у лиц группы плацбо (22,1 против 3,3 %, p < 0,001). При этом большая степень снижения HbA1c отмечена у пациентов с более тяжелой исходной гипергликемией и высоким уровнем HbA1c.
Интересно отметить, что если при монотерапии метформином повышался общий уровень инкретина ГПП-1, то при использовании метформина вместе с ситаглиптином, пролонгирующим и увеличивающим уровень активного инкретина, концентрация активного ГПП-1 возрастала в большей степени, чем под действием каждого из этих препаратов в отдельности. Этот комплементарный эффект на инкретиновую ось может объяснять относительно высокую эффективность данной комбинации пероральных гипогликемических средств. Снижение базального и постпрандиального уровней глюкозы, вероятно, отражает улучшение инкретиновой активности, что ведет к оптимизации отношения «инсулин/глюкагон», облегчению поглощения глюкозы тканями и снижению ее продукции печенью. Увеличение под действием ситаглиптина таких показателей, как НОМА-b, уровень С-пептида, отношение постпрандиальных уровней инсулина и глюкозы, базального отношения инсулина к проинсулину указывает на улучшение функции b-клеток и эффективности процессинга проинсулина. В то же время маркеры ИР в данном исследовании существенно не изменялись, что и ожидалось, исходя из механизма действия глиптинов, затрагивающего секрецию инсулина, но не влияющего на ИР.
Ситаглиптин в дозе 100 мг в день в основном хорошо переносился пациентами. За 30 недель наблюдения частота клинических ПЯ была близкой в обеих группах больных. В группе ситаглиптина не отмечено серьезных ПЯ, в то время как в группе плацебо зафиксировано 6 таких событий (в том числе фатальный инфаркт миокарда, 3 новообразования, перелом бедра, геморрагия ЖКТ). Не было достоверной разницы между группами в частоте гипогликемии, что согласуется с тем, что глюкозоснижающие эффекты ГПП-1 и ГИП являются глюкозозависимыми. Следует отметить, что у пациентов, принимавших ситаглиптин, не наблюдалось желудочно-кишечных ПЯ (боль в животе, диарея, тошнота, рвота), которые типичны при лечении метформином или же синтетическими аналогами ГПП-1.
В полном соответствии с предыдущими данными о том, что ситаглиптин не влияет на массу тела, в этом исследовании к концу 30-недельного срока наблюдения не было обнаружено существенных межгрупповых различий в массе тела при явном улучшении у пациентов гликемического контроля.
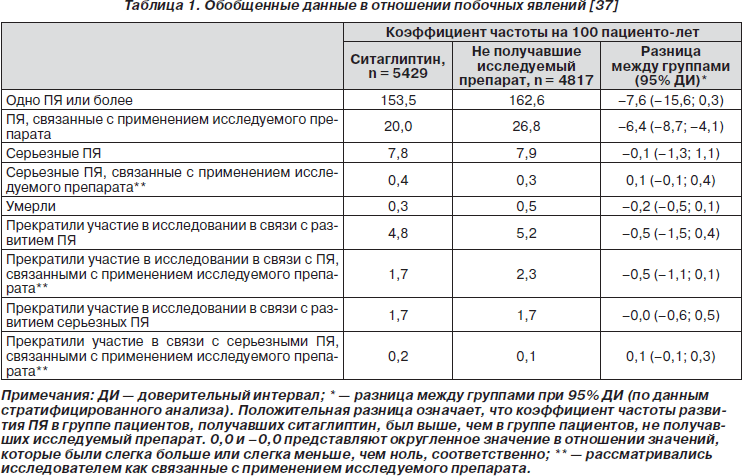
В 2010 г. опубликован подробный обобщенный анализ данных о безопасности и переносимости ситаглиптина (в дозе 100 мг/день) по результатам 19 двойных слепых рандомизированных клинических исследований, которые включали 10 246 больных СД 2-го типа. Из них 5429 больных получали 100 мг/день ситаглиптина, а группа сравнения, состоящая из 4817 больных, получала заменяющий агент (плацебо). Длительность наблюдения больных составила от 12 недель до 2 лет.
Группа, получавшая ситаглиптин в дозе 100 мг/сутки (n = 5429):
— 1805 пациентов получали терапию в течение как минимум 1 года;
— 584 пациента получали терапию в течение 2 лет;
— средняя продолжительность применения препарата составляла 282 дня.
Группа, не получавшая исследуемый препарат (n = 4817):
— 1320 пациентов получали терапию в течение как минимум 1 года;
— 470 пациентов получали терапию в течение 2 лет;
— средняя продолжительность применения препарата составляла 259 дней.
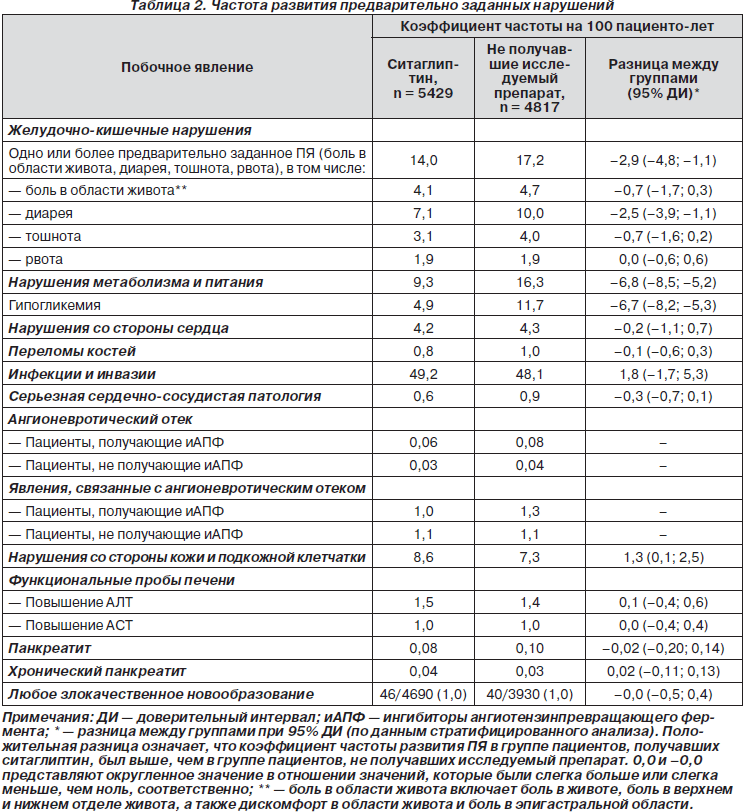
Среди специфических ПЯ, выявленных с частотой более 5 на 100 пациенто-лет, наиболее типичны гипогликемия, инфекции верхних дыхательных путей, диарея (более часты в группе ситаглиптина), назофарингиты, головная боль (чаще в группе больных, не получавших ситаглиптин) (табл. 2).
Частота связанных с лечением ПЯ была выше в группе, не получавшей ситаглиптин, в основном за счет большей встречаемости гипогликемии (7,5 против 3,5 на 100 пациенто-лет в группе ситаглиптина, или же 11,7 против 4,9 пациенто-года соответственно, после исключения данных о больных, у которых применялась экстренная гликемическая терапия). В представленном анализе различие в частоте гипогликемии объясняется тем, что в некоторых исследованиях в качестве заменяющего агента (контроль без ситаглиптина) были использованы производные сулфонилмочевины. В клинических исследованиях, в которых ситаглиптин применялся в качестве монотерапии, в сочетании с метформином или тиазолидиндионами, частота гипогликемии была такой же, как в группе плацебо. В тех случаях, когда ситаглиптин добавляли к терапии сульфаниламидами или инсулином, которые сами по себе могут провоцировать гипогликемию, их совместное действие повышало гипогликемический эффект терапии.
Кроме гипогликемии, в контрольной группе отмечена большая частота болей в области живота, диареи, гастритов, увеличения веса, парестезий. Запоры были единственным связанным с лечением ПЯ, частота которого была выше в группе ситаглиптина (2,6 против 1,9 на 100 пациенто-лет в контрольной группе).
Общая частота серьезных ПЯ была сходной в двух группах пациентов (7,8 и 7,9 на 100 пациенто-лет), так же как и частота кардиологических нарушений (Cardiac Disorders SOC) (4,2 и 4,3 на 100 пациенто-лет). Риск ССЗ для пациентов, получавших лечение ситаглиптином, по отношению к группе без лечения составил 0,67–0,68 (95% ДИ). Общая частота случаев злокачественных новообразований (Neoplasms SOC) была 2,2 на 100 пациенто-лет в группе ситаглиптина и 1,7 на 100 пациенто-лет — в контрольной группе. В обеих группах наблюдался довольно широкий спектр ПЯ этого класса, но с низкой частотой, составившей 0,8 на 100 пациенто-лет, с разницей между группами –0,1 (–0,5; 0,3). Переломы костей случались с частотой 0,8 на 100 пациенто-лет в группе ситаглиптина и 1,0 на 100 пациенто-лет в контрольной группе, разница между группами (95% ДИ) –0,1 (–0,6; 0,3).
Для инфекционных заболеваний, учащение которых может свидетельствовать об опасности иммунодефицита, обнаружено, что ситаглиптин не оказывает влияния на увеличение частоты, тяжести или длительности этих ПЯ по сравнению с контрольной группой. Не выявлено межгрупповых различий в частоте инфекций верхних дыхательных путей (вирусных, бактериальных и грибковых), бронхитов, пневмоний, инфекций мочеполового тракта (циститов, пиелонефритов) и других инфекций (стафилококковый сепсис, абсцессы, разные виды герпеса). Проведение тестов для оценки функции печени не выявило межгрупповых различий в частоте повышения активности АЛТ или АСТ.
Анализ безопасности ситаглиптина в отношении заболеваний почек показал, что разница между группами частоты выявления наличия белка в моче (в том числе альбуминурии, микроальбуминурии, альбумина в моче, белка в моче) составила 0,1 на 100 пациенто-лет (–0,2; 0,5) и была несколько выше в группе ситаглиптина. Тем не менее доля пациентов, у которых отмечено повышение уровня креатинина в сыворотке за время наблюдения более чем на 0,3 мл/дл, не отличалась в двух группах.
Результаты рассмотренного нами выше обобщенного анализа безопасности ситаглиптина по результатам 19 клинических испытаний, включивших более 10 000 человек [12], показали, что частота новообразований вообще и рака поджелудочной железы в частности у пациентов, получавших ситаглиптин, не отличалась от таковой у пациентов, не принимавших ситаглиптин. Прием ситаглиптина не был связан также с увеличением частоты панкреатита (число случаев острого панкреатита было 0,1 на 100 пациенто-лет в каждой группе).
В экспериментальных работах показано, что у грызунов ГПП-1 усиливает пролиферацию, ингибирует апоптоз b-клеток ПЖ и стимулирует дифференциацию стволовых клеток эпителия панкреатических протоков [3]. Зависимые от ГПП-1 эффекты, усиливающие процессы пролиферации b-клеток, действуют через активацию сигнальных путей, включающих фосфатидилинозитол-3-киназу, Akt, митоген-активируемую протеинкиназу, протеинкиназу Сz, киназу src, рецептор эпидермального фактора роста.
Из результатов обобщенного анализа можно сделать следующие выводы.
— В этом обобщенном анализе данных > 10 000 пациентов, принимавших участие в 19 рандомизированных контролируемых исследованиях длительностью до 2 лет, ситаглиптин продемонстрировал благоприятный профиль соотношения «польза/риск».
— Частота ПЯ, связанных с применением препарата, была выше в группе, не получавшей исследуемый препарат, что преимущественно связано с повышенной частотой развития гипогликемии.
Безусловно, факты в пользу безопасности очень важны при выборе препаратов для лечения пациентов с СД 2-го типа, так как многие из них имеют сочетанную патологию. Факты в пользу эффективности ситаглиптина доказаны в многочисленных исследованиях. При этом главным преимуществом нового класса препаратов является меньший риск развития гипогликемий и отсутствие прибавки в весе даже при длительном применении — до 2 лет.
Таким образом, в клинических исследованиях установлено, что ситаглиптин хорошо переносится пациентами. Не было отмечено нежелательных явлений ни после приема препарата, ни в результате лабораторных анализов. Не отмечено негативного влияния на иммунитет, функции печени и поджелудочной железы, желудочно-кишечного тракта, сердечно-сосудистой системы, частоту переломов костей, развития злокачественных новообразований. Случаи гипогликемии встречались реже, чем в группах больных, получавших плацебо или активные заменители, а частота и спектр нежелательных явлений сходны с таковыми в контрольной группе. Ситаглиптин также хорошо переносится в составе комбинированной терапии. Не обнаружено достоверных отличий в частоте и составе нежелательных явлений при использовании ситаглиптина в комбинации с метформином по сравнению с контрольными группами больных. Более того, доказано, что ситаглиптин в сочетании с метформином действует с помощью комплементарных механизмов, что приводит к более значительному снижению уровня глюкозы и увеличению уровня активного ГПП-1, обеспечивая уникальные преимущества в терапии СД 2-го типа. Все это свидетельствует о широких возможностях и перспективах применения ситаглиптина (Янувия, MSD) и других препаратов данного класса в современной стратегии лечения этого заболевания.
1. Aaboe K., Krarup T. et al. GLP-1: physiological effects and potential therapeutic applications // Diabetes, Obesity and Metabolism. — 2008. — 10. — 994-1003.
2. Ahren B., Pacini G., Foley J., Schweizer A. Improved meal-related (beta)-cell function and insulin sensitivity by the dipeptidyl peptidase-iv inhibitor vildagliptin in metformin-treated patients with type 2 diabetes over 1 year // Diabetes Care. — 2005. — 28 (8). — 1936-1940.
3. Holst J. Incretin Mimetics in the Treatment of Type 2 Diabetes Mellitus // European Endocrine Disease. — 2006. — 30-34.
4. Chang X., Keller D., Bjorn S., Led J. Structure and folding of glucagon-like peptide-1-(7-36)-amide in trifluoroethanol studied by NMR // Mag. Reson. Chem. — 2001. — 39. — 477.
5. Drucker D. Glucagon-like peptides: regulators of cell proliferation, differentiation, and apoptosis // Mol. Endocrinol. — 2003. — 17. — 161-171.
6. Huber B., Brunner S., Segeth A. et al. Parathyroid hormone is a DPP-IV inhibitor and increases SDF-1-driven homing of CXCR41 stem cells into the ischaemic heart // Cardiovascular Research Advance Access published. — 2011, February, 7. — P1-9.
7. Flamez D., Van Breusengem A., Scrocchi L. et al. Mouse pancreatic beta-cells exhibit preserved glucose competence after disruption of the GLP-1 glucagon-like peptide-1 receptor gene // Diabetes. — 1988. — 47. — 646-652.
8. Goke R., Wagner B., Fehmann H., Goke B. Glucose-dependency of the insulin stimulatory effect on glucagon-like peptide-1 (7-36)amide on the rat pancreas // Res. Exp. Med. (Berl.). — 1993. — 193. — 97-103.
9. Hansen P., Corbett J. Incretin hormones and insulin sensitivity // Trends Endoc. Metab. — 2005. — 16(4). — 135-136.
10. Holst J., Gromada J. Role of incretin hormones in the regulation of insulin secretion in diabetic and nondiabetic humans // Am. J. Phisiol. Endocrinol. Metab. — 2004. — 287. — E199-E206.
11. Holz G., Kuhtreiber W., Habener J. Pancreatic beta-cells are rendered glucose-competent by the insulinotropic hormone glucagon-like peptide-1 (7-37) // Nature. — 1993. — 361. — 646-652.
12. Nauck M., Heimesaat M., Orskov C. et al. Preserved incretin activity of glucagon-like peptide-1 [7-36]amide but not not synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus // J. Clin. Invest. — 1993. — 91. — 301-307.
13. Perley M., Kipins D. Plasma insulin responces to oral and intravenous glucose: studies in normal and diabetic subjects // J. Clin. Invest. — 1967. — 46. — 1954-1962.
14. Turton M., O’Shea D., Gunn I. et al. A role for glucagon-like peptide-1 in the central regulation of feeding // Nature. — 1996. — 379. — 69-72.
15. Williams-Herman D., Engel S., Round E. et al. Safety of sitagliptin in clinical studies: a pooled analysis of data from 10,246 patients with type 2 diabetes // BMC Endocrine disorders. — 1010. — V. 10, № 7. — P. 1-22.