Международный эндокринологический журнал 8 (40) 2011
Вернуться к номеру
Новая возможность достижения цели лечения пациентов с сахарным диабетом 2-го типа
Авторы: Аметов А.С., Карпова Е.В., ГОУ ДПО РМАПО Росздрава, г. Москва, Россия
Рубрики: Эндокринология
Версия для печати
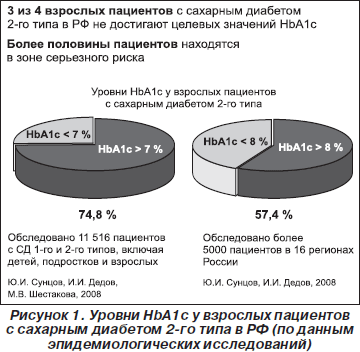
Когда говорят о сахарном диабете 2-го типа, ни у кого не вызывает сомнений, что речь идет о тяжелом и прогрессирующем заболевании, связанном с развитием как микрососудистых, так и макрососудистых осложнений. Развитие осложнений связывают в первую очередь с хронической гипергликемией, что было убедительно доказано в ходе длительных крупномасштабных исследований, в том числе UKPDS (United Kingdom Prospective Diabetes Study). К значительным факторам риска развития сосудистых осложнений заболевания также относится изменение показателей липидного спектра и уровня артериального давления. Очевидно, что единственным способом предотвратить или отсрочить развитие этих грозных осложнений является поддержание показателей уровней глюкозы крови, максимально приближенных к физиологическим, без повышения риска гипогликемии и без ущерба для качества жизни больных. В настоящее время по рекомендациям Американской диабетической ассоциации основной целью лечения сахарного диабета является снижение гликированного гемоглобина (HbA1c) до уровня < 7 %, а Европейской группой политики в области диабета рекомендован еще более жесткий критерий компенсации сахарного диабета — уровень гликированного гемоглобина < 6,5 %. Однако у большинства пациентов не удается добиться компенсации заболевания [13]. В Российской Федерации 74,8 % больных с сахарным диабетом 2-го типа не достигают целевых значений HbA1c < 7 % (Ю.И. Сунцов, И.И. Дедов, М.В. Шестакова, 2008) и, несмотря на наличие разнообразных групп сахароснижающих препаратов, 57,4 % пациентов с сахарным диабетом 2-го типа имеют уровень гликозилированного гемоглобина > 8 % (Ю.И. Сунцов, И.И. Дедов, 2006) (рис. 1). Поэтому ученые во всем мире занимаются поиском новых лекарственных средств для более эффективного управления этим заболеванием.
В последние годы значительно большее внимание со стороны ученых всего мира уделяется изучению роли гормонов желудочно-кишечного тракта — инкретинов в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека.
В настоящее время в научной литературе имеются многочисленные убедительные данные, свидетельствующие о важной роли таких гормонов желудочно-кишечного тракта, как глюкагоноподобный пептид 1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид, или желудочный ингибирующий пептид (ГИП). Эти гормоны получили название «инкретины». А их действие, приводящее к усилению глюкозозависимой секреции инсулина b-клетками поджелудочной железы, было названо эффектом инкретина.
Интересно отметить, что эффект инкретина был впервые описан двумя независимыми исследовательскими группами (McIntyre, Elrick) еще в 1964 году и характеризует действие пептидных гормонов, которые секретируются К- и L-клетками кишечника в ответ на прием пищи [4–6]. Известно, что ГИП секретируется энтероэндокринными К-клетками двенадцатиперстной кишки и проксимального отдела тощей кишки, а продукция ГПП-1 осуществляется преимущественно L-клетками подвздошной кишки и толстого кишечника.
Период полужизни циркулирующего биологически активного ГПП-1, к сожалению, меньше, чем 2 минуты. Такой короткий период полужизни ГПП-1 в плазме обусловлен протеазной активностью фермента дипептидилпептидазы-4 (ДПП-4).
В исследованиях было также установлено, что действие ГПП-1 не ограничивается только усилением экзоцитоза секреторных гранул из b-клеток, содержащих инсулин. ГПП-1 влияет также на a-клетки поджелудочной железы, подавляя секрецию глюкагона, что, в свою очередь, контролирует постпрандиальный уровень гликемии [9–12].
Определенный интерес представляют также данные о том, что эффект действия ГПП-1 проявляется путем мощного усиления, подобно «взрыву», секреции инсулина. Однако введение ГПП-1 не влияет на частоту и амплитуду пульсовой секреции инсулина (W. Porksen, 1998).
Имеются доказательства, что ГПП-1 действует как вещество, резко повышающее чувствительность b-клеток к глюкозе. При достижении максимально близких к нормогликемии показателей у больных сахарным диабетом 2-го типа в значительной степени увеличивается риск развития гипогликемий. В связи с этим уместно привести высказывание известного американского диабетолога Филлипа Крейера: «Если бы не разрушительные последствия гипогликемии, лечение сахарного диабета было бы очень легким» (P.E. Cryer, 1999).
В основном считается, что гипогликемия развивается за счет единственного фактора риска — повышения уровня инсулина. Это может наблюдаться при слишком большой дозе инсулина или пероральных сахароснижающих препаратов, слишком низком потреблении глюкозы с пищей, при повышенной утилизации глюкозы тканями (например, при чрезмерной физической нагрузке), а также при повышенной чувствительности к инсулину. Следует помнить, что гипогликемия сама по себе вызывает долговременные и серьезные проблемы при развитии тяжелых эпизодов, связанные в первую очередь с нарушением познавательной (когнитивной) функции.
Поэтому чрезвычайно клинически важным следствием зависимости эффектов ГПП-1 от концентрации глюкозы в крови, конечно, является то, что ГПП-1 не может вызвать развитие выраженной гипогликемии (кроме случаев одновременного применения с препаратами сульфонилмочевины, что требует просто снижения дозы последней группы препаратов). Это основано на том, что действие инкретинов на секрецию инсулина и глюкагона напрямую зависит от концентрации глюкозы в плазме крови и прекращается при снижении уровня глюкозы менее 3,0 ммоль/л.
Помимо этого, недавно было показано, что ГПП-1 способен ингибировать апоптоз b-клеток. В связи с тем, что нормальное количество b-клеток поддерживается равновесием процессов апоптоза и пролиферации, эти данные представляют огромный интерес и открывают возможность того, что ГПП-1 может оказаться эффективным при патологических состояниях, связанных с усиленной гибелью b-клеток. Все это позволяет предположить, что ГПП-1 может быть способным стимулировать образование новых b-клеток (неогенез) у пациентов с сахарным диабетом 2-го типа и недостаточным количеством функционирующих клеток (хотя к настоящему времени еще не выяснено, насколько этот процесс выражен у человека). Таким образом, не исключено, что новые методы терапии, основанные на действии инкретинов, смогут остановить прогрессирующее снижение массы функционирующих b-клеток при развитии дефицита секреции инсулина, что, в свою очередь, существенно замедлит прогрессирование заболевания.
Особый интерес для практической медицины представляют данные, касающиеся изучения секреции ГИП и ГПП-1 при сахарном диабете 2-го типа.
Так, в исследовании Toft — Nielsen обнаружили, что уровни ГИП натощак у больных сахарным диабетом 2-го типа близки к нормальным значениям. В то же время эти авторы, изучая секрецию ГПП-1 у больных с сахарным диабетом 2-го типа, выявили существенные нарушения этого энтерогормона при данном заболевании.
При сравнении секреции инсулина в ответ на пероральную и внутривенную нагрузку глюкозой при условии одинаковой концентрации глюкозы оказалось, что повышение секреции инсулина в ответ на пероральное введение у здоровых лиц достоверно выше, чем при сахарном диабете 2-го типа (Nauck, 1986). Необходимо напомнить, что у здоровых лиц ГПП-1 и ГИП обеспечивают 60–70 % общего инсулинового ответа после приема пищи. Однако при сахарном диабете 2-го типа эффект инкретина присутствует, но значительно снижен по сравнению со здоровыми лицами [9].
Говоря о нарушении эффекта инкретина при сахарном диабете 2-го типа, важно подчеркнуть, что при этом заболевании секреция ГПП-1 снижена на 20–30 % при сохранении в целом его инсулиностимулирующего действия. В то же время следует отметить, что секреция ГИП не меняется, однако установлено снижение его стимулирующего влияния на b-клетки поджелудочной железы [7, 8].
Причины этих нарушений окончательно не установлены, хотя большинство исследователей склоняется к тому, что нарушение секреции ГПП-1, очевидно, является следствием сахарного диабета 2-го типа.
В последнее десятилетие благодаря фундаментальным и клиническим исследованиям развилось новое перспективное направление в лечении сахарного диабета 2-го типа, основанное на использовании эффекта инкретина. Поскольку период полужизни ГПП-1 очень короткий, в клинической практике его невозможно использовать в качестве натурального препарата. В связи с этим было предложено ингибирование фермента ДПП-4, разрушающего естественные инкретины организма.
Первым ингибитором, который был создан, явился ситаглиптин (Янувия). Его действие основано на подавлении активности ДПП-4 с высокой степенью специфичности и повышении уровня собственного ГПП-1 за счет блокады его разрушения указанным ферментом. Причем ингибирование активности ДПП-4 проявляется достаточно быстро и отмечается уже через 30 минут после перорального применения, а продолжительность действия составляет около 24 часов. Поскольку действие инкретинов является глюкозозависимым, то и действие ситаглиптина (Янувии) является глюкозозависимым, т.е. препарат действует только при повышенном уровне глюкозы в крови.
В настоящее время Янувия зарегистрирована в Российской Федерации и рекомендована для лечения пациентов с сахарным диабетом 2-го типа как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами.
Эффективность ситаглиптина при его использовании в качестве монотерапии определена в целом ряде работ. В 12-недельном исследовании, в котором приняли участие пациенты с неудовлетворительным контролем диабета, отмечалось снижение уровня гликированного гемоглобина (HbA1c), исходно равного 7,8 %, по отношению к плацебо на 0,77 % [12]. Таким образом, у пациентов с сахарным диабетом 2-го типа с неудовлетворительной компенсацией монотерапия Янувией приводила практически к целевым уровням HbA1c.
Помимо этого, эффективность ситаглиптина в комбинированной терапии с другими пероральными сахароснижающими препаратами была наиболее детально изучена в ряде крупных международных исследований.
Известно, что сахарный диабет 2-го типа характеризуется нарушением регуляции гомеостаза глюкозы в системе «печень — периферические ткани — b-клетки поджелудочной железы». Основываясь на том, что комбинированная терапия метформином и ситаглиптином способна оказывать положительное влияние на все патофизиологические дефекты развития заболевания, на протяжении 2 лет проводилось исследование по изучению эффективности комбинации метформина и ситаглиптина в качестве терапии первой линии [1].
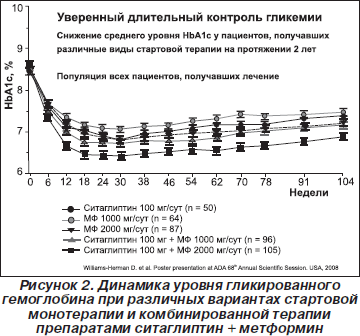
В данном исследовании пациенты получали комбинацию 100 мг ситаглиптина и 2000 мг метформина в сутки. Адекватность контроля гликемии оценивалась по изменению уровня HbA1c относительно исходного через 1 и 2 года терапии. В результате через 1 год терапии среднее снижение уровня HbA1c относительно исходного составило 1,8 %. При продолжении исследования (n = 105; исходный уровень HbA1c в данной группе пациентов — 8,6 %) среднее снижение уровня HbA1c к концу 2-го года терапии составило 1,7 % (рис. 2). Среди пациентов, получавших 100 мг ситаглиптина и 1000 мг метформина в сутки, среднее снижение уровня HbA1c составило 1,4 % (n = 147 через 1 год и n = 96 через 2 года). В то же время необходимо уточнить, что у пациентов, получавших ситаглиптин в монотерапии в дозе 100 мг 1 раз в сутки, среднее снижение уровня HbA1c относительно исходных значений составило 0,8 % в конце 1-го года (n = 106) и 1,2 % в конце 2-го года терапии (n = 50).
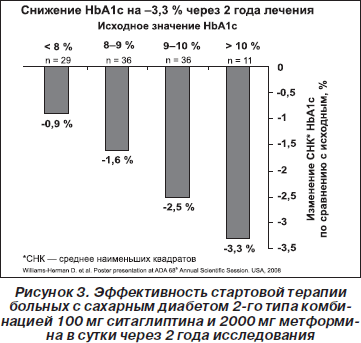
Далее при анализе подгруппы пациентов, имевших исходно высокие значения HbA1c, комбинация 100 мг ситаглиптина и 2000 мг метформина в сутки продемонстрировала более выраженное снижение средних значений HbA1c относительно исходного уровня, составивших в конце 1-го года терапии при исходных значениях HbA1c 10 % и более 3,1 %, 9–10 % — 2,2 %, 8–9 % — 1,7 % и менее 8 % — 1,0 %. Через 2 года терапии аналогичный показатель у больных, имевших исходный уровень HbA1c 10 % и более, составил 3,3 %, 9–10 % — 2,5 %, 8–9 % — 1,6 % и менее 8 % — 0,9 % (рис. 3).
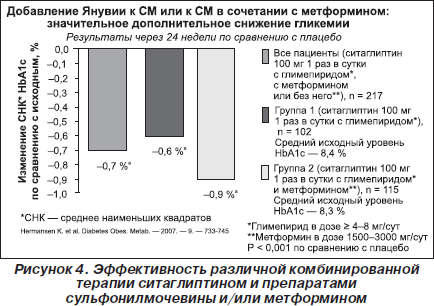
Проведено также рандомизированное двойное слепое исследование по оценке эффективности ситаглиптина (Янувия) в дополнение к метформину и/или препаратам сульфонилмочевины. В нем в течение 24 недель изучалась эффективность и безопасность добавления ситаглиптина у 441 пациента с сахарным диабетом 2-го типа в стадии декомпенсации (HbA1c от 7,5 до 10,5 %) либо к терапии комбинацией препарата сульфонилмочевины (глимепирид) и метформина, либо к монотерапии препаратом сульфонилмочевины (глимепирид). При анализе работы отмечалось статистически достоверное снижение уровня HbA1c по сравнению с плацебо — на 0,9 % при дополнительном назначении с глимепиридом и метформином и на 0,6 % — при дополнительном назначении с глимепиридом (рис. 4). Однако необходимо отметить, что в данном исследовании общая частота побочных эффектов при применении ситаглиптина была выше по сравнению с группой плацебо, в том числе чаще отмечались случаи развития эпизодов гипогликемии (12,2 % в группе приема ситаглиптина по сравнению с 1,8 % в группе плацебо). Эпизоды гипогликемии развивались при комбинированном применении с препаратами сульфонилмочевины. Поэтому для снижения риска развития гипогликемии может потребоваться уменьшение дозы препаратов сульфонилмочевины.
Учитывая данные проведенных исследований, необходимо отметить, что терапия ситаглиптином у большинства больных хорошо переносится. В целом частота развития эпизодов гипогликемии была сопоставимой либо существенно ниже по сравнению с контрольными группами. Среди наиболее часто встречающихся побочных эффектов отмечались заложенность носа, сухость во рту, головные боли, инфекционные заболевания верхних дыхательных путей и мочевыделительной системы (по сравнению с плацебо разница в среднем составляет от 0,1 до 1,5 %). Следует также отметить, что к преимуществам сахароснижающей терапии ситаглиптином относится нейтральное влияние на массу тела и возможность использования препарата в пероральной форме в отличие от инсулинотерапии и аналогов ГПП-1 [10].
Назначение ситаглиптина (Янувии) можно рекомендовать следующим пациентам с сахарным диабетом 2-го типа:
— пациенты с уровнем HbA1c выше 7 % (или гликемии натощак выше 6,1 ммоль/л), получающие метформин, или сульфонилмочевину, или комбинацию этих препаратов;
— пациенты с впервые выявленным сахарным диабетом 2-го типа — в виде монотерапии или стартовой терапии в комбинации с метформином;
— пациенты, по возможности, в ранней фазе заболевания, при которой количество b-клеток снижено еще незначительно, с целью защиты b-клеток;
— пациенты с проблемами веса:
а) с избыточным весом;
б) с нормальным весом, но со значительной прибавкой веса (более 2 кг за первый год) на фоне приема других пероральных сахароснижающих препаратов;
— пациенты с более высокой опасностью развития гипогликемии на фоне приема сульфонилмочевины:
а) пациенты, которые нерегулярно питаются;
б) худые; одинокие; пожилые пациенты;
в) водители автотранспорта;
г) пациенты, работающие с механизмами.
Таким образом, есть надежда, что в недалеком будущем мы сможем обеспечить лучший гликемический контроль у пациентов с сахарным диабетом 2-го типа, снижая уровень гликированного гемоглобина, уменьшая суточные колебания глюкозы, снижая риск развития гипогликемий и, наконец, действительно обеспечивая достойное качество жизни больных, реально управляя этим тяжелым и пока неизлечимым заболеванием с помощью ситаглиптина (Янувии) — первого представителя новой группы сахароснижающих препаратов, ингибиторов ДПП-4.
Впервые опубликовано в «Русском медицинском журнале», 2008, т. 16, № 28
1. Qi D.S. et al. Two year treatment with sitagliptin and initial combination therapy of sitagliptin and metformin provides substantial and durable glycemic control in patients with type 2 diabetes. EASD Abstract August, 2008.
2. Arjona Ferreira J. et al. Triple combination therapy with sitagliptin, metformin, and rosiglitazone improves glycemic control in patients with type 2 diabetes. EASD Poster August, 2008.
3. Аметов А.С. Регуляция секреции инсулина в норме и при сахарном диабете 2 типа: роль инкретинов // РМЖ. — 2006. — № 26.
4. McIntyre N., Holdsworth C.D., Turner D.S. New interpretation of oral glucose tolerance // Lancet. — 1964. — 41. — 20-21.
5. Creutzfeldt W. The (pre-) history of the incretin concept // Regul. Pept. — 2005. — 128. — 87-91.
6. Elrick H. Plasma insulin response to oral and intravenous glucose administration // J. Clin. Endocrinol. Metab. — 1964. — 1076-1082.
7. Ehses J.A., Casilla V.R., Doty T. et al. Glucose-dependent insulinotropic polypeptide promotes beta-cell survival via cyclic adenosine monophosphate-mediated caspase-3 inhibition and regulation of p-38 mitigen-activated protein kinase // Endocrinology. — 2003. — 144. — 4433-4445.
8. Toft-Nielsen M.-B., Damholt M.B., Madsbad S. et al. Determinats of the impaired secretion of glucagon-like peptide-1 in type 2 diabetic patients // J. Clin. Endocrinol. Metab. — 2001. — 86. — 3717-3723.
9. Nauck M., Stockmann F., Ebert R., Creutzfeldt W. Reduced incretin effect in type 2 (non-insulin-dependent) diabetes // Diabetologia. — 1986. — 29. — 46-52.
10. Романцова Т.И. Ингибитор дипептидилпептидазы-4 — ситаглиптин: новые возможности терапии сахарного диабета 2 типа // Ожирение и метаболизм. — 2006. — 4(9).
11. Maegawa H. et al. Sitagliptin added to ongoing treatment with pioglitazone study up-to 52 weeks in Japanese patients with T2DM. EASD Poster August, 2008.
12. Scott R.S. et al. Poster presented at the 41st Annual Meeting of the European Association for the Study of Diabetes (EASD). — Athens, Greece, September 12–15, 2005.
