Международный эндокринологический журнал 8 (40) 2011
Вернуться к номеру
Клинические и морфометрические предикторы заживления трофических язв нижних конечностей у пациентов с сахарным диабетом
Авторы: Баландина К.А., Курс эндокринологии кафедры факультетской терапии ГОУ ВПО «Северный государственный медицинский университет» (г. Архангельск) Федерального агентства по здравоохранению и социальному развитию
Рубрики: Эндокринология
Версия для печати
Введение
Быстрый рост распространенности сахарного диабета (СД) 2-го типа послужил основанием для экспертов ВОЗ объявить о пандемии этого заболевания. По прогнозу специалистов ВОЗ, к 2025 году количество больных диабетом должно достигнуть 380,0 миллиона человек [1]. Одним из самых частых и тяжелых хронических осложнений СД является поражение нижних конечностей, определяемое как синдром диабетической стопы (СДС). Поражения конечностей у больных диабетом являются основной причиной инвалидности этих пациентов и наносят серьезный социально-экономический ущерб. Несвоевременная диагностика СД и СДС, а также неправильная лечебная тактика приводят к осложненному течению заболевания и ампутации конечностей, которые фактически в мире выполняются каждые 30 секунд [2].
Анализ структуры поражений нижних конечностей по данным разных исследований убедительно продемонстрировал, что трофические язвы относятся к наиболее частому проявлению СДС и выявляются у 4–10 % больных [3]. Частота ампутаций конечностей составляет от 6 до 8 случаев в год на 1000 больных СД [4]. Тяжесть поражения конечностей при СДС приводит к двукратному увеличению смертности этих больных по сравнению с пациентами без этого осложнения диабета, а наиболее неблагоприятный прогноз имеют перенесшие ампутацию.
Помимо серьезного прогноза относительно жизни пациента, ампутация является высокозатратной частью расходов здравоохранения, так, если стоимость первичного заживления язвы составляет $7–17 тыс., то расходы, связанные с ампутацией нижней конечности, достигают $30–60 тыс. В России прямые расходы на ампутацию примерно такие же существенные и эквивалентны $1000–1200 [2]. Важным для клинической практики является доказанный факт, что 85 % ампутаций могут быть предотвращены при раннем выявлении СДС и проведении несложных профилактических мероприятий, снижающих риск образования язвы, а также при правильном лечении уже возникшей язвы.
Эпидемиологические исследования последних лет не вызывают сомнений в необходимости выработки мер по предотвращению и снижению частоты ампутаций у больных СД, а также по изучению и внедрению новых способов местного лечения язвенных дефектов.
Особый интерес вызывают препараты, улучшающие иммунный статус в области трофической диабетической язвы. При СД существует дисфункция макрофагов, сопровождающаяся снижением выработки цитокинов и факторов роста, имеющих большое значение в процессе репарации. К современным иммуномодулирующим препаратам относится группа бета-глюканов, являющихся гомополисахаридами, состоящими из бета-D-глюкопиразонил единиц. Растворимый препарат бета-1,3/1,6-глюкан, производимый компанией «Биотек Фармакон» (Норвегия), вырабатываемый из дрожжей Saccharomyces cerevisiae, является наиболее активным полисахаридом, усиливающим функцию макрофагов и ускоряющим процесс заживления ран. Благодаря способности растворимого бета-1,3/1,6-глюкана активировать и нейтрализовать дефекты макрофагов, имеющиеся при сахарном диабете, применение его на область диабетической язвы должно обеспечить ускорение ее заживления до полной эпителизации раны.
Также актуальными проблемами в клинической практике лечения диабетических язв остаются предикторы заживления и неблагоприятного прогноза, особенно для пациентов с высоким риском ампутации. Все вышеизложенное и определило актуальность проблемы, цель и задачи настоящего исследования.
Цель исследования — выявить особенности клинического фенотипа пациента с сахарным диабетом, имеющего трофическую язву нижних конечностей и установить факторы, влияющие на скорость и вероятность ее полного заживления, в том числе определить безопасность и эффективность местного использования растворимого геля бета-1,3/1,6-глюкана по сравнению с гелем-плацебо и стандартным алгоритмом лечения.
Материалы и методы исследования
Проведение сравнительной оценки эпидемиологической ситуации в Архангельской области с целью определения распространенности трофических язв нижних конечностей при сахарном диабете, частоты выполнения малых и больших ампутаций при осложненном течении синдрома диабетической стопы проводилось по данным общероссийского и Архангельского регистров сахарного диабета, опубликованных в монографии, обобщающей опыт 5-летней деятельности научно-практического проекта «Мобильный диабет-центр». Выполнялся анализ распространенности диабетической нейропатии и проявлений синдрома диабетической стопы, а также сравнение частоты выполнения малых и больших ампутаций в РФ и в Архангельской области. Проводился анализ ампутаций, выполняемых в профильном отделении лечения больных СДС (2-е хирургическое отделение) Первой городской клинической больницы скорой медицинской помощи (ПГКБ СМП) г. Архангельска за период с 2006 по 2008 год. Была проведена оценка работы кабинета диабетической стопы, функционирующего в составе ГЭЦ, с анализом ежегодных отчетов посещаемости и структуры выявляемой патологии у пациентов с сахарным диабетом.
Кроме того, в исследование были включены 23 пациента с нейроишемическими и нейропатическими язвами нижних конечностей. Стаж заболевания сахарным диабетом в среднем составлял 18,70 ± 12,50 года. Первичный отбор пациентов осуществлялся на основании критериев включения и исключения среди больных сахарным диабетом с трофическими язвами нижних конечностей в кабинете «Диабетическая стопа» Первой городской клинической больницы скорой медицинской помощи г. Архангельска (главный врач — народный врач СССР Е.Е. Волосевич) в период с 2003 по 2004 год. Данный этап работы являлся слепым рандомизированным исследованием первичной оценки возможности использования геля растворимого бета-1,3/1,6-глюкана для местного лечения у пациентов с диабетическими язвами. Бета-1,3/1,6-глюкан является наиболее активным полисахаридом, стимулирующим функцию макрофагов, запатентован и производится компанией «Биотек Фармакон» (Норвегия). Воздействие препарата на иммунную систему происходит через рецепторы распознавания структуры фагоцитов, что запускает серию внутриклеточных сигналов, приводя к активации клеток и образованию эффекторных молекул врожденного иммунного ответа, включая хемокины, цитокины, антимикробные вещества, и их превращение в эффективные киллеры микробных агентов и стимуляторы процесса заживления. Было высказано предположение, что бета-1,3/1,6-глюкан может способствовать более быстрому заживлению диабетических трофических язв 1–2-й степени тяжести по классификации Вагнера.
Критерии включения: информированное согласие на участие в исследовании, возраст больных от 18 до 80 лет, наличие сахарного диабета, сохранение дистального артериального кровотока (лодыжечно-плечевой индекс (ЛПИ) не менее 0,7), наличие хронической язвы нижних конечностей, купирование проявлений инфекции или целлюлита в области конечности до рандомизации в исследование, первичная хирургическая обработка язвы с удалением некротизированных тканей до рандомизации в исследование, размеры язвы должны быть более 1 см2 и менее 40 см2.
Критерии исключения: наличие остеомиелита в области язвы, суммарная площадь всех язв, превышающая 100 см2; наличие сопутствующей патологии, при которой необходимо использовать такие виды терапии, как облучение, или химиотерапия, или применение иммунодепрессантов и кортикостероидов; беременность или кормление; женщины фертильного возраста, не применяющие оральную гормональную контрацепцию.
Биохимические тесты проводились для оценки качества контроля СД (гликированный гемоглобин, гликемия натощак), почечной функции (креатинин), дислипидемии (общий ХС, ЛПНП, ТГ) на аппарате COBAS MIRA PLUS и наличия воспалительного синдрома (СОЭ, лейкоцитоз) на аппарате Hemolux AUTO hematology analyzer. Лодыжечно-плечевой индекс измеряли методом допплероманометрии с помощью индикатора ультразвуковой допплеровской скорости кровотока «Минидоп» фирмы «Биосс». Нейропатическими язвы считались при наличии у пациента дистальной нейропатии и ЛПИ в пределах 0,9–1,1. При ЛПИ в пределах 0,9–0,7 дополнительно выполняли дуплексное сканирование сосудов нижних конечностей ультразвуковым аппаратом ALKA 4000 линейным датчиком 10 мГц для исключения клинически значимых окклюзий и стенозов сосудов. Выполнялись стандартные тесты для диа-гностики тактильной, температурной, болевой, вибрационной чувствительности, рефлексов. Оценивались неблагоприятные события в ходе исследования.
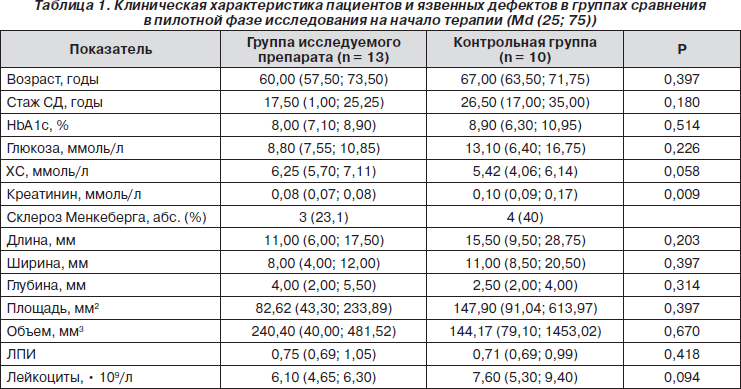
Клиническая характеристика групп сравнения
У большинства пациентов имелись следующие сосудистые поражения: ИБС — у 5 больных, облитерирующий атеросклероз нижних конечностей — у 8. Микрососудистые осложнения были зарегистрированы у 21 больного: у 12 из них отмечалась диабетическая нефропатия, у 10 — диабетическая ретинопатия. Группы сравнения не имели достоверных различий по возрасту и длительности заболевания, биохимическим показателям, клиническим особенностям и размерам язвы (табл. 1). У всех пациентов был неудовлетворительный контроль сахарного диабета, дислипидемия, некоторые больные имели диабетическую нефропатию. Состояние кровоснабжения нижних конечностей было сопоставимо в обеих группах: по 2 нейроишемические язвы в каждой группе, 11 нейропатических язв в группе исследуемого препарата и 8 — в группе сравнения. По результатам дополнительного обследования не было диагностировано критических стенозов и окклюзий сосудов. Таким образом, мы имели возможность правильно оценить влияние исследуемого препарата на процесс заживления язвенных дефектов относительно стандартной местной терапии язв, а также выявить клинически значимые факторы, влияющие на скорость этого процесса.
После завершения пилотной фазы и подтверждения первичной гипотезы о возможности использования исследуемого препарата для местного лечения диабетической трофической язвы нижней конечности было принято решение о выполнении двойного слепого клинического исследования с целью оценки эффективности и безопасности этого препарата относительно использования плацебо. Вторая фаза исследования выполнялась в период с 2005 по 2007 год на базе кабинета «Диабетическая стопа» при ГЭЦ г. Архангельска. Протокол и дизайн второй фазы исследования были составлены и утверждены отделом клинических исследований компании Biotec Pharmacon ASA (г. Осло, Норвегия), одобрены Национальным этическим комитетом РФ и Комитетом по этике ГОУ ВПО СГМУ.
Критерии включения: имеющийся у пациента сахарный диабет 1-го или 2-го типа; возраст пациента более 18 лет; наличие язвы, расположенной на ступне или в области нижней трети голени, существующей как минимум 4 недели до включения и соответствующей 1-й или 2-й степени по классификации Вагнера; адекватное кровоснабжение конечности, подтвержденное ЛПИ не менее 0,7; размеры исследуемой язвы > 1,0 см2, но < 20,0 см2; подписанное информированное согласие.
Критерии исключения: беременность, или лактация, или отсутствие адекватной контрацепции для фертильных женщин; тяжелое недоедание; клинические признаки гангрены конечности; активная или обширная флегмона; активный остеомиелит ступни с исследуемой язвой; некроз пальцев на стопе с исследуемой язвой; хирургические процедуры (за исключением санации) на ступне с исследуемой язвой, выполняемые в течение последних 21 дня, предшествующих визиту скрининга; исследуемая язва в области сустава Шарко; признаки инфицирования глубоких тканей в исследуемой язве на 0-м визите; если неисследуемая язва располагается на исследуемой стопе, ближе 5 см от исследуемой язвы на 0-м визите; уровень глюкозы в крови при случайном измерении > 25,0 ммоль/л, злоупотребление алкоголем или наркотиками.
Биохимические тесты, допплероманометрия и дуплексное сканирование сосудов нижних конечностей были выполнены на той же аппаратуре, которая была использована в пилотной фазе исследования.
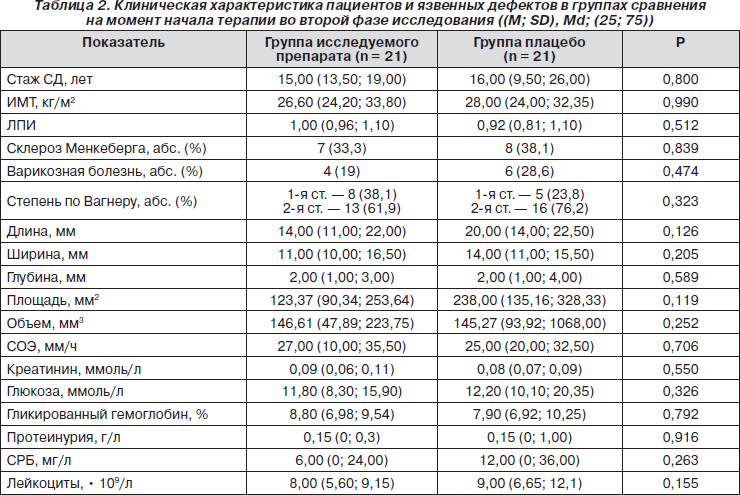
Клиническая характеристика групп сравнения
Группы сравнения второй фазы не различались по полу, возрасту, антропометрическим показателям, стажу заболевания (табл. 2). У 18 пациентов были проявления диабетической ретинопатии. Нефропатия имела место у 24 больных: стадия микроальбуминурии зарегистрирована в 12 случаях, протеинурии — в 7, в 5 случаях была диагностирована хроническая почечная недостаточность. У 17 больных имелась ИБС, а 3 пациента перенесли ОНМК (более 6 месяцев назад). В обеих группах преобладали нейропатические язвы: 12 — в группе исследуемого препарата, 9 — в группе «плацебо»; у 5 пациентов отмечены нейроишемические язвы в группе исследуемого препарата и у 7 — в группе «плацебо»; 9 язв были расположены в области голени, из них 4 — у пациентов группы исследуемого препарата и 5 — конт- рольной группы, а особенностью этих язв было сочетание в патогенезе диабетической нейропатии с варикозной болезнью нижних конечностей. Склероз Менкеберга имелся у 7 пациентов в группе исследуемого препарата и у 8 — в группе плацебо. Группы сравнения не различались по уровню лодыжечно-плечевого индекса, составу микрофлоры отделяемого трофической язвы, а также по размерам и локализации язвенных дефектов на момент начала терапии. Ни у кого из пациентов не было обнаружено клинически значимых стенозов артерий ниж-них конечностей. У всех пациентов были проявления хронической декомпенсации сахарного диабета в виде гипергликемии и повышенного уровня гликированного гемоглобина, имелись симптомы воспаления: умеренно повышенный уровень лейкоцитов, увеличенная СОЭ, повышение СРБ (табл. 2).
Математическая обработка данных проводилась с помощью программы SPSS for Windows v.13. Все данные были проверены на нормальность распределения. Количественные признаки, имеющие нормальное распределение, обозначались как среднее со стандартным отклонением (M; SD), не имеющие нормального распределения — как медиана Md (25-й; 75-й перцентили). При сравнении статистических гипотез использовали критический уровень значимости р < 0,05. В работе применяли дисперсионный анализ АNОVА и непараметрический тест Манна — Уитни для сравнения независимых групп. Первичные конечные точки были получены с помощью анализа выживаемости с переменной «дни» до полного заживления язв и выражены с помощью кривых выживаемости Каплана — Майера, лог-ранк-теста. Медиана и среднее время до полного заживления и 95% интервалы были получены в результате статистической обработки данных. Вклад препарата в заживление трофической язвы за определенный отрезок времени был установлен с помощью регрессионного анализа Кокса с получением 95% интервалов. Таким же образом были выявлены клинические предикторы заживления диабетической язвы. Построены регрессионные модели влияния клинических факторов и исследуемого препарата на процессы заживления язв с помощью регрессии Кокса. Вторичные конечные точки были определены по динамике уменьшения размеров в сравниваемых группах с помощью тестов Манна — Уитни и Уилкоксона. Были установлены относительные факторы риска появления новых язвенных дефектов и возможных ампутаций через год от начала наблюдения за пациентами в обеих группах.
Результаты исследования и их обсуждение
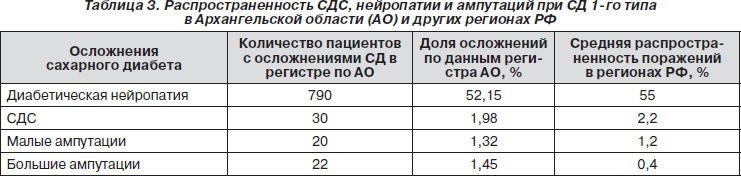
У больных СД 1-го типа доля малых ампутаций в Архангельской области незначительно превышала данные показатели по РФ, но калечащие пациента высокие ампутации встречались чаще (табл. 3).
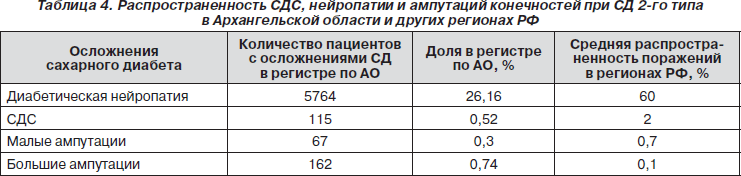
Как следует из представленных в табл. 4 данных, в когорте больных СД 2-го типа в Архангельской области распространенность диабетической нейропатии и синдрома диабетической стопы была в 3 раза меньше по сравнению с данными по РФ. Малые ампутации выполнялись в 2 раза меньше в нашем регионе, в то время как большие ампутации нижних конечностей встречались в 7 раз больше, чем по данным в РФ.
По данным регистра Архангельской области (М.А. Старцева, 2009), на протяжении последних 6 лет сохраняется большая частота высоких ампутаций нижних конечностей (29–35 вновь выявленных случаев в год).
Анализ отчетов 2-го хирургического отделения ПГКБ СМП г. Архангельска за последние 3 года позволил установить, что частота ампутаций и количество койко-дней у больных СДС в этом отделении была выше, чем в Архангельской области (по данным регистра), но при этом доля высоких ампутаций была на 33 % меньше. Уверенная тенденция снижения общего количества высоких ампутаций в г. Архангельске появилась в последнее время и была обусловлена внедрением междисциплинарного подхода к лечению и профилактике трофических язв в этом ведущем клиническом учреждении (табл. 5).
Анализ годовых отчетов подразделений стационара и амбулаторного звена не дает возможности точно оценить распространенность диабетических язв и ампутаций у больных СД в пределах г. Архангельска и области. Большая частота высоких ампутаций конечностей в Архангельской области у больных СД свидетельствует об отсутствии профилактических мероприятий в когорте пациентов с факторами риска СДС.
К концу лечебного периода в группе исследуемого препарата полностью зажили 12 язвенных дефектов из 13, а в контрольной группе — 4 из 10. Медиана времени полного заживления диабетической язвы была 35 дней в группе исследуемого препарата (Md = 35,00 (17,50; 80,50)) и 84 дня (Md = 84,00 (28,00; 84,00)) в группе сравнения соответственно (р = 0,072). При анализе времени заживления язв с помощью кривых выживаемости Каплана — Майера и лог-ранк-теста было установлено, что лучший результат местного лечения язвы отмечался при использовании исследуемого препарата по сравнению со стандартной терапией (p = 0,017). Регрессионный анализ Кокса показал, что использование исследуемого препарата повышало шанс полного заживления язвенного дефекта в 3,46 раза (95% CI 1,10; 10,83), p = 0,033, на любом временном отрезке лечения. Данное исследование убедительно продемонстрировало эффективность бета-1,3/1,6-глюкана и его способность сокращать период заживления язвы. Отсутствие нежелательных явлений свидетельствует о безопасности данного препарата.
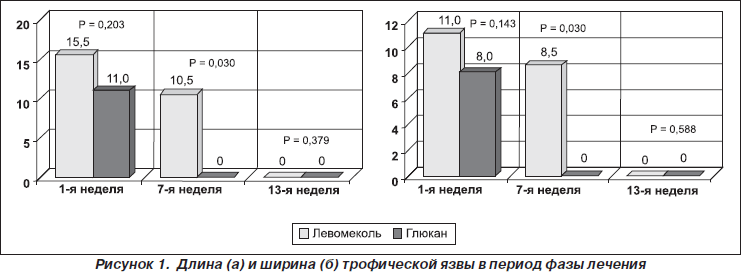
Длина язвы в группах сравнения на 1-й (р = 0,203) и на 13-й неделе (р = 0,379) достоверно не различалась, но достоверно отличалась в середине лечебной фазы на 7-й неделе (р = 0,030) с меньшим показателем в исследуемой группе (рис. 1). Ширина язвы на момент начала терапии (р = 0,143) и при окончании (р = 0,588) значимо не различались, но достоверное уменьшение ширины язвы отметили в лечебной группе на 7-й неделе (р = 0,030) (рис. 1). Динамика еженедельного уменьшения глубины язвы в группах сравнения не имела достоверных различий.
Мы выявили, что под воздействием препарата достоверно уменьшались длина, ширина и площадь язвы в период с 1-й по 7-ю недели лечения по сравнению с результатами в группе контроля. Таким образом, результаты пилотного исследования подтвердили нашу гипотезу о возможности применения исследуемого препарата для местного лечения трофической язвы нижних конечностей у больных сахарным диабетом, что явилось основанием для выполнения второй фазы исследования.
Результаты 2-й фазы исследования убедительно продемонстрировали, что трофическая язва нижней конечности достоверно быстрее заживала в группе лечения, в которой среднее время составило 56 дней (Md = 56,00; 35,00; 84,00), в то время как в группе плацебо — 84 дня (Md = 84,00; 77,00; 84,00, р = 0,019). В пределах фазы лечения в течение 12 недель в группе исследуемого препарата полностью зажили 14 язв, а в группе плацебо — только 7 язв при изначально сопоставимых размерах трофической язвы в обеих группах. При анализе времени заживления язв с помощью «кривых выживаемости» Каплана — Майера и лог-ранк-теста было установлено, что лучший результат был в случаях использования исследуемого препарата, наносимого непосредственно на область язвы, чем при использовании плацебо (p = 0,018) (рис. 2). Регрессионный анализ Кокса позволил установить, что местное применение бета-1,3/1,6-глюкана достоверно повышало шанс полного заживления язвенного дефекта в 2,78 раза (95% CI 1,12; 6,92), p = 0,028, на любом отрезке времени процесса заживления.
В случаях использования препарата гель бета-1,3/1,6-глюкана не было зафиксировано нежелательных явлений, в то время как в контрольной группе произошли неблагоприятные события: у 4 пациентов развился остеомиелит пальцев с последующей ампутацией, у 2 — флегмона стопы. Также безопасность применения препарата была подтверждена результатами биохимических исследований, выполненных по окончании лечения.
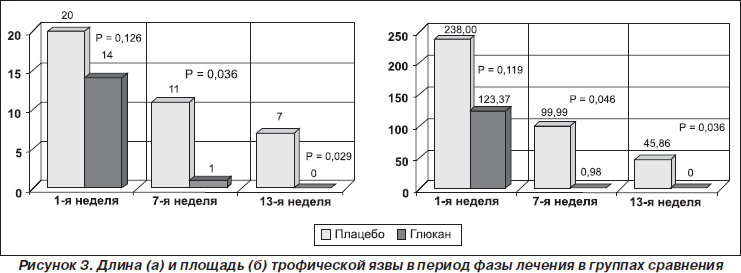
При включении пациентов в исследование длина язвы в обеих группах достоверно не различалась (р = 0,126), было зарегистрировано более быстрое уменьшение размеров язвы к середине лечения (р = 0,036) и к концу исследования (р = 0,029), с достоверными изменениями только в группе исследуемого препарата (рис. 3). При включении пациентов в исследование площадь язвы в обеих группах также достоверно не различалась (р = 0,119). В процессе лечебной фазы было отмечено достоверное уменьшение площади язвы на 7-й (р = 0,046) и на 13-й неделе лечения (р = 0,036) в группе исследуемого препарата (рис. 3).
При включении пациентов в исследование объем язвы в обеих группах достоверно не различался (р = 0,252). В процессе лечебной фазы достоверная разница уменьшения объема язвы появилась на 7-й (р = 0,023) и на 13-й неделе лечения (р = 0,044) в группе исследуемого препарата. При проведении парного сравнения динамики уменьшения глубины язвы внутри каждой группы были получены данные о более быстром уменьшении этого показателя в группе исследуемого препарата, особенно отчетливое в период с 1-й по 7-ю недели лечения (Z = –2,86, р = 0,004) и с 7-й по 13-ю неделю (Z = –2,46, р = 0,014). В группе плацебо достоверного снижения глубины язвы в эти периоды лечения не наблюдалось (Z = –1,23, р = 0,219).
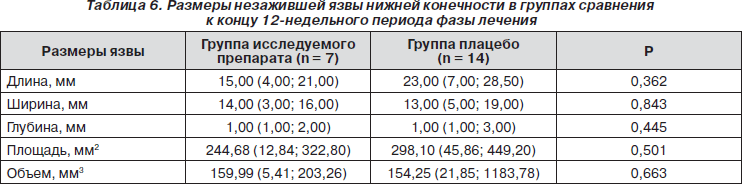
К концу 12-й недели лечения в группе исследуемого препарата не зажили 7 язвенных дефектов, а в группе плацебо — 14. Достоверных различий по размерам язвы к концу лечебной фазы не отмечалось, но при применении исследуемого препарата конечные параметры язвы были меньше, чем при терапии плацебо (табл. 6). Также отмечалась статистическая тенденция к снижению показателей, отражающих наличие воспалительного процесса в организме в группе исследуемого препарата, о чем свидетельствовали более низкие средние показатели СРБ и СОЭ, в отличие от группы плацебо.
После завершения 2-й фазы плацебо-контролируемого исследования мы продолжили наблюдение за больными в течение последующего года. В анализируемый промежуток времени в лечебной группе из незаживших 7 язв в 4 случаях язвы полностью закрылись, одна язва не зажила и были выполнены 2 ампутации пальцев стопы. В группе плацебо из 14 незаживших язв 5 зажили, 4 — не зажили в течение года и было выполнено 5 малых ампутаций. Таким образом, в целом в этой группе из 42 пациентов 5 язв (11,9 %) не зажили и в течение последующего года лечения. У этих пациентов было выполнено 7 малых ампутаций, что составило 16,6 %. Через год после выполнения исследования в группе исследуемого препарата малые ампутации были выполнены в 8,33 % случаев, а в группе плацебо — в 19,44 % (c2(1) = 1,65, р = 0,199). Относительный риск выполнения ампутаций оказался в группе исследуемого препарата в 2,09 раза меньше, чем в контрольной группе плацебо (RR = 2,09, 95% СI 0,64–6,82). В группе исследуемого препарата вновь через год появились трофические язвы в 8,82 % случаев, а в группе плацебо возникновение новых язв было в 20,59 % случаев (c2(1) = 1,66, р = 0,198), то есть в 2,3 раза больше, чем в группе пациентов, получавших препарат. Относительный риск появления новых язв оказался в 2,07 раза меньше в группе исследуемого препарата, чем в группе плацебо (RR = 2,07, 95% СI 0,64–6,70).
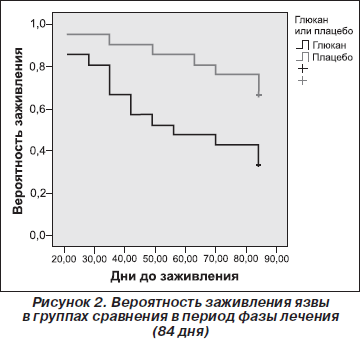
С целью оценки влияния препарата бета-1,3/1,6-глюкана на время, требующееся для полного заживления язвы, мы объединили базы данных по двум фазам исследования: пилотной и с анализом времени заживления при помощи кривых выживаемости Каплана — Майера и лог-ранк-теста. Мы установили значительное ускорение процесса заживления в группе применения исследуемого препарата на протяжении 12-недельной лечебной фазы (р = 0,01). Как следует из графика кривых выживаемости Каплана — Майера, вероятность заживления язвы за 12-недельный период лечения (к 84-му дню) в группах сравнения была разной. В группе без использования исследуемого препарата, эта вероятность была менее 40 %, а в группе исследуемого препарата она составила почти 80 %. Регрессионный анализ Кокса показал, что местное применение бета-1,3/1,6-глюкана повышало шанс полного заживления язвенного дефекта в 3,08 раза (95% CI 1,52–6,28) (p = 0,002) на любом отрезке лечения.
Для дальнейшей оценки факторов, влияющих на заживление язвы, все язвы нижних конечностей разделили на 3 группы: нейропатические, нейроишемические и язвы нижней трети голени. В группу больных с нейропатической язвой вошли 33 пациента, из них 19 человек получали в качестве дополнительной местной терапии на область язвы гель бета-1,3/1,6-глюкана. Согласно данным регрессионного анализа в этой группе вероятность заживления язвы была в 2,27 (1,00; 5,37) раза выше, чем в группе плацебо. Скорость заживления при использовании исследуемого препарата была также достоверно больше при оценке кривых выживаемости (p = 0,042). В группе нейроишемической язвы, состоявшей из 18 больных, 11 пациентов получали местно на область язвы исследуемый препарат. Скорость заживления нейроишемической язвы при использовании исследуемого препарата была также больше, чем в группе без его использования (р = 0,049), но влияние исследуемого препарата было менее достоверным, хотя и отмечалась уверенная статистическая тенденция к увеличению шанса достижения конечной точки в 6,1 раза (0,75; 49,69) в группе исследуемого препарата. Мы полагаем, что при увеличении объема выборки статистическая значимость вероятности заживления нейроишемической язвы, возможно, могла бы усилиться. В группе трофических язв с локализацией в области нижней трети голени было 14 пациентов, при этом большая часть (10 чел.) входили в группу контроля и не получали исследуемый препарат. При анализе скорости заживления определялась положительная тенденция достижения конечной точки в группе лечения (р = 0,077), но при использовании кривых выживаемости статистическая тенденция не достигла достоверности из-за недостаточной выборки. С помощью регрессионного анализа для оценки возможности исследуемого препарата увеличивать скорость заживления язвы также была выявлена только статистическая тенденция к ускорению этого процесса в 4,1 раза (0,68; 24,63) по сравнению с терапией без него.
Помимо воздействия исследуемого препарата на скорость заживления трофической язвы при сахарном диабете мы изучали некоторые другие клинические предикторы, ускоряющие или замедляющие этот процесс. Для определения значимых факторов заживления был выбран регрессионный анализ Кокса, который позволил нам проанализировать влияние каждого предиктора в отдельности на процесс заживления трофической язвы в зависимости от количества затраченных на лечение дней (в нашем случае 84 дня). При определении значимых предикторов для заживления язвы мы использовали каждый фактор в регрессии поочередно и выявляли достоверность полученных коэффициентов. Среди клинико-антропометрических показателей пациентов отрицательно влияли на скорость заживления язвы стаж сахарного диабета (HR = 0,93, 95% CI 0,89–0,97) и уровень систолического системного артериального давления (HR = 0,98, 95% CI 0,97–0,99). На процесс заживления трофической язвы негативно влияли скорость оседания эритроцитов, определяемая до начала лечения (HR = 0,97, 95% CI 0,95–0,99), и исходный уровень креатинина (HR = 0,001, 95% CI 0,001–0,768). В то же время предположительно клинически значимые при сахарном диабете факторы, такие как степень компенсации сахарного диабета на основании уровня гликированного гемоглобина (HR = 1,02, 95% CI 0,85–1,23); лейкоцитоз (HR = 0,88, 95% CI 0,77–1,002); С-реактивный белок (HR = 0,99, 95% CI 0,98–1,01), не оказались предикторами, достоверно влияющими на скорость заживления язвы. В нашей выборке исходный уровень креатинина негативно влиял на скорость заживления язвы, хотя его значение было минимальным, а при дальнейшем анализе этот показатель не оказался значимым предиктором заживления. Корреляционный анализ и линейный регрессионный анализ не выявили статистически значимого влияния фактора нефропатии — как ее наличия, так и отсутствия (HR = 1,18, 95% CI 0,62–2,26) — на скорость заживления трофических язв. Результаты выполненных нами исследований демонстрируют, что при увеличении ЛПИ в цифровом значении шанс того, что заживление произойдет быстрее, возрастает в 12,37 раза (95% СI 2,50–61,17). В целом при анализе всей выборки оказалось, что нейропатические (HR = 2,71, 95% CI 1,37–5,38) трофические язвы заживают быстрее, чем нейроишемические (HR = 0,61, 95% CI 0,28–1,33) и язвы с локализацией в нижней трети голени (HR = 0,41, 95% CI 0,16–1,05). В нашей работе были получены данные о том, что наличие склероза Менкеберга отрицательно сказывается на скорости заживления трофической язвы (HR = 0,30, 95% CI 0,12–0,75), что может несколько противоречить общепринятым данным, поскольку наличие кальциноза мелких сосудов стопы рассматривается как характерное проявление нейропатических диабетических язв. Трофические язвы заживали медленнее, если изначально имели большую длину (HR = 0,93, 95% CI 0,89–0,98) и ширину (HR = 0,94, 95% CI 0,89–0,99), в то время как глубина язвы не оказала достоверного влияния на скорость заживления язвы в обсуждаемой выборке больных (HR = 0,93, 95% CI 0,81–1,06).
Дальнейшей нашей целью было построение математической модели прогноза заживления, которое выполнили при использовании регрессионного анализа Кокса, учитывающего временной фактор заживления. Все вышеперечисленные отрицательные и положительные предикторы были включены в регрессию и затем автоматически убирались наименее значимые из них. В результате наибольшую предсказательную значимость для прогнозирования скорости заживления язвенных дефектов имели следующие предикторы: исследуемый препарат бета-1,3/1,6-глюкан, стаж сахарного диабета, длина язвенного дефекта, повышение систолического артериального давления. Модель была достоверной в определении конечного исхода — вероятности полного заживления язвы за определенный промежуток времени (–2 LL = 249, 69, c2(4) = 30,99, p < 0,001). В данной модели вклад каждого фактора был достоверным. При применении исследуемого геля скорость заживления увеличивалась в 2,59 раза (95% CI 1,24–5,39). С увеличением стажа сахарного диабета на 1 год скорость заживления уменьшалась в 0,93 раза (95% CI 0,89–0,98). Также чем больше была длина раны в миллиметрах до лечения, тем медленнее она затягивалась, — если быть точными, то в 0,95 раза (95% СI 0,91–0,99). С увеличением систолического артериального давления скорость заживления язвы уменьшалась в 0,98 раза (95% CI 0,97–0,99).
В нашей модели было небольшое количество предикторов, но она является предсказательной. Для данной мощности выборки обследованных больных такое количество предикторов оптимально. Применение этой модели в повседневной практике не должно составить трудностей, является экономически дешевым, но достоверным способом прогноза заживления трофической язвы нижних конечностей у больного сахарным диабетом.
Выводы
1. Клинический фенотип пациента сахарным диабетом и трофической язвой нижних конечностей характеризуется длительным стажем заболевания, неудовлетворительным контролем метаболизма, наличием сосудистых осложнений, особенно хронического заболевания почек и ишемической болезни сердца, а также склероза Менкеберга и проявлений общего воспалительного синдрома (увеличение СОЭ, лейкоцитоз, высокий уровень СРБ).
2. В Архангельской области на протяжении последних лет наблюдалась большая распространенность высоких ампутаций нижних конечностей у больных СДС по сравнению со средними данными по РФ: при СД 1-го типа — в 3,6 раза чаще, а при СД 2-го типа — в 7 раз. После создания кабинета «Диабетическая стопа» и внедрения современного стандарта лечения трофических диабетических язв нижних конечностей, базирующегося на основе междисциплинарного подхода и преемственности оказания помощи, в течение последующих трех лет (2006–2008 гг.) в г. Архангельске в 2 раза снизилась частота больших ампутаций — с 63,2 до 38,5 %.
3. Скорость репаративного процесса трофической диабетической язвы нижней конечности, а также шансы ее заживления достоверно увеличивались при использовании в качестве местного лечения геля растворимого бета-1,3/1,6-глюкана с медианой времени до конечной точки 35 дней, в то время как при стандартном лечении и использовании плацебо этот процесс занимал 84 дня.
4. В группах применения исследуемого препарата отсутствовали нежелательные явления и признаки токсичности, что позволило сделать заключение о безопасности данного препарата при достоверном ускорении процесса заживления в среднем более чем в 3 раза.
Клинически значимыми предикторами скорости заживления оказались ЛПИ и систолическое артериальное давление, стаж СД, склероз Менкеберга, а также ширина и длина язвы, показатель СОЭ, увеличение которых снижало скорость заживления, в то время как она увеличивалась при нейропатической язве и применении исследуемого препарата, вклад которого был существенным и достоверным.
1. Сахарный диабет и артериальная гипертензия / И.И. Дедов, М.В. Шестакова. — М.: Изд-во ООО «Медицинское информационное агентство», 2006.
2. Aspects of Foot Problems in Diabetes. The Foot in Diabetes. — 3rd edition 2000. — P. 3-17.
3. Williams R., Airey M. The size of the problem: Epidemiological and Economic with Diabetes Mellitus // Pharmacoeconomics. — 2000. — Vol. 18(3). — P. 225-238.
4. Клинические маркеры позднего заживления язв нижних конечностей у пациентов с нейроишемической формой синдрома диабетической стопы / Т.А. Зыкова, К.А. Баландина, А.В. Стрелкова и др. // Бюллетень СГМУ. — 2007. — № 1. — С. 14.