Международный эндокринологический журнал 8 (40) 2011
Вернуться к номеру
Особенности течения сахарного диабета при тревожных состояниях
Авторы: Мошняга Е.Н., ГУ «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» Министерства здравоохранения Московской области
Рубрики: Эндокринология
Версия для печати
Введение
Сахарный диабет (СД) — тяжелое хроническое заболевание с высоким риском инвалидизирующих осложнений и преждевременной смертности, что обусловливает его высокую медико-социальную значимость, диктуя необходимость оказания пациентам непрерывной высококвалифицированной помощи [1]. Лечение больных СД направлено на продление жизни путем профилактики острых и поздних осложнений и сохранение качества жизни (КЖ) [2]. Несмотря на прогресс в терапии СД, достижение этих задач у большой части пациентов все еще остается проблематичным.
Психоэмоциональное состояние больных СД — один из важных факторов, влияющих на поведение, связанное с СД (комплайентность), компенсацию углеводного обмена и диабетзависимое КЖ [3]. Несмотря на большое количество исследований по депрессии [4], состояния патологической тревоги при СД крайне мало изучены не только отечественными, но и зарубежными авторами. Практически не исследованы патогенетические особенности тревожных расстройств (ТР) у больных СД, влияние ТР на компенсацию углеводного обмена, риск развития острых и хронических осложнений СД, когнитивные функции и КЖ; не определена тактика оптимальной терапии ТР у больных СД. ТР у больных СД являются большой дифференциально-диагностической проблемой, так как в их клинической картине имеются соматические симптомы со стороны внутренних органов, которые могут быть ошибочно интерпретированы как проявления диабетических вегетативной нейропатии, микро- и макроангиопатий. В связи с этим изучение эпидемиологии, клинических особенностей и возможностей терапии ТР у больных СД, а также их влияния на течение СД представляется важным и актуальным.
Цель работы — изучение клинических и лабораторных особенностей СД и эффективности противотревожной терапии у больных СД с сопутствующими тревожными расстройствами.
Материалы и методы исследования
Проведено сравнительное изучение клинико-лабораторных особенностей и течения СД у больных с ТР и с нормальным (непатологическим) уровнем тревоги (исследование «поперечного» типа). Последовательный набор пациентов в отделении терапевтической эндокринологии ГУ МОНИКИ им. М.Ф. Владимирского проводили в 2006–2008 гг., включая всех больных СД1 и СД2, соответствовавших критериям: мужчины и женщины > 18 лет, длительность СД не менее 6 мес., наличие информированного согласия. Критериями исключения были отказ от участия в исследовании, выраженное снижение остроты зрения, беременность, ургентные состояния на момент обследования, острые и хронические психозы. В этот раздел вошли 200 больных (48 мужчин и 152 женщины): СД1 — 61 (30,5 %), СД2 — 139 человек (69,5 %), в возрасте 50,7 ± 15,0 года, с длительностью СД 11,1 ± 9,4 года. Исходно все прошли скрининг на депрессию (шкала CES-D); 24 % больных с суммой баллов ≥ 26 исключили из дальнейшего обследования из-за необходимости изучения «чистых» ТР, без коморбидной депрессии. Остальные 153 чел. участвовали в основной части исследования и были разделены на 3 группы: больные СД с ТР (57 %), больные СД с другими психическими расстройствами (ПР) (13 %), больные СД без ПР, или «условная норма» (30 %); после консультации психиатра были окончательно исключены больные депрессией для выделения группы «чистых» ТР. Влияние ТР на особенности течения СД изучали путем сравнения 87 больных СД с «чистыми» ТР без депрессии с 46 больными СД без ТР и депрессии («условная норма»).
Далее проведено открытое рандомизированное (простая рандомизация 1 : 1) проспективное сравнительное исследование гидроксизина (атаракса) и тофизопама (грандаксина) у 60 больных СД1 и СД2 с генерализованным и органическим ТР (ГТР и ОТР) и субсиндромальной тревогой (ССТ). Длительность терапии составила 3 мес., наблюдение после отмены препаратов — 1 месяц. После консультации психиатра на момент включения дальнейшее наблюдение больных и назначение препаратов, подбор дозы, оценку эффективности и безопасности терапии и состояния после ее отмены выполнял врач-эндокринолог, прошедший подготовку по вопросам диагностики и лечения ТР.
Всем больным проводили стандартное клиническое обследование, включающее физикальное исследование с оценкой АД, ЧСС и ЭКГ, биохимический анализ крови (Hitachi 912, Япония), определение HbA1c (DiaSTAT, США; норма 4–6,3 %). Осложнения СД диагностировали по принятым стандартам, включая консультации специалистов. Больные получали лечение по стандартам отделения. Для скрининговой оценки функции ГГНС провели малую пробу с 1 мг дексаметазона (МПДм) 99 больным СД. Уровень кортизола в плазме определяли методом иммунохемилюминесценции (Immulite 2000, США).
Психическое состояние оценивали клинико-психопатологическим методом. Диагнозы ТР ставил психиатр по критериям МКБ-10. Диагноз ОТР ставили при наличии у больного клиники ГТР в сочетании с клиническими признаками психоорганического синдрома. ССТ диагностровали при наличии симптомов ГТР, выраженных недостаточно для диагноза ГТР по МКБ-10. В работе использовали следующие психологические методики: шкала тревоги/тревожности Спилбергера, опросник депрессии CES-D, Гиссенский опросник соматических жалоб (ГОСЖ), опросник диабетзависимого КЖ (Ru-ADDQoL), методика многостороннего исследования личности (ММИЛ), многофакторный личностный опрос- ник 16PF. Когнитивные функции оценивали с помощью батареи тестов (корректурная проба, расстановка чисел, запоминание 10 слов) и электрофизиологического метода — определения критической частоты слияния мельканий (КЧСМ) светодиода (В. Розенблат, 1983).
Разработку русскоязычной версии Торонтской шкалы алекситимии из 20 пунктов (TAS-20) проводили в сотрудничестве с автором шкалы (проф. Г. Тэйлор, Университет Торонто, Канада) по правилам лингвистической и психометрической валидизации.
Для оценки ГОСЖ как средства скрининга на ТР определяли его чувствительность, специфичность, положительную и отрицательную диагностическую значимость и диагностическую точность (Д. Эйрон, 2011). Референсным методом служил клинический психиатрический диагноз ТР, поставленный по критериям МКБ-10.
Количественные переменные обрабатывали методами описательной статистики (даны как средние ± стандарт-ное отклонение, медианы и 1-й, 3-й квартили). Количественные переменные в независимых группах сравнивали с помощью непарного t-критерия Стьюдента, ANOVA или критерия Манна — Уитни, в зависимости от распределения данных; качественные переменные — с помощью теста c2 и точного теста Фишера. Динамику внутри групп оценивали с помощью парного критерия Стьюдента и знакового критерия Вилкоксона. Анализ корреляций между переменными проводили по методу Спирмена. Результаты сравнительного исследования анксиолитиков анализировали у больных, закончивших исследование по протоколу (n = 47). Внутреннюю согласованность и гомогенность шкалы TAS-20-R оценивали по коэффициенту a Кронбаха (≥ 0,70) и коэффициентам межпунктовой корреляции (приемлемый диапазон 0,20–0,40). Для характеристики конвергентной и дискриминантной валидности TAS-20-R рассчитывали коэффициенты корреляции Пирсона между суммарным баллом (СБ) этой шкалы и факторами 16PF, а также СБ ГОСЖ и баллами его субшкал. За уровень статистической значимости брали a = 0,05.
Результаты исследования и их обсуждение
Спектр и текущая распространенность ТР у больных СД. В результате обследования 200 больных СД (139 с СД2, 61 с СД1) «чистые» ТР (без депрессии) были выявлены у 44 %, депрессивные расстройства — у 32 %, иные ПР — у 2 %. Остальные больные СД (23 %) составили группу «условной нормы». При СД1 ТР отмечались реже (26,2 %), чем при СД2 (51,2 %); у женщин — чаще (51,3 %), чем у мужчин (18,8 %) (везде p < 0,01). Суммарная распространенность синдромов постоянной патологической тревоги при СД (ГТР + ОТР + ССТ) составила 38 %, синдромов пароксизмальной тревоги (паническое расстройство и специфичные для СД фобии гипогликемий и инсулина) — 10 %. Распространенность разных форм ТР при СД1 и СД2 существенно различалась. Синдромы постоянной патологической тревоги при СД1 встречались реже, чем при СД2 (13 и 50 % больных соответственно; р < 0,0001). Напротив, фобии гипогликемии чаще отмечались при СД1, чем при СД2 (р = 0,0002), а паническое расстройство и расстройство адаптации по тревожному типу встречались одинаково редко при обоих типах СД.
Наличие или отсутствие ТР не было ассоциировано с социально-экономическими характеристиками (профессия, трудовая занятость, образование и месячный доход).
По данным опроса, 80,5 % больных СД с ТР осо- знавали необходимость помощи врача для стабилизации психического состояния, однако лишь 8 % больных с ТР ранее обращались за этим к психиатру или неврологу. Психотропные препараты ранее принимали 59,8 % больных СД с ТР, в 82,7 % случаев — самостоятельно, без консультации психиатра или невролога, причем преимущественно средства, содержащие фенобарбитал (корвалол — 44 чел.) и бензодиазепины (феназепам — 5 чел.). Таким образом, больные СД с ТР часто и бесконтрольно принимают препараты с потенциалом развития лекарственной зависимости.
Сопоставительный анализ характеристик больных СД в зависимости от наличия и отсутствия ТР. Возраст и длительность СД у больных с ТР и без ТР не различались. Доли пациентов, получающих инсулин, среди больных СД2 с ТР и без ТР не различались (58 и 73 %, НЗ). Доли больных с ТР среди получавших пероральную сахароснижающую терапию и среди получавших инсулин также не различались, следовательно, ТР как нозологические категории не связаны с видом сахароснижающей терапии.
Факторы риска сосудистых осложнений и ТР. Уровень HbA1c у больных СД с ТР имел тенденцию к повышению в сравнении с таковым у больных без ТР (8,3 ± 1,6 и 7,9 ± 1,7 %, НЗ), причем как при СД1 (9,2 ± 1,8 % при наличии ТР и 8,3 ± 1,6 % без ТР), так и при СД2 (8,1 ± 1,5 и 7,6 ± 1,8 % соответственно, везде НЗ). Однако разность абсолютных значений уровня HbA1c (0,9 % при СД1 и 0,5 % при СД2) является клинически значимой, так как это различие отражается на риске развития хронических осложнений СД (DCCT, UKPDS). Уровень HbA1c у больных СД2, получающих инсулин, при наличии ТР был выше (8,2 ± 1,4 %), чем в отсутствие ТР (7,3 ± 1,8 %) (D = 0,9 %, р = 0,05). В анамнезе у больных СД с ТР чаще, чем у больных без ТР, отмечались тяжелые гипогликемии (32,2 и 13,0 %, р = 0,014); частота диабетического кетоацидоза не различалась.
Показатель ЧСС в группе больных СД в целом не зависел от наличия ТР, однако коррелировал с уровнем РТ (но не ЛТ), особенно у больных СД с постоянной тревогой (ГТР + ОТР + ССТ): r = 0,31 (р = 0,005). У больных СД только с постоянной патологической тревогой (ГТР, ОТР и ССТ) уровень общего холестерина был выше, чем у больных без ТР: соответственно 5,8 ± 1,1 и 5,4 ± ± 1,2 ммоль/л (p = 0,03).
По сравнению с пациентами без ТР больные СД с ТР имели более высокие уровни как САД (124,0 ± 15,0 и 136,5 ± 15,2 мм рт.ст.), так и ДАД (76,1 ± 8,9 и 81,6 ± 8,4 мм рт.ст., везде р < 0,01). Уровни САД и ДАД по группе в целом коррелировали с РТ (r = 0,43 и 0,30) и ЛТ (r = 0,37 и 0,25, везде р < 0,01), однако эта связь имела место только у больных ТР. Кроме того, ТР оказались ассоциированы с повышением САД и ДАД только при СД2, но не при СД1.
Исходя из предположения, что выявленное различие связано с преобладанием постоянного типа патологической тревоги при СД2 и приступообразного типа тревоги при СД1, мы сравнили САД и ДАД при постоянных и пароксизмальных формах ТР. Полученные данные подтвердили, что именно постоянные, а не приступообразные типы ТР, ассоциированы с формированием стойкой артериальной гипертензии при СД.
Для сравнения суммарного риска любых поздних осложнений СД каждому осложнению СД присваивали балл от 1 до 3 (в зависимости от стадии или степени тяжести конкретного осложнения) с последующим расчетом отношения шансов на наличие осложнений СД у больных с ТР и без ТР. Отношение шансов для выраженных стадий микро- и макроангиопатий при СД + ТР : СД без ТР составило 2,3, что указывает на более чем двукратное повышение риска осложнений СД у больных с ТР. В основном это происходило за счет различных клинических проявлений макроангиопатии и артериальной гипертензии: в общей сложности артериальной гипертензией страдали 85 % больных СД с ТР и лишь 46 % больных СД без ТР, а диабетические макроангиопатии имели место у 25,6 и 13,0 % больных соответственно (везде р < 0,05).
Оценка диагностического значения соматических жалоб при СД. При наличии ТР больные СД характеризовались значимо большим суммарным количеством жалоб со стороны различных органов и систем, чем в отсутствие ТР. Балл соматических жалоб со стороны различных органов и систем в большей степени коррелировал с ЛТ (r от 0,35 до 0,58, р < 0,05), чем с РТ (r от 0 до 0,32), т.е. с постоянным, а не эпизодическим компонентом тревоги. Важно подчеркнуть, что СБ ГОСЖ и баллы по каждой из его субшкал не коррелировали с HbA1c вне зависимости от уровня тревоги. Следовательно, эти соматические жалобы были связаны не с гипергликемией, т.е. СД как таковым, а исключительно с наличием ТР и уровнем патологической тревоги.
Для оценки возможности использования ГОСЖ для скрининга на ТР были рассчитаны операционные характеристики теста для СБ ГОСЖ при отрезной точке ≥ 28 баллов.
Чувствительность = a/(a + c) = 65/65 + 20 = 65/85 = = 76,4 %.
Специфичность = d/(b + d) = 34/24 + 34 = 34/58 = = 58,6 %.
Положительная прогностическая ценность = a/(a + b) = = 65/65 + 24 = 73,0 %.
Отрицательная прогностическая ценность = d/(c + d) = = 34/20 + 34 = 63,0 %.
Диагностическая точность = (a + d)/(a + b + c + d) = = (65 + 34)/(65 + 20 + 24 + 34) = 69,2 %.
Таким образом, суммарный балл ГОСЖ ≥ 28 позволяет правильно диагностировать 69,2 % случаев ТР при СД, т.е. удовлетворяет требованиям к скрининговому опроснику.
Влияние ТР на диабетзависимое КЖ. При исследовании с помощью шкалы Ru-ADDQoL были получены данные об общем выраженном снижении КЖ у обследованных пациентов: средневзвешенный балл диабетзависимого КЖ по группе в целом равнялся –2,2 ± 1,6 (–1,9 [–2,9; –1,0]), причем у больных СД1 и СД2 эти показатели не различались и составили соответственно –2,3 ± 2,1 и –2,1 ± 1,4 (НЗ). Средневзвешенный балл диабетзависимого КЖ у пациентов с ТР и без ТР не различался (–2,2 ± 1,6 и –2,0 ± 1,7, НЗ).
Состояние когнитивных функций в норме и при патологической тревоге у больных СД. Электрофизиологический показатель КЧСМ у больных СД (n = 122) закономерно снижался с возрастом (r = –0,40, р < 0,001) и с величиной САД (r = –0,29, р = 0,001), отражая нарастание цереброваскулярной патологии. За счет возрастной разницы КЧСМ при СД2 была ниже (26,8 [25,3; 28,7] Гц), чем при СД1 (29,0 [27,7; 30,8] Гц) и чем у здоровых добровольцев 29,3 ± 1,6 (29,3 [28,7; 30,3] Гц) (везде р < 0,001). КЧСМ у больных СД, не страдающих ТР (29,0 [27,0; 30,0] Гц), не отличалась от таковой у здоровых лиц. Однако у больных СД с ТР этот показатель был более низким, чем у больных СД без ТР (27,0 [25,7; 28,7] Гц, р < 0,01). Следовательно, именно присоединение ТР, а не сам СД, ухудшает этот показатель когнитивной сферы. Дальнейший анализ показателя КЧСМ показал, однако, что ТР ассоциированы с некоторым субклиническим снижением когнитивных функций только при СД1, но не СД2.
Сравнительный анализ результатов остальных когнитивных тестов показал отсутствие существенного нарушения концентрации внимания и его переключаемости у больных СД вне зависимости от наличия или отсутствия ТР. У больных СД1 и СД2, страдающих ТР, количество ошибок в корректурной пробе было одинаковым — соответственно 4,0 [3,5; 5,0] и 5,0 [3,0; 6,0] (НЗ). Однако в отсутствие ТР больные СД2 делали в корректурной пробе значимо больше ошибок, чем больные СД1: соответственно 4,5 [3,0; 6,0] и 3,0 [2,0; 4,0] (p < 0,05). В тесте «Запоминание 10 слов» у больных СД с ТР отмечалось замедление запоминания (разница после первого называния серии слов и несколько более позднее набирание наивысшего балла — после 5-го прочтения слов вместо 4-го прочтения — у больных СД без ТР). Вместе с тем воспроизведение информации через 1 час не различалось, несмотря на очевидную тенденцию к лучшей сохранности запомненной информации в отсутствие ТР.
Некоторое снижение краткосрочной памяти у больных СД2 с ТР в сравнении с больными СД1 с ТР может объясняться более старшим возрастом и более частым наличием органического (сосудистого) поражения ЦНС (церебральный атеросклероз, артериальная гипертензия). Все обнаруженные изменения являются субклиническими и отражают начальное снижение когнитивных функций при ТР, более заметное при СД2.
Патологическая тревога и функциональное состояние ГГНС у больных СД. Базальные уровни кортизола по группе в целом не коррелировали с показателями РТ, ЛТ, САД, ДАД, ЧСС и HbA1c. У 21/99 (21,2 %) больных СД, которым проводилась МПДм, достаточного подавления уровня кортизола (до < 50 нмоль/л) не было. Доли больных без подавления уровня кортизола в МПДм при СД1 (22,2 %) и СД2 (20,8 %) были абсолютно одинаковыми. Отсутствие подавления кортизола не было ассоциировано с массой тела. Клинических признаков синдрома гиперкортизолизма у этих больных не отмечалось, показатели САД, ДАД и доли больных с артериальной гипертензией среди больных СД с нормальным подавлением и с отсутствием подавления в МПДм были одинаковыми. Абсолютная разность между уровнями HbA1c у 21 больного СД без подавления уровня кортизола (8,6 [7,6; 9,2]) и у 79 больных с нормальным подавлением (7,9 [7,0; 8,9]) была клинически значимой (0,5 %) и почти достигла статистической значимости (р = 0,052).
Базальные уровни кортизола у больных СД с ТР и без ТР не различались (418,5 ± 173,4 и 450,8 ± 159,6 нмоль/л, НЗ). При проведении МПДм также не было получено данных о влиянии ТР на степень подавления: его отсутствие отмечалось с одинаковой частотой как при наличии ТР (21,4 % больных), так и в их отсутствие (13,8 % больных) (НЗ). Однако указанная выше выявленная разница в уровне HbA1c у больных СД с подавлением и без подавления в МПДм возникала только у больных СД с ТР и отсутствовала у пациентов без ТР.
У больных СД без ТР показатели САД и ДАД закономерно были ассоциированы с уровнем кортизола в МПДм (оба r = 0,4, р < 0,05, тест Спирмена). У больных СД с ТР подобная корреляция отсутствовала, но обнаруживалась слабая корреляция ЧСС с уровнем кортизола в МПДм (r = 0,25, р < 0,05).
После трехмесячного курса противотревожной терапии гидроксизином или тофизопамом МПДм повторили у 38 из 60 больных СД с ТР, включенных в терапевтическую часть исследования. Базальный уровень кортизола снизился с 418 ± 190 до 333 ± 137 нмоль/л (р = 0,005). Доля больных без подавления кортизола в повторной МПДм после лечения не изменилась и составляла 23,7 %, однако лишь у 4 чел. из них отсутствие подавления кортизола имело место и в исходной пробе (до лечения), т.е. имелись стойкие функциональные нарушения со стороны ГГНС. Клинических признаков гиперкортизолизма у них по-прежнему не наблюдалось. У больных СД с хорошим подавлением в повторной МПДм противотревожная терапия снизила уровень ЛТ до умеренного (45 [40; 51] баллов), а у больных без подавления кортизола уровень ЛТ оставался высоким (53 [48; 54] балла, р = 0,04). Таким образом, несмотря на отсутствие универсального влияния патологической тревоги на функциональное состояние ГГНС при СД, у части пациентов, характеризующихся относительной функциональной активацией (отсутствие подавления), наличие ТР сопровождается изменениями факторов риска (АД, ЧСС) и изменением эффективности противотревожной терапии.
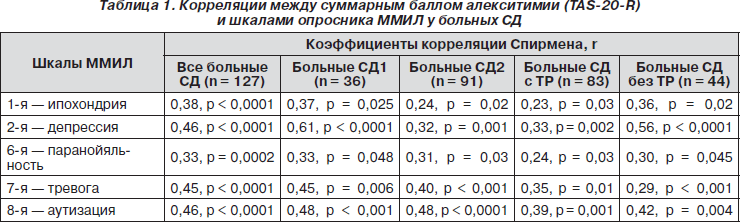
Результаты валидизации русскоязычной версии 20-пунктовой Торонтской шкалы алекситимии (TAS-20) и особенности алекситимии у больных СД. СБ TAS-20-R для всей выборки равнялся 52,25 ± 12,38 и был одинаковым у мужчин и женщин (51,25 ± 11,36 и 52,62 ± 12,74, НЗ). Коэффициент внутренней согласованности (a Кронбаха) для шкалы в целом равнялся 0,80, средний коэффициент межпунктовой корреляции — 0,15, что удовлетворяло требованиям, предъявляемым к шкалам. Были выявлены значимые обратные корреляции между СБ TAS-20-R и рядом факторов опросника 16PF — интеллекта (r = –0,43), открытости переменам и выразительности (оба r = –0,23), душевности (r = –0,18), социальной смелости (r = –0,15), эмоциональной стабильности (r = –0,31), осознавания правил (r = –0,16), самополагания (r = –0,14), а также прямая корреляция с факторами напряжения (r = 0,46) и искушенности (r = 0,27). Они подтверждают конвергент-ную валидность TAS-20-R. Прямая значимая корреляция СБ TAS-20-R и СБ ГОСЖ (r = 0,34, р < 0,01), а также с баллами по всем четырем его субшкалам (r от 0,28 до 0,38, р < 0,01) тоже подтверждает конвергентную валидность шкалы, отражая связь алекситимии с соматизацией эмоциональных переживаний. Отсутствие корреляций с такими чертами, как доминантность и пессимизм, а также бдительность и перфекционизм, концептуально не связанными с алекситимией, подтверждает дискриминант-ную валидность TAS-20-R.
СБ алекситимии у больных СД (n = 132) равнялся 52,7 ± 13,1, превышая показатель у молодых здоровых лиц в российской популяции, равный 47,8 ± 11,3 (Г. Тэйлор, Е.Г. Старостина, 2011). СБ алекситимии при СД2 (55,7 ± 12,1) был выше, чем при СД1 (45,4 ± 12,5) и у здоровых лиц (везде р < 0,01), а при СД1 не отличался от такового у здоровых лиц. Поскольку СБ алекситимии в общей группе (n = 132) находился в умеренной прямой корреляции с возрастом больных (r = 0,39, p = 0,000004), можно предположить, что именно возраст играет определяющую роль в различиях уровней алекситимии у больных СД1 и СД2. По группе больных СД в целом СБ алекситимии находился в обратной зависимости от социального статуса и уровня образования.
Изучение корреляций между СБ алекситимии и различными показателями когнитивных функций показало, что высокий уровень алекситимии ассоциирован со слабым, но статистически значимым ухудшением некоторых когнитивных показателей у больных СД в целом. Более детальный анализ показывает, что эта ассоциация складывается из умеренно выраженной корреляции между уровнем алекситимии и когнитивным ухудшением при СД1 и полного отсутствия такой корреляции при СД2.
СБ алекситимии находился в умеренной обратной корреляции с HbA1c только при СД1 (r Спирмена = = –0,36, р = 0,027). Корреляции между СБ алекситимии и показателями функционального состояния ГГНС (что могло бы повлиять на уровень HbA1c) не было.
СБ алекситимии у больных СД с ТР в целом был выше, чем у больных СД без ТР: 56,0 ± 11,9 и 46,5 ± 12,9 (p < 0,01). Однако при СД1 уровни алекситимии не были сопряжены с наличием или отсутствием ТР (46,7 ± 9,8 и 44,7 ± 14,1, НЗ). В отличие от этого при СД2 наличие ТР ассоциировано с более высоким СБ алекситимии (57,9 ± 11,5 и 48,5 ± 11,5, p < 0,01). Аналогичное различие выявлено при сравнении постоянного и пароксизмального типов патологической тревоги: 57,0 ± 11,8 и 44,2 ± 7,5 балла (р = 0,01).
Упомянутые выше различия в уровне алекситимии в разных группах социального статуса и образования больных СД становились еще более заметными у больных СД с ТР. У больных СД с ТР СБ алекситимии не коррелировал с когнитивными параметрами. В отличие от этого у больных СД без ТР были выявлены умеренные обратные корреляции между СБ алекситимии и КЧСМср (r = –0,40, р = 0,01), переключаемостью внимания (r = –0,32, р = 0,04), числом правильно воспроизведенных слов при первом и третьем прочтениях в ходе теста на запоминание 10 слов (соответственно r = –0,47, р = 0,003 и r = –0,40, р = 0,01).
Ассоциация ТР с некоторыми личностными характеристиками больных СД. Исследование актуального психоэмоционального состояния пациентов и их личностных характеристик с помощью ММИЛ выявило значимые различия между группами больных СД с ТР и без ТР. У больных СД с текущими ТР отмечается выраженное патологическое повышение по шкале 1 (ипохондрическая настроенность) в сочетании с некоторым повышением по шкалам 7 (тревога), 8 (изолированность, аутизация) и в небольшой степени по шкале 2 (депрессия). Все это, вместе взятое, указывает на формирующуюся у этих больных депрессивную настроенность (гипотимный вариант тревоги), хотя при скрининговом тестировании на депрессию и по заключению психиатра клинических признаков даже субдепрессии у этих пациентов не обнаруживалось. Кроме того, различия между больными СД с ТР и больными СД без ТР были выявлены по шкале 3 (истерии), что указывает на склонность к конверсионным реакциям и развитию соматических эквивалентов тревоги при наличии ТР; по шкале 6 (паранойяльность), отражающей ригидность мышления и склонность к застреванию в негативных эмоциях, а также по шкале 8 (аутизация), указывающей на более выраженную изоляцию больных с ТР от окружающего и погруженность в собственные проблемы.
Однако дальнейшее сопоставление показало, что указанные различия профилей ММИЛ возникают только за счет больных СД2 с ТР и без ТР, в то время как значимых различий профиля ММИЛ у больных СД1 в зависимости от ТР не было. По-видимому, это связано с тем, что больные СД1 страдают преимущественно приступообразными формами ТР, которые не ассоциированы со стойкими изменениями личности и поведения.
Все названные характеристики (ипохондрия, депрессия, паранойяльность, тревога и аутизация) находились в значимой корреляции с СБ алекситимии при обоих типах СД и вне зависимости от наличия или отсутствия ТР. Поскольку алекситимия является одной из важнейших личностных характеристик, был проведен поиск ее ассоциаций с характеристиками личности, определяемыми по опроснику ММИЛ (табл. 1).
Дополнительную информацию об особенностях поведения и личности больных СД, страдающих ТР, дает личностный опросник PF16. Он показывает, что больные СД с ТР менее зрелы в психологическом отношении (фактор C), более сдержанны и даже скованны в поведении (фактор F), менее активны в межличностных взаимодействиях и могут производить впечатление робких (фактор H). Они испытывают большее внутреннее напряжение вследствие значительной приверженности воспитанным формам поведения, этикету и правилам (фактор N). У них чаще отмечаются невротические черты с несбалансированной самооценкой, «заученной беспомощностью» и пессимизмом (фактор O). Больные с тревогой существенно более консервативны и хуже приспосабливаются к изменениям в окружающей обстановке и жизненном укладе (фактор Q1). Они испытывают большую степень фрустрации и неудовлетворенности (фактор Q4).
Клинико-психопатологический анализ генерализованного и органического ТР при СД. Группы больных СД с ГТР (n = 32) и ОТР (n = 18) имели одинаковые показатели шкал тревоги/тревожности Спилбергера: РТ — 29,3 ± 7,5 и 32,5 ± 8,8 балла соответственно, ЛТ — 51,8 ± 8,5 и 54,9 ± 5,8 балла (везде НЗ). Балл депрессии по шкале CES-D в обеих группах также не различался (15,3 ± 4,9 и 17,8 ± 4,9, НЗ). Кроме того, сравнение больных СД с ГТР и больных СД с ОТР показало отсутствие различий в показателях CАД (соответственно 138,0 ± 11,1, 140,0 [130,0; 142,5] и 142,5 ± 15,8, 140,0 [130,0; 150,0] мм рт.cт.), ДАД (81,7 ± 7,9, 80,0 [77,5; 87,5] и 85,0 ± 7,7, 80,0 [80,0; 90,0] мм рт.cт., везде НЗ). Разницы в уровнях HbA1c в группах больных с ГТР и ОТР также не было (7,8 ± 1,3 и 8,1 ± 1,4 %, НЗ). Больные СД с ГТР и ОТР не различались между собой по количеству эпизодов диабетического кетоацидоза и тяжелых гипогликемий в анамнезе. Все эти данные говорят о том, что сам по себе СД и связанные с ним метаболические факторы не имеют отношения к развитию органического поражения головного мозга при СД, т.е. не дают оснований считать СД причиной ОТР.
Больные СД с ГТР и ОТР имели одинаковый СБ ГОСЖ. Баллы по большинству субшкал ГОСЖ в двух группах также не различались, за исключением балла по субшкале истощения (астенизации): в группе ОТР он был выше (13,1 ± 3,3), чем в группе ГТР (10,8 ± 3,5, p < 0,05). Это отражает более выраженные астенические явления у больных с психоорганическим синдромом и косвенно подтверждает этот клинический диагноз. Средневзвешенный балл диабетзависимого КЖ и СБ алекситимии в группах больных СД с ГТР и ОТР также были одинаковыми.
Что касается когнитивных показателей, то в пробе с расстановкой чисел больные СД с ОТР затратили больше времени на выполнение задания, чем больные СД с ГТР (228,2 ± 90,5 и 179,3 ± 59,8 с, p < 0,05) при одинаковом числе сделанных ошибок. Это указывает на замедление процессов восприятия и переработки информации без нарушения правильности ее обработки. Показатели КЧСМ, количество ошибок в пробе с расстановкой чисел, показатели концентрации и переключаемости внимания в корректурной пробе у больных СД с ГТР и ОТР не различались. Существенные различия между больными ГТР и ОТР в тесте на запоминание 10 слов касались только 1-го и 4-го прочтения, указывая на минимальное замедление запоминания при ОТР, без существенных различий в долгосрочной (1 час) памяти. Выявленные особенности соответствуют небольшим нарушениям памяти у больных нетяжелым психоорганическим синдромом.
Анализ результатов оценки психоэмоционального состояния методом ММИЛ в целом отражает склонность больных ОТР к развитию депрессивного состояния (более высокие баллы по шкалам депрессии, тревоги, аутизации и социальной изоляции). Результаты ММИЛ указывают на то, что сочетание психоорганического компонента с постоянной патологической тревогой, возможно, обусловливает наибольшую вероятность последующего развития депрессии.
При сопоставительной оценке личностных характеристик теста 16PF у больных СД с ГТР и ОТР значимые отличия были выявлены только по фактору Q1 — «открытость переменам» и отражали более выраженную ригидность, являющуюся характерным элементом органической личности.
Таким образом, существенных для клиники отличий больных СД с ГТР от больных с ОТР не обнаружено. Они различались между собой лишь субклиническим, выявляемым при углубленном психологическом тестировании, снижением когнитивных функций и, предположительно, большим риском развития депрессии при ОТР.
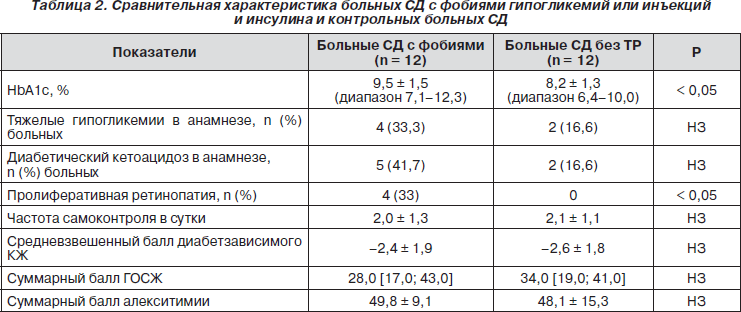
Фобии гипогликемий и инъекций как фактор декомпенсации СД1. Для уточнения клинического значения специфичных для СД фобий сравнили 12 пациентов с фобиями гипогликемии и инъекций с 12 пациентами из группы контроля, не имевших каких-либо ПР, которых подобрали с применением метода сопоставимых пар. 12 пар больных СД с фобиями и больных СД без фобий были сопоставимы по возрасту, длительности и типу СД и полу, а также баллу депрессии, т.е. основная и конт-рольная группы были идентичны по главным демографическим характеристикам и психическому состоянию, за исключением наличия или отсутствия фобий. Сравнительный анализ клинических, социальных, психологических и поведенческих показателей у больных СД со специфическими фобиями и их контрольных пар представлен в табл. 2. Она иллюстрирует, что у больных СД с фобиями отмечается статистически незначимая тенденция к большему числу тяжелых гипогликемий в анамнезе и, что еще более важно, диабетических кетоацидозов, что вполне согласуется с выявленной значимой разницей в уровне HbA1c. Более того, вследствие худшей компенсации углеводного обмена у больных СД с фобиями отмечается более высокая частота пролиферативной ретинопатии (у этой подгруппы больных уровень HbA1c был наиболее высоким — 10,4 ± 1,5 %).
Других клинических различий между указанными группами больных СД, а также разницы каких-либо когнитивных параметров, изучавшихся в данном исследовании, не было. Уровни их образования и группы социального статуса также не различались.
Как правило, фобии гипогликемий имели отчетливое ятрогенное происхождение и развивались после того, как больной получал неверную информацию о гипогликемиях от врачей или из литературы. У больных СД с фобиями гипогликемий развивается избегающее поведение патологического (неконструктивного) типа, а именно поддержание гликемии на более высоком уровне, что само по себе в краткосрочной перспективе приводит к увеличению частоты диабетического кето-ацидоза и повышению уровня HbA1c, а в долгосрочной — к повышению риска поздних осложнений СД, что и было иллюстрировано значимо более высокой частотой пролиферативной ретинопатии. Кроме того, у больных с фобиями отмечалась умеренная обратная корреляция уровня HbA1c с РТ, которая не достигала статистической значимости из-за малого числа наблюдений (r = –0,5, р = 0,08, n = 12); при постоянных формах тревоги такой корреляции не было. Выявленная закономерность «чем выше гликемия (HbA1c), тем меньше тревога» отражает патологическое избегающее поведение больных СД с фобиями гипогликемий. Вместе с тем у обследованных больных СД с фобиями отсутствуют навыки и знания, необходимые для избегающего поведения конструктивного типа, которые помогают больным избегать гипогликемий, соблюдая правила их профилактики и купирования: они не имеют при себе углеводов (как и все остальные больные СД) и не знают причин гипогликемии, что указывает на недостаточное обучение этих пациентов.
Открытое рандомизированное сравнительное исследование эффективности и безопасности тофизопама и гидроксизина. Трехмесячный курс противотревожной терапии сопровождался выраженным уменьшением психологических симптомов тревоги (нарушений сна, хронического беспокойства, раздражительности, волнений по многочисленным поводам), положительной динамикой показателей по шкале Спилбергера: нормализацией балла РТ с 32,3 ± 9,0 [32,0] до 25,5 ± 9,3 [26,0] и снижением балла ЛТ с 52,5 ± 9,7 [52,0] до 47,1 ± 8,8 [47,0] (везде р < 0,05). Анксиолитическая терапия положительно влияла и на соматические эквиваленты тревоги: суммарный балл ГОСЖ по группе в целом значимо снизился с 38,0 ± 13,2 [37,0] до 31,5 ± 12,2 [32,0] (р < 0,01); та же закономерность выявлена для всех субшкал ГОСЖ, кроме «истощения/астении». Это указывало на существенное улучшение физического самочувствия больных за счет уменьшения выраженности соматических (вегетативных и вегетативно-болевых) симптомов ТР.
На фоне терапии анксиолитиками в группе в целом отмечалось значимое улучшение компенсации углеводного обмена: уровень HbA1c (%) снизился с 7,9 ± 1,4 [7,6] до 7,4 ± 1,4 [7,1] (p < 0,05), при этом абсолютное снижение HbA1c равнялось 0,5 %, будучи клинически значимым. На фоне терапии анксиолитиками положительную динамику продемонстрировали показатели САД — с 141,4 ± 12,4 до 129,8 ± 13,5 мм рт.ст. (р < 0,01) и ДАД — с 82,3 ± 7,4 до 77,8 ± 8,6 мм рт.ст. (p < 0,05), а также еще один фактор сердечно-сосудистого риска — ЧСС: с 76,3 ± 9,5 до 72,7 ± 5,6 (p < 0,05).
Исходно две группы, получавшие разные анксиолитики — гидроксизин и тофизопам, — были сопоставимы между собой по основным клиническим и психологическим характеристикам. Через 3 месяца лечения значимой разницы между лечением гидроксизином и тофизопамом ни по одному из изученных параметров также не было.
Однако динамика ряда показателей внутри каждой терапевтической группы несколько различалась. Так, гидроксизин, в отличие от тофизопама, заметно снижал уровень ЛТ, но не оказывал выраженного влияния на ДАД и ЧСС. При приеме тофизопама отмечалась положительная динамика HbA1c, ЧСС, которая не достигала статистической значимости на фоне лечения гидроксизином.
Исходный СБ алекситимии значимо и умеренно коррелировал лишь с динамикой соматических эквивалентов тревоги (суммарный балл ГОСЖ) на фоне лечения (r = 0,46, р = 0,002), т.е. высокая алекситимия сопровождается наиболее значимой редукцией соматических жалоб на фоне лечения. Корреляции СБ алекситимии с таким параметром, как динамика уровня HbA1c, РТ, ЛТ, САД и ДАД, отсутствовали.
При анализе динамики соматических эквивалентов тревоги оказалось, что до лечения разницы баллов субшкал и СБ ГОСЖ между двумя терапевтическими группами не было. В процессе лечения отмечалось значимое уменьшение жалоб со стороны желудочно-кишечного тракта на обоих препаратах, очень незначительная динамика жалоб со стороны опорно-двигательного аппарата на фоне лечения гидроксизином и почти полное ее отсутствие на фоне приема тофизопама, а также более выраженное уменьшение жалоб со стороны сердечно-сосудистой системы на фоне лечения гидроксизином, чем на фоне лечения тофизопамом. Результирующие СБ ГОСЖ в равной степени снижались на фоне лечения обоими анксиолитиками и не различались между группами после лечения.
При оценке когнитивных функций было установлено, что значимой динамики КСЧМ на фоне лечения и разницы между группами ни на фоне медикаментозной терапии, ни через месяц после ее отмены не наблюдалось. На фоне применения обоих препаратов отмечается увеличение времени выполнения корректурной пробы, что указывает на некоторое замедление скорости обработки информации, без какой-либо разницы в зависимости от используемого препарата. Через месяц после отмены анксиолитиков изменений ни одного из изученных параметров ни в одной из групп больных не наблюдалось.
В процессе лечения отмечалось значимое уменьшение времени тестирования параллельно снижению среднего времени ответа и числа ошибок только на фоне лечения гидроксизином, причем через месяц после отмены терапии эти показатели возвращались к исходному уровню (до лечения).
В тесте на запоминание 10 слов на фоне противотревожной терапии отмечалось значимое увеличение числа воспроизведенных слов при первом, втором, четвертом и пятом прочтениях, т.е. увеличение скорости запоминания. При этом оказалось, что статистически значимое улучшение скорости запоминания происходило преимущественно в группе гидроксизина, что и повлияло на результаты в группе в целом. Динамики показателей долгосрочной памяти (воспроизведение слов через 1 час) получено не было. Через 1 месяц после отмены противотревожной терапии показатели запоминания и воспроизведения оставались такими же, как на момент окончания лечения.
На фоне лечения анксиолитиками у больных СД с ТР и исходно высоким риском депрессии по ММИЛ (n = 25) отмечалось более выраженное снижение РТ, ЛТ, ДАД и более заметное улучшение показателей пробы с расстановкой чисел, а также теста на запоминание 10 слов, чем у больных СД с ТР, исходно не имевших латент- ного риска депрессии. Кроме того, у этой подгруппы больных исчезли признаки высокого риска депрессии по ММИЛ.
По окончании курса лечения прием обоих препаратов прекращали одномоментно, признаки синдрома отмены ни у одного пациента не возникали. Переносимость обоих препаратов была хорошей. Нежелательные явления наблюдались в группе гидроксизина у 5 (одно связано с препаратом), в группе тофизопама — у 2 человек (одно связано с препаратом). Из группы гидроксизина выбыли 7 (23 %), из группы тофизопама — 6 (20 %) человек; из них 5 и 6 больных соответственно выбыли по причинам, не связанным с лечением.
Сравнительная оценка противотревожной терапии у больных СД с ГТР и ОТР. Полностью закончили исследование по протоколу 22 больных СД с ГТР и 11 — с ОТР. К концу терапии уровень РТ значимо снизился как при ГТР (с 28,9 ± 7,5 до 23,5 ± 6,1), так и при ОТР (с 36,6 ± 7,7 до 28,0 ± 11,0), уровень ЛТ также снизился при ГТР (с 51,5 ± 8,7 до 45,4 ± 7,1) и при ОТР (с 54,4 ± 7,1 до 47,1 ± 6,0) (везде р < 0,05). Полная ремиссия реактивного психологического компонента тревоги (РТ < 30 баллов) была получена у 86 % больных ГТР и 55 % больных ОТР (p = 0,04). Хорошая ремиссия личностного компонента тревоги (ЛТ < 45 баллов) отмечалась у 50 % больных ГТР и 27 % больных ОТР, причем через 1 месяц после отмены препаратов отмечалось дальнейшее снижение ЛТ, одинаковое в обеих группах (42 и 30 %, везде НЗ). При ОТР был получен несколько более выраженный эффект терапии в отношении соматических симптомов тревоги, причем преимущественно за счет уменьшения жалоб астенического круга.
Показатели КЧСМ, концентрация и переключаемость внимания в корректурной пробе у больных СД с ГТР и ОТР не различались, не изменялись в процессе лечения и после отмены препаратов. В пробе с расстановкой чисел к концу терапии в группе ГТР общее время тестирования уменьшилось с 169,3 ± 44,8 до 141,1 ± 37,2, среднее время тестирования — с 6,6 ± 1,7 до 5,6 ± 1,5, количество ошибок — с 5,0 ± 1,7 до 3,8 ± 1,5 (везде р < 0,05). В группе ОТР динамика отсутствовала. Эти данные указывают на то, что противотревожная терапия больных СД с ГТР сопровождается некоторым увеличением скорости реакции и повышением концентрации внимания, чего не происходит при ОТР. Через месяц после отмены препаратов все эти показатели оставались стабильными, без различий между группами пациентов с ГТР и ОТР.
Через 3 месяца лечения в группе больных СД с ОТР отмечалось снижение баллов по шкале тревоги ММИЛ (с 71,5 ± 10,7 до 61,8 ± 14,0) и шкале аутизации (с 77,3 ± 15,6 до 66,3 ± 13,0, везде р < 0,05), указывая на уменьшение предрасположенности к развитию депрессии. В группе ГТР динамики не было. Объективная оценка психического статуса больного и его субъективного отчета не выявила разницы между группами больных СД с ГТР и ОТР: хороший эффект терапии был достигнут у 32 и 27 % больных соответственно, удовлетворительный — у 59 и 64 %, отсутствие эффекта — у 9 и 9 % (везде НЗ). Через месяц после отмены препаратов клинических рецидивов ТР ни в одной из групп не было.
Выводы
1. Установлена высокая распространенность ТР при СД, достигающая 44 % больных СД эндокринологического стационара. ТР почти в два раза чаще встречаются при СД2 (51,2 % больных), чем при СД1 (26,2 % больных). Среди ТР при СД2 преобладает синдром постоянной патологической тревоги, который развивается в рамках генерализованного и органического ТР, а также субсиндромальной тревоги (в общей сложности 50 % больных), а при СД1 чаще отмечается приступообразная патологическая тревога, связанная со специфической фобией гипогликемии (16 % больных). Наличие ТР при СД повышает суммарный риск развития выраженных стадий сосудистых осложнений в 2,3 раза, что связано с большей выраженностью основных сердечно-сосудистых факторов риска (САД, ДАД, HbA1c и общего холестерина) при наличии патологической тревоги. При этом негативное влияние ТР на уровень HbA1c более выражено при приступообразной тревоге (фобиях) у больных СД1, а на артериальную гипертензию — при синдромах постоянной тревоги у больных СД2.
2. Клиническая картина ТР при СД характеризуется большим количеством соматических проявлений астенического, вегетативного и болевого спектра, которые не коррелируют со степенью компенсации углеводного обмена и находятся в прямой зависимости от уровня патологической тревоги. Благодаря этому Гиссенский опросник соматических жалоб позволяет диагностировать ТР постоянного и пароксизмального типа при СД с чувствительностью 76,4 %, специфичностью 58,6 % и диагностической точностью 69,2 % (для диагностически значимого количества баллов ≥ 28). СД у больных с фобиями гипогликемий имеет неблагоприятное клиническое течение с маской «лабильности», клинически значимым ухудшением компенсации углеводного обмена, более выраженной склонностью к тяжелым гипогликемиям, диабетическому кетоацидозу и более высокой частотой пролиферативной ретинопатии, чем у больных СД без фобий. Указанный вариант протекания СД с сопутствующими специфичными фобиями сопряжен с низкой комплайентностью больных, обусловленной психопатологическими особенностями их состояния и поведения.
3. Наличие ТР у больных СД сопряжено с нерезкими нарушениями когнитивных процессов в виде ухудшения внимания, скорости обработки информации и краткосрочной памяти. При ТР у больных СД1 когнитивная дисфункция минимальна и обнаруживается только по показателю КЧСМ. В ходе противотревожной терапии выявленные когнитивные нарушения могут редуцироваться. Особенности личности больных СД, страдающих ТР, характеризуются ипохондрическими установками, склонностью к депрессивным и психосоматическим реакциям, а также повышенной ригидностью и сужением сферы социальных контактов. По сравнению с больными без ТР больные СД с патологической тревогой менее способны интегрировать свои способности и поведение в целях адаптации, в том числе к факту наличия хронического соматического заболевания. Однако при этом прямой связи между наличием ТР и ухудшением диабетзависимого КЖ не отмечается.
4. Прямых корреляций между выраженностью патологической тревоги и активацией ГГНС у больных СД не получено, однако на наличие относительной активации этой системы при сочетании СД с ТР указывает снижение уровня базального кортизола в ходе противотревожной терапии, меньшая эффективность последней в плане снижения тревоги, более высокий уровень HbA1c и потеря физиологической корреляции между уровнем кортизола и АД у больных без подавления в малой дексаметазоновой пробе. Доля последних не зависит от наличия ТР и одинакова при СД2 (20,8 %) и СД1 (22,2 %).
5. Терапия синдрома постоянной патологической тревоги у больных СД средними терапевтическими дозами гидроксизина или тофизопама одинаково эффективна в плане снижения уровня тревоги, уменьшения выраженности важнейших сердечно-сосудистых факторов риска (уровня HbA1c, АД) и снижения предрасположенности к развитию депрессии. Гидроксизин активнее воздействует на аффективные и когнитивные, а тофизопам — на вегетативные компоненты патологической тревоги. Оба препарата хорошо переносятся и безопасны при СД. Генерализованное и органическое ТР у больных СД имеют сходные клинические, психопатологические и лабораторные проявления, а также одинаково отвечают на противотревожную терапию. Это делает нецелесообразным выделение ОТР как самостоятельной нозологической категории у больных СД.
1. Starostina E.G., Moshnyaga E.N., Bobrov A.E. Psychological profile of endocrinologists entering a postgraduate course on psychiatry // Journal of Psychosomatic research. — 2006. — V. 60. — P. 663.
2. Старостина Е.Г., Бобров А.Е., Мошняга Е.Н., Володина М.Н. Непсихотические психические расстройства при сахарном диабете // Ученые записки СПБГМУ им. академика И.В. Павлова. — 2010. — Т. XVII, № 2, приложение. — C. 29-31.
3. Старостина Е.Г., Тейлор Г.Д., Квилти Л.К., Бобров А.Е., Мошняга Е.Н. и др. Торонтская шкала алекситимии (20 пунктов): валидизация русскоязычной версии на выборке терапевтических больных // Соц. и клин. психи- атрия. — 2010. — Т. 20, № 4. — C. 31-38.
4. Старостина Е.Г., Мошняга Е.Н., Бобров А.Е. Эффективность и безопасность медикаментозной терапии хронических тревожных расстройств у больных сахарным диабетом // Сахарный диабет. — 2010. — № 3. — C. 52-55.