Международный эндокринологический журнал 8 (40) 2011
Вернуться к номеру
Комплексный подход к диагностике и хирургическому лечению заболеваний щитовидной железы
Авторы: Соловьев Н.А., Кафедра хирургии, анестезиологии и эндоскопии ФГОУ ДПО «Институт повышения квалификации» Федерального медико-биологического агентства РФ, Центр эндокринной хирургии ФГУЗ «Клиническая больница № 83» Федерального медико-биологического агентства РФ, г. Москва, Россия
Рубрики: Эндокринология
Версия для печати
Введение
Среди современных медико-социальных проблем одними из самых актуальных являются болезни щитовидной железы (ЩЖ). По статистике ВОЗ, в России насчитывается более одного миллиона больных с зобом. В эндемичных регионах, к которым недавно стали относить Москву и Московскую область, частота различных форм тиреопатий нередко превышает 50 % [1].
Наблюдаемый повсеместно рост числа больных с заболеваниями ЩЖ происходит преимущественно за счет узловых форм зоба и дифференцированного рака [2]. Так, ряд авторов сообщают о 4–5-кратном увеличении за последние годы числа больных узловыми формами зоба [3].
На долю рака ЩЖ, по данным российских авторов, приходится 0,4–2 % всех злокачественных новообразований головы и шеи, не менее 1 % раков всех локализаций и примерно 0,5 % всех смертей от рака [4]. В большинстве случаев рак ЩЖ диагностируется при обследовании пациентов с узловым зобом и, как правило, выявляется в возрасте 40–50 лет, редко у детей и подростков. В целом данное заболевание у женщин встречается чаще (2 : 1–3 : 1), но в пожилом и старческом возрасте все же преобладает относительная доля мужчин [5].
Как в конце прошлого века, так и в первое десятилетие текущего столетия отмечается постепенное увеличение числа пациентов с диффузным токсическим зобом (ДТЗ). В экономически развитых странах ДТЗ страдают почти 5–6 человек на 100 000 населения, а соотношение женщин и мужчин составляет 7 : 1. Пик заболеваемости приходится в основном на трудоспособный возраст — 20–40 лет.
Продолжают активно изучаться возможности различных методов диагностики, в том числе ультразвукового исследования (УЗИ) и пункционной тонкоигольной аспирационной биопсии (ПТАБ), в верификации морфологической природы узловых тиреоидных заболеваний. До настоящего времени не существует какой-либо универсальной методики, позволяющей в 100 % случаев определить морфологическую структуру новообразования ЩЖ до операции. Приходится констатировать, что отсутствует и единый лечебный алгоритм при обследовании пациентов с многоузловым поражением ЩЖ.
В последние 3 года в литературе появились сведения о применении в экспериментах при лечении узловых образований ЩЖ новой малоинвазивной методики — чрескожного электрохимического лизиса (ЭХЛ), основными достоинствами которого являются малая травматичность окружающих тканей и отсутствие повышения температуры в зоне лизиса, что дает возможность многократного применения метода при узловых образованиях ЩЖ.
Особенностью современного развития хирургии ЩЖ является стремление использовать малоинвазивные высокотехнологичные способы хирургического вмешательства. Несомненно, видеоассистированная хирургия ЩЖ является новым, малотравматичным и перспективным вмешательством, однако для окончательных выводов о возможности более широкого применения этого метода требуется дальнейшее изучение.
Несмотря на накопленный опыт хирургии ЩЖ, профилактика интраоперационных осложнений еще остается не до конца решенной проблемой. Их частота при хирургическом лечении заболеваний ЩЖ, даже в специализированных стационарах, колеблется от 3 до 20 %. В связи с этим существует явная потребность в разработке и внедрении единых, наиболее оптимальных профилактических мероприятий, направленных на снижение интраоперационных осложнений.
В проведенной работе использованы новые методики, позволяющие уменьшить или полностью исключить возникновение ряда интраоперационных осложнений (кровотечение, повреждение возвратных нервов), а именно: рентгеноэндоваскулярная окклюзия щитовидных артерий при больших объемах ЩЖ (ДТЗ), мини- инвазивные операции с видеоподдержкой и применением ультразвуковых ножниц (скальпеля), прибор «Нейросайн-400» для нейромониторинга возвратных нервов во время операции.
Таким образом, многие вопросы эффективной диагностики, хирургического лечения и профилактики интраоперационных осложнений продолжают оставаться дискутабельными и требующими решения. В связи с вышеизложенным представляются актуальными дальнейший поиск и разработка новых путей улучшения результатов хирургического лечения заболеваний ЩЖ.
Цель исследования: улучшение результатов хирургического лечения больных с заболеваниями ЩЖ путем внедрения новых комплексных подходов на диагностическом и оперативном этапах.
Материалы и методы исследований
Работа основана на анализе результатов обследования 482 больных с заболеваниями ЩЖ, находившихся на стационарном лечении с 2002 по 2010 г. в ФГУЗ «Клиническая больница № 83» Федерального медико-биологического агентства РФ.
Для объективной оценки результатов хирургического лечения заболеваний ЩЖ все пациенты были разделены на две группы. В первую, основную, группу вошли 323 больных, пролеченных с применением новых современных методик (интраоперационный нейромониторинг возвратных нервов; операции из мини-доступа и с применением видео-ассистированной технологии и ультразвуковых ножниц; предоперационная эмболизация щитовидных артерий при ДТЗ; срочное интраоперационное гистологическое исследование с помощью автоматизированной системы «Атлант-Биопсия»; мини-инвазивный чрескожный электрохимический лизис доброкачественных узлов ЩЖ).
Среди 323 больных основной группы у 128 установлен диагноз узлового или многоузлового зоба (86 пациентов — с эутиреоидным зобом; 23 — с токсическим; 19 — с узловой формой аутоиммунного тиреоидита (АИТ)); у 56 больных — диагноз рака ЩЖ (42 больных с папиллярным раком (ПР), 12 — с фолликулярным и 2 — с медуллярным); у 78 пациентов — ДТЗ. У 61 больного выполнялся ЭХЛ узлов ЩЖ.
Во вторую, контрольную, группу включены 159 больных, находившихся под наблюдением в период с 2002 по 2009 г., которым выполняли традиционные хирургические вмешательства. Из них 94 пациента имели узловой и многоузловой зоб (59 пациентов — эутиреоидный; 20 — токсический; 15 — узловую форму хронического аутоиммунного тиреоидита); 27 пациентов — рак ЩЖ (21 — папиллярный, 5 — фолликулярный, 1 — медуллярный); 38 пациентов страдали ДТЗ.
И в основной, и в контрольной группах практически три четверти пациентов, преимущественно женщины (75 и 71,7 % соответственно), находились в возрасте от 30 до 60 лет, что соответствует распределению заболевания среди населения и отражает важную социально-экономическую значимость проблемы. Возраст больных колебался от 18 до 80 лет. Из числа пролеченных пациентов мужчин было 96 (19,9 %), женщин — 386 (81,1 %).
Длительность заболевания до операции варьировала от 3 месяцев до 12 лет. В основной группе средняя длительность заболевания до операции составила 2,2 ± 0,7 года, в контрольной группе — 2,4 ± 0,8 года. В первые 2 года от начала заболевания на оперативное лечение поступил 351 пациент, что составило 72,8 %. Из 482 больных 456 (94,6 %) поступили для оперативного вмешательства впервые, 26 (5,4 %) — повторно, в связи с рецидивом заболевания.
В контрольной группе рецидивный узловой зоб отмечен у 9 пациентов (5,7 %), в основной группе — у 17 больных (5,2 %). При этом в основной группе у 14 пациентов был рецидив узлового и многоузлового зоба (12 больных — с эутиреозом, 2 — с токсическим зобом); у одного пациента — рецидив ПР ЩЖ и у 2 — рецидив ДТЗ (после нерадикально выполненных первичных операций). В контрольной группе было соответственно 7 пациентов с рецидивом узлового и многоузлового зоба (5 — с эутиреозом, 2 — с токсическим); 1 пациент — с рецидивом ПР ЩЖ и 1 пациент — с рецидивом ДТЗ.
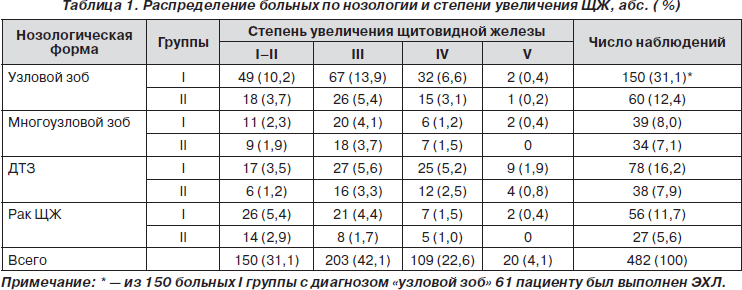
Увеличение ЩЖ у оперированных больных в обеих группах соответствовало I–II степени по классификации ВОЗ и I–V степени по классификации О.В. Николаева (табл. 1).
Сопутствующую патологию имели 285 пациентов (59,1 %). Наиболее часто встречались артериальная гипертензия, ишемическая болезнь сердца, хронические заболевания органов брюшной полости (холецистит, язвенная болезнь желудка и двенадцатиперстной кишки), сахарный диабет и др. Некоторые пациенты имели несколько сопутствующих заболеваний. Все заболевания во время оперативного лечения находились в стадии ремиссии.
Сопутствующая сердечно-сосудистая патология была выявлена у 36,6 % пациентов основной и у 35,2 % пациентов контрольной группы. Хронические заболевания органов брюшной полости имели 23,5 % больных обеих групп, хронические заболевания органов малого таза — 16,9 % пациенток основной группы и 18,6 % — контрольной. Значительно реже (до 13,2 % больных) в обеих группах встречались болезни органов дыхания и сахарный диабет. Пациенты из основной и контрольной групп были сравнимы по наличию сопутствующей патологии.
При сборе и анализе информации использовался персональный компьютер Pentium IV, программные средства общего назначения — текстовый процессор MS Word 2003, электронные таблицы MS Exсel 2003 с пакетом средств статистического анализа. С целью автоматизации статистических вычислений также был использован пакет компьютерных программ Statgraphics Plus 5.1, Statistica 6.0. Статистическая обработка полученных данных выполнялась с помощью биометрических методов анализа. Вычислялись среднее значение М, среднее квадратичное отклонение, средняя ошибка среднего значения t. Оценка достоверности различий проводилась по методу двухвыборочного t-теста с различными дисперсиями. Достоверными считались различия при р < 0,05. Для сопоставления групп использовались непараметрические критерии Манна — Уитни (U) и Вилкоксона. Для определения наличия взаимо-связи между двумя признаками применяли коэффициент корреляции — r. Корреляционную зависимость оценивали с помощью парной и множественной корреляции и регрессии.
Результаты исследования и их обсуждение
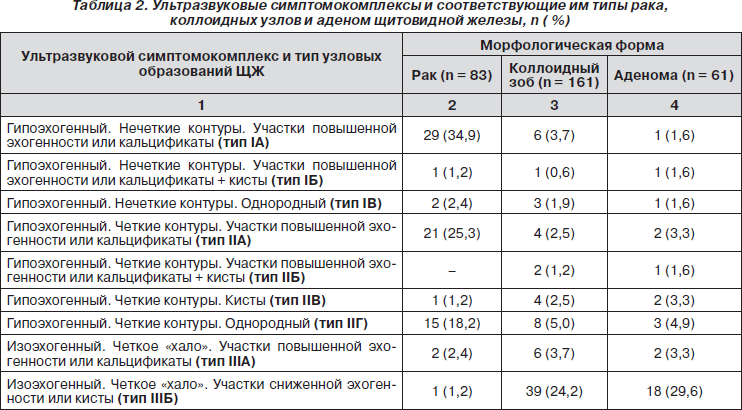
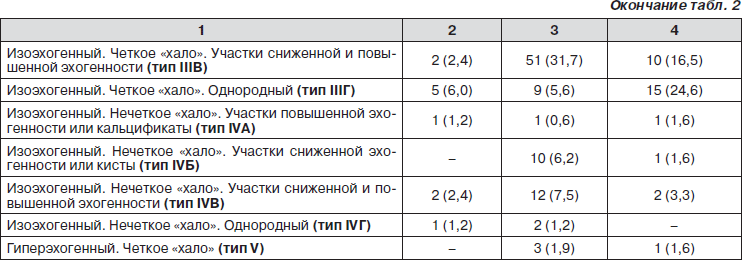
Несмотря на выявленные различия эхо-характеристик коллоидных узлов, аденом и злокачественных опухолей, рассмотренные в отдельности ультразвуковые признаки узловых образований различной морфологической структуры часто совпадали и не позволяли четко определить характер патологического процесса.
В проведенной работе были выделены и сформированы группы признаков, или симптомокомплексы, которые дают возможность более точно предполагать морфологическую природу образования (табл. 2).
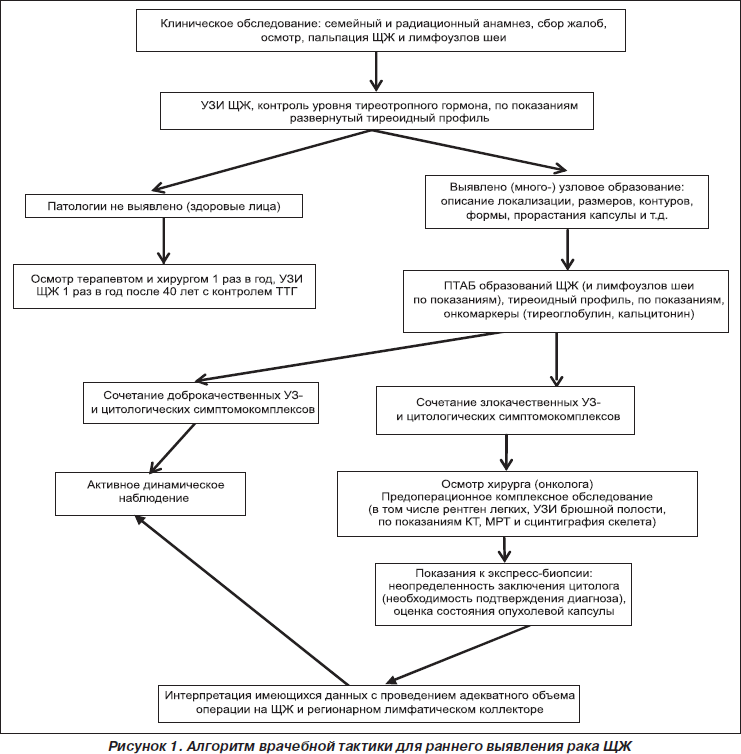
На основе таких симптомокомплексов выделены ультразвуковые типы злокачественных опухолей, коллоидных узлов и аденом ЩЖ. Установив и систематизировав ультрасонографические и цитоморфологические признаки различных форм узловых образований ЩЖ, мы создали диагностический алгоритм с целью оптимизации ранней диагностики рака (рис. 1).
При анализе результатов операций из мини-доступа с видеоподдержкой и применением гармонических ножниц и традиционных методов лечения заболеваний ЩЖ выявлено, что лучшие результаты были получены при мини-инвазивном методе лечения.
Для сравнительного анализа мини-инвазивного и традиционного методов оперативного лечения больные были распределены на две группы. Хирургическое вмешательство на ЩЖ из мини-доступа выполнено у 62 из 323 больных I группы (19,2 %), из них с видеоподдержкой — у 29 пациентов (9 % от общего числа операций в I группе). Во вторую группу вошли 159 больных, оперированных традиционным хирургическим методом.
Сравнительному анализу подвергнуты следующие оперативные вмешательства:
1. Субтотальная резекция доли произведена 9 (14,5 %) пациентам в I и 26 (16,4 %) пациентам во II группе. В обеих группах данная операция выполнялась только при одностороннем узловом доброкачественном (коллоидном) поражении ЩЖ.
Преимущество эндовидеохирургической субтотальной резекции перед традиционной заключается в том, что при оставлении одного и того же количества ткани, как показывают наши эксперименты, после резекции ЩЖ ультразвуковыми ножницами ткань полностью восстанавливается уже на седьмые сутки, а после ушивания шовным материалом — почти через месяц. Однако субтотальная резекция доли не может считаться операцией выбора при узловом поражении ЩЖ в соответствии с современными тенденциями в эндокринной хирургии и рекомендациями большинства хирургических эндокринологических ассоциаций. Мы применяли данную операцию на этапе освоения методики, сместив акцент в объеме операции в сторону гемитиреоидэктомии, которая, по нашему мнению и данным литературы, является более оправданной и адекватной операцией.
2. В I группе гемитиреоидэктомия с перешейком (по существующим онкологическим принципам операция гемитиреоидэктомии всегда выполнялась нами только вместе с резекцией перешейка) была произведена 26 (41,9 %) больным, у которых доля была замещена узловыми образованиями или был подтвержден диагноз ПР I ст. Т1N0М0, не выходящего, по данным срочной гистологии, за пределы капсулы ЩЖ. Таких пациентов было 5 (8,0 %). Во II группе гемитиреоидэктомия с перешейком выполнена традиционным способом 20 больным (12,6 %), из них 6 пациентов (3,7 %) имели ПР I ст. Т1N0М0.
Операцию из мини-доступа начинали с максимального выделения верхнего полюса доли с помощью тупфера, стараясь не использовать ультразвуковые ножницы ближе чем на 3 мм от возможного прохождения возвратных гортанных нервов (ВГН). Далее с помощью ультразвуковых ножниц резецировали боковые сосуды (вена Кохера). При мобилизации верхнего полюса также максимально прецизионно выделяли верхние щитовидные сосуды, чтобы предотвратить повреждение наружной ветви ВГН.
3. В I группе субтотальная резекция ЩЖ выполнена из мини-доступа у 9 пациентов с многоузловым эутиреоидным зобом II ст. Во II группе — у 69 больных (43,4 % — наиболее распространенная операция во II группе), из них 38 пациентам с многоузловым эутиреоидным зобом II ст. (23,9 %), 2 пациентам с папиллярным раком I ст. Т1N0М0 (1,3 %) и 20 пациентам с ДТЗ (12,5 %).
Показаниями к операции при узловой форме хронического АИТ (данную категорию пациентов мы отнесли к подгруппе больных с многоузловым зобом) было чувство сдавления, удушья, комка в горле.
4. Тиреоидэктомия из мини-доступа произведена у 13 (21 %) пациентов в I группе и традиционным способом — у 36 (22,6 %) во II группе. При эндовидеохирургическом методе начинали с выделения левой доли, перешейка, далее меняли место расположения хирургической бригады и переходили на правую долю. Ткань ЩЖ, освобожденную от окружающих тканей, перемещали в операционном пространстве.
В I группе 11 пациентов из 13 имели многоузловой эутиреоидный зоб II ст. (17,7 %), а 2 пациента (3,2 %) — ПР I ст. Т2N0М0. Во II группе 11 больных (6,9 %) имели многоузловой эутиреоидный зоб II ст., 16 (10 %) — папиллярный либо фолликулярный рак ЩЖ I–II ст. Т1-3N0М0, 9 пациентов (5,7 %) — ДТЗ.
В I группе тиреоидэктомия с лимфодиссекцией сознательно не выполнялась из мини-доступа с видеоподдержкой ввиду недостаточного собственного опыта и отсутствия убедительных данных в литературе об адекватности и безопасности подобной операции.
При выявлении показаний к лимфодиссекции (поражение регионарных лимфоузлов) проводили конверсию на традиционный доступ и выполняли необходимый по онкологическим принципам объем операции.
Мы придерживались рекомендаций большинства исследователей, имеющих опыт мини-инвазивной хирургии ЩЖ, и применяли мини-доступ при узлах не более 3,0 см и объеме ЩЖ не более 30 мл. Пациенты с узловой формой хронического АИТ и перенесшие ранее тиреоидит не были включены в группу больных, которым выполняли операцию из мини-доступа.
Применение мини-доступа с видеоподдержкой и ультразвуковыми ножницами позволило значимо улучшить результаты хирургического лечения пациентов с заболеваниями ЩЖ и снизить количество осложнений.
Среднее количество кровопотери при традиционной тиреоидэктомии составило 99,5 ± 7,0 мл, тогда как при операции из мини-доступа — 40,5 ± 7,3 мл.
Таким образом, кровопотеря при эндовидеохирургическом методе оперативного вмешательства на ЩЖ и при использовании ультразвуковых ножниц незначительна и не оказывает существенного влияния на процесс лечения. Такой объем кровопотери позволяет завершить операцию с минимальными расходами перевязочного материала и в ряде случаев — без установки страховочного дренажа.
При традиционном методе оперативного вмешательства на ЩЖ после операции дренаж или резиновый выпускник устанавливался в 100 % случаев (159 пациентов). Среднее количество серозно-сукровичного отделяемого из раны за первые сутки составило 42 ± 8 мл. Дренаж удаляли на следующий день, по показаниям — на второй день после операции. При эндовидеохирургическом вмешательстве дренирование раны произведено в 75,8 % случаев (47 пациентов), у 15 больных после-операционная рана не дренировалась (все пациенты после гемитиреоидэктомии). У 47 пациентов страховочный дренаж устанавливался только на сутки, при этом среднее количество отделяемого из раны не превышало 7,0 ± 1,0 мл (р > 0,05).
Длительность операции традиционным способом на одной доле ЩЖ составила в среднем 42 ± 6 мин, эндовидеохирургическим методом из мини-доступа — 28 ± 5 мин. Оперативное вмешательство при двустороннем узловом поражении ЩЖ традиционным способом продолжалось в среднем 72 ± 7 мин, эндовидеохирургическим методом — в среднем 54 ± 6 мин, притом по мере освоения методики оперирования из мини-доступа с видеоподдержкой время операции сокращалось.
Средний койко-день после операции, выполненной традиционном способом, составил 6,4 ± 2,1, а при видео- ассистированном вмешательстве — 2,7 ± 1,9.
Обезболивающие препараты в послеоперационном периоде при эндовидеохирургическом вмешательстве назначались реже и менее продолжительное время. В I группе среднее количество кетонала, использованного в послеоперационном периоде, составило 700 мг/пациента, во второй — 1600 мг/пациента.
Останавливаясь на количестве и характере осложнений, имевшихся после традиционных операций и при использовании мини-доступа с видеоподдержкой и ультразвуковыми ножницами, следует отметить, что в обеих группах отмечено по 1 случаю кровотечения в раннем послеоперационном периоде, что потребовало повторных операций. Во II (контрольной) группе наблюдали 2 случая (1,3 %) преходящих односторонних парезов гортани, тогда как в I группе парезов зафиксировано не было. Однако следует учитывать тот факт, что в I группе имелось более благоприятное для хирурга условие оперирования, несмотря на период освоения новой методики, — меньший объем ЩЖ и узлов, что наряду с видеоподдержкой давало преимущества при выделении и визуализации ВГН.
Прецизионные и менее травматичные манипуляции с ультразвуковыми ножницами, работа на более сухом операционном поле отразились и на снижении количества послеоперационного гипопаратиреоза — с 6,2 % во II группе до 2,7 % в I группе.
Успех любого оперативного вмешательства может во многом зависеть от величины кожного разреза. Сравнительно небольшая площадь шеи наряду с большим числом жизненно важных образований, расположенных близко друг к другу, обусловливают особую сложность и ответственность действий хирурга. Определенной особенностью операций на шее является то, что эта область обычно открыта для обзора, поэтому всегда желателен хороший косметический эффект операции.
Самый изящный рубец после окончания операции можно получить, когда разрез линейный, проходит по естественной складке кожи шеи и длина его незначительна.
Эндовидеохирургический метод лечения заболеваний ЩЖ предполагает вмешательство из кожного разреза длиной 2–3 см. Формирование доступа производили механическим лифтингом, с помощью крючков, набором инструментов для хирургии малых пространств. Операционное поле, созданное таким способом без пересечения претрахеальных мышц, было достаточным для дальнейших манипуляций.
Использование ультразвуковых ножниц позволяло с малой травматичностью из небольшого разреза резецировать ткань ЩЖ в труднодоступных участках, достигать надежного гемостаза без использования лигатур.
Доступ при традиционном методе оперативного вмешательства предполагал разрез кожи длиной 6–8 см, рассечение претрахеальных мышц, постоянное применение лигатур.
При эндовидеохирургическом методе лечения у максимального количества пациентов получен отличный и хороший косметический эффект (95,2 %), при традиционном методе — лишь у 57,9 % (в 1,6 раза лучше, чем при традиционном методе оперативного вмешательства). Неудовлетворительный результат отмечен при традиционном методе лечения у 2 (1,3 %) больных. При эндовидеохирургическом методе оперативного лечения неудовлетворительного результата не наблюдали.
Таким образом, приведенные сравнительные данные, полученные при использовании эндовидеохирургических инструментов и ультразвуковых ножниц, доказывают преимущества эндовидеохирургического метода оперативного вмешательства из мини-доступа перед традиционным вмешательством при определенных формах и размерах ЩЖ.
Результаты применения нейромониторинга возвратного гортанного нерва. Интраоперационный нейромониторинг был использован у 116 пациентов в I группе. Из этих 116 больных 78 пациентов имели диагноз ДТЗ (2 пациента с рецидивом заболевания); 24 — рак ЩЖ (1 пациент — с рецидивом рака) и 14 — узловой и многоузловой зоб (у всех 14 — рецидивный зоб).
Акцент при применении нейромониторинга был сознательно сделан на операциях, при которых четкая визуализация нерва особенно актуальна и трудна: ДТЗ (применение нейромониторинга у всех пациентов I группы), раке ЩЖ (42,9 % пациентов I группы) и повторных вмешательствах на ЩЖ (все пациенты I группы).
Использование во время операции мониторинга возвратного нерва сократило время его поиска. Так, в контрольной группе (II) время поиска в среднем составило 9 ± 1мин, тогда как в основной (I) группе — 3 ± 1 мин (р < 0,05). Кроме того, наличие 2 односторонних парезов гортани во II группе (1,3 %) показывает, что не всегда идентификация возвратного нерва давала уверенность в его реальной сохранности во время операции.
Следует отметить, что применение нейромониторинга потенцировало эффективность применения мини-доступа за счет более четкой визуализации возвратного гортанного нерва при манипуляциях на ограниченном операционном поле и явилось одним из условий безопасного применения методики, особенно на этапе ее освоения, что позволило обойтись без ожидаемых на данном этапе осложнений.
Применение нейромониторинга в комплексе с другими высокотехнологичными инновациями в I группе пациентов сместило акцент в операциях по поводу рака ЩЖ в сторону более радикальной операции — тиреоид-эктомии. Так, в I группе при раке ЩЖ выполнена всего одна субтотальная резекция ЩЖ (1,8 % от общего числа операций по поводу рака, тогда как во II группе этот показатель был равен 11,1 %).
При операциях по поводу ДТЗ четкая идентификация возвратного нерва с помощью аппарата «Нейросан-400» позволила хирургу более свободно манипулировать и безопасно выполнять необходимый объем операции. Так, количество тиреоидэктомий, являющихся операциями выбора при ДТЗ, увеличилось с 23,7 % во II группе до 84,6 % — в I.
Результаты применения эмболизации щитовидных артерий. Эмболизация щитовидных артерий была использована у 38 из 78 больных I группы с диагнозом ДТЗ. У этих пациентов объем ЩЖ превышал 100 см3, составив в среднем 126 см3. Кроме того, у 11 больных отмечалось частично загрудинное расположение ЩЖ.
Эмболизация щитовидных артерий применялась только у пациентов с ДТЗ в качестве предоперационной подготовки за 3–4 дня до операции. Благодаря применению данной инновационной методики удавалось достичь редукции кровотока в ткани ЩЖ с уменьшением объема железы на 15–20 %, что приводило к потенцированию предоперационной тиреостатической терапии, а в последующем — к уменьшению интраоперационной кровопотери.
В итоге объем кровопотери при оперативном вмешательстве при ДТЗ в I группе оказался значительно меньшим, чем в контрольной (II), а именно: 105 ± 15 мл против 200 ± 17 мл соответственно (р < 0,05).
Общая длительность операции у пациентов с ДТЗ II группы колебалась от 48 до 74 минут и составила в среднем 63,0 ± 12,1 мин. В I группе за счет использования предварительной эмболизации щитовидных артерий средняя продолжительность оперативного вмешательства оказалась меньше и составила 45,4 ± 9,8 мин (от 37 до 53 мин) (р < 0,05).
Также следует отметить меньшую кровоточивость тканей во время операции и, соответственно, меньшее количество затраченного интраоперационно расходного материала и меньшее время на завязывание лигатур у пациентов основной группы.
Считаем принципиальным применение данной методики при ДТЗ с объемом железы более 100 см3. Именно при больших и гигантских размеров зобах существуют объективные сложности в предоперационной подготовке больных, связанные с достижением эутиреоза или хотя бы субклинического тиреотоксикоза, и выраженные интраоперационные проблемы, обусловленные как размерами самого зоба, так и выраженной кровоточивостью тканей. При зобах с объемом железы менее 100 см3 применение этой достаточно сложной в исполнении и дорогостоящей методики считаем нецелесообразным.
Результаты применения системы гистологической экспресс-диагностики «Атлант-Биопсия». Срочное интраоперационное гистологическое исследование с применением системы «Атлант-Биопсия» было проведено в I группе у 164 больных: 56 — с раком ЩЖ; 53 — с узловым и многоузловым зобом и 55 пациентов с аденомой ЩЖ. Целью исследования было определение эффективности метода в сравнении с результатами стандартного планового гистологического исследования у данной категории пациентов и данными предоперационного цитологического исследования.
Чувствительность экспресс-диагностики в выявлении коллоидного зоба оказалась равной 94,3 %. Ложноотрицательные результаты составили 5,7 %, в 3 случаях был неправильно поставлен диагноз аденомы. Чувствительность экспресс-диагностики в выявлении коллоидного зоба превышала чувствительность пред-операционной ПТАБ, которая была равна 87 %. Ложноотрицательные результаты при ПТАБ также встречались чаще и составили 13 %: в 5,4 % случаев цитологически неправильно был поставлен вероятностный диагноз аденомы и в 7,6 % случаев на основании атипии клеток фолликулярного эпителия заподозрена злокачественная опухоль.
Специфичность экспресс-диагностики в выявлении коллоидного зоба составила 100 %, а специфичность ПТАБ — 86,9 %. Ложноположительные результаты при ПТАБ получены в 13,1 % случаев: в 6 % не была диагностирована аденома и в 7,1 % случаев цитологически не удалось поставить диагноз рака ЩЖ.
Точность экспресс-диагностики при коллоидном зобе составила 98,2 %, а цитологического метода — 86,9 %.
Чувствительность экспресс-диагностики в выявлении фолликулярных аденом оказалась равной 94,5 %, а чувствительность ПТАБ — 87,2 %. Ложноотрицательные результаты при экспресс-диагностике составили 5,5 %. Ошибки состояли в том, что в 1 (1,8 %) случае неправильно диагностирован зоб и в 2 случаях имелась гипердиагностика злокачественной опухоли (3,7 %). Ложноотрицательные результаты при ПТАБ встретились в 2 раза чаще и составили 12,8 %: в 10,7 % случаев цитологически неправильно диагностирован зоб и в 2,1 % случаев имелась гипердиагностика злокачественной опухоли.
Специфичность экспресс-диагностики аденом равна 98,2 %, а предоперационой ПТАБ — 93 %. Ложноположительные результаты экспресс-диагностики составили 1,8 %, а цитологической диагностики — 7 %. Ошибки экспресс-диагностики заключались в том, что в 2 случаях не удалось четко поставить диагноз злокачественной опухоли. При ПТАБ в 3,9 % случаев не был правильно диагностирован коллоидный зоб и в 3,1 % случаев цитологически не удалось обнаружить злокачественную опухоль.
Точность цитологического метода исследования в комбинации с УЗИ в диагностике фолликулярной аденомы составила 91,5 %, а системы экспресс-диагностики — 96,99 %.
Чувствительность экспресс-диагностики в выявлении злокачественных опухолей равна 98,2 %, предоперационной ПТАБ — 73 %. Ложноотрицательные результаты при экспресс-диагностике составили 1,8 %, а при ПТАБ — 27 %. Ошибка при срочном гистологическом исследовании была лишь в 1 случае — неправильно диагностирована аденома. Ошибки цитологического исследования заключались в том, что в 16,2 % случаев неверно диагностирован зоб и в 10,8 % — аденома.
Специфичность «Атлант-Биопсии» в выявлении рака ЩЖ равна 98,2 %, а ПТАБ — 94,2 %. Ложноположительные результаты составили 1,8 % при экспресс-диагностике и 5,8 % — при ПТАБ. Ошибки при гистологическом исследовании заключались в том, что в 2 случаях не удалось диагностировать аденому ЩЖ, а при цитологическом — в 5 % случаев не диагностирован коллоидный зоб и в 0,8 % — не выявлена аденома ЩЖ.
Точность метода интраоперационной экспресс-диагностики рака ЩЖ составила 96,4 %, а цитологического метода исследования в комбинации с УЗИ — 89,8 %.
Анализируя результаты, полученные при сравнении эффективности системы экспресс-диагностики «Атлант-Биопсия» и предоперационного цитологического исследования, можно прийти к выводу, что применение экспресс-диагностики значительно повышает вероятность получения правильного диагноза во время операции и, соответственно, проведения адекватного объема операции.
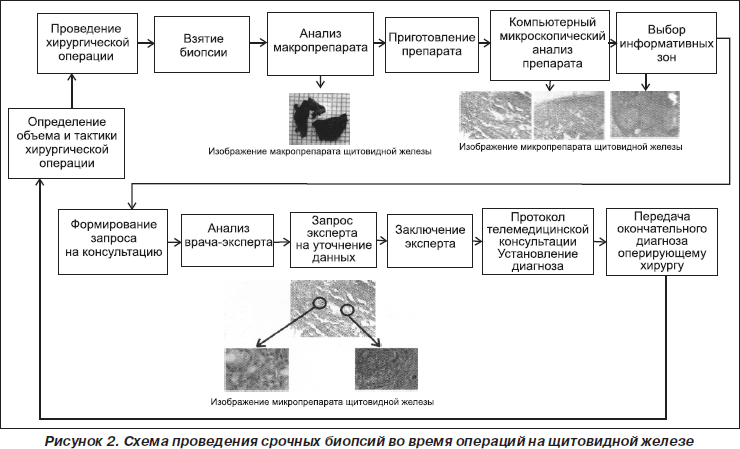
Разработанная система «Атлант-Биопсия» позволяет вводить в компьютер изображения анализируемых гистологических препаратов, сохранять их, сравнивать наблюдаемые изображения с имеющимися в базе, осуществлять коллективные обсуждения анализируемых препаратов (в том числе с участием оперирующих хирургов) со специалистами других медицинских учреждений с одновременным наблюдением изображений препаратов всеми участниками обсуж-дения и возможностью указания областей интереса при обсуждении.
На основании полученных в работе данных сформулированы четкие показания к применению гистологической экспресс-диагностики. Применение экспресс-биопсии показано при выявлении злокачественных симптомокомплексов на УЗИ, при настораживающем или неопределенном цитологическом заключении, а также для оценки прорастания опухолью капсулы.
Компьютерный атлас патологий ЩЖ, созданный на основе системы «Атлант-Биопсия», состоит из базы изображений и средств программной поддержки, обеспечивающих возможность визуализации изображения и поиска его в базе данных. Компьютерный атлас опухолей ЩЖ содержит эталонные изображения, как отсканированные из печатных атласов, так и полученные с натуральных препаратов при использовании системы «Атлант-Биопсия».
При создании атласа была решена основная проблема — обеспечение точности воспроизведения на цифровом изображении информативных признаков опухолей в гистологических препаратах. Приведение вводимых изображений к единой (стандартизованной) цветовой гамме, обеспечивающей сопоставимость эталонных и исследуемых изображений, достигнуто за счет стандартизации условий освещенности препарата с применением необходимых светофильтров и дополнительной цветовой коррекции цифрового изображения при компьютерной обработке.
Программное обеспечение атласа позволяет осуществлять ввод изображений с телевизионной камеры, установленной на микроскопе, и одновременное наблюдение изображения препарата, находящегося под микроскопом, и выбранных изображений из базы. Атлас может использоваться как автономно с помощью персонального компьютера, так и в составе диагностической системы «Атлант-Биопсия». При использовании атласа в составе диагностической системы база эталонных изображений может пополняться в процессе эксплуатации за счет анализируемых препаратов (рис. 2).
Результаты применения электрохимического лизиса узлов щитовидной железы. Неудовлетворенность пациентов косметическими результатами хирургических операций привела к высокой востребованности мини- инвазивных методик лечения узловых заболеваний ЩЖ. В последнее время активно развиваются такие мини- инвазивные методики, как склеротерапия, криодеструкция, диатермокоагуляция и лазериндуцированная термотерапия, радиочастотная абляция узлов ЩЖ. В своей работе мы применили новую методику — ЭХЛ в лечении коллоидных узловых образований ЩЖ размерами до 2,5 см. Ее основными достоинствами являются малая травматичность окружающих тканей, отсутствие повышения температуры в зоне лизиса, что дает возможность многократного применения данного метода при узловых образованиях ЩЖ при практически полном отсутствии осложнений и минимальном стационарном койко-дне.
Одной из задач исследования являлось внедрение методики ЭХЛ — нового эффективного мини-инвазивного метода лечения узловых доброкачественных образований ЩЖ, что помогло бы улучшить результаты лечения пациентов с данной патологией. В процессе исследования мы опирались на свои результаты ЭХЛ узловых образований ЩЖ в условиях эксперимента. В 30 острых и хронических экспериментах на животных и 48 предоперационных клинических испытаниях ранее была доказана зависимость степени деструкции ткани узла от таких факторных признаков, как сила тока и время воздействия. Установлено, при силе тока 90 мА независимо от времени воздействия и расстояния между электродами в данной группе деструкция IV степени наблюдалась в 90 % наблюдений, в 8 % — III степени. При силе тока 60–80 мА прослеживается явная зависимость и от времени экспозиции. Максимальная степень деструкции при данных параметрах силы тока наблюдалась при времени воздействия не менее 15 минут.
Отмечена следующая особенность: решающее значение для распространения некроза имела не только сила тока, но и время воздействия на ткань, то есть можно регулировать объем деструкции по продолжительности воздействия постоянного тока. Таким образом, в эксперименте полная деструкция узла размерами 20–25 мм наблюдалась при силе тока 90 мА и времени экспозиции 15 минут или при силе тока 60–80 мА и времени воздействия 15–30 минут. Попытка применения в клинике режима 90 мА с временем экспозиции 15 минут была признана нецелесообразной, так как подобного эффекта можно было бы достигнуть и при использовании меньшей силы тока (70 мА), а значит, и избежать возможных серьезных осложнений.
При динамическом наблюдении за морфологическими изменениями ЩЖ выявлено, что со временем зона ЭХЛ замещается соединительнотканным рубцом, что является показателем полной деструкции ткани и эффективности методики ЭХЛ.
Сразу после удаления катетеров-стилетов у 1 (1,6 %) больного возникло кровотечение из подкожных вен, остановленное наложением тугой повязки. Также 3 пациентки (4,9 %) пожаловались на ощущение давления в области ЩЖ, которое прошло самостоятельно в течение 1 недели. При оценке общего соматического состояния (температура, пульс, артериальное давление) отклонений от нормы выявлено не было.
Изучение осложнений в раннем послеоперационном периоде в контрольной группе (II) показало, что у 3 (5 %) пациентов выявлены признаки гипопаратиреоза, потребовавшего дополнительной медикаментозной терапии. У 5 (8,3 %) больных после операции отмечены воспалительные изменения со стороны послеоперационной раны, потребовавшие назначения дополнительной противовоспалительной терапии и перевязок. У 42 (70 %) пациентов после оперативного лечения развился клинически значимый гипотиреоз, потребовавший назначения заместительной гормональной терапии. Таким образом, выявлены достоверные различия между двумя исследуемыми группами по признаку «осложнения» (р < 0,05).
В работе также оценивали отдаленные последствия проведения ЭХЛ у пациенток с доброкачественными образованиями ЩЖ и у пациенток после стандартного хирургического лечения. В данном разделе исследования важными вопросами являлись наблюдение за изменениями размеров узловых образований после ЭХЛ и изменения гормонального фона у пациенток с доброкачественными образованиями ЩЖ после ЭХЛ.
При анализе результатов лечения мы не выявили клинически значимого изменения уровня гормонов ЩЖ у пациенток после проведенного ЭХЛ, на основании чего можно сделать вывод, что ЭХЛ воздействует только на ткань узла. При оценке размеров узлов в 54 (88,5 %) случаях наблюдали их уменьшение в объеме более чем на 50 % от исходного, а в 7 случаях (11,5 %) — уменьшение менее чем на 50 %, что дает возможность говорить об ЭХЛ как эффективном методе лечения доброкачественных узловых образований ЩЖ. Ни в одном случае при наблюдении пациентов в течение года роста узлов не отмечено.
Такие критерии, как косметический эффект и длительность пребывания в стационаре, также использовали для оценки результатов лечения в двух группах: в группе, где лечение доброкачественных узловых образований ЩЖ осуществлялось методом ЭХЛ (солитарный коллоидный узел до 2,5 см диаметром), и в группе ретроспективного анализа, где осуществлялось традиционное хирургическое лечение — гемитиреоидэктомия.
Проведенный статистический анализ показал, что наименьшая длительность пребывания в стационаре наблюдалась в группе, где ЭХЛ использовался в качестве самостоятельного метода лечения (р < 0,05), что лишний раз доказывает его безопасность. Применение методики ЭХЛ в лечении пациентов с доброкачественными узловыми образованиями ЩЖ признано экономически обоснованным. Сравнение по критерию косметического эффекта показало достоверно лучшие результаты в группе, где применялся ЭХЛ доброкачественных узловых образований ЩЖ, что говорит о социальной значимости метода, ведь большинство пациентов, имеющих доброкачественные образования ЩЖ, — женщины.
Анализ результатов комплексного УЗИ ЩЖ после лечения методом ЭХЛ показал, что эхоструктура железы в месте воздействия лизиса в ранние сроки характеризовалась наличием участка повышенной эхогенности, который соответствовал некрозу, а через 1 месяц исследования и более участок уменьшался в размерах и выявлялось гиперэхогенное образование, соответствующее фиброзу, по данным допплерометрии кровоток в этой зоне не определялся. Через 3, 6 месяцев и 1 год рецидивов не наблюдалось.
Таким образом, применение нового комплексного подхода к диагностике и хирургическому лечению заболеваний ЩЖ с использованием новых методик позволяет значимо улучшить ближайшие и отдаленные результаты лечения больных.
Выводы
1. Методика определения ряда ультразвуковых и цитоморфологических признаков позволяет оптимизировать диагностику раков щитовидной железы на ранней стадии, при этом ее чувствительность составляет 73 %, специфичность — 94,2 %, диагностическая точность — 89,8 %. Компьютерная система гистологической экспресс-диагностики «Атлант-Биопсия» позволяет устанавливать точный диагноз уже на интраоперационном этапе. Так, чувствительность метода при диагностике рака щитовидной железы составляет 98,2 %, специфичность — 100 %, точность — 96,4 %.
2. Использование электрохимического лизиса как альтернативы хирургическому лечению пациентов возможно при солитарных узловых образованиях щитовидной железы не более 2,5 см в диаметре, при отсутствии подозрения на злокачественный процесс в узле и эутиреоидном состоянии пациента. Достоверными клинико-инструментальными критериями его эффективности непосредственно при выполнении служат: появление на экране УЗ-прибора округлого эхопозитивного образования, захватывающего весь объем узла и не менее 3–5 мм вокруг него, исчезновение кровотока по всему периметру узла; в отдаленном периоде — уменьшение объема узла более чем на 50 % от исходного через 3–6 месяцев, отсутствие рецидива заболевания.
3. Разработанная методика операции из мини-доступа с помощью видеоассистированной технологии и ультразвуковых ножниц показала свое преимущество перед традиционным хирургическим лечением по поводу узловых заболеваний щитовидной железы по всем параметрам сравнения при размерах узлов до 3,0 см и объеме щитовидной железы до 30 см3. Применение при операциях на щитовидной железе методики интраоперационного нейромониторинга с помощью прибора «Нейросайн-400» позволяет во всех случаях провести быструю и четкую идентификацию возвратных нервов и тем самым избежать их травматического повреждения, что особенно актуально при операциях по поводу диффузного токсического зоба, рака щитовидной железы и при повторных вмешательствах на щитовидной железе.
4. Методика эндоваскулярной эмболизации щитовидных артерий у пациентов с диффузным токсическим зобом объемом более 100 см3 в предоперационном периоде способствует уменьшению объема щитовидной железы на 15–20 % по сравнению с исходным, потенцирует проводимую тиреостатическую терапию, значимо снижает интраоперационную кровопотерю, продолжительность и травматичность операции.
5. Использование новых технологий (предоперационная рентгенэндоваскулярная эмболизация щитовидных артерий, интраоперационный нейромониторинг возвратных нервов, видеоассистированная технология с использованием ультразвуковых ножниц) позволяет значимо улучшить непосредственные и отдаленные результаты хирургического лечения заболеваний щитовидной железы.
1. Иванов Ю.В., Соловьев Н.А., Волчанская С.В., Степанов В.А. Новые подходы к хирургическому лечению заболеваний щитовидной железы // Анналы хирургии. — 2002. — № 6. — С. 67-70.
2. Агапов В.К., Истомин Н.П., Иванов Ю.В., Кейян С.В., Истомин Д.Н, Соловьев Н.А. Методические рекомендации по лечению рака щитовидной железы // Институт повышения квалификации ФМБА России. — М., 2004. — 26 с.
3. Борсуков А.В., Косова А.А., Андреева О.В., Амиров А.Х., Иванов Ю.В., Соловьев Н.А. Первые результаты экспериментального электрохимического лизиса в хирургической эндокринологии // Медицинский вестник МВД. — 2009. — № 3. — С. 6-11.
4. Иванов Ю.В., Шабловский О.Р., Истомин Н.П., Соловьев Н.А., Попов Д.В., Злобин А.И. Особенности лечебно-диагностической тактики при заболеваниях щитовидной железы // Хирург. — 2010. — № 3. — С. 14-21.
5. Соловьев Н.А., Иванов Ю.В., Панченков Д.Н. и др. Роль пункционной тонкоигольной аспирационной биопсии в диагностике узловых образований щитовидной железы // Эндоскопическая хирургия. — 2010. — № 3. — С. 25-34.