Международный эндокринологический журнал 3 (51) 2013
Вернуться к номеру
Первичная недостаточность коры надпочечников
Авторы: Панькив В.И. - Украинский научно-практический центр эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины, г. Киев
Рубрики: Эндокринология
Разделы: Медицинское образование
Версия для печати
Надпочечные железы представляют собой парный внебрюшинный орган, располагающийся у верхних полюсов почек, латеральнее позвоночника, на уровне ThXII и LI позвонков. Каждый надпочечник имеет массу в среднем 4 г, которая не зависит от пола и массы тела. Каждая железа снабжается кровью трех артерий за счет a. suprarenalis superior (от a. phrenica inferior), a. suprarenalis media (от aorta abdominalis), a. suprarenalis inferior (от a. renalis). Иннервация надпочечников осуществляется за счет п. splanchnicus major через plexus coeliacus et plexus renalis. Кроме чревных нервов, к надпочечникам идут волокна блуждающего и диафрагмального нервов.
Надпочечные железы состоят из коркового и мозгового вещества. Мозговое вещество состоит из хромаффинных элементов, а также большого количества безмиелиновых нервных волокон и ганглиозных (симпатических) мультиполярных нейронов. Хромаффинные клетки секретируют адреналин и норадреналин (катехоламины). На долю коркового слоя у взрослого человека приходится около 90 % ткани. Этот слой состоит из трех зон: наружной — клубочковой, средней — пучковой и внутренней — сетчатой. Клубочковая зона находится непосредственно под капсулой, занимает примерно 15 % объема коркового слоя и вырабатывает гормон альдостерон. На долю пучковой зоны приходится около 75 % коркового вещества, ее клетки богаты холестерином и вырабатывают в основном кортизол (гидрокортизон). Клетки сетчатой зоны также продуцируют кортизол и вырабатывают половые гормоны — андрогены и эстрогены. Гормоны коркового вещества надпочечников по химической структуре являются производными циклопентанпергидрофенантрена, в основе их химической структуры лежит стероидное кольцо из 17 атомов углерода.
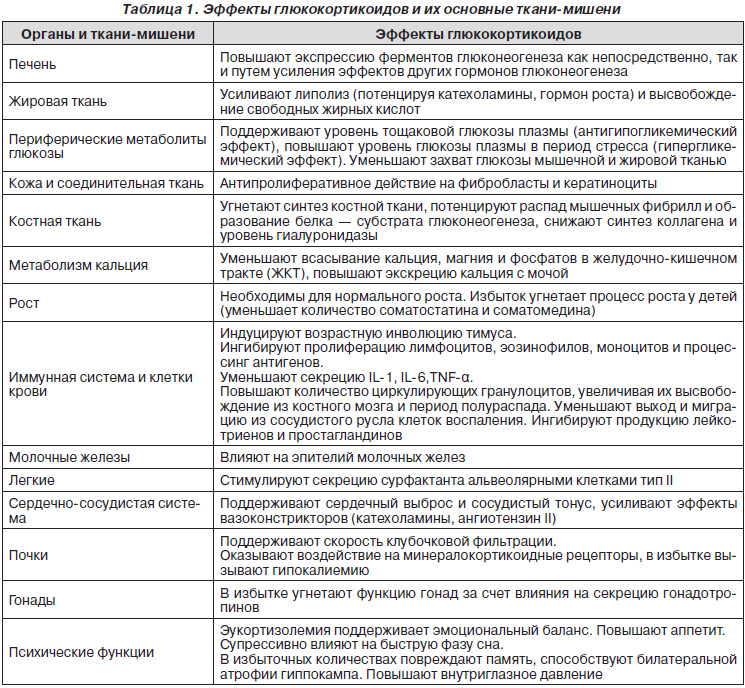
Основным глюкокортикоидом у человека является кортизол, избыток или недостаток которого сопровождаются угрожающими жизни сдвигами (табл. 1). В регуляции секреции кортизола принимают участие по меньшей мере 4 механизма, регулирующих функцию гипоталамо-гипофизарной системы: циркадный, стресс, принцип обратной связи, стимуляция цитокинами.
Альдостерон — основной минералокортикоид человека, регулирующий водно-солевой обмен, в первую очередь обмен ионов натрия, калия, водорода. Секрецию альдостерона регулирует главным образом концентрация калия в сыворотке крови и активность ренин-ангиотензиновой системы. Адренокортикотропный гормон (АКТГ) имеет незначительное влияние на секрецию альдостерона. Избыток минералокортикоидов обусловливает артериальную гипертензию, а недостаток — гиперкалиемию, которые могут оказаться несовместимыми с жизнью (табл. 2).
Андрогены надпочечникового происхождения. Кора надпочечников выделяет следующие андрогенные стероиды: дегидроэпиандростерон, его сульфат и андростендион. Все эти вещества являются слабыми андрогенами, однако в периферических тканях они могут превращаться в сильный андроген тестостерон. В печени и жировой ткани из андрогенов надпочечникового происхождения образуется эстрогенное вещество — эстрон. Кроме кортикотропина, стимулирующего секрецию андрогенов, в надпочечнике существуют и другие регулирующие факторы (особенно в пубертатном периоде). Вклад надпочечных андрогенов в общий андрогеновый пул взрослого мужчины незначителен в сравнении с тестостероном яичек, в то время как у женщин кора надпочечников является основным источником андрогенов. Избыток секреции андрогенов у женщин приводит к вирилизации. У мужчин же как избыток, так и недостаток секреции андрогенов надпочечниками могут проходить незамеченными. У женщин андрогены надпочечных желез играют роль в поддержании нормального роста волос в паховой области и на лобке, а также, возможно, в формировании либидо.
Сфера применения кортикостероидов в современной клинической медицине чрезвычайно широка. На сегодня это самые мощные противовоспалительные средства, которые ежедневно спасают жизнь тысячам людей. Но врачи-эндокринологи нередко сталкиваются с этими лекарственными средствами совсем в другой ситуации: когда необходимо назначить заместительную гормональную терапию при недостаточности надпочечников. Очевидно, что использование лекарственных средств для решения последней задачи принципиально отличается от их применения в качестве противовоспалительных средств.
Первые попытки создать лекарственные средства для заместительной терапии гипокортицизма предпринимались еще во второй половине XIX века: пациентам с болезнью Аддисона (недостаточностью надпочечников) назначали сырой или высушенный надпочечник животных, водный, спиртовой и глицериновый экстракты целых надпочечников, однако клиническая эффективность этих средств была невысока.
В конце 20-х гг. XX века с успехом начал использоваться экстракт коры надпочечников (кортин). Дополнительно больным рекомендовали принимать 10 г поваренной соли либо 1 л так называемого эликсира Аддисона (10 г поваренной соли и 5 г лимонно-кислого натрия в 1 л воды с фруктовым соком).
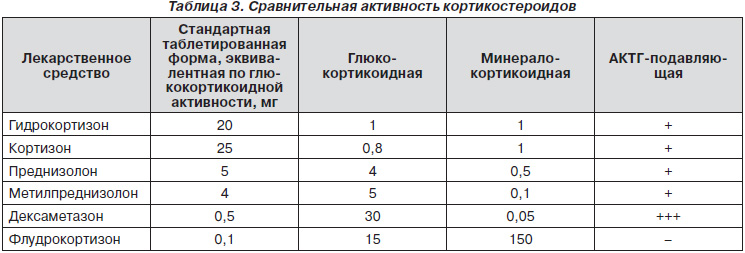
В 1937 г. из экстракта коры надпочечников был выделен основной глюкокортикоид надпочечников человека — кортизол (средство получило название «гидрокортизон»). Сначала он применялся только для лечения болезни Аддисона, но в конце 1940-х гг. будущий лауреат Нобелевской премии Хенч предложил использовать глюкокортикостероиды (ГКС) для лечения ревматоидного артрита. С этого момента в ревматологии открылась новая эра, и сразу же возникла необходимость в лекарственных средствах с максимально выраженными глюкокортикоидными и минимально выраженными минералокортикоидными свойствами. В 1955 г. путем введения двойной связи между первым и вторым атомами стеранового скелета был синтезирован преднизолон, а вскоре и все остальные современные ГКС.
В 1937 г. помимо кортизола был получен и дезоксикортикостерона ацетат (ДОКСА) — средство, обладающее высокой минералокортикоидной активностью. ДОКСА практически полностью метаболизируется в печени при первом прохождении, поэтому были предложены масляные растворы ДОКСА для внутримышечного и подкожного введения. К сожалению, применение лекарственных средств нередко сопровождалось передозировками, постинъекционными абсцессами. В связи с этим была разработана сублингвальная форма ДОКСА.
В 1953 г. был синтезирован 9а-фторкортизол (флудрокортизон), который, с одной стороны, эффективен при приеме внутрь, а с другой — обладает мощным минералокортикоидным действием, сопоставимым с таковым альдостерона, тогда как биологическая активность ДОКСА в 30 раз меньше по сравнению с альдостероном. Именно поэтому к настоящему моменту флудрокортизон полностью вытеснил ДОКСА, который больше не применяется для заместительной терапии при первичной надпочечниковой недостаточности.
Следует отметить, что естественный альдостерон не может использоваться для заместительной терапии, потому что полностью метаболизируется при первом прохождении через печень (как и ДОКСА) и слишком дорог.
Кортикостероиды оказывают свое действие при связывании с внутриклеточными стероидными рецепторами, при этом они осуществляют регуляцию экспрессии генов на транскрипционном и посттранскрипционном уровнях.
Неактивные глюкокортикоидные рецепторы существуют в форме гетероолигомерных комплексов, в состав которых, помимо самого рецептора, входят белки теплового шока (heat shock protein — hsp), различные виды РНК и другие структуры. С-конец рецептора связан с крупным белковым комплексом, включающим две субъединицы белка hsp90. Этот белок необходим для конформационных изменений молекулы рецептора, способствующих приобретению сродства к кортизолу. После связывания кортизола с рецептором hsp90 отщепляется, а образовавшийся комплекс «гормон — рецептор» проникает в ядро и действует на определенные участки ДНК. ГКС обладают как прямым, так и опосредованным действием. Внутри клетки ГКС-рецепторы образуют димер, который связывается с участками ДНК, получившими название глюкокортикоидотвечающих элементов. Последние расположены в промоторном участке стероидотвечающего гена.
Кроме того, ГКС-рецепторы взаимодействуют с различными факторами транскрипции, или ядерными факторами. Ядерные факторы, такие как активированный белок фактора транскрипции и ядерный фактор каппа-В, являются естественными регуляторами нескольких генов, принимающих участие в иммунном ответе и воспалении, включая гены цитокинов, их рецепторов, молекул адгезии, протеинов.
ГКС обеспечивают адаптацию организма к стрессорным воздействиям со стороны внешней среды. Происходит это за счет многостороннего влияния на обмен веществ.
ГКС являются контринсулярными гормонами, по-этому способствуют развитию гипергликемии. Во-пер-вых, они стимулируют печеночный глюконеогенез, во-вторых, усиливают катаболизм белков, тем самым стимулируя высвобождение аминокислот — субстратов глюконеогенеза из периферических тканей. Кроме того, ГКС помогают другим гормонам стимулировать ключевые метаболические процессы, в том числе глюконеогенез, с максимальном эффектом (пермиссивное действие ГКС).
ГКС усиливают липолитическое действие катехоламинов и гормона роста, а также снижают потребление и использование глюкозы жировой тканью. Избыточное количество ГКС стимулирует липолиз в одних частях тела (конечности) и липогенез в других (лицо, туловище) и приводит к возрастанию уровня свободных жирных кислот в плазме.
На обмен белков ГКС оказывают анаболическое действие в печени и катаболическое — в мышцах, жировой и лимфоидной тканях, коже, костях. Они тормозят рост и деление фибробластов, образование коллагена, за счет чего нарушают репаративную фазу воспаления.
В системе «гипоталамус — гипофиз — надпочечники» действует классический принцип «отрицательной обратной связи», в соответствии с которым ГКС подавляют образование кортикотропин-рилизинг-гормона и адренокортикотропного гормона. ГКС обладают различной АКТГ-подавляющей активностью.
В отличие от ГКС-рецепторов, распространенных по всему организму, альдостероновые рецепторы сосредоточены преимущественно в области дистальных извитых канальцев нефрона. ГКС обладают высоким аффинитетом не только к собственным, но и к альдостероновым рецепторам. Однако фермент 11а-гидроксистероиддегидрогеназа, присутствующий в почках, превращает кортизол в биологически малоактивный кортизон. Из всех кортикостероидов только альдостерон и флудрокортизон не подвергаются инактивации, что обусловливает их высокую минералокортикоидную активность. Интересно, что флудрокортизон обладает в 200–400 раз большей минералокортикоидной активностью, чем кортизол, хотя отличается от последнего всего одним атомом фтора. Именно этот атом фтора защищает флудрокортизон от действия 11а-гидроксистероиддегидро-геназы и позволяет тому стимулировать альдостероновые рецепторы (табл. 3).
Основной функцией минералокортикоидов является задержка в организме натрия и поддержание физиологической осмолярности внутренней среды. Главным органом-мишенью для минералокортикоидов является почка, где они усиливают активную реабсорбцию натрия в дистальных извитых канальцах и собирательных трубочках путем стимуляции экспрессии гена Na+/К+-АТФазы. Кроме того, минералокортикоиды способствуют выделению поч-ками ионов калия, водорода и аммония. При ре-абсорбции двух ионов натрия выделяется один ион калия.
Современные кортикостероиды хорошо всасываются в ЖКТ. Пища мало влияет на абсорбцию лекарственных средств. Внутривенные, внутримышечные и другие пути введения врачи-эндокринологи практически не используют, за исключением терапии острой надпочечниковой недостаточности, когда гидрокортизон необходимо вводить парентерально.
Кортикостероиды, как и большинство гормонов, активно связываются с белками плазмы. Большая часть кортизола (80 %) связана со специфическим кортикостероидсвязывающим глобулином — транскортином. Альбумин — это второй по важности транспорт-ный белок.
Первичная хроническая надпочечниковая недостаточность
Первичная хроническая надпочечниковая недостаточность (ПХНН) (недостаточность коры надпочечников, первичный гипокортицизм) — клинический синдром, обусловленный недостаточной секрецией гормонов коры надпочечников в результате разрушения последней различными деструктивными процессами. Первичный гипокортицизм аутоиммунной и туберкулезной этиологии обозначается термином «болезнь Аддисона».
Эпидемиология
ПХНН является относительно редким заболеванием. Частота новых случаев составляет от 40–60 до 100–110 на 1 млн взрослых в год.
Классификация
Выделяют следующие этиологические факторы ПХНН:
— аутоиммунную деструкцию коры надпочечников:
- изолированную;
- при аутоиммунном полигландулярном синдроме (АПС) 1-го типа;
- при АПС 2-го типа;
— туберкулез надпочечников;
— адренолейкодистрофию;
— ятрогенную ПХНН (вследствие двусторонней адреналэктомии);
— метастатическое и опухолевое поражение надпочечников;
— геморрагический инфаркт надпочечников (ДВС-синдром, синдром Уотерхауса — Фридериксена);
— редкие причины: амилоидоз, грибковые инфекции, сифилис, ВИЧ-ассоциированный комплекс и др.
Для развития ПХНН необходимо разрушение 90 % коры обоих надпочечников.
Аутоиммунная деструкция коры надпочечников в настоящее время является основной причиной ПХНН. На ее долю в развитых странах приходится до 90 % случаев и более ПХНН. В 40 % случаев и более ПХНН аутоиммунного генеза встречается в рамках АПС.
Деструкция надпочечников туберкулезным процессом занимает второе место в ряду этиологических факторов ПХНН. Туберкулез надпочечников развивается вследствие гематогенного распространения микобактерий.
Адренолейкодистрофия (АЛД) (болезнь Зимерлинга — Кройцфельдта, меланодермическая лейкодистрофия) — это заболевание с Х-сцепленным рецессивным типом наследования; основным проявлением АЛД является поражение белого вещества центральной нервной системы (ЦНС) и коры надпочечников в результате нарушения метаболизма и аккумуляции в этих тканях длинноцепочечных жирных кислот (ДЖК). Предположительная распространенность заболевания составляет 1 на 100 000–150 000 мужчин. Первичный гипокортицизм, развившийся при АЛД, имеет наиболее тяжелый прогноз по сравнению с ПХНН другого генеза, что определяется сопутствующей неврологической патологией. Помимо коры надпочечников при АЛД нередко отмечают поражение яичек с развитием первичного гипогонадизма.
Поражение надпочечников метастазами опухолей встречается достаточно часто. Метастазы рака молочной железы поражают надпочечники примерно в 58 % случаев, бронхогенного рака легкого — в 36–40 %, меланомы — в 33 % случаев. Однако ПХНН при этом развивается очень редко, поскольку для этого необходимо разрушение 90 % коры обоих надпочечников. Латентно протекающая ПХНН выявляется у 8–12 % больных ВИЧ-инфекцией. Наиболее часто ПХНН развивается в результате поражения надпочечников инфильтративным процессом с последующей деструкцией ткани (цитомегаловирусная инфекция, грибковые инфекции, саркома Капоши, лимфома и т.д.).
Этиология и патогенез
В основе патогенеза ПХНН лежит абсолютный дефицит кортикостероидов. Наиболее тяжелые метаболические сдвиги развиваются вследствие дефицита основного минералокортикоида — альдостерона. Этот дефицит приводит к потере натрия и воды через почки и ЖКТ. В результате развиваются обезвоживание, гипотония и желудочно-кишечные расстройства. В тяжелых случаях, при развитии выраженной гипонатриемии и гипоосмолярности, происходит нарушение трансмембранного гомеостаза с последующим развитием клеточной дегидратации. Наиболее тяжелые в этом плане изменения наблюдаются со стороны ЦНС и могут включать прогрессирующее нарушение сознания, кому и смерть больного. Параллельно с потерей натрия и воды происходит задержка калия. В наиболее явной форме гиперкалиемия проявляется нарушением работы сердца — гиперкалиемической миокардиодистрофией. Дефицит кортизола — основного адаптогенного гормона человеческого организма приводит к снижению сопротивляемости к различным эндо- и экзогенным стрессорным воздействиям (чаще всего инфекциям), на фоне чего и происходит декомпенсация заболевания. Принципиальное значение имеет выпадение такой функции кортизола, как стимуляция глюконео-генеза и гликогенолиза в печени, а также пермиссивные эффекты кортизола в отношении тиреоидных гормонов и катехоламинов.
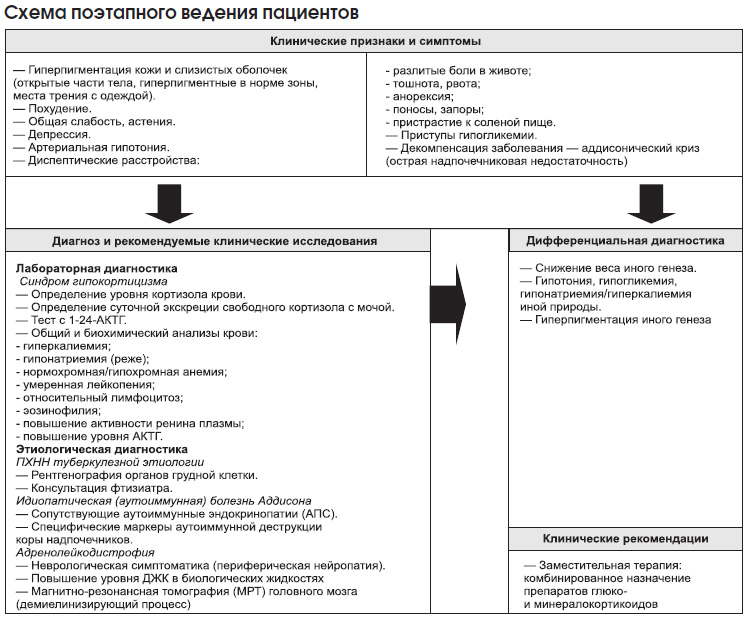
Клинические признаки и симптомы
— Гиперпигментация кожи и слизистых оболочек.
— Похудение.
— Общая слабость, астения, депрессия.
— Артериальная гипотония.
— Диспептические расстройства (разлитые боли в животе, тошнота, рвота, анорексия, поносы, запоры).
— Пристрастие к соленой пище.
— Приступы гипогликемии.
Гиперпигментация кожи и слизистых. Это наиболее известный и типичный симптом ПХНН. Выраженность гиперпигментации соответствует тяжести и давности процесса. Вначале темнеют открытые части тела, наиболее подверженные действию солнца: лицо, шея, руки, а также места, которые и в норме более сильно пигментированы: соски, мошонка, наружные половые органы. Большую диагностическую ценность имеет гиперпигментация мест трения и видимых слизистых. Характерна гиперпигментация ладонных линий, которые выделяются на относительно светлом фоне окружающей кожи, потемнение мест трения одеждой, воротником, поясом. Оттенок кожи может варьировать от дымчатого, бронзового («бронзовая болезнь»), цвета загара, «грязной» кожи вплоть до выраженной диффузной гиперпигментации. Достаточно специфична, но не всегда выражена гиперпигментация слизистой губ, десен, щек, мягкого и твердого неба.
Похудение относится к характерным симптомам ПХНН; прогрессирующее увеличение веса пациента на протяжении предполагаемого анамнеза практически исключает диагноз.
Общая и мышечная слабость в начале заболевания может быть выражена умеренно (снижение работоспособности) и достигает значительных степеней при декомпенсации (вплоть до адинамии).
Важнейший симптом ПХНН — артериальная гипотония. Наличие у больного выраженной систолической и диастолической гипертонии в большинстве случаев позволяет исключить диагноз ПХНН.
Диспептические расстройства той или иной выраженности имеются практически всегда. Характерный симптом ПХНН, патогенетически связанный с выраженной потерей натрия, — это пристрастие к соленой пище.
Тяжелые инфекции, прием ряда лекарственных средств, травма или хирургическое вмешательство могут спровоцировать декомпенсацию заболевания с развитием острой надпочечниковой недостаточности (аддисонический криз).
Диагноз и рекомендуемые клинические исследования
Диагностический поиск при ПХНН включает следующие этапы:
— оценка клинических проявлений (на основании данных клинической картины высказывается предположение о наличии ПХНН);
— лабораторное подтверждение синдрома гипокортицизма (на этом этапе при помощи гормональных исследований, объем которых определяется конкретной клинической ситуацией, необходимо доказать или отвергнуть наличие дефицита кортикостероидов);
— этиологическая диагностика (выяснение причины деструкции коры надпочечника).
Лабораторное подтверждение синдрома гипокортицизма
Определение уровня кортизола крови имеет ограниченное диагностическое значение, поскольку у многих больных ПХНН он нередко оказывается на нижней границе нормы.
Простым, но недостаточно надежным методом диагностики ПХНН является определение суточной экскреции свободного кортизола с мочой. При развернутой клинической картине первичного гипокортицизма обнаружение значительного снижения суточной экскреции свободного кортизола с мочой позволяет подтвердить диагноз и приступить к лечению.
При стертой клинической картине ПХНН, а также при пограничных или сомнительных результатах определения экскреции кортизола пациентам показано проведение теста с 1-24-АКТГ (первые 24 аминокислоты 39-аминокислотной молекулы АКТГ). Проведение теста с 1-24-АКТГ целесообразно в любой ситуации, когда врач не имеет опыта работы с больными ПХНН или у пациента отсутствует хотя бы один из таких симптомов, как выраженная меланодермия, похудение, артериальная гипотония и диспепсия. Стимуляционный тест с исследованием уровня кортизола плазмы через 30 и 60 мин после внутривенного введения 250 мг (25 ЕД) 1-24-АКТГ на 5 мл физиологического раствора — классическое исследование в диагностике первичного гипокортицизма. Повышение уровня кортизола более 500 нмоль/л надежно исключает ПХНН.
В связи с частым отсутствием препаратов 1-24-АКТГ короткого действия можно использовать синтетический аналог АКТГ тетракозактид (препарат-депо): в 21–22 ч пациенту глубоко внутримышечно вводят 250–1000 мкг лекарственного средства; на следующий день в 8–9 ч утра исследуют уровень кортизола плазмы. Обнаружение уровня кортизола > 500–550 нмоль/л позволяет исключить ПХНН.
Результаты общего клинического и биохимического анализов крови имеют ограниченное значение в диагностике ПХНН. Для ПХНН характерны гиперкалиемия и, реже, гипонатриемия, нормохромная или гипохромная анемия, умеренная лейкопения, относительный лимфоцитоз и эозинофилия. Кроме того, при ПХНН отмечают повышение активности ренина плазмы и уровня АКТГ.
Этиологическая диагностика
— Исключение туберкулезной этиологии ПХНН (рентгенография органов грудной клетки, консультация фтизиатра).
— При отсутствии данных о туберкулезном процессе устанавливают диагноз предположительно идиопатической (аутоиммунной) болезни Аддисона. Веским аргументом в пользу этого диагноза служит наличие у пациента сопутствующих аутоиммунных эндокринопатий, т.е. АПС. Специфическими иммунологическими маркерами аутоиммунной деструкции коры надпочечников являются аутоантитела к ферментам надпочечникового стероидогенеза — 21-гидроксилазе (Р450с21), 17-гидроксилазе (Р450с17) и ферменту отщепления боковой цепи (P450scc). При изолированной ПХНН наибольшее диагностическое значение имеют антитела к Р450с21. Метод применяется редко.
— АЛД можно заподозрить при сочетании ПХНН с различного рода неврологической симптоматикой (в частности, с периферической нейропатией). Лабораторным маркером АЛД является повышение уровня длинноцепочечных жирных кислот в биологических жидкостях. Определяют уровни тетракозановой (С24:0), пентакозановой (С25:0) и гексакозановой (С26:0) кислот в плазме, а также их отношение к уровню бегеновой кислоты (С22:0). При подозрении на АЛД обязательным исследованием является МРТ головного мозга для выявления демиелинизирующего процесса.
— Традиционно в этиологической диагностике ПХНН инструментальным методам, позволяющим визуализировать надпочечники (рентгеновское исследование, компьютерная томография, МРТ), отводится небольшая роль. Тем не менее при туберкулезе возможно выявление увеличенных надпочечников, иногда кальцинатов.
Дифференциальная диагностика
Дифференциальную диагностику ПХНН проводят со следующими заболеваниями и состояниями:
— снижение веса иного генеза;
— гипотония, гипогликемия, гипонатриемия/гиперкалиемия иной природы;
— гиперпигментация иного генеза.
Клинические рекомендации
Заместительная терапия ПХНН подразумевает обязательное комбинированное назначение ГКС и минералокортикоидов.
Заместительная терапия минералокортикоидами
Современная заместительная терапия ПХНН минералокортикоидами подразумевает использование только одного лекарственного средства — 9а-фторкортизола (флудрокортизона): утром после еды 0,05–0,10 мг 1 р/сут внутрь (возможно увеличение дозы до 0,2 мг), длительно.
Заместительная терапия ГКС
В качестве глюкокортикоидного компонента терапии могут назначаться различные лекарственные средства, при этом нужно иметь в виду следующее:
— циркадный характер секреции ГКС в норме;
— короткий период полужизни естественного и основного ГКС человека кортизола и лекарственных средств, содержащих кортизол;
— отсутствие объективных (лабораторных) критериев адекватности заместительной терапии ГКС, пригодных для повседневной практики. Наиболее используемым в мире глюкокортикоидным лекарственным средством для заместительной терапии ПХНН является таблетированный гидрокортизон (короткого действия). Отрицательным свойством синтетических лекарственных средств является их относительно узкий терапевтический диапазон. Лекарственным средством выбора у детей и подростков является именно гидрокортизон, поскольку терапия синтетическими препаратами может вызвать задержку роста у детей. У взрослых возможно назначение ГКС средней продолжительности действия (преднизолона).
Назначают гидрокортизон внутрь 10–20 мг утром и 5–10 мг после обеда (2-разовый режим) или 10–15 мг утром, 5–10 мг после обеда, 5 мг вечером (3-разовый режим), длительно или преднизолон внутрь 5 мг утром и 2,5 мг после обеда, длительно. Профилактика декомпенсации заболевания и развития острой надпочечниковой недостаточности при ПХНН подразумевает увеличение дозы ГКС при возникновении сопутствующих заболеваний, а также переход на парентеральное введение в случае тяжелых заболеваний, операций. Следует заметить, что при быстрой стабилизации состояния пациента, например при плановых операциях, нет необходимости в долгой терапии большими дозами гидрокортизона. Нужно по возможности быстрее переходить на таблетированные лекарственные средства, пусть в несколько большей дозе, чем до операции. Передозировка ГКС в послеоперационном периоде приводит к замедленному заживлению операционной раны и развитию в связи с этим осложнений. При родоразрешении — как при per vias naturalis, так и при оперативном — принята аналогичная тактика заместительной терапии.
Таким образом, при легких простудных и иных заболеваниях (без высокой лихорадки) дозу ГКС увеличивают в 2–3 раза. Например, если пациент получал 7,5 мг преднизолона (5 мг утром, 2,5 мг после обеда), доза увеличивается до 15 мг (10 мг утром, 5 мг после обеда).
При тяжелых заболеваниях, например при гриппе с лихорадкой, отменяют пероральные ГКС, назначают гидрокортизон (суспензия) в/м 75 мг утром, 50 мг в обед, 25 мг вечером, до нормализации состояния. При малых и кратковременных вмешательствах (экстракция зуба и т.д.) назначают гидрокортизон (суспензия) в/м 50 мг однократно за 15–30 мин до манипуляции.
При больших оперативных вмешательствах назначают гидрокортизон (суспензия) в/м 100 мг перед началом операции + гидрокортизон в/в капельно 200–300 мг во время операции (в зависимости от длительности вмешательства).
После стабилизации сопутствующего заболевания, гемодинамики и общего самочувствия пациента переходят на схему для тяжелых заболеваний.
Оценка эффективности лечения
Адекватность терапии оценивается отдельно по минералокортикоидному и глюкокортикоидному компонентам.
По минералокортикоидному компоненту:
— нормальные уровни калия и натрия плазмы;
— нормальный или умеренно повышенный уровень активности ренина плазмы;
— нормальное (комфортное) АД;
— отсутствие отечности, задержки жидкости (признаки передозировки лекарственных средств).
По глюкокортикоидному компоненту:
— клиническая картина; надежные объективные (лабораторные) критерии отсутствуют;
— минимально выраженные жалобы на слабость и низкую работоспособность;
— отсутствие выраженной гиперпигментации кожи и постепенный регресс пигментации;
— поддержание нормальной массы тела, отсутствие жалоб на постоянное чувство голода и признаков передозировки (ожирение, кушингоид, остеопения);
— отсутствие гипогликемических эпизодов, нормальное АД.
Осложнения и побочные эффекты лечения
Передозировка по глюкокортикоидному компоненту заместительной терапии может сопровождаться развитием синдрома Кушинга (ожирение, остеопороз, артериальная гипертензия, миокардиодистрофия, рабдомиолиз).
При передозировке минералокортикоидов может развиваться задержка жидкости, отеки, гипокалиемия, артериальная гипертензия.
Ошибки и необоснованные назначения
Типичной ошибкой является использование в лечении ПХНН только монотерапии ГКС. При ПХНН противопоказаны лекарственные средства, способствующие дегидратации (мочегонные), усугубляющие гипонатриемию и гиперкалиемию.
Прогноз
Прогноз больных с ПХНН во многом зависит от успеха профилактики и лечения острого гипокортицизма.
Острая надпочечниковая недостаточность
Этиология и патогенез. Аддисонический криз чаще развивается у лиц с первичной или вторичной надпочечниковой недостаточностью, когда они подвергаются воздействию стресса, инфекций, травм, хирургических вмешательств или дегидратации, связанной с потерей соли, рвотой, поносами.
Острая надпочечниковая недостаточность может возникать в результате тромбоза или эмболии первично поврежденных надпочечников (синдром Уотерхауса — Фридериксена). При этом геморрагический инфаркт надпочечных желез возникает на фоне менингококковой инфекции, пневмококковой или стрептококковой бактериемии, при полиомиелите или гриппе. Синдром Уотерхауса — Фридериксена наблюдается у пациентов разного возраста, в том числе у новорожденных после родовой травмы и инфекционно-токсического воздействия.
Особую группу лиц составляют больные неэндокринными заболеваниями, в течение длительного времени принимающие глюкокортикоиды (за счет угнетения активности гипоталамо-гипофизарно-надпочечниковой системы). Острое кровоизлияние в надпочечники может возникнуть при стрессе, травме, объемной операции, сепсисе, ожогах, лечении препаратами кортикотропина и антикоагулянтами, а также во время беременности.
Существует мнение, что острая надпочечниковая недостаточность является формой проявления нарушения общего адаптационного синдрома вследствие тяжелого сепсиса и перенапряжения гипоталамо-гипофизарно-надпочечниковой системы. Таким образом, адреналовый криз обусловлен быстрым (молниеносным) уменьшением или прекращением секреции гормонов коркового вещества надпочечников. Отсутствие секреции глюко- и минералокортикоидов приводит к потере ионов натрия, хлоридов, жидкости, уменьшается их всасывание в кишечнике. Возникающая гиперкалиемия приводит к нарушению сократительной способности миокарда. Превалируют эффекты инсулина, снижается уровень глюкозы крови. Гипогликемия не сопровождается усилением продукции глюкозы печенью, что иногда приводит к гипогликемической коме. Для острой надпочечниковой недостаточности характерно снижение функции почек, что сопровождается повышением уровня небелкового азота крови, снижением скорости клубочковой фильтрации, нарушением реабсорбции воды и электролитов.
Клиника. Острая надпочечниковая недостаточность чаще развивается на фоне болезни Аддисона, когда больной подвергается стрессу, инфекционным заболеваниям, травме, оперативному вмешательству или проводится неадекватная терапия хронической надпочечниковой недостаточности.
Продолжительность адреналового криза составляет от нескольких часов до двух суток в зависимости от степени надпочечниковой недостаточности.
Острый гипокортицизм проявляется сердечно-сосудистыми, желудочно-кишечными и нервно-психическими нарушениями. Для него характерны: гипотензия и шок, высокая температура, дегидратационный синдром, тошнота, рвота, анорексия, слабость, апатия, депрессивные состояния, гипогликемия.
Анорексия, тошнота и рвота возрастают и приводят к снижению объема циркулирующей жидкости, гиповолемическому шоку, который сопровождается снижением давления, цианозом, одышкой, нитевидным пульсом. Боль в животе может имитировать клинику «острого живота». Температурная реакция, встречающаяся часто, возникает в результате инфекции или гипокортицизма. Гиперпигментация может помочь в постановке диагноза, как и имеющиеся гипонатриемия, гиперкалиемия, лимфоцитоз, эозинофилия, гипогликемия.
Диагноз острой надпочечниковой недостаточности устанавливается на основании анамнеза (наличие туберкулеза, аутоиммунных процессов, заболевания и травмы центральной нервной системы, операции и лучевая терапия гипоталамо-гипофизарной области, глюкокортикоидная терапия), характерной клинической картины и дополняется лабораторными данными. Гипонатриемия и гиперкалиемия, типичные для надпочечниковой недостаточности, возникают не во всех случаях острого состояния, а гиперазотемия обнаруживается всегда, отмечается снижение уровня глюко- и минералокортикоидов. При проведении компьютерной томографии можно обнаружить двустороннее увеличение надпочечников.
Лечение. Показано немедленное введение глюкокортикоидов, минералокортикоидов и проведение противошоковой терапии. Гидрокортизона гемисукцинат вводят внутривенно струйно и капельно. Начиная лечение с внутривенного струйного введения 100–150 мг гидрокортизона сукцината, параллельно внутривенно капельно назначают по 500 мл 0,9% раствора натрия хлорида и 5% раствора глюкозы со 100–150 мг гидрокортизона сукцината.
Лечение острой надпочечниковой недостаточности
Глюкокортикоидная терапия
1. Назначение гидрокортизона гемисукцината или фосфата внутривенно каждые 6 часов 100–150 мг в первые сутки.
2. При стабилизации состояния пациента дозу уменьшают на 50 мг каждые 6 часов.
3. Доведение терапии глюкокортикоидами до поддерживающих доз к 4–5-му дню (15–20 мг утром и 10 мг в 16–17 часов, возможно per os) и добавление минералокортикоидов 0,05–0,1 мг/сут утром.
4. При нестабильном состоянии или при появлении осложнений дозу гидрокортизона увеличивают до 200–400 мг/сут.
Общие мероприятия
1. Коррекция электролитов, регидратация, ликвидация гипогликемии (внутривенное введение 0,9% раствора натрия хлорида, 5% раствора глюкозы).
2. Ликвидация причин, вызвавших острую надпочечниковую недостаточность.
Прогноз при возникновении острой надпочечниковой недостаточности при несвоевременных диагностике и лечении — летальный. Это во многом зависит от причин и степени обратимости поражения коры надпочечников.

1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Дифференциальная диагностика и лечение эндокринных заболеваний (руководство). — М.: Медицина, 2002. — 752 с.
2. Боднар П.Н. (ред.). Эндокринология. — Винница: Нова книга, 2007. — 344 с.
3. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. Учебник. — 2-е изд. — М.: Медиа, 2009. — 432 с.
4. Казаков А.В., Кравчун Н.А., Ильина И.М. и др. Словарь-справочник эндокринолога. — Харьков: «С.А.М.», 2009. — 682 с.
5. Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ / Под общ. ред. И.И. Дедова, Г.А. Мельниченко. — М.: Литтерра, 2006. — С. 406-428.
6. Швед М.І., Пасєчко Н.В., Мартинюк Л.П. та ін. Клінічна ендокринологія в схемах і таблицях. — Тернопіль: ТДМУ «Укрмедкнига», 2006. — 344 с.
7. Nussey S.S., Whitehead S.A. Endocrinology. An integrated approach. — BIOS Scientific Publishers Limited, 2001. — 358 p.