Международный эндокринологический журнал 2 (58) 2014
Вернуться к номеру
Антиэндотоксиновый иммунитет и уровень С-реактивного белка у больных диффузным токсическим зобом с патологией сердца
Авторы: Белоглазов В.А., Кулагина Ю.Ю. - ГУ «Крымский государственный медицинский университет имени С.И. Георгиевского», г. Симферополь
Рубрики: Кардиология, Эндокринология
Разделы: Клинические исследования
Версия для печати
Изменения со стороны сердечно-сосудистой системы занимают одно из ведущих мест в клинике диффузного токсичного зоба (ДТЗ) и могут определять прогноз болезни. Индуктором системного воспаления у больных ДТЗ, который делает его течение тяжелым, может быть эндотоксин (ЭТ). Исходя из этого, целью данной работы было исследование гуморального, клеточного антиэндотоксинового иммунитета и уровня С-реактивного белка (СРБ) у больных ДТЗ с патологией сердца. Содержание антиэндотоксиновых антител и СРБ определяли методом твердофазного иммуноферментного анализа. Как антиген использовали ЭТ грамотрицательной энтеробактерии Escheriсhia coli K30 (09:K30:P12), выделенный из бактерийной биомассы методом водно-фенольной экстракции и дополнительно очищенный от примесей РНК обработкой цетавлоном (Serva, Германия). Рецепторы к ЭТ определяли методом проточной лазерной цитометрии с помощью двухцветного иммунофлюоресцентного анализа с использованием моноклональных антител анти-CD14-PE IOTest® (CD14) и конъюгата липополисахарида Escherichia coli K235 с флюоресцеинизотиоцианатом (ЭТ-Р). Для исследования было выделено 3 группы больных. В первую группу вошли 11 больных ДТЗ, которые не имеют патологии сердца, вторую группу составили 47 больных ДТЗ с эндокринной кардиомиопатией, осложненной аритмией, и третья группа — это 13 больных ДТЗ с сопутствующей ишемической болезнью сердца (ИБС). Контрольную группу составили 33 практически здоровых лица. Установлено, что у всех больных ДТЗ с патологией сердца наблюдается возможное снижение по сравнению с группой контроля анти-ЭТ-sIgА, анти-ЭТ-IgМ и анти-ЭТ-IG. Это сопровождается увеличением уровня СРБ в этих группах, особенно у больных ДТЗ с ИБС, у которых его уровень достоверно выше, чем в группе больных ДТЗ без патологии сердца. Анализ данных литературы и полученных нами результатов подтверждает гипотезу, согласно которой проникновение избыточного количества ЭТ в кровоток истощает резервы синтеза специфических антител, оказывает содействие усилению системной воспалительной реакции и возникновению у исследуемых больных характерной сердечной патологии, которая делает течение основного заболевания тяжелым.
Зміни з боку серцево-судинної системи посідають одне з провідних місць у клініці дифузного токсичного зоба (ДТЗ) та можуть визначати прогноз хвороби. Індуктором системного запалення у хворих на ДТЗ, що робить його перебіг тяжким, може бути ендотоксин (ЕТ). Виходячи з цього, метою даної роботи було дослідження гуморального, клітинного антиендотоксинового імунітету та рівня С-реактивного білка (СРБ) у хворих на ДТЗ з патологією серця. Вміст антиендотоксинових антитіл та СРБ визначали методом твердофазного імуноферментного аналізу. Як антиген використовували ЕТ грамнегативної ентеробактерії Escheriсhia coli K30 (09:K30:P12), виділений з бактерійної біомаси методом водно-фенольної екстракції та додатково очищений від домішок РНК обробкою цетавлоном (Serva, Німеччина). Рецептори до ЕТ визначали методом проточної лазерної цитометрії за допомогою двохкольорового імунофлюоресцентного аналізу з використанням моноклональних антитіл анти-CD14-PE IOTest® (CD14) і кон’югату лiпополiсахариду Escherichia coli K235 з флюоресцеїнізотіоціанатом (ЕТ-Р). Для дослідження було виділено 3 групи хворих. До першої групи увійшло 11 хворих на ДТЗ, які не мають патології серця, другу групу становили 47 хворих на ДТЗ із ендокринною кардіоміопатією, ускладненою аритмією, та третя група — це 13 хворих на ДТЗ із супутньою ішемічною хворобою серця (ІХС). Контрольну групу становили 33 практично здорових особи. Установлено, що у всіх хворих на ДТЗ із патологією серця спостерігається вірогідне зниження порівняно з групою контролю анти-ЕТ-sIgА, анти-ЕТ-IgМ та анти-ЕТ-IgG. Це супроводжується збільшенням рівня СРБ у цих групах, особливо у хворих на ДТЗ із ІХС, у якій його рівень вірогідно вище, ніж у групі хворих на ДТЗ без патології серця. Аналіз даних літератури та отриманих нами результатів підтверджує гіпотезу, згідно з якою проникнення надлишкової кількості ЕТ у кровотік виснажує резерви синтезу специфічних антитіл, сприяє посиленню системної запальної реакції та виникненню в досліджуваних хворих характерної серцевої патології, що робить перебіг основного захворювання тяжчим.
The changes in cardiovascular system take one of the leading places in the clinic of diffuse toxic goiter (DTG) and can define prognosis for a disease. Endotoxin (ET) can be the inductor of a systemic inflammation in patients with DTG and aggravate its clinical course. From there, the purpose of this work was to study humoral and cellular antiendotoxin immunity and C-reactive protein (CRP) level in patients with heart pathology. The level of antiendotoxin antibodies and CRP were studied by enzyme-linked immunosorbent assay. As an antigen, we used ET of the Gram-negative Escheriсhia coli K30 (09:K30:P12), isolated from bacterial biomass by method of water phenol extraction and additionally purified from RNA admixtures using cetavlon processing (Serva, Германия). Receptors to ET were determined by flow lase cytometry using a two-color immunofluorescence analysis using a monoclonal anti-CD14-PE IOTest® (CD14) and conjugate of lipopolysaccharide Escherichia coli K235 with fluorescein isothiocyanate (ET-P). For the study we allocated 3 groups of patients. The first group included 11 patients with DTG who do not have heart disease, the second group consisted of 47 patients with DTG and endocrine cardiomyopathy complicated by arrhythmia, and the third group — 13 patients with DTG and concomitant ischemic heart disease (IHD). Control group consisted of 33 apparently healthy subjects. It is found that in all patients with DTG and heart pathology, a possible reduction of anti-ET-sIgA, anti-ET-IgM and anti-ET-IG is observed in comparison with the control group. This is accompanied by an increase in CRP levels in these groups, especially in patients with DTG and IHD, in whom its level was significantly higher than in patients with DTG and without heart disease. Analysis of literature data and our results confirm the hypothesis that extravasation of the excess amount of ET into the bloodstream depletes reserves of synthesis of specific antibodies, assists enhance of the systemic inflammatory response and the emergence of typical cardiac pathology in examined patients, which makes the course of the underlying disease difficult.
диффузный токсический зоб, сердечно-сосудистая система, эндотоксин, иммунитет.
дифузний токсичний зоб, серцево-судинна система, ендотоксин, імунітет.
diffuse toxic goiter, cardiovascular system, endotoxin, immunity.
Статья опубликована на с. 15-20
Изменения со стороны сердечно-сосудистой системы занимают одно из ведущих мест в клинике диффузного токсического зоба (ДТЗ) и могут определять прогноз болезни [15, 20]. Повреждение сердца при ДТЗ связывают с высокой плотностью рецепторов к гормонам щитовидной железы (ЩЖ) на кардиомиоцитах [17, 20]. На фоне болезни у больных ДТЗ развивается так называемое тиреотоксическое сердце — клинический синдром поражения миокарда вследствие прямого или опосредованного воздействия избыточного количества гормонов ЩЖ. Он проявляется в виде тахикардии, артериальной гипертензии, разнообразных нарушений ритма и проводимости — экстрасистолии, мерцательной аритмии (МА), эндокринной кардиомиопатии (ЭКМП), вследствие чего развивается хроническая сердечная недостаточность (ХСН). Так, МА на фоне ДТЗ без предшествующих изменений в сердечной мышце наблюдается у 9 % больных и у 60 % больных пожилого возраста на фоне атеросклероза, порока сердца, гипертонической болезни и других заболеваний. Частота ХСН у больных ДТЗ колеблется в пределах 12–68 % [15]. При этом клинические проявления сердечной недостаточности значительно ухудшают прогноз заболевания. Интересным является факт наличия у больных ДТЗ аутоантител к бета-1-адренергическому (AAb1AR) и M2-мускариновому рецепторам (AAM2R), способствующим возникновению у них МА [21]. То есть в возникновении МА у больных ДТЗ определенную роль играют и аутоиммунные процессы.
Известно, что при МА и ХСН отмечается активация системного воспаления. Например, ХСН сопровождается повышением, а ее лечение — снижением содержания в крови фактора некроза опухолей альфа (ФНО-α) — одного из ключевых участников системного воспаления [5]. Также доказана роль системного воспаления в патогенезе ишемической болезни сердца (ИБС) [2, 10, 11]. Одним из потенциальных мощных индукторов системного и аутоиммунного воспаления может быть эндотоксин (ЭТ), или липополисахарид (ЛПС), клеточной стенки грамотрицательных микроорганизмов [16].
У больных ДТЗ создается ряд условий, способствующих избыточному проникновению ЭТ в системный кровоток. Среди них наиболее значимыми являются дисбиотические процессы в полости рта и толстом кишечнике [6, 9]. Также у больных ДТЗ, особенно при тяжелом и длительном его течении, страдает функция печени как основного эндотоксин-нейтрализующего органа, наблюдается активация симпатической нервной системы, увеличивающей сброс крови по портокавальным анастомозам [18]. Интегральный эффект системного воздействия ЭТ на организм зависит от состояния эндотоксин-связывающих систем организма [1, 7, 16].
С учетом вышеизложенного целью данной работы было изучение взаимосвязи между состоянием антиэндотоксинового иммунитета и развитием ЭКМП и ИБС у больных ДТЗ.
Материалы и методы
Обследована группа из 87 больных ДТЗ в возрастном диапазоне от 22 до 59 лет, находящихся на стационарном лечении в эндокринологическом отделении КРУ «Клиническая больница им. Н.А. Семашко», г. Симферополь. Диагноз ДТЗ устанавливали на основании клинических данных, изучения тиреоидного статуса по уровню тиреотропного гормона (ТТГ) с определением свободных Т3 и Т4 в сыворотке крови, иммунологических параметров, отражающих состояние гуморального звена неспецифического иммунитета (антитела к тиреопероксидазе (ТПО), антитела к рецептору ТТГ (Ат-рТТГ)), УЗИ ЩЖ с определением ее объема и оценкой эхоструктуры ткани. Критерием включения в исследование был диагностированный ДТЗ (высокий уровень Т3, Т4, низкий уровень ТТГ, высокий титр Ат-рТТГ) при коморбидном течении с ЭКМП и ИБС. Критерии исключения — узловой токсический зоб и тиреотоксическая фаза аутоиммунного тиреоидита, а также другие состояния, ассоциирующиеся с тиреотоксикозом без гипертиреоидизма [14]. Из группы исследуемых больных ДТЗ были выделены 3 клинические группы. В первую группу вошли 11 больных ДТЗ без патологии сердца, во вторую группу — 47 больных ДТЗ с ЭКМП и аритмиями (синусовая аритмия — 4 %, синусовая тахикардия — 52 %, желудочковая экстрасистолия — 2 % и мерцательная аритмия — 42 %), в третью группу — 13 больных ДТЗ с ИБС (диффузный кардиосклероз — 92 %, стабильная стенокардия 2-го ФК — 8 %). Диагноз ИБС был верифицирован на основании клинико-анамнестических данных (данные амбулаторной карты, наличие у больных модифицированных и немодифицированных факторов риска ИБС, приступов стенокардии 2-го ФК, а также признаков атеросклеротического поражения по результатам УЗИ сердца и допплеро-графического исследования сосудов, наличие блокад по данным ЭКГ).
Для сравнительного анализа полученных результатов обследовано 33 здоровых донора (контрольная группа), достоверно не отличающихся от клинических групп с ДТЗ по половому и возрастному распределению.
Для достижения поставленной цели данной работы у всех больных ДТЗ определялись уровни антиэндотоксиновых антител классов А, М, G (соответственно анти-ЭТ-IgА, анти-ЭТ-IgМ и анти-ЭТ-IgG), секреторного антиэндотоксинового иммуноглобулина А (анти-ЭТ-sIgА) в ротовой жидкости, уровни экспрессии ЭТ связывающих рецепторов (CD14 и ЛПС-Fits) на моноцитах и гранулоцитах периферической крови, а также уровни С-реактивного белка (СРБ).
Содержание антиэндотоксиновых антител и СРБ определяли методом твердофазного иммуноферментного анализа. В качестве антигена использовали ЭТ грамотрицательной энтеробактерии Escherichia coli K30 (09:K30:P12), выделенный из бактериальной биомассы методом вводно-фенольной экстракции и дополнительно очищенный от примесей РНК обработкой цетавлоном (Serva, Германия) [3, 4].
Экспрессию рецепторов к ЭТ на мембранах поли- и мононуклеарных лейкоцитов изучали с помощью двухцветного иммунофлуоресцентного анализа методом проточной лазерной цитофлюорометрии, используя в качестве лиганда конъюгат ЛПС E.coli K235 c флюоресцеинизотиоцианатом по методике, разработанной в лаборатории клинической иммунологии Крымского государственного медицинского университета, и моноклональных антител к CD14-дифференцировочному антигену фирмы DakoCytomation, Denmark A/S. Использовали проточный цитофлюориметр PAS III и программное обеспечение PartecFloMax. Уровень экспрессии ЕТ-связывающих рецепторов на каждом типе клеток выражали в условных единицах флюоресценции, которые определяли на проточном цитометре с помощью функции Fit Gauss Peak, встроенной в программу Peak analysis при анализе не менее 10 тысяч клеток [12, 13].
Статистические расчеты производились с использованием программы MedStat (серийный № MS0011) ДНПП ТОВ «Альфа», г. Донецк.
Результаты и их обсуждение
Клинические и лабораторные данные обследуемых больных ДТЗ представлены в табл. 1.
Анализируя данные табл. 1, мы видим, что во всех группах больных ДТЗ с патологией сердца удельный вес лиц мужского пола достоверно выше, чем в первой группе больных. В третьей группе средний возраст больных достоверно выше по сравнению с первой и второй группами. Сравнивая уровень тиреоидных гормонов, мы видим, что во второй группе больных с ЭКМП и аритмиями уровень трийодтиронина (Т3) достоверно выше, чем в первой группе. Эти данные согласуются с данными, описываемыми в литературе, согласно которым у больных ДТЗ, осложненным МА, синдром тиреотоксикоза обусловлен повышением как Т3, так и Т4 [17, 19]. Также из табл. 1 видно, что уровень Ат-рТТГ во второй группе больных достоверно выше, чем в первой и третьей группах.
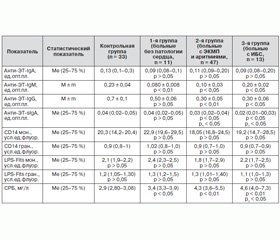
Данные изучения системного, мукозального, гуморального, клеточного антиэндотоксинового иммунитета и уровня системного воспаления у больных ДТЗ с патологией сердца представлены в табл. 2.
В условиях нормального функционирования иммунной системы IgM, являясь слабоспецифичным, может связывать сразу пять молекул антигена, что ведет к образованию крупных иммунных комплексов и способствует более быстрому выведению антигенов из циркуляции, а также предотвращает возможность их прикрепления к клеткам инициации патологического процесса. Из табл. 2 мы видим, что уровень анти-ЭТ-IgМ достоверно (p < 0,05) снижен во всех группах больных ДТЗ по сравнению с контрольной группой. IgG, обладая высокой специфичностью, активно участвует в иммунном ответе и одновременно регулирует его, влияя на активность других механизмов иммунного ответа — клеточных и гуморальных, определяя в конечном итоге полноценность иммунного ответа. Среди исследуемых нами больных уровень анти-ЭТ-IgG достоверно снижен по сравнению с контрольной группой только у больных ДТЗ с патологией сердца. Также из табл. 2 мы видим, что уровень анти-ЭТ-sIgA в группах больных ДТЗ с патологией сердца достоверно (р < 0,05) снижен как по сравнению с показателем нормы, так и по сравнению с группой больных без патологии сердца. Это может являться причиной повышенной транслокации бактериальных ЭТ в системный кровоток. Достоверных различий в уровне сывороточного анти-ЭТ-IgA в группах больных ДТЗ не наблюдается. Достоверных отличий в уровне экспрессии антиэндотоксиновых рецепторов у больных ДТЗ с патологией сердца также не наблюдается.
При этом мы видим, что снижение содержания анти-ЭТ-IgМ, анти-ЭТ-IgG и анти-ЭТ-sIgA у больных ДТЗ с патологией сердца сопровождается увеличением уровня СРБ в этих группах, особенно у больных ДТЗ с ИБС, у которых его уровень достоверно (р < 0,01) выше, чем в группе больных ДТЗ без патологии сердца.
Что касается темы нашего исследования, известно, что фактором, способствующим повышенной транслокации ЭТ из кишечника, являются гемодинамические расстройства, возникающие вследствие патологии сердца у больных ДТЗ. Так, исследователи Е.С. Мазур и Е.Н. Егорова доказали, что после восстановления синусового ритма у больных идиопатической фибрилляцией предсердий отмечается достаточно выраженное снижение уровня ЭТ в крови [8]. Таким образом, у больных с ЭКМП и аритмиями на фоне сниженного местного специфического иммунитета к ЭТ создаются дополнительные условия для избыточного проникновения его в системный кровоток. Анализируя уровень специфических аутоантител во второй группе больных, мы видим, что количество Ат-рТТГ превышает аналогичные показатели в первой и третьей группах. То есть у больных ДТЗ с ЭКМП имеет место повышение специфического аутоиммунного воспаления.
По полученным данным видно, что у больных ДТЗ с патологией сердца достоверно снижены по сравнению с контрольной группой уровни анти-ЭТ-IgМ и анти-ЭТ-IgG. Снижение этих антител у больных ДТЗ с патологией сердца может быть следствием истощения резервов их синтеза вследствие повышенного проникновения ЭТ в системный кровоток. Объяснить факт снижения специфических антител также можно тем, что при аутоиммунном воспалении у больных ДТЗ имеет место патологическое переключение антителогенеза на синтез аутоантител (Ат-рТТГ, Ат к ТПО, Ат к ТГ, у больных с МА — AAb1AR и AAM2R, у больных с офтальмопатией — Ат к мембранам глазодвигательных мышц и др.).
Нами обнаружен повышенный уровень СРБ у всех больных ДТЗ. При этом наибольшее повышение зарегистрировано у больных ДТЗ на фоне ИБС. В этой группе уровень СРБ достоверно превышает аналогичный показатель и в группе больных ДТЗ без патологии сердца. В настоящее время повышенный уровень системного воспаления рассматривают как относительный фактор риска острых коронарных событий [2, 10, 11]. Поэтому сочетанное течение ДТЗ с патологией сердца ассоциируется с более высоким уровнем системного воспаления, что может создавать условия для дестабилизации атеросклеротических образований. У больных ДТЗ с ЭКМП и аритмиями уровень СРБ достоверно повышен только по сравнению с группой контроля.
Полученные нами данные позволяют считать, что у больных ДТЗ с патологией сердца нарушение нейтрализации ЭТ на уровне слизистых (снижение анти-ЭТ-sIgA) и системного кровотока (снижение анти-ЭТ-IgG и анти-ЭТ-IgМ) приводит к повышенной стимуляции эндотоксин-связывающих рецепторов на моно– и полинуклеарных лейкоцитах, что в конечном итоге приводит к повышенной секреции ими провоспалительных цитокинов и возрастанию системного воспаления (высокий уровень СРБ). Эти процессы могут оказывать негативное воздействие на течение сопутствующей ИБС у больных ДТЗ. У больных с ЭКМП и аритмиями вследствие ДТЗ создаются дополнительные предпосылки для повышенной транслокации ЭТ из кишечника вследствие гемодинамических нарушений, что, возможно, является одной из причин усиления аутоиммунного воспаления у данной категории больных.
Выводы
1. В группах больных ДТЗ с патологией сердца удельный вес лиц мужского пола достоверно выше, чем в группе больных без патологии сердца. Средний возраст больных ДТЗ с ИБС достоверно выше по сравнению с больными первой и второй групп. Во второй группе больных ДТЗ уровень Т3 и Ат-рТТГ достоверно выше, чем в первой и третьей группах.
2. Уровень секреторного анти-ЭТ-sIgA в группе больных ДТЗ с патологией сердца достоверно ниже по сравнению как с контрольной группой, так и с группой больных без патологии сердца. Уровень анти-ЭТ-IgG достоверно снижен у больных ДТЗ с патологией сердца только по сравнению с контрольной группой. Уровень анти-ЭТ-IgМ достоверно снижен во всех группах больных ДТЗ по сравнению с группой контроля.
3. Снижение содержания анти-ЭТ-IgМ, анти-ЭТ-IgG и анти-ЭТ-sIgA у больных ДТЗ с патологией сердца сопровождается увеличением уровня СРБ в этих группах, особенно у больных ДТЗ с ИБС, у которых его уровень достоверно выше, чем в группе больных ДТЗ без патологии сердца.
1. Белоглазов В.А. Гуморальный эндотоксиновый иммунитет и С-реактивный белок у больных хроническими обструктивными заболеваниями легких / Белоглазов В.А., Али Мохамад Таха, Гордиенко А.И. // Імунологія та алергологія. — 2012.
2. Белокопытова И.С. Неспецифические маркеры воспалительного процесса у женщин со стенокардией напряжения и вазоспастической стенокардией / Белокопытова И.С., Палеев Ф.Н. // Кардиоваскулярная терапия и профилактика (приложение). — 2009. — № 8(6). — С. 37–38.
3. Гордиенко А.И. Использование твердофазного иммуноферментного анализа для определения общего и антиэндотоксинового секреторного IgA человека // Таврический медико-биологический вестник. — 2009. — С. 82–89.
4. Пат. 70193 А Україна, МКІ 7 А61К31/01. Спосіб визначення антитіл до діполісахаридів грамнегативних бактерій / А.И. Гордиенко, В.А. Белоглазов; КГМУ им. С.И. Георгиевского. — Заявл. 29.12.03; Опубл. 15.09.04, Бюл. № 9.
5. Егорова Е.Н. Роль эндотоксина и системного воспаления в патогенезе хронической сердечной недостаточности / Егорова Е.Н., Мазур В.В., Калинкин М.Н. // Российский кардиологический журнал. — 2012. — № 3.
6. Зангиева М.Э. Частота заболеваний пародонта и биохимические показатели смешанной слюны у больных диффузным токсическим зобом / V Международная студенческая электронная научная конференция «Студенческий научный форум», 15 февраля — 31 марта 2013 года // http://www.scienceforum.ru/2013/211/3216.
7. Кулагина Ю.Ю. Особенности гуморального антиэндотоксинового иммунитета у больных диффузным токсическим зобом в зависимости от длительности заболевания / Ю.Ю. Кулагина, В.А. Белоглазов, А.И. Гордиенко // Таврический медико-биологический вестник. — 2009. — Т. 12, № 3. — С. 53–55.
8. Мазур Е.С. Влияние восстановления синусового ритма на гемодинамику и системное воспаление у больных идиопатической фибрилляцией предсердий / Мазур Е.С., Егорова Е.Н., Кинах Т.А. // Вестник аритмологии. — 2012. — № 70. — С. 59–62.
9. Маковийчук А.А. Видовой состав и популяционный уровень микрофлоры полости толстой кишки у больных диффузным токсическим зобом // Буковинський медичний вісник. — 2002. — Т. 6, № 3. — С. 61–65.
10. Палеев Ф.Н. Неспецифические маркеры воспаления в прогнозировании течения ишемической болезни сердца / Палеев Ф.Н., Абудеева И.С., Москалец О.В. // Кардиология. — 2009. — Т. 49, № 9. — С. 59–65.
11. Палеев Ф.Н. Неспецифические маркеры воспалительного процесса у пациентов с ишемической болезнью сердца / Палеев Ф.Н., Москалец О.В., Яздовский В.В. // Бюл. НЦССХ им. А.Н. Бакулева РАМН (приложение). — 2010. — Т. 11, № 3. — С. 92–93.
12. Потапов А.Л. Состояние клеточных факторов антиэндотоксинового иммунитета после объемных хирургических вмешательств // Таврический медико-биологический вестник. — 2012. — Т. 15, № 1(57). — С. 188–190.
13. Сульская Ю.В. Экспрессия эндотоксинсвязывающих рецепторов различных типов на моноцитах и гранулоцитах периферической крови у больных сахарным диабетом 2-го типа / Сульская Ю.В., Белоглазов В.А., Гордиенко А.И., Бакова А.А. // Імунологія та алергологія: наука і практика. — 2010. — 1. — С. 78–81.
14. Черенько С.М. Современные подходы к диагностике и лечению различных форм тиреотоксикоза: обзор последних рекомендаций Американской тиреоидной ассоциации и Американской ассоциации клинических эндокринологов / Черенько С.М., Черенько М.С. // Здоров’я України. — 2012. — № 2. — Тематичний номер: тиреоїдологія. — С. 1–4.
15. Шульгина В.Ю. Факторы риска тиреотоксической кардиомиопатии / Шульгина В.Ю., Фадеев В.В., Мельниченко Г.А. // Проблемы эндокринологии. — 2007. — Т. 53, № 4. — С. 22–26.
16. Яковлев М.Ю. Кишечный эндотоксин и воспаление // Дерматовенерология: Национальное руководство. — 2011. — С. 99–110.
17. Ando T. Graves’ disease complicated by ventricular fibrillation in three men who were smokers / Henmi T., Haruta D. // Thyroid. — 2011. — Vol. 21(9). — P. 1021–1025.
18. Elias R.M. Hepatic dysfunction in hospitalized patients with acute thyrotoxicosis: a decade of experience / Elias R.M., Dean D.S., Barsness G.W. // Endocrinol. — 2012.
19. Kunii Y. Atrial fibrillation in Graves’ disease // Nihon Rinsho. — 2013. — Vol. 71(1). — P. 148–152.
20. Sibel Ertek. Hyperthyroidism and cardiovascular complications: a narrative review on the basis of pathophysiology / Sibel Ertek, Arrigo F. Cicero // Arch. Med. Sci. — 2013. — Vol. 31; 9(5). — P. 944–952.
21. Stavrakis S. Activating autoantibodies to the beta-1 adrenergic and М2 muscarinic receptors facilitate atrial fibrillation in patients with Graves’ hyperthyroidism / Stavrakis S., Yu X., Patterson E. // J. Am. Coll. Cardiol. — 2009. — Vol. 54(14). — P. 1309–1316.

/17/17.jpg)
/17/17_2.jpg)