Международный эндокринологический журнал 2 (58) 2014
Вернуться к номеру
Гиперкортицизм и ожирение
Авторы: Кравчун Н.А., Полозова Л.Г., - Государственное учреждение «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины», отделение фармакотерапии эндокринных заболеваний, г. Харьков; Попова С.С. - Харьковская медицинская академия последипломного образования, кафедра эндокринологии и детской эндокринологии; Дорош Е.Г. - Государственное учреждение «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины», отделение фармакотерапии эндокринных заболеваний, г. Харьков
Рубрики: Семейная медицина/Терапия, Эндокринология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 81-84
Среди множества эндокринопатий, сопровождающихся ожирением, одно из ведущих мест занимает гиперкортицизм — состояние, в основе которого лежит длительно сохраняющийся избыток глюкокортикостероидных гормонов (ГКС). Как известно, в норме ГКС играют в организме чрезвычайно важную роль в реакции организма на стресс, в регулировке энергетического обмена и модулировании воспалительных и иммунных реакций. Что же касается патологически повышенного уровня ГКС (как в результате поступления гормонов извне (экзогенный медикаментозный гиперкортицизм), так и вследствие органических нарушений в гипоталамо-гипофизарно-надпочечниковой оси (опухоли гипофиза или надпочечников или эктопическая продукция адренокортикотропного гормона (АКТГ) опухолями других локализаций), то такое состояние может приводить к выраженным и зачастую необратимым морфологическим и патофизиологическим изменениям.
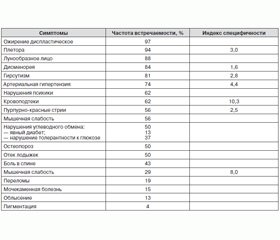
Увеличение массы тела и ожирение — наиболее типичные проявления гиперкортицизма, которые наблюдаются более чем у 95 % пациентов (табл. 1) [1, 2], являясь своеобразной визитной карточкой данной патологии и определяя диагностическую направленность врача. Как правило, при длительно сохраняющемся избытке ГКС жировая ткань распределяется диспластично.
При этом формируется так называемый кушингоидный тип ожирения, для которого характерно: относительное истончение дистальных отделов конечностей (что объясняется мышечной атрофией) и увеличение массы жировой ткани в области живота, груди, надключичных ямок (жировые подушки), на тыльной поверхности шеи («горб бизона»), а также в области щек и висков. Появляется так называемое лунообразное лицо. А при наличии плеторы имеет место картина матронизма. Кроме того, возможно усиленное отложение жировой ткани в эпидуральном пространстве, что в ряде случаев может сопровождаться неврологическими нарушениями [3]. В некоторых случаях описанная диспластика жировой ткани может иметь место даже при отсутствии истинной прибавки в весе.
Но в чем причина такой специфической связи между гиперкортицизмом и диспластическим ожирением?
Несмотря на то, что еще в 1924 году советским неврологом Николаем Михайловичем Иценко впервые были описаны 15 пациентов с характерной клиникой гиперкортицизма, до настоящего времени точные механизмы, лежащие в основе появления специфического диспластического кушингоидного ожирения, до конца не изучены.
Избирательность отложения жировой ткани при гиперкортицизме ранее объяснялась различной чувствительностью жировой ткани отдельных частей тела к глюкокортикоидам, что связывалось с особенностью распределения рецепторов к ГКС (различные уровни экспрессии глюкокортикоидных рецепторов на адипоцитах) [4, 5].
Однако сам факт того, что избыток ГКС приводит к увеличению массы жировой ткани в организме, парадоксален с учетом биологических эффектов ГКС (ведь активность последних имеет преимущественно катаболическую направленность (!)) [6]. Например, хорошо известно, что кортизол интенсифицирует глюконеогенез и ингибирует b-окисление жирных кислот в печени, усиливает распад белков и блокирует синтез аминокислот. Однако при этом также снижается чувствительность жировой ткани к инсулину. Это в конечном итоге способствует поддержанию необходимого уровня гликемии и обеспечению доставки энергетических субстратов прежде всего к центральной нервной системе (что особенно необходимо в условиях стресса (!)) [4, 7]. В то же время ГКС обладают «пермиссивным» эффектом в отношении липолитического действия других гормонов, в частности глюкагона и катехоламинов.
В настоящее время увеличение массы жировой ткани при гиперкортицизме связывают с влиянием сочетанного действия повышенных уровней ГКС и инсулина на фоне потребления избыточного количества калорий. Последнему способствует стимулирующий центр голода эффект ГКС [8]. В таких условиях образование эфиров жирных кислот преобладает над липолизом, что в сочетании со стимуляцией гиперпластических процессов в жировой ткани в конечном счете приводит к увеличению массы жировой ткани. Ведь известно, что ГКС стимулируют дифференцировку адипоцитов и способствуют образованию новых клеток жировой ткани посредством активации транскрипции ряда ключевых генов, в том числе гена липопротеинлипазы, глицерол-3-фосфатдегидрогеназы, а также лептина [9, 10].
Однако, несмотря на такую специфичность ожирения, в реальной клинической практике, как правило, подозрение о гиперкортицизме возникает при наличии у пациента нескольких типичных признаков, например диспластического ожирения, гиперемии и лунообразности лица, трофических изменений кожных покровов, артериальной гипертензии, вторичного гипогонадизма, нарушения углеводного обмена, появления сине-багровых полос растяжения на коже шириной более 1 см и т.д. (табл. 1) [1, 2]. Конечно, присутствие вышеперечисленных специфических клинических проявлений гиперкортицизма и особенно их сочетание являются важным подспорьем в диагностике.
Тем не менее данные последних лет свидетельствуют о большом количестве пациентов со слабо выраженными проявлениями эндогенного гиперкортицизма, когда нет классического сочетания признаков либо они вообще отсутствуют [11–13]. Таким образом, на сегодняшний день, как и целый ряд других заболеваний, эндогенный гиперкортицизм трансформируется из клинически явного заболевания в клинически скрытое, что обосновывает необходимость более тщательного изучения случаев со слабо выраженными клиническими проявлениями [14]. И особого внимания заслуживают пациенты с диспластическим ожирением, которое в ряде случаев может явиться главным, а то и единственным признаком манифестации эндогенного гиперкортицизма! Проиллюстрировать такую ситуацию поможет клиническое наблюдение пациентки с центральной формой гиперкортицизма — болезнью Иценко — Кушинга.
Пациентка Б., 30 лет, находилась в клинике ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины» с 04.11 по 17.11.2011 г. Поступила с жалобами на прибавку в весе на 30 кг за последние 10 лет (на фоне стабильного рациона питания), с преимущественным распределением подкожно-жировой клетчатки на животе, в области лица, а также на оволосение лица, верхних и нижних конечностей, повышение цифр артериального давления (АД) до 190 и 120 мм рт.ст., прогрессивное снижение остроты зрения ежегодно, одышку, спазмообразный кашель, периодическую сухость во рту, частую бессонницу, общую слабость, тошноту, боли в левом подреберье, обильное потоотделение, жар во всем теле, головные боли, головокружение, раздражительность, частые депрессивные состояния.
Анамнез заболевания. С 18 лет стала отмечать прибавку массы тела по верхнему типу, что связывала с двумя черепно-мозговыми травмами (2000, 2003 гг.) и сильным эмоциональным стрессом. Попытки самостоятельно снизить вес при помощи различных диет были неэффективными.
Кроме того, с указанного возраста беспокоили выраженные головные боли, по поводу чего в декабре 2009 г. по рекомендации невропатолога была проведена МРТ головного мозга. Данное исследование позволило выявить микроаденому гипофиза. Затем лишь в марте 2010 г. в условиях городского эндокринологического отделения по месту жительства был установлен диагноз: болезнь Иценко — Кушинга, по поводу чего была направлена в Киевский НИИ нейрохирургии, где 07.07.2010 г. выполнено эндокапсулярное удаление (аспирация) аденомы гипофиза трансфеноидальным путем.
В послеоперационном периоде больная отмечала некоторое улучшение состояния в виде незначительного уменьшения выраженности головной боли, некоторого уменьшения объема талии. Однако через год после нейрохирургической операции снова началось прогрессивное изменение внешности: прибавка массы тела, преимущественно за счет отложения жира в верхних отделах туловища, округлилось и покраснело лицо, уменьшился объем верхних и нижних конечностей; стало повышаться АД. И с подозрением на прогрессирование болезни Иценко — Кушинга в октябре 2011 г. больная была госпитализирована в городское эндокринологическое отделение по месту жительства, где был проведен ряд исследований:
— АКТГ — 53 пг/мл (норма 8,3–57,8 пг/мл);
— кортизол сыворотки крови — 700 нмоль/л (норма 138–403 нмоль/л);
— экскреция свободного кортизола — 102,9 мкг/в 24 ч (норма 28,5–213,7 мкг/в 24 ч);
— глюкозотолерантный тест — 6,5–5,2 ммоль/л;
— МРТ головного мозга: состояние после эндокапсулярного удаления аденомы гипофиза.
В связи с несоответствием клинических проявлений и лабораторных данных для уточнения диагноза пациентка была направлена в клинику ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины».
Анамнез жизни. Беременностей не было, mensis — регулярные, эндокринной патологии в семье нет, аллергический анамнез не отягощен.
Данные осмотра и физикального исследования с анализом выявленных изменений. При объективном осмотре подкожно-жировая клетчатка развита избыточно по верхнему типу. Антропометрические показатели на момент госпитализации составляли: рост — 177 см, вес — 101 кг, ИМТ — 31 кг/м2, ОТ/ОБ = 110 см/120 см = 0,92.
Кожа умеренно влажная, папулезные высыпания в подмышечных впадинах, мраморность кожи верхних и нижних конечностей.
АД — 160 и 100 мм рт.ст.
Данные лабораторного и инструментального исследования. Клинический анализ крови без особенностей, за исключением уровней гемоглобина — 160 г/л (норма 120–140 г/л) и эритроцитов — 5,0 . 1012 г/л (норма 3,9–4,7 . 1012 г/л).
Глюкоза крови в течение суток — 5,27–6,27–7,7–11,16 ммоль/л, при этом уровень гликированного гемоглобина составил 4,5 %.
Обращало на себя внимание повышение показателей трансаминаз сыворотки крови при нормальном уровне билирубина: билирубин общ. — 15,43 мкмоль/л (норма 8,55–20,5 мкмоль/л), АсАТ — 0,90 мкмоль/ч·мл (норма 0,1–0,45 мкмоль/ч·мл), АлАТ — 2,50 мкмоль/ч·мл.
С целью уточнения наличия гиперкортицизма пациентке была проведена малая дексаметазоновая проба: 17-ОКС (фон) — 20,5 мкмоль/сут (норма 3,61–20,38 мкмоль/сут) при суточном диурезе 1400 мл; 17-ОКС (после пробы) — 16,8 мкмоль/сут (норма 3,61–20,38 мкмоль/сут) при суточном диурезе 1500 мл; кортизол (фон) — 643,4 нмоль/л (норма 138–635 нмоль/л); кортизол (после пробы) — 667 нмоль/л (норма 138–635 нмоль/л). Проведение большой дексаметазоновой пробы, с нашей точки зрения, было нецелесообразно с учетом ранее установленного характера эндогенного гиперкортицизма, а именно его центральной формы — болезни Иценко — Кушинга.
Заключение КТ органов брюшной полости: данных по патологии органов брюшной полости, забрюшинного пространства, таза не выявлено.
Таким образом, выявленные изменения позволили утверждать отсутствие у пациентки ремиссии после эндокапсулярного удаления АКТГ-продуцирующей аденомы гипофиза.
С целью ингибирования стероидогенеза пациентке был рекомендован прием:
— кетоконазола по 200 мг 2 раза/сутки — длительно, под контролем уровня кортизола сыворотки крови 1 раз в 3 месяца;
— бромокриптина по 1 табл. 2 раза в день (с учетом центрального характера гиперкортицизма, несмотря на нормальные показатели уровня пролактина) — длительно под контролем уровня АКТГ сыворотки крови 1 раз в 3 месяца.
На фоне данной терапии уже через 2 месяца больная отметила улучшение состояния (масса тела снизилась на 10 кг, нормализовались АД и показатели гликемии). В дальнейшем было рекомендовано наблюдение в динамике: контрольный осмотр еще через 3 мес.
Выводы
Таким образом, данный клинический случай демонстрирует мягкое течение АКТГ-продуцирующей аденомы гипофиза, единственным клиническим проявлением которой длительное время было специфическое диспластическое ожирение, прогрессирующее в течение 10 лет. Причем только случайная находка аденомы гипофиза при МРТ головного мозга явилась причиной проведения дальнейших лабораторных тестов, позволивших в конечном итоге диагностировать болезнь Иценко — Кушинга.
В заключение нам хотелось бы еще раз подчеркнуть важность внесения гиперкортицизма в диагностический поиск при всех неясных случаях ожирения.
1. Заболевания коры надпочечников и эндокринная артериальная гипертензия [Tекст] / М.К. Генри, Ш. Мелмед, К.С. Полонски, П.Р. Ларсен: Пер. с англ. / Под ред. И.И. Дедова, Г.А. Мельниченко. — М.: РидЭлсивер, 2010. — 207 с.
2. The diagnosis of Cushing’s syndrome: an endocrine society clinical practice guideline [Text] / L.K. Nieman, B.M. Biller, J.W. Findling [et al.] // J. of Clin. Endocrinol. & Metabolism. — 2008. — Vol. 93(5). — Р. 1526–1540.
3. Bodelier A.G. Symptomatic epidural lipomatosis in ectopic Cushing’s syndrome [Text] / A.G. Bodelier, W. Groeneveld, A.N. van der Linden, H.R. Haak // Eur. J. Endocrinol. — 2004. — Vol. 151(6). — Р. 765–769.
4. Особенности жирового обмена при болезни Иценко — Кушинга [Tекст] / Л.К. Дзеранова, В.М. Парамонов, Л.Я. Рожинская [и др.] // Ожирение и метаболизм. — 2010. — № 1. — С. 58–62.
5. Glucocorticoid receptor messenger ribonucleic acid in different regions of human adipose tissue [Text] / M. Bronnegard, P. Arner, L. Hellstrom [et al.] // Endocrinology. — 1990. — Vol. 127. — Р. 1689–1696.
6. Гарднер Д. Базисная клиническая эндокринология. Книга 2 [Текст] / Д. Гарднер, Д. Шобек: Пер. с англ. — М.: Бионом, 2011. — С. 468.
7. Goodman H.M. Basic Medical Endocrinology. — 3ed [Text] / H.M. Goodman // Elsevier. — 2003. — Р. 135–136.
8. Castonguay T.W. Glucocorticoids as modulators in the control of feeding [Text] / T.W. Castonguay // Brain Research Bulletin. — 199. — Vol. 27. — Р. 423–428.
9. Promoting effects of glucocorticoids on the differentiation of human adipocyte precursor cells cultured in a chemically defined medium [Text] / H. Hauner, G. Entenmann, M. Wabitisch [et al.] // J. Clin. Invest. — 1989. — Vol. 84. — Р. 1663–1670.
10. Differentiation of adipocyte precursors in a serum-free medium is influenced by glucocorticoids and endogenously produced insulin-like growth factor-I [Text] / J. Nougues, Y. Reyne, B. Barenton [et al.] // J. Int. J. Obes. Relat. Metab. Disord. — 1993. — Vol. 17(3). — Р. 159–167.
11. Occult Cushing’s syndrome in type-2 diabete [Text] / B. Catargi, V. Rigalleau, A. Poussin [et al.] // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — P. 5808–5813.
12. Subclinical hypercortisolism among outpatientsreferred for osteoporosis [Text] / I. Chiodini, M.L. Mascia, S. Muscarella [et al.] // Ann. Intern. Med. — 2007. — Vol. 147. — P. 541–548.
13. Association of subclinical hypercortisolism with type 2 diabetes mellitus: a case-control study in hospitalized patients [Text] / I. Chiodini, M. Torlontano, A. Scillitani [et al.] // Eur. J. Endocrinol. — 2005. — Vol. 153. — P. 837–844.
14. Черенько С.М. Скрытый и субклинический варианты синдрома Кушинга: распространенность, диагностика, лечебная тактика [Tекст] / С.М. Черенько // Здоров’я України. — 2013. — № 1. — С. 54–56.

/82/82.jpg)