Журнал «Здоровье ребенка» 3 (54) 2014
Вернуться к номеру
Функціональний стан та метаболічні порушення печінки в дітей із неалкогольною жировою хворобою печінки та ожирінням
Авторы: Крючко Т.О., Пилипенко О.А., Несіна І.М. - Вищий державний навчальний заклад України «Українська медична стоматологічна академія», м. Полтава
Рубрики: Семейная медицина/Терапия, Гастроэнтерология, Педиатрия/Неонатология, Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета дослідження: вивчення функціонального стану печінки, порушень вуглеводного та ліпідного обмінів у дітей із діагностованою неалкогольною жировою хворобою печінки (НАЖХП) та екзогенно-конституціональним ожирінням.
Матеріали та методи: обстежені 67 дітей віком від 7 до 17 років. Основну групу (n = 34) становили діти, у яких було діагностовано НАЖХП, до групи порівняння (n = 33) ввійшли пацієнти з діагностованим ожирінням без порушень функцій печінки, контрольну групу становили здорові діти (n = 10).
Результати: перебіг НАЖХП у дітей у більшості випадків є безсимптомним. Жирова дегенерація печінки в дітей не завжди характеризується вираженим синдромом цитолізу. Структурно-функціональні зміни в печінці при НАЖХП можуть спричиняти виражені метаболічні наслідки у вигляді гіперглікемії, гіперінсулінізму, інсулінорезистентності з формуванням атерогенної дисліпідемії, що проявляється в основному підвищенням концентрації тригліцеридів та зниженням фракції загального холестерину ліпопротеїдів високої щільності вже в дитячому віці.
Цель исследования: изучение функционального состояния печени, нарушений углеводного и липидного обменов у детей с диагностированной неалкогольной жировой болезнью печени (НАЖБП) и экзогенно-конституциональным ожирением.
Материалы и методы: обследованы 67 детей в возрасте от 7 до 17 лет. Основную группу (n = 34) составили дети, у которых была диагностирована НАЖБП, в группу сравнения (n = 33) вошли пациенты с диагностированным ожирением без нарушений функций печени, контрольную группу составили здоровые дети (n = 10).
Результаты: течение НАЖБП у детей в большинстве случаев бессимптомное. Жировая дегенерация печени у детей не всегда характеризуется выраженным синдромом цитолиза. Структурно-функциональные изменения в печени при НАЖБП могут вызывать выраженные метаболические последствия в виде гипергликемии, гиперинсулинизма, инсулинорезистентности с формированием атерогенной дислипидемии, что проявляется в основном повышением концентрации триглицеридов и снижением фракции холестерина высокой плотности уже в детском возрасте.
The aim of the research: the study of functional status of liver, disorders of carbohydrate and lipid metabolisms in children diagnosed with nonalcoholic fatty liver disease (NAFLD) and exogenous constitutive obesity.
Materials and Methods. 67 children aged from 7 to 17 years have been examined. The main group (n = 34) contained children who were diagnosed with NAFLD; the comparison group (n = 33) consisted of patients with diagnosed obesity without functional disorders of liver, the control group included healthy children (n = 10).
Results. The course of NAFLD in children in most cases is asymptomatic. Fatty degeneration of liver in children is not always characterized by a marked cytolysis syndrome. Structural and functional changes in liver at NAFLD can cause pronounced metabolic effects in the form of hyperglycemia, hyperinsulinism, insulin resistance with the formation of atherogenic dyslipidemia which is manifested mainly as the increase in the concentration of triglycerides and decrease in high-density lipoprotein cholesterol fraction already in childhood.
метаболічний синдром, неалкогольна жирова хвороба печінки, діти.
метаболический синдром, неалкогольная жировая болезнь печени, дети.
metabolic syndrome, nonalcoholic fatty liver disease, children.
Статья опубликована на с. 34-38
З моменту першого описання взаємозв’язку між ожирінням, артеріальною гіпертензією, порушеннями вуглеводного обміну, дисліпідемією і пов’язаних із ними метаболічних змін та введенням у наукову літературу терміну «метаболічний синдром» (МС) інтерес спеціалістів різних галузей до даного симптомокомплексу залишається підвищеним. На сьогодні фактори ризику, об’єднані в МС, значно поширені, поширеність стрімко зростає внаслідок збільшення чисельності людей з ожирінням та неправильним способом життя [1–3]. Так, частота розвитку МС у підлітків та осіб молодого віку підвищилася за останні 60 років у 1,5 раза, а наявність надмірної маси тіла в дітей в економічно розвинених країнах досягає 14 % [4–7]. Подібна негативна динаміка спостерігається і в Україні, де за останні 10 років практично вдвічі збільшилася кількість дітей та підлітків із надмірною масою тіла та ожирінням [8].
Стан органів травної системи та їх роль у розвитку метаболічного синдрому на даний час є недостатньо вивченим аспектом медицини, у той час як самі органи системи травлення мають пряме відношення до розвитку МС та нерідко самі стають органами–мішенями [9–11]. На сьогодні все більше дослідників звертають увагу на тісний взаємозв’язок між ожирінням, асоційованими з ним інсулінорезистентністю, артеріальною гіпертензією, дисліпідемією та розвитком неалкогольної жирової хвороби печінки (НАЖХП) не лише серед дорослих, але і в дитячій популяції. Так, у країнах Євросоюзу НАЖХП виявляється у 2,6 % дітей, у той час як у дітей із підвищеною масою тіла — у 10–20 разів частіше [12, 13]. Важливою патогенетичною ланкою розвитку МС є порушення метаболізму глюкози та ліпідів у жировій тканині, що призводить до посилення ліполізу та надмірного вивільнення вільних жирних кислот (ВЖК), які через портальну циркуляцію потрапляють до печінки. Отже, центральною ланкою інсулінорезистентності стає печінка, де підвищена утилізація ВЖК, з одного боку, призводить до розвитку компенсаторної гіперінсулінемії, з іншого — до каскаду реакцій з інтенсифікації синтезу атерогенних фракцій ліпопротеїдів [14, 15]. У свою чергу, гіперінсулінемія через порушення авторегуляції інсулінових рецепторів підвищує периферичну інсулінорезистентність. Таким чином, виникає замкнене коло, у якому печінка внаслідок різноманітності виконуваних нею функцій визначає тяжкість патологічного процесу та сама виступає в ролі органа–мішені [16].
Отже, актуальною на сьогодні залишається проблема своєчасної діагностики та прогнозування розвитку неалкогольної жирової хвороби печінки в дітей із надмірною масою тіла та ожирінням.
Метою нашого дослідження стало вивчення функціонального стану печінки, порушень вуглеводного та ліпідного обмінів у дітей з діагностованою неалкогольною жировою хворобою печінки та екзогенно–конституціональним ожирінням (ЕКО).
Матеріали та методи
Дослідження проводили на базі гастроентерологічного відділення ПОДКЛ та ендокринологічного відділення ДМКЛ м. Полтави. Усього під спостереженням знаходилися 67 дітей віком від 7 до 17 років, у яких діагностовано ожиріння згідно з міжнародними рекомендаціями та чинним протоколом діагностики та лікування ендокринних захворювань у дітей. Діагноз НАЖХП формулювали згідно з класифікацією МКХ–10 (К.76.0 — жирова дегенерація печінки). Усі пацієнти були розподілені на три групи. Основну групу (n = 34) становили діти, у яких на фоні вираженого ожиріння було діагностовано неалкогольну жирову хворобу печінки, до групи порівняння (n = 33) ввійшли пацієнти з діагностованим ожирінням без порушень функцій печінки, конт–рольну групу становили здорові діти (n = 10), аналогічні за статтю та віком. Діагноз НАЖХП верифікували за допомогою даних УЗ–обстеження печінки (підвищення ехогенності та дифузна неоднорідність паренхіми печінки, поглинання УЗ–променя та ознаки помірної гепатомегалії) та змін у біохімічному аналізі крові (підвищення сироваткових транс–аміназ). Із метою скринінгу для виключення уражень вірусної та автоімунної етіології всі пацієнти були обстежені на HBs–Ag та анти–HCV, визначали антинуклеарні (ANA) та антимітохондріальні антитіла, а також рівень а–трипсину та церулоплазміну як маркерів обмінних порушень печінки. Усім дітям було проведено комплексне обстеження, що включало в себе збір анамнестичних даних, антропометрію та загальноклінічні аналізи. Надлишкова маса тіла/ожиріння розраховувалася за відсотком надлишкової маси від потрібної з використанням перцентильних таблиць згідно з віком і статтю. Абдомінально–вісцеральний тип ожиріння визначали за допомогою співвідношення окружності талії та стегон. Для виявлення порушень вуглеводного обміну всім пацієнтам визначали концентрацію глюкози крові натщесерце, проводили пероральний глюкозотолерантний тест, концентрацію імунореактивного інсуліну (ІРІ) визначали імунохімічним методом із використанням тест–системи Roche Diagnostics (Швейцарія). Розраховували індекси НОМА та Caro, які є показниками інсулінорезистентності, за формулами: НОМАIR = (ІРІ0• Гл0)/22,5; Caro = = Гл0/ІРІ0; де ІРІ0 — концентрація інсуліну в сироватці крові натщесерце, мкОд/мл, Гл0 — глюкоза плазми натщесерце, ммоль/л. За нормативні значення приймали: для индексу НОМАIR — > 3,2, для индексу Caro — < 0,3 [17]. Показники ліпідного спектра крові — загальний холестерин (ЗХ), тригліцериди (ТГ), холестерин ліпопротеїдів високої щільності (ХС ЛПВЩ), холестерин ліпопротеїдів низької щільності (ХС ЛПНЩ) та холестерин ліпопротеїдів дуже низької щільності (ХС ЛПДНЩ) визначали ферментативно–колометричним методом за допомогою тест–систем Roche Diagnostics (Швейцарія). Інтегральний показник — коефіцієнт атерогенності (КА) розраховували за формулою: КА = (ЗХС – ХС ЛПВЩ)/ХС ЛПВЩ. Обробка числових даних здійснювалася загальноприйнятими в медичній статистиці математичними методами за допомогою прикладної програми ХL Statistics. Вираховували показники середніх величин (М), помилок середніх величин (m) досліджуваних показників. Статистичну вірогідність обчислювали, використовуючи t–критерій Стьюдента. Аналіз відмінності частотних характеристик якісних ознак у незалежних групах проводили за допомогою точного критерію Фішера. Для усіх видів аналізу статистично значущими вважали відмінності при р < 0,05.
Результати та обговорення
Аналіз статевого складу обстежуваних дітей показав, що переважну більшість пацієнтів із діагностованою неалкогольною жировою хворобою печінки становили дівчатка (65 %), у той час як статевий склад групи дітей з екзогенно–конституціональним ожирінням мав практично рівномірний розподіл. Середній вік всіх пацієнтів вірогідно не відрізнявся і становив у середньому 12 років (у діапазоні 7–17 років). Слід зауважити, що серед хворих обох груп питома вага дітей віком 11–15 років виявилася найбільшою —62 % серед пацієнтів із НАЖХП та 60,6 % серед дітей з ЕКО відповідно. Скарги обстежуваних дітей відзначалися поліморфністю і в більшості випадків були пов’язані з супутньою патологією шлунково–кишкового тракту. Так, практично 53 % пацієнтів обох груп скаржилися на періодичні болі в епігастрії, болі в гастродуоденальній ділянці відмічали 15 % хворих, на нудоту скаржилися 42 % дітей, періодична печія турбувала 31 % обстежених. Вірогідні відмінності були виявлені лише щодо скарг на болі в правому підребер’ї (р = 0,00), метеоризм (р = 0,007), схильність до запорів та розрідження випорожнень (р = 0,009), головні болі та підвищену втомлюваність (р = 0,036), що частіше турбували дітей із діагностованою НАЖХП. А скарги на болі в серці, запаморочення та підвищену пітливість, які відмічалися практично у чверті хворих, свідчили про прояви вегетосудинної дисфункції як компонента кардіоваскулярного синдрому, характерного для дітей із МС.
При вивченні показників білковосинтетичної функції печінки в обстежених дітей встановлено, що рівень загального білка знаходився у межах норми практично у всіх пацієнтів обох груп та не мав статистичної відмінності (р > 0,05). Середні показники фібриногену знаходилися в межах вікової норми в усіх обстежених дітей, але рівень був вірогідно вищим у групі дітей із НАЖХП порівняно з показниками дітей з ЕКО (3,27 ± 0,15 та 2,88 ± 0,06 відповідно, р < 0,05). Проте слід відмітити, що практично третина дітей основної групи (35 %) мала рівень фібриногену більше ніж 4 г/л, що збігається з даними інших дослідників, які відмічають підвищення концентрації фібриногену та зниження показників фібринолізу в дітей із МС [18]. Показники протромбінового індексу мали тенденцію до зниження в дітей із НАЖХП, але в більшості випадків відповідали віковим нормам, без статистично значущої різниці по групах та за віком (р > 0,05). При дослідженні рівня ферментемії в обстежених дітей виявлено статистично вірогідну різницю рівнів ферментів цитолізу — аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), гаммаглутамінтранспептидази (ГГТП) у дітей із діагностованою НАЖХП порівняно з пацієнтами інших груп (р < 0,01) (табл. 1).
Проте слід зазначити, що підвищення ферментемії спостерігалося не в усіх дітей із жировим гепатозом, збільшення рівня АЛТ вище від фізіологічної норми відмічалося в 38 % дітей, АСТ — у 18 %, а рівень ГГТП, вищий від допустимих значень, спостерігався лише у 2 пацієнтів (6 %). Отримані дані свідчать про те, що неалкогольна жирова хвороба печінки в дітей не завжди перебігає з вираженим синдромом цитолізу. Рівень загального білірубіну практично в усіх обстежених дітей знаходився у межах вікової норми та не мав статистично значущих відмінностей (р > 0,05). Показники тимолової проби були вірогідно вищими в дітей із НАЖХП (р < 0,01) порівняно з пацієнтами інших груп. Рівень лужної фосфатази (ЛФ) знаходився у межах вікової норми практично в усіх обстежених дітей, проте середні показники були вірогідно вищими в пацієнтів із НАЖХП порівняно з дітьми з ЕКО (р < 0,05) (табл.1). Рівень амілази крові знаходився на нижній межі норми в більшості пацієнтів із діагностованою НАЖХП та ЕКО порівняно з показниками здорових дітей, проте статистично значущих відмінностей не було виявлено (р > 0,05). Слід зазначити, що схильність до гіпоамілаземії в поєднанні зі змінами в копрограмі та порушенням ехоструктури підшлункової залози спостерігалася майже в 70 % хворих, що свідчить про порушення зовнішньосекреторної функції підшлункової залози в дітей з ожирінням. Рівень сечової кислоти був вірогідно вищим у групі дітей із НАЖХП порівняно з пацієнтами з ЕКО (324,4 ± 11,7 та 211,09 ± 11,60 відповідно, р < 0,01), що підтверджує схильність до гіперурикемії як одного з додаткових компонентів МС у дітей із жировою дегенерацією печінки.
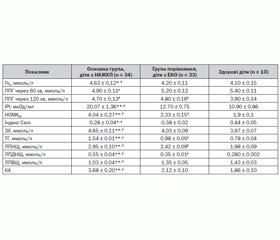
Моніторинг стану вуглеводного обміну показав, що вміст глюкози натщесерце був у ме–жах норми практично в усіх хворих (92 %), лише 5 пацієнтів мали збільшення глікемії натщесерце вище від 5,6 ммоль/л, а в однієї дитини був діагностований цукровий діабет 2–го типу. Проте, незважаючи на те, що базальний рівень глюкози знаходився в –межах норми в більшості хворих обох груп, середні показники були вірогідно вищими в дітей із діагностовано жировою хворобою печінки (4,63 ± 0,12 та 4,2 ± 0,11 відповідно, р < 0,05) (табл. 2).
Досліджуючи глікемічний профіль, ми виявили, що лише в 10 (29,4 %) пацієнтів із НАЖХП та в 14 (42,4 %) дітей групи порівняння тест виявлення толерантності до глюкози був нормальним, решта дітей обох груп мали тенденцію до гіперінсулінемічного типу глікемічної кривої (так звана плоска крива), що характеризується відсутністю вираженого підвищення рівня глюкози в крові через 60 хв після вуглеводного навантаження. Постпрандіальна глюкоза (ППГ) через 120 хв після навантаження залишалася на тому ж рівні та навіть мала тенденцію до підвищення практично в 78 % дітей обох груп. Отримані дані можуть свідчити про те, що у відповідь на глюкозне навантаження рівень інсуліну в крові спочатку істотно підвищується, а потім тривале перенапруження інсулярного апарату може призводити до його виснаження та інсулінової недостатності [19, 20].
Показники імунореактивного інсуліну крові натщесерце були вірогідно вищими в групі пацієнтів із неалкогольною жировою хворобою печінки, ніж у дітей із діагностованим ожирінням (20,07 ± 1,36 та 12,70 ± 0,75 відповідно, р ≤ 0,01). Причому базальна гіперінсулінемія (рівень вище від 20 мкОд/мл) спостерігалася у 16 (47 %) дітей основної групи, в основному в дівчаток. Розраховуючи індекс інсулінорезистентності НОМА, ми виявили його вірогідне підвищення майже вдвічі в дітей із НАЖХП порівняно з пацієнтами з ЕКО (4,04 ± 0,27 та 2,33 ± 0,15 відповідно, р < 0,01). Показник індексу Caro < 0,3 відмічався практично в 59 % пацієнтів із жировою дегенерацією печінки. Виявлені зміни засвідчують високу поширеність інсулінорезистентності в дитячій популяції й підтверджують необхідність своєчасного виявлення порушень вуглеводного обміну, особливо в групі ризику, до якої відносяться діти з надмірною масою тіла та ожирінням.
Аналіз ліпідного спектра крові виявив, що практично 90 % усіх обстежених дітей з ожирінням мали виражені зміни в ліпідограмі, які проявлялися тенденцією до підвищення загального холестерину плазми, тригліцеридів, ліпопротеїдів низької щільності з підвищенням коефіцієнту атерогенності. У групі дітей з НАЖХП на відміну від пацієнтів з ЕКО відмічалася найвища концентрація рівня ТГ сироватки крові (1,54 ± 0,01 ммоль/л проти 0,98 ± 0,05 ммоль/л відповідно, р < 0,01) та найменший рівень ЛПВЩ (середнє значення 1,03 ± 0,04 ммоль/л).
Виявлена тенденція до відносного зниження антиатерогенного класу ліпопротеїдів та підвищення індексу атерогенності в пацієнтів із зайвою вагою відображає процес формування атерогенної дисліпідемії вже в дитячому віці і може бути пояснена впливом гіперінсулінемії та інсулінорезистентності при ожирінні.
Висновки
Перебіг неалкогольної жирової хвороби печінки в дітей у більшості випадків є безсимптомним, із відсутністю скарг, характерних саме для даної нозології. Формування жирової дегенерації печінки відбувається на фоні виражених порушень вуглеводного та ліпідного обмінів як основних компонентів метаболічного синдрому. Крім того, самі структурно–функціональні зміни в печінці при НАЖХП можуть спричиняти виражені метаболічні наслідки у вигляді гіперглікемії, гіперінсулінізму, інсулінорезистентності з формуванням атерогенної дисліпідемії вже в дитячому віці. Дані обмінні порушення в подальшому є загрозою розвитку серцево–судинних захворювань, цукрового діабету 2–го типу, атеросклерозу та інших станів, асоційованих із МС.
З метою запобігання розвитку НАЖХП усім дітям із надмірною масою тіла та ожирінням із метою скринінгу рекомендується обов’язково перевіряти структурно–функціональний стан печінки за допомогою біохімічного аналізу крові та ультрасонографічного обстеження, проводити контроль рівня глікемії з розрахунками індексів інсулінорезистентності та дослідження ліпідного спектра крові.
1. Синицин П.А. Метаболічний синдром в дітей та підлітків. Клініко–генетичні паралелі: Автореф. дис… канд. мед. наук: спец. 14.01.10 «Педіатрія» / П.А. Синицин. — М., 2009. — 27 с.
2. Сергеев В.П. Метаболический синдром: причины, лечение и профилактика / Сергеев В.П. // Врач. — 2009. — № 2. — С. 36–41.
3. Кайдашев И.П. Эволюция понятия «метаболический синдром» и его современное значение / И.П. Кайдашев // Український медичний часопис. Актуальні питання клінічної практики. — 2012. — № 2 (88) III–IV.
4. Vos M.B., Welsh J. Childhood obesity: update on predisposing factors and prevention strategies / Vos M.B., Welsh J. // Curr. Gastroenterol. Rep. — 2010. — № 12(4). — P. 280–287.
5. Аверьянов А.П. Ожирение у детей и подростков: клинико–метаболические особенности, лечение, прогноз и профилактика осложнений / Аверьянов А.П. // Междунар. эндокрин. журнал. — 2009. — № 4(22). — С. 85–91.
6. Zimmet P., Alberti G. The metabolic syndrome in children and adolescents / Zimmet P., Alberti G. // Lancet. — 2007. — 369. — 2059–2961.
7. Балыкова Л.А. Солдатов О.М. Метаболический синдром у детей и подростков / Балыкова Л. А. Солдатов О.М. // Педиатрия. — 2010. — Т. 89, № 3. — С. 127–134.
8. Зелінська Н.Б. Метаболічний синдром у дітей / Н.Б. Зелінська // Здоров’я України. — 2013. — № 3. — С. 48–51.
9. Лазебник Л.Б., Звенигородская Л.А. Метаболический синдром и органы пищеварения / Лазебник Л.Б., Звенигородская Л.А. — М., 2009. — 177 с.
10. Бокова Т.А., Урсова Н.И. Патология гепатобилиарной системы у детей и подростков с ожирением и метаболическим синдромом / Бокова Т.А., Урсова Н.И. // Врач. — 2011. — № 1. — С. 56–58.
11. Скрипник И.Н. Избыточный вес как основа НАСГ и актуальная медико–социальная проблема / И.Н. Скрыпник // Здоров’я України. — 2009. — № 20 (225). — С. 6–10.
12. Бабак О.Я. Причини та метаболічні наслідки жирової хвороби печінки / О.Я. Бабак // Сучасна гастроентерологія. — 2010. — № 4 (54). — С. 8–16.
13. Чернявський В.В. Жирова хвороба печінки як інтегральна проблема внутрішньої медицини / В.В. Чернявський // Новини медицини та фармації. — 2011. — № 4 (354). — С. 64–67.
14. Stefan N., Kantartzis K., Hаring H. Causes and Metabolic Consequences of Fatty Liver / Stefan N., Kantartzis K., Hаring H. // Endocrine Reviews. — 2008. — № 29. — Р. 939–960.
15. Bagry H.S. Metabolic syndrome and insulin resistance / H.S. Bagry, S. Raghavendram, F. Carli // An esthesiology. — 2008. — Vol. 108 (3). — P. 506–523.
16. Lamt K.T. Mechanisms of the free fatty acid–induced increase in hepatic glucose production / K.T. Lamt // Am. J. Physiol. Endocrinol. Metab. — 2003. — Vol. 284. — P. 863–873.
17. Васюкова О.В. Инсулинорезистентность при ожирении у детей: спорность оценки / О.В. Васюкова, А.В. Витебская // Проблемы эндокринологии. — М., 2009. — Т. 55, № 3. — С. 8–13.
18. Абатуров А.Е. Особенности метаболического синдрома у детей / А.Е. Абатуров // Дитячий лікар. — 2011. — № 4. — С. 54–61.
19. Бєлоусов Ю.В. Жировий гепатоз у дітей: дефініція та діагноз / Ю.В. Бєлоусов, Е.Н. Бабаджанян // Сучасна педіатрія. — 2010. — № 5 (33). —С. 107–109.
20. Пилипенко О.А. Характеристика порушень вуглеводного обміну в дітей з неалкогольною жировою хворобою печінки / Пилипенко О.А. // Актуальні проблеми сучасної медицини. Вісник Української медичної стоматологічної академії. — 2013. — Т. 13, № 2 (42). — С. 141–145.

/36/36.jpg)
/37/37.jpg)