Международный эндокринологический журнал 4 (60) 2014
Вернуться к номеру
Вплив пробіотикотерапії на клініко-біохімічні та інструментальні показники неалкогольної жирової хвороби печінки у хворих на цукровий діабет типу 2
Авторы: Михальчишин Г.П., Боднар П.М., Кобиляк Н.М. - Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Обстежені 72 пацієнти з цукровим діабетом (ЦД) 2-го типу та неалкогольною жировою хворобою печінки (НАЖХП). Відповідно до проведеного курсу терапії всі пацієнти розділені нами на дві групи. Хворі основної групи (n = 45) отримували пероральні цукрознижувальні засоби та мультипробіотик симбітер протягом 30 днів. Для оцінки функціонального стану печінки досліджували білковий, пігментний, ферментативний та ліпідний обмін. Усім хворим проводили ультразвукове дослідження, у тому числі еластографію хвилі зсуву. Доведена ефективність застосування мультипробіотика симбітер ацидофільний концентрований у хворих на ЦД 2-го типу із НАЖХП. За наявності підвищення трансаміназ гепатопротекторний ефект проявляється зниженням рівня їх у крові, запально-некротичних змін у паренхімі печінки. У хворих із нормальними показниками трансаміназ проявляються гіполіпідемічний та антистеатогенний ефекти мультипробіотика.
Обследованы 72 пациента с сахарным диабетом (СД) 2-го типа и неалкогольной жировой болезнью печени (НАЖБП). В соответствии с проведенным курсом терапии все пациенты разделены на две группы. Больные основной группы (n = 45) получали пероральные сахароснижающие средства и мультипробиотик симбитер в течение 30 дней. Для оценки функционального состояния печени исследовали белковый, пигментный, ферментативный и липидный обмен. Всем больным проводили ультразвуковое исследование, в том числе эластографию волны сдвига. Доказана эффективность применения мультипробиотика симбитер ацидофильный концентрированный у больных СД 2-го типа с НАЖБП. При повышении трансаминаз гепатопротекторный эффект проявляется снижением их уровня в крови, воспалительно-некротических изменений в паренхиме печени. У больных с нормальными показателями трансаминаз проявляются гиполипидемический и антистеатогенный эффекты мультипробиотика.
We examined 72 patients with type 2 diabetes mellitus (DM) and nonalcoholic fatty liver disease (NAFLD). According to course of therapy all patients were divided into two groups. Patients of the main group (n = 45) received oral hypoglycemic agents and multiprobiotic symbiter within 30 days. To assess the functional state of the liver we studied protein, pigment, enzyme and lipid metabolism. All patients underwent ultrasound examination, including shear wave elastography. The efficacy of using multiprobiotic symbiter acidophilic concentrated in patients with DM type 2 and NAFLD has been proved. With increasing transaminases, hepatoprotective effect is a decrease of their levels in the blood, inflammatory and necrotic changes in the liver parenchyma. In patients with normal transaminases, hypolipidemic and antisteatogenic effects of multiprobiotic are present.
цукровий діабет 2-го типу, неалкогольна жирова хвороба печінки, мультипробіотик симбітер.
сахарный диабет 2-го типа, неалкогольная жировая болезнь печени, мультипробиотик симбитер.
diabetes mellitus type 2, nonalcoholic fatty liver disease, multyprobiotic symbiter.
Статья опубликована на с. 49-56
Неалкогольна жирова хвороба печінки (НАЖХП) є найпоширенішою патологією серед усіх хронічних захворювань печінки, що призводить до погіршення якості життя, інвалідизації і смерті. Це зумовлено прогресуванням НАЖХП та розвитком неалкогольного стеатогепатиту (НАСГ), печінкової недостатності та гепатоцелюлярної карциноми. Поширеність НАЖХП у різних країнах перебуває в межах від 14 до 40 % [2].
Патогенез НАЖХП тісно пов’язаний із синдромом інсулінорезистентності (ІР) та вісцеральним ожирінням, унаслідок якого в печінці накопичуються тригліцериди (ТГ) і формується жировий гепатоз — перший етап (поштовх) захворювання. У подальшому відбувається вивільнення з жирової тканини і синтез у гепатоцитах вільних жирних кислот, що спричинюють виникнення окисного стресу — другого поштовху захворювання, розвиваються запально-деструктивні зміни в печінці у вигляді стеатогепатиту, із подальшим прогресуванням до фіброзу, при надмірному утворенні екстрацелюлярного матриксу [13, 14]. Певну роль у розвитку НАЖХП відіграє синдром надлишкового бактеріального росту, при якому в результаті порушення проникності кишкового бар’єру спостерігається підвищена ендогенна секреція етанолу та абсорбція ліпополісахаридів (ЛПС), що призводить до стимуляції надмірної продукції прозапальних цитокінів, особливо фактора некрозу пухлини альфа (ФНП-а клітинами Купфера [4, 5].
За результатами водневого дихального тесту в 50–75 % хворих із НАСГ виявляють надмірну бактеріальну проліферацію в тонкій кишці. Максимальна вираженість росту бактерій відзначається у хворих з прогресуванням НАЖХП у стеатогенний цироз [3].
Gordon et аl. вперше описав роль мікрофлори кишечника в регуляції енергетичного гомеостазу організму-хазяїна та її роль у розвитку ожиріння та асоційованих із ним захворювань. Учені помітили, що у GF-мишей (germ-free mice, безмікробні миші, які вирощені у стерильних умовах) спостерігалось на 42 % менше загального та на 47 % гонадного жиру, ніж у CONV-R мишей (conventionally raised mice, миші, вирощені за звичайних умов), навіть при споживанні ними їжі на 29 % вищої калорійності. Через 2 тижні після колонізації GF-мишей мікробіотою сліпої кишки контрольної групи (конвенціоналізація) навіть без змін в умовах харчування та споживання енергії в експериментальних тварин спостерігався 60% приріст загальної жирової маси, що супроводжувалось розвитком ІР, триразовим збільшенням рівня ТГ у печінці та підвищенням рівня глюкози й лептину в сироватці крові [7]. На думку вчених, в основі даних ефектів лежать такі механізми:
— після колонізації в експериментальних тварин відзначалось подвоєння щільності капілярів у ворсинках тонкого кишечника й підвищення всмоктування моносахаридів з просвіту кишечника в портальну вену, підвищення ліпогенезу з подальшим накопиченням жирової тканини в печінці та жировій тканині;
— мікробіота, пригнічуючи секрецію в кишечнику інгібітору ліпопротеїнліпази жирової тканини — FIAF (fastin-induced adipose factor), забезпечує накопичення циркулюючих ТГ в адипоцитах;
— у GF-мишей відзначалось підвищення b-окиснення жирних кислот у м’язах та печінці за рахунок підвищення активності ферменту AMPК (AMP-activated protein kinase) з подальшою активацією ключових ферментів мітохондріального b-окиснення — АСС (acetyl-CoA carboxylase), СТР-1 (carnitin-palmitoyl-transferase-1) [8].
Кишкова мікробіота синтезує велику кількість глікозидних гідролаз, що розщеплюють складні рослинні полісахариди до моносахаридів та коротколанцюжкових жирних кислот (КЛЖК) — ацетату, пропіонату і бутирату. КЛЖК беруть участь в секреції слизу, регуляції іонного обміну, пригнічують ріст умовно-патогенної мікрофлори, інактивують шкідливі метаболіти та ферменти, відіграють важливу роль в енергетичному і конструктивному обміні кишкового епітелію, активують місцевий імунітет та блокують адгезію до епітелію агресивної мікрофлори. КЛЖК є важливим джерелом енергії для ліпогенезу de novo та є лігандами для рецепторів вільних жирних кислот (FFAR) – Gpr41 (FFAR3) (Gpr41-G-protein-coupled receptors) та Gpr43 (FFAR2) в ентероендокринних клітинах кишечника [10, 16, 18].
Виражені порушення кишкової мікрофлори, що спостерігаються при парентеральному харчуванні або після ілеоеюнального шунтування, асоціюються з накопиченням ЛПС в крові і активацією TLRs (Toll-like receptors). Тому не дивно, що після хірургічних втручань, що призводять до втрати маси тіла (резекція тонкої кишки, ілеоеюнальне шунтування, гастропексія), практично у всіх прооперованих розвивається НАСГ. Дослідження, проведені у пацієнтів з НАСГ, що розвинувся внаслідок баріатричного хірургічного втручання, продемонстрували ефективність застосування метронідазолу при цьому патологічному процесі [9].
Останнім часом доведена патогенетична роль дефіциту амінокислот метіоніну та холіну в розвитку та прогресуванні НАЖХП. В експериментальних мишей, яких тримали на метіонін-холін-дефіцитній дієті протягом чотирьох тижнів, відзначалася втрата маси тіла, підвищення рівня печінкових ферментів та підвищення рівня ТГ і перекисного окислення ліпідів у печінці.
Іншим патогенетичним механізмом, що провокує системну запальну відповідь та бере участь у прогресуванні НАСГ, є підвищена продукція кишковою мікрофлорою ендогенного алкоголю. Ацетальдегід та ацетат — два основних метаболіти етилового спирту. Етанол, інгібуючи цикл Кребса, може підвищувати продукцію ацетату, що є субстратом для синтезу жирних кислот. У свою чергу, ацетальдегід і його метаболіти беруть участь в утворенні активних форм кисню, які підвищують окисний стрес, а також підвищують експресію гена TLR4 у клітинах Купфера [15, 17].
Cope et al. продемонстрували, що в мишей лінії Lep ob/ob із генетично детермінованим ожирінням та НАЖХП кишкова мікрофлора виробляє ендогенний етанол. Лікування даних експериментальних тварин пробіотиками призводило до зниження сироваткового рівня печінкових ферментів та покращення гістологічної картини НАЖХП [12]. Крім того, пероральний прийом антибіотиків зменшував прояви індукованої етанолом ендотоксемії і припиняв прогресування запальних змін у паренхімі печінки [6].
На даний час проводиться низка клінічних досліджень із вивчення ефективності пре- та пробіотиків при НАЖХП. При нормалізації мікрофлори кишечника відбувається зниження рівня прозапальних цитокінів, в першу чергу ФНП-a, що призводить до уповільнення процесів фіброгенезу [19]. Планується дослідження PROFIMET (Protein, Fiber and Metabolic Syndrome) з вивчення ефективності харчових волокон при метаболічному синдромі. Також відкрито набір у подвійне сліпе плацебо-контрольоване дослідження FATLOSE з вивчення ефективності транспозиції кишкової мікрофлори від здорових донорів у вигляді клізм на стан ліпідного, вуглеводного обміну та системну запальну відповідь у хворих з ожирінням та метаболічним синдромом [20].
Мета дослідження — вивчення ефективності застосування мультипробіотика симбітер на динаміку основних клінічних проявів НАЖХП.
Матеріали та методи дослідження
Дослідження проводилося на базі Київського міського клінічного ендокринологічного центру. Критеріями включення хворих були вік понад 18 років, згода хворого на дослідження, виявлення у хворого НАЖХП, супутній цукровий діабет 2-го типу (ЦД2).
Діагноз НАЖХП на стадії стеатогепатозу встановлювали згідно з рекомендаціями Американської гастроентерологічної асоціації та Американської асоціації з вивчення захворювань печінки [11] на підставі клінічного аналізу захворювання, лабораторних показників ліпідного та вуглеводного обміну, активності АЛТ, АСТ, співвідношення АСТ/АЛТ та комплексного ехографічного обстеження і комп’ютерної томографії.
Усі хворі, які брали участь у дослідженні, не зловживали алкоголем (споживання < 21 алкогольної одиниці на тиждень для чоловіків, < 14 алкогольних одиниць на тиждень для жінок протягом останнього року; одна алкогольна одиниця — 10 г етанолу) [11]; не мали ознак хронічного вірусного гепатиту, асоційованого з HBV-, HCV-, HDV-інфекціями; автоімунного і медикаментозного гепатитів. До групи обстеження не включали пацієнтів з хворобою Коновалова — Вільсона, ідіопатичним гемохроматозом, вродженою недостатністю альфа-1-антитрипсину.
Нами обстежені 72 хворі на ЦД2. Відповідно до проведеного курсу терапії всі пацієнти розподілені на дві групи. Основну групу становили 45 (62,5 %) пацієнтів із НАЖХП та ЦД2, середній вік хворих — 53,6 ± 10,1 року, тривалість ЦД — 6,6 ± 5,1 року. Хворі основної групи отримували пероральні цукрознижувальні засоби та мультипробіотик симбітер ацидофільний концентрований, що містить концентровану біомасу 14 штамів пробіотичних бактерій родів Bifidobacterium, Lactobacillus, Lactococcus, Propionibacterium, по одному пакетику (10 г) 1 раз на добу під час або після їжі впродовж 30 діб. До групи порівняння увійшли 27 (37,5 %) хворих із НАЖХП та ЦД2, які отримували лише цукрознижувальну терапію. Середній вік хворих даної групи — 59,6 ± 10,7 року, тривалість ЦД — 6,7 ± 7,1 року.
Додатково в кожній групі нами виділено хворих з нормальним та підвищеним рівнем трансаміназ. У пацієнтів основної групи нормальний рівень трансаміназ спостерігався у 25 (55,6 %), а підвищений — у 20 (44,4 %) пацієнтів, у групі порівняння — у 17 (63 %) та 10 (37 %) хворих відповідно.
До початку терапії всім пацієнтам давали рекомендації щодо зміни способу життя: зниження калорійності раціону, обмеження в дієті жирів тваринного походження та вмісту холестерину до 300 мг/добу, повне виключення алкоголю та обов’язкове дозоване фізичне навантаження.
Схема обстеження пацієнтів із НАЖХП включала біохімічні та інструментальні методи дослідження, що дозволили оцінити функціональний стан печінки. Досліджували білковий, пігментний, ферментативний обміни за стандартними методиками. У всіх пацієнтів ферментативним методом визначали рівні загального холестерину (ЗХС) та ТГ.
Усім хворим проводили ультразвукове дослідження (УЗД) В-методом з одночасною еластографією хвилі зсуву (ЕХЗ) на апараті Ultima PA (Фірма «Радмир» ДП АТ НДІРІ, м. Харків, Україна) контактно датчиком лінійного формату на частотах 7–10 МГц на глибині 10–30 мм. Контрольний об’єм 5 мм встановлювали в зоні інтересу 10 мм на глибині 1–3 см. Жорсткість виражали модулем Юнга в кПа. Окрім цього, визначали краніокаудальний розмір правої і лівої часток печінки.
Діагностика жирового гепатозу ультразвуковим методом проводилася за такими критеріями: збільшення розмірів печінки при незмінній формі та рівних контурах; зниження ехопровідності органа за рахунок того, що тканина, яка містить жирові включення, має здатність розсіювати, відображати і поглинати ультразвукове випромінювання більшою мірою, ніж незмінена; підвищення ехогенності, що супроводжується акустичним ефектом ослаблення ультразвуку в глибоких шарах паренхіми; однорідність структури паренхіми зі збідненням судинного рисунка.
Статистичний аналіз виконували за допомогою стандартного пакету програм SPSS версії 20.0 та Microsoft Excel. Кількісні зміни наведені у вигляді середньої величини та стандартного відхилення середньої величини (М ± SD), якісні — у відсотках. Для оцінки відмінності кількісних показників використовували t-критерій Стьюдента, якісних — критерій x2. Відмінності між групами вважали статистично вірогідними при р < 0,05.
Результати та їх обговорення
Проведене дослідження показало, що курс лікування із застосуванням мультипробіотика симбітер ацидофільний концентрований виражено позитивно впливало на динаміку клінічних проявів ураження гепатобіліарної системи у хворих на ЦД2. Повне зникнення патологічних симптомів досягнуто у 80–100 % хворих (p < 0,001) (табл. 1). Побічних реакцій не було виявлено.
Відчуття тяжкості, розпирання, дискомфорту в правому підребер’ї, яке спостерігалося у 37 (82,22 %) хворих, відчуття гіркоти у роті — у 21 (46,67 %) хворого і нудота — у 24 (53,34 %) зникли в 100 % випадків після 30-добового курсу лікування мультипробіотиком (p < 0,001).
Запори, що виявлялися у 20 (44,45 %) хворих до лікування, після курсу мультипробіотика зникли у 15 (33,33 %) хворих, у 4 (8,88 %) — зменшилися. У 9 (20,0 %) хворих спостерігалися проноси, які у 7 хворих повністю зникли, за винятком двох (4,44 %) хворих (p < 0,013), у яких вдалося досягти значного зменшення кількості дефекацій та поліпшення консистенції випорожнень.
Біль у правому підребер’ї спостерігався у 30 (66,67 %) хворих, після лікування зник у 24 (53,33 %) хворих (p < 0,001), у 6 (13,3 %) — зменшилася інтенсивність болю. Астенічний синдром (порушення сну, підвищена стомлюваність, слабкість) був виявлений у 25 (55,56 %) хворих, а після лікування його прояви зникли у 18 (40,0 %) пацієнтів (p < 0,001). Мультипробіотик симбітер ацидофільний концентрований сприяє нормалізації функції травлення і всмоктування в кишечнику, регулює його моторику.
У хворих основної групи виявлено підвищення АЛТ у трьох (15 %), АСТ — у двох (10 %) та обох трансаміназ — у 15 (75 %) пацієнтів. У групі порівняння констатували підвищення трансаміназ за рахунок АЛТ у чотирьох (40 %), АСТ — у двох (20 %), а також у чотирьох (40 %) хворих виявлено підвищення обох печінкових ферментів. Після проведеного лікування функціональний стан печінки у хворих суттєво покращився. Нормалізацію хоча б одного із печінкових ферментів нами виявлено в одного (10 %) хворого групи порівняння та 11 (55 %) пацієнтів, які отримували мультипробіотик симбітер (р = 0,024). Нами відмічено статистично вірогідне зниження АЛТ на 14,78 % (р < 0,001) (рис. 1а) та АСТ — на 16,33 % (р = 0,002) (рис. 1б) під впливом лікування у хворих основної групи. У хворих групи порівняння спостерігалася тенденція до зниження АЛТ. До лікування рівень АЛТ становив 54,91 ± 19,54 Од/л, а після — 51,89 ± 17,93 (р = 0,292) (рис. 1а). Також нами відзначається статистично невірогідне зростання АСТ з 46,4 ± 18,25 Од/л до 47,58 ± 16,23 Од/л (р = 0,432) (рис. 1б).
Загальний білірубін, тимолова проба, загальний білок були в нормі у двох групах пацієнтів до лікування та статистично значуще не змінилися при повторному обстеженні.
У хворих з підвищеним рівнем трансаміназ ми не відзначали статистично вірогідної різниці між показниками ліпідного обміну. Рівень ТГ та ЗХС до початку лікування становив 2,57 ± 0,96 ммоль/л і 6,35 ± 0,63 ммоль/л та відповідно знизився після курсу пробіотика до 2,51 ± 0,79 ммоль/л (р = 0,659) (рис. 1в) та 6,16 ± 0,63 ммоль/л (р = 0,133) (рис. 1г). У групі порівняння ми також спостерігали лише тенденцію до зниження зазначених показників. Рівень ТГ зменшився з 2,67 ± 0,74 ммоль/л до 2,59 ± 0,64 ммоль/л (р = 0,772) (рис. 1в) та відповідно ЗХС — з 6,12 ± 0,90 ммоль/л до 5,99 ± 0,69 ммоль/л (р = 0,348) (рис. 1г).
Гепатопротекторний ефект мультипробіотика симбітер, що проявляється зниженням рівня трансаміназ, підтверджується даними, отриманими нами під час інструментального дослідження печінки. Нами відзначено статистично вірогідне зниження жорсткості печінки, виміряної з допомогою ЕХЗ, на 10,4 % (р = 0,003) (рис. 2а) в динаміці лікування лише в основній групі хворих. У групі порівняння жорсткість печінки до лікування становила 9,69 ± 3,21кПа та знизилась до 9,53 ± 3,03 кПа (р = 0,721) (рис. 2а).
Одночасно зі зменшенням рівня трансаміназ та вираженості запальної відповіді, яка спостерігається у цієї групи хворих в плазмі крові, зниження показників жорсткості за даними ЕХЗ є непрямим підтвердженням зменшення запально-некротичних змін в паренхімі печінки на тлі проведеної терапії, що також підтверджується рутинним УЗ-обстеженням у В-режимі (рис. 2б,в, 3). Ми спостерігали статистично вірогідне зменшення розміру лівої частки печінки з 81,6 ± 14,79 мм до 78,65 ± 12,42 мм (р = 0,033) та тенденцію до зменшення розміру правої частки після курсу пробіотикотерапії. До лікування розмір правої частки становив 177,55 ± 20,42 мм, а після — 175,3 ± 21,73 мм (р = 0,182). У групі порівняння статистично вірогідної зміни розмірів часток печінки в динаміці лікування не виявлено (рис. 2б, в).
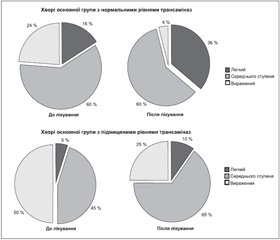
До лікування в 5 % хворих основної групи з підвищеним рівнем трансаміназ діагностовано легкий ступінь стеатогепатозу, у 45 % — середній ступінь та 50 % мали виражений ступінь. Після проведеного курсу лікування мультипробіотиком структура хворих за ступенем вираженості стеатогепатозу становила: у 10 % — легкий ступінь, у 65 % — середній ступінь та лише у 25 % — виражений ступінь стеатогепатозу (р = 0,251). Так, кількість пацієнтів із вираженим ступенем гепатозу зменшилась вдвічі під впливом лікування (рис. 3). У групі порівняння вираженість гепатозу на тлі лікування не змінилася. У 10 % хворих виявлено легкий ступінь гепатозу, у 70 % — середнього ступеня та у 20 % — виражений стеатогепатоз.
Отримані результати в сукупності з даними інструментальних методів дослідження свідчать, що у хворих із НАЖХП та нормальним рівнем трансаміназ в основному проявляється гіполіпідемічний та антистеатогенний ефект симбітеру. Після курсу терапії пробіотиком у хворих не спостерігалося статистично вірогідної різниці між маркерами цитолітичного синдрому в динаміці лікування. Так, рівень АЛТ знизився з 27,21 ± 7,46 Од/л до 26,45 ± 6,46 Од/л (р = 0,395) (рис. 4а) та АСТ відповідно з 25,76 ± 5,23 до 24,72 ± 5,42 (р = 0,221) (рис. 4б). У групі порівняння також відмічалася лише тенденція до зниження печінкових ферментів. Рівень АЛТ становив до початку лікування 27,96 ± 5,67 Од/л та після — 27,98 ± 5,99 Од/л (р = 0,987) (рис. 4а) та АСТ відповідно 25,55 ± 7,16 Од/л і 24,90 ± 8,47 Од/л (р = 0,672) (рис. 4б).
Аналіз проведених досліджень показав наявність гіперхолестеринемії та підвищення рівня ТГ у двох групах пацієнтів. Під впливом симбітеру відбулося вірогідне зниження цих показників в групі хворих із нормальним рівнем трансаміназ. Концентрація ТГ зменшилась на 16,9 % (р = 0,005) (рис. 4в) та ЗХС — на 6,17 % (р = 0,001) (рис. 4г). У групі порівняння ми спостерігали лише тенденцію до зниження показників ліпідного обміну. Рівень ТГ знизився з 2,37 ± 0,7 ммоль/л до 2,27 ± 0,66 ммоль/л (р = 0,286) (рис. 4в) та ЗХС — із 5,74 ± 0,83 ммоль/л до 5,64 ± 0,83 ммоль/л (р = 0,360) (рис. 4г).
Антистеатогенний ефект пробіотика підтверджується даними інструментальних досліджень. У хворих із нормальними рівнями трансаміназ також спостерігалось підвищення показників жорсткості паренхіми печінки за даними ЕХЗ, проте воно було нижчим, ніж у хворих на НАЖХП та з підвищеними рівнями трансаміназ. Тому жорсткість печінки за даними ЕХЗ може використовуватися як неінвазивний маркер діагностики НАЖХП. Ці результати відповідають отриманим нами раніше вимірюванням під час моделювання експериментального неалкогольного стеатогепатозу [1].
За нашими результатами, лише у хворих основної групи спостерігалось статистично вірогідне зниження жорсткості печінки на 12 % (р < 0,001) (рис. 5а), що свідчить про зменшення накопичення ТГ у тканині печінки та вираженості стеатогепатозу. За даними рутинного УЗД у В-режимі легкий ступінь стеатогепатозу діагностовано в 16 %, середнього ступеня — у 60 % та виражений — у 24 % хворих. Після курсу пробіотикотерапії кількість хворих із середнім ступенем не змінилася. Проте ми констатували збільшення хворих із легким ступенем жирового гепатозу (36 %) в основному за рахунок значного зниження числа хворих із вираженим стеатогепатозом (4 %) (р = 0,064). Розмір часток печінки в динаміці лікування не змінився (рис. 5б, в). Розмір лівої частки печінки до лікування становив 78,88 ± 14,99 мм та після лікування — 77,08 ± 13,13 мм (р = 0,201), правої — 176,96 ± 19,36 мм та 176,24 ± 19,35 мм (р = 0,701) відповідно.
У хворих групи порівняння ми спостерігали тенденцію до збільшення жорсткості печінки. До лікування її рівень становив 7,02 ± 1,14 кПа та після — 7,11 ± 1,40 кПа (р = 0,589) (рис. 5а). Отримані результати підтверджуються у даної групи хворих рутинним УЗ-обстеженням у В-режимі (рис. 5б, в, 3). Так, у динаміці лікування у 23,5 % хворих відзначали виражений ступінь стеатогепатозу до та після лікування. Також ми відзначали зростання кількості хворих із гепатозом середнього ступеня з 47,1 до 58,8 % в основному за рахунок прогресування захворювання, оскільки легкий ступінь до лікування ми діагностували в 29,4 %, а після — лише у 17,6 % (р = 0,697). Статистично вірогідної зміни розмірів часток печінки в динаміці лікування ми також не відзначали.
Висновки
Застосування мультипробіотика симбітер позитивно впливає на динаміку основних клінічних проявів НАЖХП. Препарат справляє двонаправлену терапевтичну дію. У хворих із підвищеними трансаміназами пробіотик забезпечує в основному гепатопротекторний ефект, який проявляється зниженням рівня трансаміназ, запально-некротичних змін у паренхімі печінки. У хворих на НАЖХП та з нормальними трансаміназами в основному проявляються гіполіпідемічний та антистеатогенний ефекти мультипробіотика.
1. Боднар П.М., Динник О.Б., Михальчишин Г.П. та ін. Оцінка еластографії хвилі зсуву в діагностиці експериментальної неалкогольної жирової хвороби печінки // Журн. НАМН України. — 2011. — Т. 17, № 4. — С. 422–430.
2. Боднар П.М., Михальчишин Г.П., Кобиляк Н.М. Неалкогольна жирова хвороба печінки у хворих на цукровий діабет типу 2: патогенез, діагностика та лікування // Ендокринологія. — 2012. — Т. 17, № 1. — С. 94–101.
3. Интегральная роль симбиотической микрофлоры в физиологии человека / Янковский Д.С., Широбоков В.П., Дымент Г.С. — К.: Червона Рута-Турс, 2011. — 502 с.
4. Микрофлора и здоровье человека / Янковский Д.С., Дымент Г.С. — К.: Червона Рута-Турс, 2008. — 502 с.
5. Панькив В.И. Сахарный диабет 2-го типа и неалкогольная жировая болезнь печени. Эффекты метформина // Международный эндокринологический журнал. — 2013. — № 5(53). — С. 55–63.
6. Adachi Y., Moore L.E., Bradford B.U. et al. Antibiotics prevent liver injury in rats following long-term exposure to ethanol // Gastroenterology. — 1995. — 108. — Р. 218–224.
7. Backhed F., Ding H., Wang T. et al. The gut microbiota as an environmental factor that regulates fat storage // Proc. Natl. Acad. Sci. USA. — 2004. — 101. — Р. 15718–15723.
8. Backhed F., Manchester J.K., Semenkovich C.F., Gordon J.I. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice // Proc. Natl. Acad. Sci. USA. — 2007. — 104. — Р. 979–984.
9. Carter B.A., Karpen S.J. Intestinal failure-associated liver disease: management and treatment strategies past, present and future // Semin. Liver Dis. — 2007. — 27. — Р. 251–258.
10. Cherbut C., Ferrier L., Roze C. et al. Short-chain fatty acids modify colonic motility through nerves and polypeptide YY release in the rat // Am. J. Physiol. — 1998. — 275. — Р. 1415–1422.
11. Chalasan N., Younossi Z., Lavine J. et al. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association // Hepatology. — 2012. — Vol. 55, № 6. — P. 2005–2023.
12. Cope K., Risby T., Diehl A.M. Increased gastrointestinal ethanol production in obese mice: implications for fatty liver disease pathogenesis // Gastroenterology. — 2000. — 119. — Р. 1340–1347.
13. Day C.P., James O.F. Steatohepatitis: a tale of two «hits»? // Gastroenterology. — 1998. — Vol. 114, № 4. — P. 842–845.
14. Day C.P. Pathogenesis of steatohepatitis // Best Pract. Res. Clin. Gastroenterol. — 2002. — Vol. 16, № 5. — P. 663–678.
15. Faggioni R. et al. Leptin deficiency enhances sensitivity to endotoxin-induced lethality // Am. J. Physiol. — 1999. — 276. — P. 136–142.
16. Fukumoto S., Tatewaki M., Yamada T. et al. Short-chain fatty acids stimulate colonic transit via intraluminal 5-HT release in rats // Am. J. Physiol. Regul. Integr. Comp. Physiol. — 2003. — 284. — P. 1269–1276.
17. Gustot T. et al. Differential liver sensitization to Toll-like receptor pathways in mice with alcoholic fatty liver // Hepatology. — 2006. — 43. — P. 989–1000.
18. Samuel B.S., Shaito A., Motoike T. et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41 // Proc. Natl. Acad. Sci. USA. — 2008. — 105. — P. 16767–16772.
19. Solga S.F., Diehl A. Non-alcoholic fatty liver disease: lumen-liver interactions and possible role for probiotics // J. Hepatol. — 2003. — Vol. 38. — P. 681–687.
20. Vrieze А., Holleman F., Zoetendal E.G. et al. The environment within: how gut microbiota may influence metabolism and body composition // Diabetologia. — 2010. — Vol. 53, № 4. — P. 606–613.

/51/51.jpg)
/52/52.jpg)
/53/53.jpg)
/54/54.jpg)
/55/55.jpg)