Международный эндокринологический журнал 4 (60) 2014
Вернуться к номеру
Оцінка ефективності комбінованої терапії хворих на синдром діабетичної стопи препаратами альфа-ліпоєвої кислоти і низькомолекулярного гепарину
Авторы: Горобейко М.Б. - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
У роботі вивчали ефективність комбінації альфа-ліпоєвої кислоти (АЛК) з беміпарином порівняно з базисною цукрознижувальною терапією або додатковою монотерапією АЛК у хворих із синдромом діабетичної стопи. У дослідження включили 82 пацієнти. До групи контролю (ГК) увійшли 14 пацієнтів, які отримували лише цукрознижувальну терапію. 37 хворих становили першу дослідну групу (ДГ-1), якій призначали тільки АЛК додатково до цукрознижувальної терапії, спочатку парентерально, з переходом на пероральний прийом. У другій дослідній групі (ДГ-2, 31 хворий) застосовувалася комбінація АЛК та беміпарину. Критеріями ефективності виступали рівень черезшкірного парціального тиску кисню (PtcO2) на тильній стороні стопи та середні оцінки за шкалою вираженості симптомів невропатії NSS. Їх визначали тричі: до початку лікування, після закінчення парентерального введення АЛК та підшкірних ін’єкцій беміпарину (в середньому через 12–16 днів) та після закінчення перорального прийому АЛК (приблизно через 50 днів). У пацієнтів ДГ-1 зростання PtcO2 на першому етапі було більш повільним (з 33,11 ± 7,21 мм рт.ст. до 36,19 ± 6,45 мм рт.ст.) та невірогідним (р = 0,054), в той час як у групі комбінованої терапії рівень оксигенації виріс із 30,74 ± 8,50 мм рт.ст. до 39,94 ± 8,14 мм рт.ст., що вірогідно краще від показника в ДГ-1 (р < 0,05), а також відносно початкового рівня (р < 0,01). У ДГ-1 PtcO2 на кінець лікування досягнув 37,65 ± 5,44 мм рт.ст., що вірогідно краще від початкового рівня (р < 0,05). В ДГ-2 PtcO2 на 50-й день становив 41,61 ± 7,74 мм рт.ст., це вірогідно кращий результат порівняно з ДГ-1 (р < 0,05) та з початковим рівнем (р < 0,01). Крім того, комбінована терапія вірогідно зменшувала вираженість невропатії за NSS: з 6,26 ± 1,19 до 3,74 ± 0,62 порівняно з групою контролю (з 6,14 ± 0,99 до 5,43 ± 0,90). Також відмічалася дещо краща динаміка оцінок за NSS порівняно з групою монотерапії АЛК, проте вона не досягла рівня статистичної вірогідності.
В работе изучали эффективность комбинации альфа-липоевой кислоты (АЛК) и бемипарина по сравнению с базисной сахароснижающей терапией или дополнительной монотерапией АЛК у пациентов с синдромом диабетической стопы. В исследование включили 82 пациента. В группу конт-роля вошли 14 пациентов, которые получали только сахароснижающую терапию. 37 больных составили первую опытную группу (ОГ-1), в которой назначали только АЛК дополнительно к сахароснижающей терапии, сначала парентерально, с переходом к пероральному приему. Во второй опытной группе
(ОГ-2, 31 пациент) применялась комбинация АЛК и бемипарина. Критериями эффективности служили уровень чрескожного парциального давления кислорода (PtcO2) на тыльной стороне стопы и средние оценки по шкале выраженности симптомов нейропатии NSS. Их определяли трижды: до начала лечения, по окончании парентерального введения АЛК и инъекций бемипарина (в среднем через 12–16 дней) и по окончании перорального приема АЛК (примерно через 50 дней). У пациентов ОГ-1 прирост PtcO2 на первом этапе был более медленным (с 33,11 ± 7,21 мм рт.ст. до 36,19 ± 6,45 мм рт.ст.) и статистически недостоверным (р = 0,054), в то время как в группе комбинированной терапии уровень оксигенации вырос с 30,74 ± 8,50 мм рт.ст. до 39,94 ± 8,14 мм рт.ст., что достоверно лучше показателя в ОГ-1 (р < 0,05), а также относительно исходного уровня (р < 0,01). В ОГ-1 PtcO2 по окончании всего курса лечения достиг 37,65 ± 5,44 мм рт.ст., что достоверно лучше по сравнению с исходным уровнем (р < 0,05). В ОГ-2 PtcO2 на 50-й день составил 41,61 ± 7,74 мм рт.ст., это достоверно лучший результат по сравнению с ОГ-1 (р < 0,05) и относительно исходного уровня (р < 0,01). Кроме того, комбинированная терапия достоверно уменьшала выраженность нейропатии по NSS: с 6,26 ± 1,19 до 3,74 ± 0,62 по сравнению с контрольной группой (с 6,14 ± 0,99 до 5,43 ± 0,90). Также отмечалась несколько лучшая динамика оценок по NSS в сравнении с группой монотерапии АЛК, однако она не достигла уровня статистической значимости.
In this study we have investigated the efficacy of combination of alpha-lipoic acid (ALA) and bemiparin compared to baseline hypoglycemic therpay or additional monotherapy with ALA in patients with diabetic foot syndrome. The study involved 82 patients. Control group included 14 patients who received only hypoglycemic therapy. 37 patients made-up first study group
(SG-1) treated with alpha-lipoic acid only in additional to hypoglycemic therapy, first parenterally, then per os. In the second study group (SG-2, 31 patients) we administered combination of ALA and bemiparin. Efficacy criteria were level of transcutaneous partial pressure of oxygen (PtcO2) on the back of the foot and average rating by scale of neuropathy symptoms — NSS. They were determined three times: before treatment, after parenteral administration of ALA and injection of bemiparin (average 12–16 days) and after oral administration of ALA (approximately in 50 days). In patients from SG-1, PtcO2 growth in the first stage has been slower (from 33.11 ± 7.21 mmHg to 36.19 ± 6.45 mmHg) and statistically insignificant (p = 0.054), while in the combination therapy group oxygenation level increased from 30.74 ± 8.50 mmHg up to 39.94 ± 8.14 mmHg, which was significantly better that indicator in the SG-1 (p < 0.05), and baseline (p < 0.01). In the
SG-1, PtcO2 at the end of the whole course of treatment has reached 37.65 ± 5.44 mmHg, which was significantly better compared to baseline (p < 0.05). In the SG-2, PtcO2 on the 50th day was 41.61 ± 7.74 mmHg, it is significantly better result as compared to the SG-1 (p < 0.05) and baseline (p < 0.01). In addition, the combination therapy significantly reduced the severity of neuropathy on NSS: from 6.26 ± 1.19 to 3.74 ± 0.62 compared with the control group (from 6.14 ± 0.99 to 5.43 ± 0.90). Also we observed a somewhat better dynamics by NSS compared with ALA monotherapy group, but it did not reach statistical significance.
цукровий діабет, синдром діабетичної стопи, альфа-ліпоєва кислота, беміпарин.
сахарный диабет, синдром диабетической стопы, альфа-липоевая кислота, бемипарин.
diabetes mellitus, diabetic foot syndrome, alpha-lipoic acid, bemiparin.
Статья опубликована на с. 63-66
Цукровий діабет (ЦД) та його ускладнення є однією з найбільш актуальних медико-соціальних проблем у всьому світі, що зумовлено пандемічними масштабами поширеності, тягарем інвалідності для суспільства та високою смертністю хворих. Поширеним інвалідизуючим ускладненням ЦД є синдром діабетичної стопи (СДС) — перша за частотою причина ампутацій кінцівок [1]. Результати лікування багатьох пацієнтів із діабетичними ураженнями стоп залишаються незадовільними, що змушує науковців постійно випробовувати нові методи і засоби загоєння діабетичних виразок. Важливо, щоб вони були ретельно оцінені методами доказової медицини, а ті методи, що не мають доказів ефективності, не застосовувалися на практиці.
Підходи до консервативного лікування СДС визначаються сучасними уявленнями про взаємозв’язок метаболічних і судинних (ішемічних) чинників у складному патогенезі пізніх ускладнень ЦД [2–4]. Підґрунтям розвитку СДС вважаються такі ускладнення, як діабетична периферична полінейропатія та діабетична мікроангіопатія, які є наслідком одного стану — хронічної гіперглікемії. На практиці важливо враховувати взаємообумовленість цих патологічних процесів. Відомо, що не лише зміни vasa nervorum можуть призводити до порушення функції периферичних нервів і розвитку дистальної невропатії, але й порушення інервації мікросудинного русла можуть викликати погіршення мікроциркуляції шляхом розвитку феномену артеріоло-венулярного шунтування [5].
Згідно з метаболічною теорією у патогенезі діабетичної невропатії важливу роль відіграє оксидативний стрес нервових структур унаслідок накопичення недоокислених метаболітів глюкози. Детальний аналіз численних досліджень медикаментозного лікування діабетичної поліневропатії демонструє добре доведену ефективність антиоксидантної терапії, насамперед препаратами альфа-ліпоєвої (тіоктової) кислоти [6, 7].
З іншого боку, не менш важливою в розвитку периферичної поліневропатії та СДС є роль мікроангіопатії, хоча клінічні симптоми ангіопатії у таких хворих можуть бути відсутніми. Тому патогенетично обґрунтованим є одночасний вплив на порушення мікроциркуляції, наприклад призначенням антикоагулянтної терапії. У подвійному сліпому рандомізованому дослідженні іспанських авторів терапія низькомолекулярним гепарином (НМГ) другого покоління (беміпарин, 3500 МО на день у перші 10 днів, потім 2500 МО на день до трьох місяців) вірогідно збільшувала відсоток хворих, у яких розміри неускладнених виразок стопи зменшилися більше ніж на 50 % [8].
Проте в жодній із робіт не оцінювали ефективність комбінованої терапії альфа-ліпоєвою кислотою (АЛК) і НМГ, хоча вона є прикладом втручання, спрямованого на метаболічний і судинний чинники патогенезу СДС. Тому метою нашого дослідження була оцінка ефективності комбінації альфа-ліпоєвої кислоти з беміпарином порівняно з базисною цукрознижувальною терапією ЦД та додатковою монотерапією АЛК.
Матеріал і методи
У дослідження включили 82 пацієнтів Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України. Групу контролю (ГК) становили 14 пацієнтів із компенсованим ЦД, які знаходилися на амбулаторному лікуванні та отримували тільки цукрознижувальну терапію. За 50–70 днів до включення у дослідження вони отримували стаціонарне лікування. До першої дослідної групи (ДГ–1) увійшли 37 хворих, які лікувалися в стаціонарному відділенні центру з подальшим переведенням на амбулаторну терапію. Окрім стандартної цукрознижувальної терапії пацієнти отримували АЛК спочатку по 600 мг внутрішньовенно краплинно протягом 12–16 днів, потім у таблетках — до 40 днів. У другу дослідну групу (ДГ-2) включили 31 хворого, які додатково до лікування, аналогічного з ДГ-1, отримували підшкірні ін’єкції беміпарину по 2500 МО протягом 18–24 днів.
Усім пацієнтам черезшкірно визначали рівень парціального тиску кисню (PtcO2) на тильній стороні правої стопи за допомогою газоаналізатора компанії «Радиометр» із візуалізуючою приставкою для обробки даних. Парціальний тиск кисню у периферичних тканинах є інтегральним показником стану мікроциркуляції. Вимірювання проводили тричі: перед призначенням лікування, після закінчення курсу внутрішньовенного введення АЛК (перший етап) та після закінчення прийому таблетованої форми АЛК (другий етап). З такою ж періодичністю проводилися дослідження в контрольній групі. Крім того, у всіх хворих визначали рівень глікованого гемоглобіну.
Окрім збору анамнезу, фізикального огляду та лабораторних тестів, проводили низку досліджень для підтвердження дистальної невропатії та виключення наявності порушень прохідності магістральних артерій нижніх кінцівок. Досліджували прохідність артерій гомілок шляхом ультразвукової допплерографії з обчисленням кісточко-плечового індексу, проводили оцінку вібраційної чутливості нижніх кінцівок за допомогою С 128 Гц камертона, дискримінаційної чутливості за допомогою тактильного циркулярного дискримінатора, температурної чутливості за допомогою «Типтерма», больової чутливості за допомогою набору «Нейропен», тактильної чутливості за допомогою монофіламентів і висоти рефлексів з ахіллового сухожилка за допомогою неврологічного молоточка та рефлексометрії. Вираженість невропатії оцінювали за шкалою NSS (Neuropathy Symptomatic Score) [19].
Результати та їх обговорення
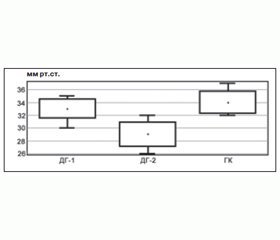
До початку лікування в контрольній групі рівень PtcO2 перебував у межах від 27 до 48 мм рт.ст., що значно нижче від фізіологічного. Середнє значення становило 34,64 ± 5,09 мм рт.ст. У ДГ-1 (терапія АЛК) початковий середній рівень PtcO2 становив 33,11 ± 7,21 мм рт.ст. У пацієнтів ДГ-2 (АЛК + беміпарин) PtcO2 був у межах 21–51 мм рт.ст., середнє значення 30,74 ± 8,50 мм рт.ст. Кращі показники у контрольній групі, імовірно, пов’язані з тим, що всі пацієнти цієї групи до включення в дослідження отримували адекватне стаціонарне лікування в ендокринологічному відділенні. Про це свідчить і середній рівень глікованого гемоглобіну: в ГК він становив 7,23 ± 0,89 %, в ДГ-1 — 8,27 ± 1,39 %, а в ДГ-2 — 8,37 ± 1,87 %. Проте міжгрупові відмінності цього показника були невірогідними (р > 0,1).
Після проведення курсу внутрішньовенної терапії АЛК середній парціальний тиск кисню на тильній стороні стопи у хворих ДГ-1 збільшився до 36,19 ± 7,29 мм рт.ст., у ДГ-2 — до 39,94 ± 8,14 мм рт.ст. Порівняно зі значеннями на початку лікування спостерігалося вірогідне зростання цього показника в ДГ-2 (р < 0,01). У ДГ-1 видима різниця між початковим рівнем та PtcO2 після першого етапу лікування виявилася статистично не значущою (р = 0,054). Але ситуація кардинально змінилася, коли ми проаналізували дані 29 хворих із вираженою симптоматикою діабетичної невропатії (оцінка за шкалою NSS ≥ 6). Середній парціальний тиск кисню в цій підгрупі на початку дослідження становив 30,93 ± 5,92 мм рт.ст, а після закінчення першого етапу лікування — 34,48 ± 5,26 мм рт.ст., причому різниця виявилася вірогідною (р < 0,05). Можливо, це пов’язано з тим, що на тлі вираженої діабетичної невропатії розвивається картина артеріоло-венулярного шунтування, а при покращенні інервації судин нижніх кінцівок малого діаметру (артеріол, венул) на тлі терапії АЛК відновлюється капілярний кровоток та перестають функціонувати патологічні шунти.
При порівнянні результатів у ДГ-1 та ДГ-2 вірогідно кращий результат (р < 0,05) спостерігався в групі комбінованої терапії АЛК та беміпарином. Це стосується і абсолютних чисел, і темпів зростання насиченості тканин киснем: у ДГ-1 середній приріст становив трохи більше 3 мм рт.ст., у ДГ-2 — перевищував 9 мм рт.ст. Після переходу на таблетовану форму АЛК та припинення введення НМГ темпи зростання PtcO2 зменшилися. На 50-й день дослідження PtcO2 у ДГ-1 досяг 37,19 ± 6,45 мм рт.ст., у ДГ-2 — 41,61 ± 7,74 мм рт.ст. Важливо підкреслити, що результати в групі комбінованої терапії залишалися статистично кращими (р < 0,05), ніж у групі монотерапії АЛК. В обох дослідних групах результати наприкінці лікування були достовірно кращими, ніж на початку (р < 0,05 в ДГ-1 та р < 0,01 в ДГ-2), а також кращими (р < 0,01) порівняно з контрольною групою, у якій середнє значення PtcO2 становило 33,01 ± 4,84 мм рт.ст. Більш наочно динаміка PtcO2 подана на рис. 1 та 2.
/65/65.jpg)
Додатковий аналіз оцінок за шкалою NSS у хворих дослідних груп до та після лікування виявив чітку тенденцію до зменшення вираженості невропатії. Якщо до лікування середня оцінка за NSS в ДГ-1 становила 6,31 ± 1,14, то після парентерального та перорального етапів призначення АЛК — 3,82 ± 0,99 (різниця вірогідна, р < 0,01). У хворих ДГ-2 середня оцінка за NSS становила 6,26 ± 1,43, а після лікування знизилася (покращилася) до 3,74 ± 0,62 (різниця вірогідна, р < 0,01). У контрольній групі динаміка оцінок за NSS була значно менш помітною: відбулося невелике зменшення — з 6,14 ± 0,99 до 5,43 ± 0,91. При порівнянні з даними ГК відмічається вірогідна різниця (р < 0,01) на користь лікування із застосуванням монотерапії АЛК або комбінованої терапії. Проте між двома дослідними групами різниця в динаміці NSS була статистично невірогідною (р = 0,038).
Висновки
1. Комбінована терапія з парентеральним введенням АЛК та НМГ (беміпарину) у хворих на ЦД, ускладнений СДС, вірогідно пришвидшує відновлення мікроциркуляції у тканинах нижніх кінцівок порівняно з монотерапією АЛК, що, у свою чергу, повинно зменшити час загоєння діабетичних виразок.
2. Після переходу з внутрішньовенного на пероральне призначення АЛК та припинення ін’єкцій беміпаріну в групі комбінованої терапії динаміка зростання PtcO2 залишається вірогідно кращою порівняно з групою монотерапії АЛК.
3. Комбінована терапія вірогідно зменшує прояви діабетичної нейропатії за шкалою NSS порівняно з контрольною групою. Також відзначається дещо краща динаміка оцінок за NSS порівняно з групою монотерапії АЛК, хоча вона не мала статистичної значимості.
4. Комбінацію парентеральної форми АЛК та НМГ (беміпарину) доцільно застосовувати як базову терапію СДС. Такий підхід дозволяє пришвидшувати загоєння виразок шляхом одночасного покращення кровопостачання нижніх кінцівок та зменшення вираженості нейропатії.
1. Міжнародна угода з проблеми діабетичної стопи [Текст]. — Київ, 2004. — 96 с.
2. Cameron N.E., Cotter M.A. The relationship of vascular changes to metabolic factors in diabetes mellitus and their role in development of peripheral nerve complications // Diab. Metab. Rev. — 1994. — V. 10, № 3. — P. 189–224.
3. Cameron N.E., Cotter M.A. Metabolic and vascular factors in the pathogenesis of diabetic neuropathy // Diabetes. — 1997. — Vol. 46, Suppl. 2. — P. S31–S37.
4. Gershater M.A., Löndahl M., Nyberg P. et al. Complexity of factors related to outcome of neuropathic and neuroischaemic/ischaemic diabetic foot ulcers: a cohort study // Diabetologia. — 2009. — V. 52, № 3. — P. 398–407.
5. Ellenberg M. Diabetic neuropathy. Clinical aspects // Metabolism. — 1976. — Vol. 25. — P. 1627–1655.
6. Аметов А.С., Строков И.А., Баринов А.Н. и др. Альфа-липоевая кислота в лечении симптомной диабетической полиневропатии: symptomatic diabetic neuropathy (Sydney) trial // Фарматека. — 2004. — Т. 88, № 11. — С. 69–73.
7. Паньків В.І. Класифікація, діагностика, сучасні підходи до лікування діабетичної полінейропатії // Міжнародний ендокринологічний журнал. — 2008. — № 6 (18). — С. 64–68.
8. Rullan M., Cerdà L., Frontera G. et al. Treatment of chronic diabetic foot ulcers with bemiparin: a randomized, triple blind, placebo-controlled, clinical trial // Diabet Med. — 2008. — Vol. 25. — P. 1090–1095.