Международный эндокринологический журнал 4 (60) 2014
Вернуться к номеру
Інциденталоми надниркових залоз: діагностика та вибір тактики ведення хворих
Авторы: Луценко Л.А. - Київський міський клінічний ендокринологічний центр; Кваченюк А.М. - ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
З огляду на широке використання сучасних інструментальних методів топічної діагностики вибір тактики ведення хворих з інциденталомами надниркових залоз є актуальною проблемою сучасної медицини. Виявлення гормональної гіперсекреції та виключення злоякісного процесу є ключовими моментами при виборі тактики ведення хворих з інциденталомами надниркових залоз. Авторами представлено результати лабораторної та інструментальної діагностики 333 хворих з інциденталомами надниркових залоз.
С учетом широкого использования современных инструментальных методов топической диагностики выбор тактики ведения больных с инциденталомами надпочечных желез является актуальной проблемой современной медицины. Выявление гормональной гиперсекреции, а также исключение злокачественного процесса являются ключевыми моментами при выборе тактики ведения больных с инциденталомами надпочечных желез. Авторами представлены результаты инструментальной и лабораторной диагностики 333 больных с инциденталомами надпочечников.
Taking into the consideration the widespread usage of modern instrumental methods of topical diagnosis, the choice of the management of patients with adrenal incidentalomas is a topical problem in current medicine. Both the detection of hormonal hypersecretion and the malignant process exclusion are principal when choosing management tactics for the patients with adrenal incidentalomas. The authors presented the results of instrumental and laboratory diagnosis of 333 patients with adrenal incidentalomas.
інциденталоми надниркових залоз, комп’ютерна томографія, кортизол, метанефрини, альдостерон.
инциденталомы надпочечников, компьютерная томография, кортизол, метанефрины, альдостерон.
adrenal ncidentalomas, computer tomography, cortisol, metanephrines, aldosterone.
Статья опубликована на с. 67-74
За останні роки опубліковано ряд робіт, що аналізують та узагальнюють досвід діагностики та лікування інциденталом надниркових залоз (ІН), а саме алгоритм Національного інституту здоров’я США, 2002; Pheochromocytoma: recommendations for clinical practice from the First International Symposium, 2005; The Diagnosis of Cushing’s Syndrome: An Endocrine Society Clinical Practice Guidelines, 2008; Guidelines for management of Patients with Primary Aldosteronism, 2008; рекомендації Американських асоціацій клінічних ендокринологів та ендокринних хірургів, 2009 [1–5]. Але, незважаючи на фундаментальність досліджень та широке впровадження нових методів топічної діагностики (комп’ютерна томографія (КТ), магнітно-резонансна томографія, спіральна КТ) та їх модифікації (внутрішньовенне посилення та ін.), які дозволяють не тільки виявити ІН, а й охарактеризувати її, залишається не до кінця вирішеним питання диференційної діагностики доброякісних та злоякісних ІН. Існує «мертвий простір» в диференціації утворень надниркових залоз (НЗ) розміром < 4 см, при якому ведеться лише спостереження за хворобою, та при розмірах 4–6 см, коли необхідно використовувати невизначені «інші критерії». Як диференційний критерій, що підтверджує доброякісний характер утворення, використовується лише нативна щільність < 10 одиниць Hounsefield (HU), що призводить до гіпердіагностики злоякісного потенціалу ІН. Крім того, асоціаціями клінічних ендокринологів та ендокринних хірургів рекомендується використовувати більш жорсткі критерії для оперативного втручання, а саме розмір ІН > 4 см, що призводить до збільшення частоти невиправданих оперативних втручань. Ці обставини вказують на невирішеність усіх аспектів даної проблеми.
Мета роботи: уточнити лабораторні та інструментальні критерії вибору тактики ведення хворих з ІН.
Матеріали та методи дослідження
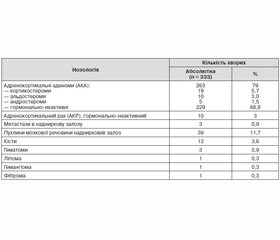
Обстежено 333 хворих віком від 18 до 84 років, які вперше звернулися до ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України» у зв’язку з виявленням ІН. Серед пацієнтів переважали хворі жіночої статі — 67,9 % (226 пацієнток). У 218 хворих виявлено пухлину правої надниркової залози, у 105 — лівої та у 10 — двосторонні пухлини. Розподіл хворих за нозологіями відображено в табл. 1.
Клінічна частина обстеження включала вивчення анамнезу, скарг хворих, оцінку давності скарг, даних об’єктивного огляду по органах та системах. Особлива увага зверталась на онкологічний анамнез, наявність артеріальної гіпертензії (АГ), ступінь її тяжкості, характер та давність перебігу, надлишкову масу тіла та ожиріння, ознаки порушень вуглеводного обміну.
Всім хворим виконувалось комплексне обстеження, що включало загальноклінічні, спеціальні лабораторні та інструментальні методи.
З метою топічної діагностики були використані методи ультразвукового дослідження (УЗД) на апараті Toshiba SSA-240A (Японія), КТ надниркових залоз та заочеревинного простору на апаратах CT-9000HP (General Electric, США) та Brightspeed (General Electric, США) з товщиною зрізу 3 та 5 мм. З метою підвищення інформативності КТ-дослідження проводилося з внутрішньовенним «посиленням» із використанням неіонних контрастних речовин ультравіст, візипак, омніпак.
При проведенні УЗД аналізувалися такі характеристики інциденталоми, як розмір ІН, форма, контури, ехогенність, структура, наявність інвазії та лімфаденопатії.
При проведенні КТ вивчалися такі характеристики пухлини: розмір ІН, форма, контури, структура, щільність (нативна, контрастна, градієнт щільності), що визначалася за одиницями Hounsefield, наявність інвазії та лімфаденопатії.
Враховуючи, що характер клінічних синдромів є важливим фактором, який впливає на вибір тактики ведення пацієнтів з ІН, проводився аналіз можливої гормональної активності ІН. Контрольну групу хворих (при лабораторному обстеженні) становили 40 осіб без патології НЗ. Забір крові для проведення біохімічних досліджень виконувався ранком натще з ліктьової вени.
Функціональний стан НЗ оцінювали, використовуючи ряд показників крові (кортизол, адренокортикотропний гормон (АКТГ), альдостерон, ренін, альдостерон-ренінове співвідношення (АРС), дегід-роепіандростерону сульфат (ДГЕА-С) і тестостерон) та добової сечі (кортизол та метанефрини).
Забір крові для проведення гормональних досліджень виконувався ранком до 10-ї години натще з ліктьової вени. Преаналітичний етап для визначення альдостерону, реніну, розрахунку АРС проводився з дотриманням рекомендацій Міжнародного ендокринологічного товариства [4] вранці (до 10-ї години), пацієнт перебував у вертикальному положенні протягом двох годин, а потім сідав у крісло для забору крові в маніпуляційному кабінеті та сидів упродовж 5–15 хв, після чого здійснювався забір крові з ліктьової вени. Збір добової сечі (для визначення рівня кортизолу, метанефринів та інших показників добової сечі) проводився таким чином: перша порція сечі після сну не збиралася, а збиралися всі наступні, включаючи вранішню порцію другого дня. Посудину для збору сечі, у яку поміщали консервант, тримали в холодильнику, але не заморожували. З метою виключення хибнопозитивних та хибнонегативних результатів при проведенні гормональних досліджень обов’язково збиралася інформація про лікарські препарати, які приймав хворий напередодні та протягом останнього місяця, та проводилися бесіди з хворим щодо дотримання певних правил харчування. Так, при зборі добової сечі для визначення вмісту метанефринів пацієнтам заборонялося приймати їжу та напої, що містять аміни (ваніль, шоколад, кава, чай, кола, банани, томати та ін.), вживати алкоголь та палити.
Результати та їх обговорення
При аналізі скарг відмічено, що 120 (36,0 %) хворих з ІН не мали скарг. Гіпертонічну хворобу в анамнезі мав 121 (36,3 %) пацієнт. У 113 (33,9 %) хворих виявлено надлишкову вагу та у 77 (23,1 %) — порушення вуглеводного обміну. Скарги характеризувалися значною варіабельністю та в більшості випадків мали неспецифічний характер. Найбільш поширеними були підвищення артеріального тиску (37,8 %), загальна слабкість та втомлюваність (29,4 %), серцебиття (15,3 %) та головний біль (12,6 %). При порівнянні скарг у пацієнтів із доброякісними та злоякісними новоутвореннями виявлено такі відмінності. Для пацієнтів з ІН, які були верифіковані як гормонально-неактивні аденоми, частіше порівняно з хворими зі злоякісними пухлинами, були характерні скарги, пов’язані з серцево-судинною системою, а саме серцебиття (у 18,8 раза частіше), підвищення артеріального тиску (в 1,4 раза частіше), що може бути зумовлено більшою кількістю пацієнтів старшого віку з доброякісними утвореннями. У хворих з ІН, які були верифіковані як злоякісні утворення, переважали загальна слабкість (в 1,4 раза частіше), біль у животі (у 6,6 раза частіше), зниження маси тіла (у 3,2 раза частіше), тобто скарги, що можуть бути пов’язані з інвазивністю та пухлинною інтоксикацією. У 59,1 % скарги мали неспецифічний характер та в більшості випадків були пов’язані з супутньою кардіальною (27,8 %) та неврологічною (23,8 %) патологією. Отже, проведений аналіз скарг наших хворих не дозволив виявити вірогідно специфічні скарги, що притаманні більшості ІН та які могли бути їх патогномонічною ознакою.
При аналізі давності скарг хворих чітких закономірностей не виявлено, що пояснюється випадковим та абсолютно не пов’язаним із наявністю скарг виявленням пухлин НЗ у даних хворих. Хоча в більшості хворих з гормонально-неактивними АКА (140 осіб, 61,1 %) клінічна симптоматика була відсутня або ж давність неспецифічних скарг перевищувала 5 років. На противагу цьому давність скарг, що мали також неспецифічний характер, у пацієнтів з ІН, які були верифіковані як злоякісні, у більшості випадків (10 осіб, 76,9 %) не перевищувала 5 років, що може бути пов’язано з інвазивністю або ж пухлинною інтоксикацією.
Серед обстежених нами хворих з ІН питома вага гормонально-неактивних аденом становила 68,8 % (n = 229). Майже половина хворих (96 осіб, 41,9 %) із гормонально-неактивними аденомами не мали скарг; 74 (32,3 %) пацієнти скаржилися на загальну слабкість та втомлюваність, 43 (18,8 %) — на серцебиття, 20 (8,7 %) — на головний біль, 16 (7,0 %) — на біль у животі, 15 (6,6 %) — на біль у поперековій ділянці та порушення серцевого ритму. У 74 (32,3 %) пацієнтів із гормонально-неактивними АКА анамнез був обтяжений гіпертонічною хворобою, у 10 (4,4 %) — онкологічними хворобами, у 28 (12,2 %) були порушення вуглеводного обміну. При аналізі лабораторних даних хворих з ІН, які були верифіковані як гормонально-неактивні аденоми, підтверджено відсутність гормональної активності даних утворень.
Крім гормонально-неактивних пухлин, у 19 осіб (5,7 %) виявлено АКА, асоційовані з синдромом Іценка — Кушинга (кортикостероми). Серед даних хворих у 36,8 % захворювання мало безсимптомний перебіг. У більшості випадків скарги пацієнтів були неспецифічні та їх давність перевищувала 5 років (26,3 %). Серед скарг переважали підвищення артеріального тиску (31,6 %), загальна слабкість та втомлюваність (26,3 %), збільшення маси тіла (21,1 %), головний біль (15,8 %). Тільки у двох випадках (10,5 %) пацієнти мали скарги, характерні для стану гіперкортицизму (зміна зовнішнього вигляду, порушення менструального циклу, болі в кістках та м’язова слабкість). Третина пацієнтів (31,6 %) в анамнезі мали гіпертонічну хворобу. Порушення вуглеводного обміну в пацієнтів даної групи виявлено у 18 пацієнтів (94,7 %). Незважаючи на відсутність специфічної клінічної симптоматики, у хворих цієї групи була виявлена надмірна секреція глюкокортикоїдів.
Скринінговими тестами для діагностики синдрому Кушинга, за даними керівництва The Diagnosis of Cushing’s Syndrome: An Endocrine Society Clinical Practice Guideline, 2008, вважаються кортизол слини, одноміліграмовий супресивний тест із дексаметазоном та визначення кортизолу в добовій сечі. Серед хворих із кортикостеромами у 15 осіб (79 %) виявлено підвищену добову екскрецію кортизолу з сечею, середній рівень якої становив 623,2 ± 48,0 мкг/24 год. Гіперкортизолемія, середній рівень якої відповідав 29,6 ± 2,7 мкг/дл, була характерна для 17 (89,5 %) пацієнтів. Рівень АКТГ у хворих даної групи в більшості випадків (14 осіб, 73,7 %) не виходив за референтні межі, що може свідчити про АКТГ-незалежну гіперпродукцію кортизолу та знаходить підтвердження в літературі [7–10].
Серед обстежених нами хворих альдостероми виявлено у 3,0 % (n = 10). Резистентна АГ спостерігалася у 100 % пацієнтів протягом від 6 до 17 років, що свідчить про відсутність своєчасного проведення диференційної діагностики гіпертонічної хвороби. Нейром’язовий синдром виявлено лише в одного пацієнта.
Як скринінговий тест для діагностики первинного гіперальдостеронізму розраховувалося АРС [4, 10, 11]. За рекомендаціями деяких дослідників для підтвердження гіперальдостеронізму обов’язковим є отримання не тільки підвищення рівня АРС, але й альдостерону > 15 нг/дл (416 пмоль/л) [4]. Наявність гіперальдостеронізму у наших хворих була підтверджена високим рівнем альдостерону та АРС. В одному випадку нормальний рівень альдостерону та низький рівень реніну поєднувався з високим АРС, що було пов’язано з прийомом препарату з групи b-адреноблокаторів. При визначенні рівня калію у 8 (80 %) хворих з альдостеромами отримано результати в межах референтних значень.
У нашому дослідженні серед ІН найрідше траплялися андростероми, які були виявлені у п’яти пацієнток (1,5 %). Лише одна пацієнтка мала специфічні для андростероми скарги, а саме на надмірний ріст волосся на тілі та порушення менструального циклу. При аналізі лабораторних показників у хворих з адренокортикальними пухлинами з вірильним синдромом виявлено підвищення рівня ДГЕА-С у трьох випадках, у двох — рівень ДГЕА-С перебував на верхній межі норми. Разом із цим показники АКТГ знаходилися на нижній межі референтних значень, становлячи в середньому 9,6 ± 0,6 мкг/мл. Рівень вільного тестостерону не перевищував лабораторну норму.
Незважаючи на те, що аналіз нашого матеріалу підтвердив виражений поліморфізм ІН, одне з головних завдань при виявленні ІН — діагностувати АКР. У наших хворих з ІН питома вага злоякісних пухлин становила 3,9 % (13 пацієнтів). АКР — 3,0 % (10 пацієнтів) серед ІН, метастази в надниркові залози — 0,9 % (3 пацієнти). За нашими даними, основними скаргами пацієнтів при злоякісних пухлинах надниркових залоз були біль у животі, загальна слабкість та втомлюваність, що спостерігалися в шести (46,2 %) пацієнтів. Троє (23,1 %) пацієнтів скаржилися на біль, неприємні відчуття в поперековій ділянці та АГ, яка мала постійний характер у двох пацієнтів протягом 2–3 років. У двох пацієнтів (15,4 %) відзначалося несуттєве зниження маси тіла. Серед даної групи не пред’являли скарг двоє (15,4 %) хворих. Давність скарг у 10 (76,9 %) пацієнтів цієї групи не перевищувала 5 років. Обтяжений онкологічний анамнез спостерігався у 38,5 % хворих даної групи (3 хворих із метастазами та 2 — з АКР). Хворі з АКР в анамнезі отримували лікування з приводу раку товстого кишечника та шлунка, хворі з метастазами в надниркові залози — з приводу карцином легень та нирок. За нашими даними лабораторні показники у хворих зі злоякісними ІН не виходили за межі референтних значень.
Одним із чинників, який може вказувати на злоякісний характер пухлини, є давність скарг на момент виявлення ІН. Серед обстежених нами хворих у 10 (76,9 %) хворих з ІН, які були верифіковані як злоякісні, давність скарг не перевищувала п’яти років. При цьому кількість хворих з ІН, які були верифіковані як аденоми та мали скарги протягом останніх п’яти років, була вдвічі меншою, склавши 38,0 % (p < 0,05). Двоє (15,4 %) пацієнтів зі злоякісними новоутвореннями не мали жодних скарг, що в 2,7 раза менше порівняно з ІН, які в подальшому були верифіковані як гормонально-неактивні аденоми. Більш рання поява скарг на загальну слабкість, біль у животі, зниження маси тіла в пацієнтів зі злоякісними новоутвореннями свідчить про інвазивність та пухлинну інтоксикацію. З іншого боку, значна кількість безсимптомних злоякісних пухлин призводить до пролонгації періоду з моменту появи пухлини НЗ до моменту випадкового виявлення.
Серед 333 обстежених хворих з ІН у 39 осіб (11,7 %) були визначені пухлини мозкової речовини надниркових залоз, у 7 (18 %) з яких — феохромобластоми (ФХБ). Гіпертонічну хворобу з АГ середнього ступеня тяжкості без виражених кризів та тривалістю від шести місяців до 20 років в анамнезі мали 25 (64,1 %) хворих із пухлинами мозкового шару. Порушення вуглеводного обміну в даній групі було виявлено у 25 (64,1 %) пацієнтів. У 9 (23,1 %) пацієнтів були скарги на головний біль, у 7 (18 %) — на біль та неприємні відчуття в поперековій ділянці, загальну слабкість та втомлюваність. Вірогідної різниці при порівнянні частоти скарг серед хворих з феохромоцитомами (ФХЦ) та ФХБ не виявлено.
Як лабораторне підтвердження катехоламінової гіперпродукції згідно з рекомендаціями Першого Інтернаціонального симпозіуму 2005 року необхідне визначення вмісту метанефринів та норметанефринів сечі або плазми крові. За результатами лабораторних досліджень 35 (89,7 %) хворих мали підвищений рівень метанефринів у добовій сечі, який у середньому становив 969,8 ± 334,5 мкг/24 год. Середній рівень метанефринів у добовій сечі хворих із ФХБ, підвищення якого виявлено у п’яти (71,4 %) пацієнтів, в 1,5 раза вищий, ніж у хворих із ФХЦ, — 1475,8 ± 576,8 мкг/24 год. Підвищення рівня метанефринів більше ніж удвічі виявлено у 21 (53,9 %) пацієнта з пухлинами мозкової речовини НЗ; більше ніж утричі — у 12 (30,8 %). Підвищення рівня метанефринів було більшим у хворих із ФХБ, ніж із ФХЦ, — відповідно у 6,4 та 4,1 раза (p > 0,05).
Підвищення рівня метанефринів в добовій сечі було виявлено у восьми (3,5 %) пацієнтів з пухлинами нехромафінного генезу, які були верифіковані як гормонально-неактивні аденоми. Середній рівень метанефринів у добовій сечі хворих із пухлинами нехромафінного генезу становив 377,3 ± 27 мкг/24 год, що в 3,3 раза нижче порівняно з даним показником у хворих з ІН, які в подальшому були верифіковані як пухлини мозкової речовини надниркових залоз. При повторному обстеженні хворих із гормонально-неактивними аденомами з підвищеним рівнем метанефринів у добовій сечі рівень метаболітів катехоламінів перебував у межах референтних значень. Отже, можливе хибнопозитивне підвищення рівня метанефринів у добовій сечі в пацієнтів за відсутності катехоламінпродукуючої пухлини. Тому при виявленні ІН, що супроводжується незначним (до 5–10 %) підвищенням рівня метанефринів, ми вважаємо за необхідне повторне визначення вмісту метаболітів у добовій сечі та використання допоміжних критеріїв діагностики, а саме томографічних ознак утворення.
Серед інших пухлин надниркових залоз було виявлено 12 (3,6 %) кіст, 3 гематоми, 1 гемангіому, 1 ліпому, 1 фіброму. Частина кіст (у шести осіб, 50,0 %) та всі інші рідкісні утворення були безсимптомними. Половина пацієнтів із кістами мали скарги, що не відрізнялися різноманіттям. У двох осіб в анамнезі була гіпертонічна хвороба протягом двох років, чотирьох пацієнтів турбували неприємні відчуття в поперековій ділянці.
Оскільки виявлення ІН відбувається завдяки методам топічної діагностики, дані дослідження є одними з найбільш важливих. Серед наших хворих 182 (54,65 %) інциденталоми надниркових залоз уперше було діагностовано при УЗД, виконаному з приводу жовчно– та сечокам’яної хвороби, гепатиту, панкреатиту та з профілактичною метою. Майже половина інциденталом (45,35 %, n = 151) були виявлені при проведенні КТ, що виконувалося з приводу патології шлунково-кишкового тракту та сечовидільної системи. У хворих з ІН, виявленими при УЗД, діагноз в обов’язковому порядку підлягав подальшій верифікації за допомогою КТ-дослідження, що розглядається як основний метод топічної діагностики.
При аналізі результатів УЗД надниркових залоз були використані такі диференційно-діагностичні ультразвукові критерії злоякісності, як розмір ІН більше 6 см, неправильна форма, нечіткі контури, наявність інвазії, лімфаденопатії, регіонарних (РМ) та/або віддалених метастазів (ВМ). Із 13 хворих з ІН, які в подальшому були верифіковані як злоякісні пухлини, в 11 (84,6 ± 10,0 %) було можливо за допомогою даного методу діагностувати злоякісне ураження. Серед хворих на ІН, які в подальшому були верифіковані як аденоми, подібні «критерії злоякісності» були виявлені тільки у 16 (13,3 ± 3,1 %) зі 120 хворих (хибнопозитивні результати). Та незважаючи на це, частка хибнопозитивних результатів при доброякісних утвореннях є невеликою, а тяжкість патології у випадку злоякісності виправдовує ставлення до ІН із вищеназваними ознаками як до злоякісних.
Ультразвукові характеристики пухлин мозкового шару НЗ не мали суттєвих відмінностей порівняно з аналогічними показниками аденом.
Серед наших хворих за допомогою УЗД виявлено кісти надниркових залоз у восьми осіб. Ультразвукова картина кіст надниркових залоз не відрізнялася від ультразвукової картини, характерної для кіст іншої локалізації, а саме анехогенність ІН у поєднанні з ехопозитивною, чітко окресленою капсулою. У всіх хворих розміри кіст не перевищували 6 см. Це утворення правильної форми, в більшості випадків (90,9 %) з чіткими контурами. В одного хворого виявлена неоднорідність структури за рахунок наявності кальцинатів. Середній діаметр кіст за даними УЗД був 4,1 ± 0,4 см.
У 22 (14,6 %) хворих з ІН, виявленими при КТ, пухлини за допомогою УЗД візуалізувати не вдалося, з них 20 (13,3 %) хворих з аденомами та 2 (1,3 %) хворих із пухлинами мозкової речовини. Максимальний діаметр утворень, не візуалізованих при УЗД, не перевищував 4 см; виняток становила одна аденома діаметром 5,2 см.
Нами проаналізовані результати 213 КТ, із них 143 — результати хворих з ІН, які в подальшому були верифіковані як аденоми, 13 — з ІН, які в подальшому були верифіковані як злоякісні пухлини, 39 — з ІН, які в подальшому були верифіковані як пухлини мозкової речовини, 12 — верифікованих як кісти, 3 — верифікованих як гематоми, 1 — ліпома, 1 — фіброміома, 1 — гемангіома. При аналізі результатів КТ надниркових залоз були використані такі диференційно-діагностичні критерії, як розмір ІН, форма, контури, нативна та контрастна щільність, градієнт концентрації, наявність інвазії, лімфаденопатії, РМ та/або ВМ.
При аналізі результатів КТ одним з основних показників є максимальний розмір утворення. При розмірах ІН < 4 см доброякісні утворення траплялися в 3,7 раза частіше, ніж злоякісні (p < 0,05). На противагу цьому при розмірах ІН > 6 см злоякісні утворення траплялися в 6,6 раза частіше, ніж доброякісні (p < 0,05). Отже, розмір ІН за даними КТ може в ряді випадків слугувати критерієм злоякісності процесу. При розмірі ІН < 4 см найбільш вірогідно, що утворення має доброякісний характер. При розмірі ІН > 6 см вірогідність злоякісного процесу є високою. Розмір ІН 4–6 см не може вказувати на потенційну природу ІН, оскільки в даному діапазоні частота виявлення доброякісних та злоякісних утворень не має великих розбіжностей і в даних випадках диференціацію необхідно проводити за іншими критеріями, використовуючи інші томографічні характеристики пухлини. Характеристика контурів та форми ІН у ряді випадків може слугувати критерієм злоякісності пухлини НЗ. При наявності нечітких контурів та неправильної форми до ІН необхідно ставитися як до потенційно злоякісної. Якщо ж ІН має чіткі контури та правильну форму, то в даному випадку дані томографічні характеристики не можуть бути диференційно-діагностичними критеріями доброякісності, оскільки як більшість доброякісних, так і значна частка злоякісних утворень мають подібні томографічні ознаки.
Незалежно від нозологічної приналежності, утворення мали як однорідну, так і неоднорідну структуру. Тому дана томографічна характеристика не може слугувати надійним діагностичним критерієм злоякісного процесу.
Важливою томографічною характеристикою ІН є щільність, яка визначається за одиницями Hounsefield. За нативною щільністю чітко простежується тенденція до розділу ІН. Середня нативна щільність злоякісних утворень вірогідно вища, ніж доброякісних: 31,7 ± 3,6 HU та 9,6 ± 5,0 HU відповідно (p < 0,05). У хворих з ІН, які в подальшому були верифіковані як пухлини мозкового шару НЗ, середня нативна щільність становила 41,9 ± 9,3 HU, тобто суттєво не відрізнялася від нативної щільності злоякісних пухлин (p > 0,05). При порівнянні середньої нативної щільності серед ІН, які були в подальшому верифіковані як злоякісні утворення та аденоми, нативна щільність була вища у злоякісних пухлин незалежно від розміру утворень. Так, при розмірах ІН < 4 см середня нативна щільність злоякісних пухлин була вища в 3,5 раза, при розмірах 4–6 см — в 2,6 раза, при розмірах ІН > 6 см — у 4 рази. Отже, нативна щільність в ряді випадків може слугувати критерієм злоякісності процесу: серед ІН зі щільністю < 10 HU зустрічалися виключно аденоми (p < 0,05), тож відповідно при виявленні ІН з нативною щільністю < 10 HU до неї потрібно ставитись як до потенційно доброякісної. Злоякісні утворення та феохромоцитоми не мали нативної щільності < 10 HU. Отже, якщо ІН має нативну щільність < 10 HU та рівень метанефринів у межах референтних значень, до неї можна ставитись як до потенційно доброякісної та застосовувати відповідну лікувальну тактику.
Нативна щільність ≥ 10 HU траплялася з високою частотою у хворих з пухлинами різного характеру (p < 0,05). А отже, томографічний показник нативної щільності як критерій диференційної діагностики може бути використаний для невеликої кількості ІН.
Більш інформативною характеристикою ІН є здатність накопичувати контрастну речовину, яка, певно, свідчить про активну проліферативну та метаболічну активність ІН, що характерно для малігнізованих пухлин та новоутворень мозкової речовини. Середня контрастна щільність ІН, які верифіковані як злоякісні, була вірогідно більша, ніж доброякісних: 65,9 ± 5,5 HU та 11,9 ± 5,7 HU відповідно (p < 0,05), що підтверджує більшу проліферативну та метаболічну активність злоякісних пухлин, ніж доброякісних. Серед 13 пацієнтів з ІН, які були верифіковані як злоякісні утворення, не було хворих, у яких пухлина не накопичувала б контраст та не підвищувала б свою КТ-щільність, у двох (15,4 %) хворих КТ-щільність підвищувалася менше ніж на 20 HU та в 11 (84,6 ± 10,0 %) — ≥ 20 HU. Серед 109 хворих з ІН, які були верифіковані як аденоми та у яких визначалася контрастна щільність, у 54 (49,54 ± 4,80 %) — щільність пухлини не змінилася після внутрішньовенного посилення, у 48 (44,04 ± 4,80 %) — щільність підвищувалась < 20 HU та у 7 (6,42 ± 2,50 %) — на ≥ 20 HU. Із семи ІН, градієнт щільності яких становив 20 HU та вище, 5 пухлин мали розміри, що перевищували 6 см, а 2 новоутворення супроводжувалися гіперкортицизмом. Серед 28 хворих із пухлинами мозкового шару НЗ, у яких визначалася контрастна щільність, не було хворих, у яких щільність пухлини не змінилася після внутрішньовенного посилення, в одного (3,6 %) — щільність підвищилася менше ніж на 20 HU та у 27 (96,4 ± 3,5 %) — ≥ 20 HU. Таким чином, після внутрішньовенного посилення при градієнті щільності ≥ 20 HU злоякісні утворення зустрічаються у 13,2 раза частіше (p < 0,05), ніж аденоми, та майже з однаковою частотою порівняно з пухлинами мозкового шару надниркових залоз. У групі з градієнтом щільності < 20 HU аденоми зустрічалися в 6 разів частіше, ніж злоякісні утворення (p < 0,05). Тільки аденоми (p < 0,05) траплялися при градієнті щільності 0 HU та тільки злоякісні утворення та пухлини мозкового шару — при градієнті щільності > 50 HU (p < 0,05).
Отже, якщо ІН не накопичує контраст, то її можна вважати потенційно доброякісною. Використання градієнта щільності ІН при показниках < 20 HU має обмежене диференційно-діагностичне значення, оскільки в даному сегменті трапляються ІН із різним потенціалом і використовувати його як диференційно-діагностичний критерій можливо в поєднанні з іншими ознаками. Ми проаналізували частоту самостійного або поєднаного виявлення двох ознак в ІН розмірами < 6 см та нативною щільністю ≥ 10 HU, таких як контрастна щільність > 50 HU та градієнт щільності ≥ 20 HU, серед ІН, верифікованих у подальшому як злоякісні та доброякісні утворення. Всі виявлені злоякісні утворення (100 %) мали контрастну щільність > 50 HU та/або градієнт щільності ≥ 20 HU. Серед аденом ≤ 6 см частота такого поєднання склала 7,5 ± 4,2 %. Це були двоє хворих із субклінічним гіперкортицизмом та один хворий із гормонально-неактивною АКА. Таким чином, контрастна щільність > 50 HU та/або градієнт щільності ≥ 20 HU підтверджують проліферативну та метаболічну активність пухлини, а отже, до цієї ІН необхідно ставитись як до утворення, що має високий злоякісний потенціал.
Градієнт щільності > 50 HU можна використовувати як диференційно-діагностичний критерій, по–перше, для виключення аденоми. По-друге, з огляду на те, що показник градієнта щільності > 50 HU був характерний для злоякісних утворень та для пухлин мозкового шару НЗ, його частота становила 23,1 ± 11,7 % та 32,0 ± 8,8 % відповідно, необхідно провести диференціацію не тільки з метою виявлення злоякісності ІН, але і з метою диференційної діагностики адренокортикальної карциноми та «німої» ФХЦ, використовуючи інші критерії, а саме визначити катехоламіни чи їх метаболіти в сечі або плазмі крові. Необхідність даної диференційної діагностики обґрунтована різною передопераційною підготовкою та інтраопераційним веденням хворих з АКР та ФХЦ. Найбільшу чутливість та специфічність у диференційній діагностиці АКР та ФХЦ із контрастною щільністю > 50 HU та/або градієнтом щільності ≥ 20 HU мало визначення метанефринів. У хворих з ІН, які в подальшому були верифіковані як злоякісні, рівень метанефринів добової сечі не виходив за межі норми, становлячи в середньому 199,5 ± 3,8 мкг/24 год. Тому при виявленні ІН з градієнтом щільності > 50 HU визначення рівня метанефринів має абсолютну (100 %) чутливість та специфічність у диференційній діагностиці АКР та ФХЦ та дозволяє вибрати правильну тактику перед– та інтраопераційної підготовки пацієнта.
Підвищення рівня метанефринів при первинному обстеженні було виявлено у хворих з пухлинами нехромафінного генезу, а саме у восьми (3,5 %) пацієнтів із гормонально-неактивними аденомами, середнє значення нативної щільності яких становило 3,9 ± 3,8 HU, контрастної щільності — 13,5 ± 6,3 HU та градієнта щільності — 9,6 ± 3,9 HU. При повторному обстеженні рівень метаболітів перебував у межах референтних значень. Таким чином, при виявленні ІН солідної структури, томографічна щільність якої нижча за 26 HU, можливе хибнопозитивне підвищення рівня метанефринів в добовій сечі.
Іншими важливими томографічними характеристиками ІН є інвазія пухлини та лімфаденопатія. Томографічні ознаки інвазії в прилеглі структури визначалися у семи (53,9 ± 13,8 %) із 13 хворих з ІН, які в подальшому були верифіковані як злоякісні, що вірогідно вище, ніж при УЗД (p < 0,001). У хворих з ІН, які були верифіковані як аденоми, томографічні ознаки інвазії не визначалися. В одного хворого з ФХЦ було виявлено ознаки інвазії, у чотирьох (10,3 ± 4,9 %) — збільшені лімфатичні вузли заочеревинного простору (лімфаденопатія). Лімфаденопатія визначалась в одного хворого з ІН, яка була верифікована як злоякісна, в одного хворого з ІН, яка була верифікована як аденома, та у чотирьох — з пухлинами мозкового шару. Лімфаденопатія при злоякісному утворенні характеризувалася множинними збільшеними до 0,9 см паранефральними лімфовузлами та до 4 см при ФХБ, у яких після видалення при гістологічному дослідженні визначалися РМ. Лімфаденопатія у хворих з ІН, які в подальшому були верифіковані як аденома та ФХЦ, проявлялась збільшенням паранефральних лімфовузлів до 2 см, що було наслідком загострення хронічних запальних процесів у заочеревинному просторі, а у двох випадках — хибнонегативним результатом. Характер лімфаденопатії не завжди збігався зі злоякісним потенціалом ІН, що можливо пов’язано з достатньо раннім виявленням пухлини надниркової залози.
Серед 333 хворих з ІН у 22 пацієнтів обтяжений онкологічний анамнез (карциноми нирок, легень, кишечника, шлунка, яєчника). Таким чином, у даних хворих автоматично виникла підозра щодо метастазів раку надниркової локалізації. Проаналізовано результати КТ 19 хворих. Діагноз «метастази в надниркову залозу» підтверджено у трьох хворих, з яких в одного в анамнезі карцинома легень, у двох інших — карцинома нирки. Середній розмір даних утворень становив 4,5 ± 0,4 см, що не перевищує середній розмір первинних злоякісних утворень надниркової залози (11,4 ± 2,2 см), але суттєво не відрізняється від середнього розміру аденом. У двох хворих даної групи за результатами КТ пухлини мали розміри < 4 см, в одного — 4–6 см. Пухлини < 4 см мали правильну форму та чіткі контури. Нативна щільність метастазів перебувала в межах від 20 до 30 HU, становлячи в середньому — 26,7 ± 1,2 HU. Щільність після введення контрасту та градієнт щільності суттєво не відрізнялися від відповідних показників первинних злоякісних пухлин надниркових залоз, становлячи 68,7 ± 6,0 HU та 65,1 ± 5,7 HU відповідно. Таким чином, при виявленні ІН у пацієнта з обтяженим онкологічним анамнезом необхідно в першу чергу враховувати показники томографічної щільності після контрастування та градієнт щільності.
Кісти було діагностовано у 12 (3,6 %) хворих. Характерною ознакою для солітарної кісти надниркової залози є наявність чіткої капсули, що може бути кальцинованою. У частини хворих із кістами (33,3 %) виявлена неоднорідність структури за рахунок наявності кальцинатів. Середній розмір кіст був 4,7 ± 0,5 см. Кісти мали низьку щільність 9,2 ± 3,5 HU, яка майже не збільшувалась при контрастуванні — середній градієнт щільності був 0,6 ± 0,4 HU.
Висновки
1. Специфічні скарги, за допомогою яких можна було б запідозрити утворення надниркових залоз та які могли бути їх патогномонічною ознакою, відсутні. Скарги хворих характеризувалися значною варіабельністю та в більшості випадків мали неспецифічний характер. Чітких закономірностей при аналізі давності скарг не виявлено, що пояснюється випадковим виявленням пухлин надниркових залоз у даних хворих.
2. З урахуванням неінвазивності та доступності, УЗД має переваги як скринінговий метод і в більшості випадків має обмежені можливості при проведенні диференційної діагностики ІН. Виняток становлять кісти НЗ, що при проведенні УЗД мають вигляд анехогенних утворень із чітко окресленою ехопозитивною капсулою.
3. Більш цінним методом топічної діагностики ІН є КТ, що дозволяє зробити висновок про характер пухлини та використати характеристики утворення з метою диференційної діагностики доброякісних і злоякісних пухлин.
4. Контрастна щільність > 50 HU та/або градієнт щільності ≥ 20 HU підтверджують проліферативну та метаболічну активність пухлини. Контрастна щільність ≤ 50 HU та градієнті щільності < 20 HU при наявності нечітких контурів, неправильної форми ІН, чітких ознаках інвазії та лімфаденопатії також свідчать про потенційну злоякісність ІН.
5. Диференційно–діагностичні КТ критерії злоякісності, такі як розмір ІН понад 6 см, неправильна форма, нечіткі контури, контрастна щільність > 50 HU та/або градієнт щільності ≥ 20 HU, наявність інвазії, лімфаденопатії, РМ та/або ВМ, дають можливість діагностувати злоякісне ураження. Чутливість методу КТ у диференційній діагностиці ІН при використанні вищевказаних критеріїв становить 100 %, специфічність — 84,6 ± 3,0 %, точність — 85,9 ± 2,8 %.
6. При виявленні ІН солідної структури, томографічна щільність якої нижча за 26 HU, можливе хибнопозитивне підвищення рівня метанефринів у добовій сечі.
1. Adrenal Incidentalomas or Adrenalomas: The NIH state-of-the-science conference statement // — Hormones. — 2003. — № 2 (1). — Р. 9–11.
2. Pacak K. Феохромоцитома: клинические рекомендации I международного симпозиума (ISP) / K. Pacak, G. Eisenhofer, H. Ahlman [et al.] // Эндокринная хирургия. — 2007. — № 1 (1). — С. 3–11.
3. Nieman L.K. The Diagnosis of Cushing’s Syndrome: аn endocrine society clinical practice guideline / L.K. Nieman, B.M. Biller, J.W. Findling [et al.] // J. Clin. Endocrinol. Metabol. — 2008. — Vol. 93, № 5. — Р. 1526–1540.
4. Funder J.W. Первичный гиперальдостеронизм. Клинические рекомендации / J.W. Funder, R.M. Carey, С. Fardella [et al.], коспонсоры разработки рекомендаций: Международное эндокринологическое общество, Европейское эндокринологическое общество [и др.] // Международный эндокринологический журнал. — 2009. — № 4 (22). — С. 99–111.
5. American association of clinical endocrinologists and American association of endocrine surgeons medical guidelines for the management of adrenal incidentaloma / M.A. Zeiger [et al.] // Endocrine Practice. — 2009. — Vol. 15. — Р. 1–20.
6. Большова Е.В. Клиника, диагностика и лечение болезни и синдрома Иценко — Кушинга / Е.В. Большова // Здоровье Украины. — 2007. — № 10/1. — С. 80–81.
7. Бельцевич Д.Г. Инсиденталома надпочечников / Д.Г. Бельцевич, Н.С. Кузнецов, Т.В. Солдатова [и др.] // Эндокринная хирургия. — 2009. — № 1 (4). — С. 19–23.
8. Бельцевич Д.Г. Феохромоцитома / Д.Г. Бельцевич, Н.С. Кузнецов, М.А. Лысенко [и др.] // Consilium medicum. — 2007. — Т. 9, № 9. — С. 88–94.
9. Феохромоцитома / [Дедов И.И., Бельцевич Д.Г., Кузнецов Н.С., Мельниченко Г.А.]. — М.: Практическая медицина, 2005. — 216 с.
10. Левитская З.И. Первичный идиопатический гиперальдостеронизм в клинической перспективе / З.И. Левитская, А.А. Вабищевич, Е.В. Перистая // Лечащий врач. — 2007. — № 3. — С. 76–79.
11. Подзолков В.И. Первичный гиперальдостеронизм: диагностика и лечение / В.И. Подзолков, А.В. Родионов // Артериальная гипертензия. — 2004. — Т. 10, № 2. — С. 109–114.

/68/68.jpg)