Международный эндокринологический журнал 4 (60) 2014
Вернуться к номеру
Роль апеліну у розвитку глюкометаболічних порушень (огляд літератури та власних досліджень)
Авторы: Демиденко Г.В. - Харківський національний медичний університет МОЗ України
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Проаналізована фізіологічна та патогенетична роль адипокіну апеліну, ендогенного ліганду апелінових (APJ або APLNR) рецепторів, у розвитку глюкометаболічних порушень. Установлені кореляційні залежності апеліну від компонентів вуглеводного обміну підтверджують факт впливу на глюкометаболічні прояви. Неоднозначні дані щодо рівня апеліну при синдромі інсулінорезистентності, предіабеті, цукровому діабеті 2-го типу, артеріальній гіпертензії потребують подальшого ретельного вивчення. Виявлено тісну асоціацію апеліну з розвитком цукрового діабету 2-го типу та предикцією кардіоваскулярних подій в осіб із метаболічним синдромом.
Проанализирована физиологическая и патогенетическая роль адипокина апелина, эндогенного лиганда апелиновых (APJ или APLNR) рецепторов, в развитии глюкометаболических нарушений. Установленные корреляционные зависимости апелина от компонентов углеводного обмена подтверждают факт влияния на глюкометаболические проявления. Неоднозначные данные об уровне апелина при синдроме инсулинорезистентности, предиабете, сахарном диабете 2-го типа, артериальной гипертензии нуждаются в дальнейшем детальном изучении. Выявлена тесная ассоциация апелина с развитием сахарного диабета 2-го типа и предикцией кардиоваскулярных событий у лиц с метаболическим синдромом.
The physiological and pathogenetic role of adipokine apelin, endogenous ligand of apelin (APJ or APLNR) receptors in the development of glucose metabolism disorders has been analyzed. Established correlations of apelin with components of carbohydrate metabolism confirm the effect on glucose metabolism manifestations. Ambiguous data about apelin level at insulin resistance syndrome, prediabetes, diabetes mellitus type 2, hypertension require further detailed study. The close association of apelin with development of diabetes mellitus type 2 and prediction of cardiovascular events in patients with metabolic syndrome has been found.
ожиріння, адипокіни, апелін, кардіометаболічний ризик.
ожирение, адипокины, апелин, кардиометаболический риск.
obesity, adipokines, apelin, cardiometabolic risk.
Статья опубликована на с. 103-111
Жирова тканина є не тільки пасивним акумулятором жирних кислот, але й ендокринним органом, що продукує субстанції з локальними (автокринними) та системними (ендокринними) ефектами [11, 28]. Загалом клітини підшкірної та вісцеральної жирової тканини експресують понад 50 гетерогенних за своєю структурою та функціями різних адипоцитокінів, що беруть безпосередню участь в забезпеченні гомеостазу, метаболізму глюкози та ліпідів, а також впливають на інтенсивність процесів запалення, згортання крові, ангіогенезу, пухлинного росту, диференціювання тканин, активності імунітету [7, 45].
Відомо два типи адипоцитокінів: специфічні для жирової тканини, біологічно активні речовини, які є справжніми адипоцитокінами, та інші, що у надмірній кількості секретуються жировою тканиною, але не є специфічними для жирової тканини (рис. 1, табл. 1).
Частина із наведених речовин продукується більшою мірою адипоцитами, а інша частина — «нежировим» компонентом адипозного органа [11, 27].
/104/104_2.jpg)
Продукція лептину адипоцитами значно більша за таку ж для «нежирового матриксу», секреція адипонектину майже однакова, а продукція фактора некрозу пухлини (ФНП) та інтерлейкіну (ІЛ-6) у жирових клітинах суттєво (до 5–10 разів) слабша, ніж у нежирових.
Увагу науковців привернув нещодавно відкритий адипокін апелін та G-білковий рецептор апеліну (APLNR), що був відкритий у 1993 р. O’Dowd та колегами в процесі пошуку рецепторів до вазопресину. APLNR, спочатку названий APJ, є 377-м амінокислотним 7-м трансмембранним доменом G-протеїнового рецептора, ген якого локалізується в 11-й хромосомі. APLNR людини гомологічний із таким же у щурів на 74 % [11].
У 1998 р. апелін був ізольований Tatemoto та колегами [28]. Ген апеліну кодує утворення препропротеїну, що містить 77 амінокислот та сигнальну частину в N-термінальній частині молекули. Активна форма апеліну отримана із C-термінального 77-амінокислотного препроапеліну. Після транслокації в саркоплазматичний ретикулум та від’єднання сигнального протеїну із пропротеїну, що містить 55 амінокислотних залишків (проапелін-55), утворюються декілька активних ферментів: aпелін-36 (пептид, що містить 36 амінокислотних залишків, сформований із послідовності 42–77), aпелін-17 (пептид, що містить 17 амінокислотних залишків, сформований із послідовності 61–77) та апелін-13 (пептид, що містить 13 амінокислотних залишків, сформований із послідовності 65–77) [28, 29]. Фрагменти із 36, 17, 13 амінокислотних залишків, що містять N-термінальний піроглютаматний апелін-13 (Pyr 1 — апелін-13), мають біологічну активність in vivo, також синтетично отриманий фрагмент із 12 амінокислот із C-термінальної частини може також активувати рецептор [25].
Деякі автори локалізували транскрипцію APJ у паравентрикулярному та супраоптичних ядрах гіпоталамуса, передній і проміжній частинах гіпофіза та шишкоподібній залозі [44, 47]. Інші дослідники [37] продемонстрували експресію апеліну в цих ядрах гіпоталамуса, в тому числі колокалізацію у вазопресинергічних нейронах супраоптичного ядра. Функціональні дослідження показали ефекти інтрацеребровентрикулярних ін’єкцій апеліну-13 на активність вазопресину у мишей з вільним доступом до води, що наводить на думку про пряму пригнічувальну дію APJ на вазопресин через вазопресинергічні нейрони. Не виключено, що активна форма апеліну має здатність до гіпоталамічної регуляції харчової поведінки та водної потреби, що реалізується більшою мірою за рахунок зниження вивільнення вазопресину [35]. На моделі мишей без APJ показано збільшення вазопресорної відповіді на ангіотензин II, припускається контррегулююча роль апеліну щодо ренін-ангіотензинової системи. Однак інша група дослідників повідомила, що апелін призводить до скорочення ізольованих вен [22, 36], що свідчить про недостатнє вивчення дії апеліну на судинний тонус. Наведені твердження мають суперечливий характер та потребують подальшого підтвердження [6, 7, 10]. Тим не менше екзогенний апелін демонструє помірний діуретичний ефект, що пов’язаний із зниженням рівня вазопресину та підвищенням швидкості клубочкової фільтрації [10]. Більше того, наведені докази існування реципрокної асоціації між циркулюючим рівнем апеліну та вазопресину при осмотичній стимуляції в експериментальних умовах [9, 11]. Тим не менше це питання потребує подальшого вивчення.
Boucher і співавт. продемонстрували, що апелін секретується в адипоцитах мишей та людей. Рівень експресії апеліну в жировій тканині можна зіставити з рівнем активності в клітинах серця та нирок. Дещо нижча експресія встановлена у м’язових клітинах і в бурій жировій тканині. Активності апеліну не зареєстровано в клітинах печінки. Апелін виявлено у недиференційованих преадипоцитах мишей лінії 3T3F442A, рівень адипокіну зростав протягом процесу диференціації майже в 4 рази [7].
Встановлено, що апелін є ендогенним лігандом апелінових (APJ або APLNR) рецепторів, властивості якого подібні до ліганду рецептора ангіотензину ІІ (АТ) 1-го типу.
Апелін на 54 % гомологічний рецептору ангіотензину ІІ 1-го типу. Незважаючи на гомологічність, ангіотензин ІІ не зв’язує APJ. Ангіотензинперетворюючий фермент — єдиний відомий ензим, здатний метаболізувати апелін. Він відщепляє один амінокислотний залишок від С-термінального апеліну-13 шляхом гідролізу [13]. На даний час невідомо, чи може це інактивувати протеїн, адже дослідження апеліну-17 із видаленою частиною із С-терміналу показало здатність пептиду зв’язуватись із рецептором [31, 43]. У той же час відомо, що період напіврозпаду апеліну дуже малий. У середньому період напіврозпаду в організмі людини становить менше восьми хвилин.
Рецептори до апеліну виявлені в багатьох органах та тканинах, таких як серце, легені, нирки, шлунково-кишковий тракт, надниркові залози, артерії та вени, а також у кістковій тканині [44, 46, 48].
Біологічні ефекти апеліну впродовж останнього десятиріччя інтенсивно досліджуються (табл. 2). На кардіоваскулярну систему апелін має як позитивний, так і негативний вплив.
Одним із важливих прогностичних ефектів апеліну є позитивний вплив на вуглеводний метаболізм, адже ідентифікація апеліну як адипокіну призвела до висновку про зв’язок апеліну з інсуліновим сигнальним шляхом.
Встановлено, що кореляція апеліну з інсулінорезистентністю обумовлена гіперінсулінемією [45]. Схематично сигнальний шлях інсуліну та апеліну поданий на рис. 2.
/105/105_2.jpg)
Продемонстровано, що апелін зв’язується з APJ та G-протеїновим рецептором, а APJ — із гетеротримерним G-протеїном Gi [28]. В експерименті показано, що коклюшний токсин (потужний інгібітор Gi) інгібує апелін-стимульоване поглинання глюкози й Akt (протеїнкіназа В) фосфорилювання [47], що підтверджує залучення Gi-сигнального шляху до процесу апелінзалежного контролю поглинання глюкози клітинами. Видалення Gi з гепатоцитів і адипоцитів призводить до розвитку інсулінорезистентності, у той час як гіперекспресія Gi в гепатоцитах, адипоцитах і міоцитах призводить до підвищення чутливості до інсуліну [29, 30].
Відомо, що APJ також зв’язується із Gq та призводить до накопичення інозитидтрифосфату (IP3) [46]. Крім інгібування Gq-залежних речовин, таких як фосфоліпаза С, протеїнкіназа С, Na+/H+ і Na+/Ca2+ обмін у сарколемі, апелін призводить до блокування aпелінзалежного скорочення міозинів в ізольованих серцях [28]. Тривимірне моделювання APJ за допомогою алгоритму Маркова спрогнозувало високу ймовірність зв’язування із Gq [39]. Таким чином, ці дані переконливо свідчать, що апелін активізує Gq через його взаємодію з APJ. Але й досі залишається невизначеним питання, чи залежить апелін-опосередковане поглинання глюкози від Gq.
Зв’язок активності апеліну з інсулінорезистентністю підтверджено в лабораторних умовах декількома групами дослідників [7, 28]. Boucher et al. продемонстрували, що інсулін безпосередньо залучений до механізмів регуляції синтезу апеліну на моделі мишей in vivo та in vitro. Систематичне введення стрептозотоцину (рис. 2) мишам призвело до значного підвищення рівня глюкози в плазмі крові, зниження інсуліну й апеліну [7]. Встановлено, що інсулін контролює в адипоцитах експресію генів, які відповідають за синтез апеліну. Виявлено вірогідну позитивну кореляцію адипоцитарної експресії транскрипції гена апеліну й рівня інсуліну у гризунів. Статистично значущого взаємозв’язку адипоцитарної експресії транскрипції гена апеліну й глюкози не виявлено.
У нашому дослідженні у 60 % пацієнтів з гіпертонічною хворобою (ГХ) встановлена гіперінсулінемія. Аналіз активності апеліну проводився у хворих, які були розподілені на 12 груп залежно від рівня інсуліну натще (рис. 3) [2].
Рівень апеліну був статистично вищий у хворих з інсулінорезистентністю (ІР). Це підтверджує зв’язок апеліну із сигнальним шляхом інсуліну. Встановлені кореляційні зв’язки пептиду з індексом ІР Caro (r = –0,38; р < 0,05) та рівнем інсуліну натще (r = 0,49; р < 0,05). В групі хворих без ІР встановлений кореляційний зв’язок апеліну з показником глікованого гемоглобіну (HbA1c) (r = 0,52; р < 0,05).
Ефекти апеліну на поглинання глюкози були продемонстровані із залученням АМФ протеїнкінази, яка є визнаним посередником в метаболічній реакції із внутрішньоклітинним ATФ [41]. Відомо, що апелін активує AMPK та інгібування активності AMPK (фармакологічного, генетичного, молекулярного) призводить до нівелювання aпелініндукованого поглинання глюкози. Інактивація AMPK призводить до інгібування апелінзалежного Akt фосфорилювання [9, 15]. Тож доведено, що апелін стимулює активність Akt та фосфоінозитол-3-кіназу, які є компонентами сигнального шляху інсуліну [9, 15]. Апелін впливає на метаболізм глюкози через AMPK із залученням eNOS. Зважаючи на те, що шлях APJ-AMPK-eNOS є найбільш вивченим механізмом впливу апеліну на чутливість до інсуліну, існують також й інші можливі патогенетичні особливості.
У нашому дослідженні [3, 12, 13] ожиріння супроводжується підвищенням рівня апеліну, але більшою мірою експресія пептиду залежить від супутньої дисглікемії та ІР. Дисфункція ендотелію в обстежених хворих встановлена у 89 % випадків, що супроводжувалося зниженням активності eNOS, підвищенням iNOS. Значне підвищення S-нітрозотіолу свідчить про високий ступінь депонування та зниження біодоступності оксиду азоту. В осіб із ГХ значна дисглікемія, гіперінсулінемія, гіперцитокінемія супроводжувалися зниженням активності апеліну порівняно з пацієнтами з ГХ без коморбідних порушень вуглеводного обміну. Гіперекспресія апеліну в пацієнтів із ГХ із помірними порушеннями вуглеводного обміну пов’язані з компенсаторною реакцією.
Жирова тканина виявляється також локусом запалення, де виникає активація рецепторів TLR ліпополісахаридами, зростає продукція прозапальних цитокінів, що є однією з патогенетичних ланок розвитку цукрового діабету (ЦД) 2-го типу, серцево-судинної патології [4].
Так, показано, що апелін інгібує активність NF-kB шляхом взаємодії між APJ й рецептором ангіотензину ІІ 1-го типу [32]. Пригнічення активності NF-kB, у свою чергу, призводить до інгібування TNF-залежної інсулінорезистентності. Дослідження ефектів апеліну на інсулінозалежне поглинання глюкози на моделі культивованих адипоцитів також підтвердило цю думку [48]. Зокрема, апелін призводить до зменшення продукції прозапальних цитокінів (ІЛ-6), реактивних форм кисню та MCP1 (monocyte chemoattractant protein-1) [23, 26].
Варто відзначити, що прозапальні зміни залежать від локалізації жирової тканини. Концентрація деяких адипокінів та активність низки ферментів вища у вісцеральному жирі (має вихід до системи портальної вени), а інших, навпаки, — у підшкірній жировій тканині, що пов’язано із загальною циркуляцією крові. У вісцеральному жирі превалює (порівняно з підшкірною жировою тканиною) продукція PAI-1, ангіотензиногену, ІЛ-6, вище співвідношення андрогени/естрогени, більша активність 17 гідроксистериддегідрогенази. У підшкірній жировій тканині превалює порівняно з вісцеральним жиром продукція адипонектину та лептину, вища активність ароматази.
Збільшення об’єму вісцеральної жирової тканини призводить до системного вивільнення білка резистину та проатерогенних інтерлейкінів. Підвищення рівня циркулюючих цитокінів пов’язано з розвитком інсулінорезистентності м’язової тканини. Так, при дослідженні характеру розподілу жирової тканини (за даними магнітно-резонансної томографії) та функції мікроциркуляторного русла (відеомікроскопічно) встановлено, що прозапальний стан асоційований із вісцеральним типом ожирінням та збіднінням мікроциркуляторного русла [26].
Біологічний ефект у вигляді стимуляції проліферації парієтальних клітин слизової оболонки шлунка та секреції холецистокініну, а також інгібування секреції інсуліну b-клітинами підшлункової залози, гістаміну, соляної кислоти парієтальними клітинами у поєднанні зі стимуляцією утилізації глюкози периферичними тканинами проявляє циркулююча форма апелін-36 [7, 15, 40].
Секреція апеліну пригнічується при голодуванні та відновлюється при подальшому прийомі їжі. Після 24-годинного голодування, введення інсуліну мишам лінії C57BL6/J призводила до підвищення рівня апеліну через 3–6 годин в ізольованих адипоцитах утричі. Інсулін підвищує транскрипцію гена апеліну в адипоцитах мишей лінії 3T3F442A. Більше того, потенційна активація рецепторів інсуліноподібного фактора росту-1 інсуліном може бути виключена із патогенетичної ланки, оскільки інсулін не має активності в недиференційованих адипоцитах мишей лінії 3T3F442A. Культивування преадипоцитарних клітин мишей з ожирінням лінії 3T3F442A за умов високих рівнів глюкози не призводило до суттєвого підвищення рівня mRNA апеліну [7].
Встановлено, що інсулін безпосередньо регулює секрецію апеліну жировими клітинами мишей та людини. У хворих на ожиріння в крові підвищений як рівень інсуліну, так і апеліну, причому ці параметри строго корелюють між собою. Порівняння чотирьох різних моделей ожиріння у мишей показало, що найбільша секреція апеліну та його рівень у плазмі крові спостерігався у випадку ожиріння, поєднаного з гіперінсулінемією. Вплив ожиріння та інсулінемії на активність апеліну вивчався у чоловіків з ожирінням, які мали рівні глюкози та холестерину в межах норми. При цьому встановлено підвищення апеліну й інсуліну в плазмі крові. Також дослідження експресії апеліну в адипоцитах людини, що було культивовано з інсуліном, дозволило встановити підвищення активності апеліну в 6 разів порівняно з контролем. Підвищення секреції апеліну менше детерміновано такими чинниками, як маса жирової тканини або високожирова дієта. Секреція апеліну за фізіологічних умов підвищується при прийомі їжі, збагаченої вільними жирними кислотами та тригліцеридами [24, 25, 27].
Інсулін як сигнальна молекула має різні шляхи трансдукції в адипоцитах. Тому вивчення патогенетичних ланок експресії апеліну в адипоцитах проводилося шляхом використання специфічних інгібіторів. Преінкубація диференційованих 3T3F442A клітин з інгібітором 3-фосфатидилінозитолкінази — вортманіном призводить до статистично значущого зниження інсулінозалежної індукції mRNA апеліну. Селективне інгібування протеїнкінази С блокує експресію апеліну.
Тож можливо зробити висновок, що інсулін здатний контролювати секрецію апеліну та впливати на метаболізм завдяки опосередкованим ефектам.
В іншому нашому дослідженні [1] для виявлення вікових та гендерних особливостей активності апеліну обстежено 94 пацієнти з ГХ, серед яких — 62 жінки (65,9 %) та 32 чоловіки (34,1 %) віком від 32 до 74 років. В осіб із ГХ рівень апеліну вірогідно перевищував показники групи контролю: 0,36 ± 0,27 мкг/мл проти 0,14 ± 0,06 мкг/мл, p < 0,05.
Аналіз активності апеліну залежно від віку показав, що у пацієнтів з ГХ зрілого віку рівень пептиду дещо нижчий (0,32 ± 0,26 мкг/мл) від показників осіб похилого віку (0,40 ± 0,27 мкг/мл). Встановлені вірогідні кореляційні зв’язки рівня апеліну з показниками ліпідного обміну в групі хворих похилого віку. Плазмові рівні апеліну позитивно корелювали із показником холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) (R = 0,40, p < 0,05) та постпрандіальним рівнем інсуліну (R = 0,64, p < 0,05) та негативно корелювали із рівнем холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) та показником коефіцієнта атерогенності (КА) (R = –0,34, R = –0,50, R = –0,46, p < 0,05 відповідно).
Вивчення гендерних особливостей показало вищий рівень пептиду у жінок з ГХ (0,38 ± 0,30 мкг/мл), ніж у чоловіків (0,32 ± 0,22 мкг/мл, p < 0,05). В групі жінок з ГХ встановлені вірогідні кореляційні зв’язки апеліну з рівнем систолічного артеріального тиску (САТ) та пост–прандіальним рівнем глюкози (R = 0,41, R = 0,65 відповідно, p < 0,05).
Більш детальний аналіз активності адипокіну за віком та статтю показав, що у жінок рівень апеліну підвищується з віком, а у чоловіків — навпаки (рис. 4).
При аналізі кореляційних зв’язків у групі зрілого віку в жінок активність апеліну зростала пропорційно віку (R = 0,70, p < 0,05), також рівень пептиду позитивно корелював із глюкозою натще (R = 0,55, p < 0,05), ХС ЛПНЩ (R = 0,46, p < 0,05), КА (R = 0,53, p < 0,05) та негативно корелював із рівнем ХС ЛПВЩ (R = –0,46, p < 0,05). У чоловіків похилого віку винайдена вірогідна пряма залежність активності апеліну від віку, глюкози натще та постпрандіально (R = 0,69, R = 0,61, R = 0,98, p < 0,05 відповідно) та обернена залежність від рівня тригліцеридів та холестерину ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ) (R = –0,63 та R = –0,63, p < 0,05 відповідно). У жінок похилого віку встановлено підвищення рівня пептиду пропорційно глюкозі постпрандіально та ХС ЛПВЩ (R = 0,79 та R = 0,52, p < 0,05 відповідно) й зниження адипокіну при зростанні плазмових рівнів ХС, ХС ЛПДНЩ та індексу ІР Caro (R = –0,40, R = –0,65 та R = –0,34, p < 0,05 відповідно).
Таким чином, у пацієнтів із ГХ встановлені вікові та гендерні особливості активності апеліну, рівень експресії пептиду підвищений у чоловіків зрілого віку та жінок похилого віку. Плазмові рівні апеліну в осіб з ГХ ІІ стадії вищі від показників у пацієнтів із ГХ І стадії незалежно від статі та віку. У жінок із другим і третім ступенями ГХ рівень експресії адипокіну вищий від показників у чоловіків. При розподілі пацієнтів за тривалістю хвороби встановлено більш виражене підвищення апеліну в жінок, ніж у чоловіків, при тривалості ГХ — понад 5 років.
Можливо, розмір жирової клітини є ще одним параметром, що може впливати на рівень експресії апеліну в адипоцитах мишей. Фактично в моделі досліджень мишей із гіперінсулінемією та ожирінням виявлені гіпертрофічні адипоцити та підвищений рівень апеліну. У мишей із введенням стрептозотоцину встановлено менший розмір адипоцитів й невелику експресію апеліну. Єдина модель мишей з ожирінням (AR–TG) із відсутністю гіпертрофії адипоцитів асоційована з нормальним рівнем інсуліну і апеліну [30].
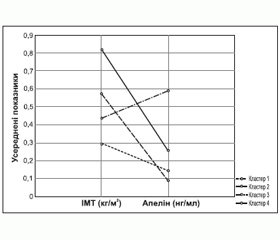
Для вивчення взаємозв’язків підвищеної маси тіла з експресією адипокіну хворі були розподілені на 4 кластери [14] (рис. 5).
/108/108.jpg)
У першому кластері було 23 особи з ГХ віком від 40 до 71 років: 13 жінок, 10 чоловіків. У другому кластері — 22 пацієнти з ГХ віком від 35 до 72 років: 12 жінок, 10 чоловіків. Третій кластер становили 14 осіб із ГХ віком від 54 до 74 років: 8 жінок, 6 чоловіків. У четвертому кластері було 37 пацієнтів з ГХ віком від 30 до 72 років.
Різниця показників індексу маси тіла (ІМТ) була вірогідною, рівні апеліну в групах різноспрямовані. Протилежні значення апеліну поряд із незначною різницею в ІМТ зафіксовані в третьому та четвертому кластерах. У хворих третього кластера рівень апеліну був найменшим серед усієї вибірки хворих, а в четвертому — найбільшим та втричі перевищував середні показники інших груп. У хворих третьої групи встановлені найбільші значення САТ та ДАТ. У четвертій групі зафіксовані найвищі рівні ХС, тригліцеридів, ХС ЛПНЩ та ХС ЛПДНЩ, а також КА вдвічі перевищував показники в інших групах. Найбільші зміни вуглеводного обміну встановлені у хворих четвертого кластера. Показники глюкози, інсуліну натще та після перорального глюкозотолерантного тесту, HbA1c, індекс HOMA у хворих четвертого кластера вірогідно перевищував значення інших груп. Значна гіперцитокінемія з превалюванням прозапального ІЛ-6 також встановлена у хворих четвертого кластера. Можливо, що активність апеліну залежить не тільки від компенсації вуглеводного обміну, але й від вираженості дисліпідемії, рівня прозапальних цитокінів, що відображають ступінь атерогенності.
Показано, що апелін сприяє засвоєнню глюкози м’язовими клітинами [15], культивованими скелетними м’язами [46] та жировими клітинами [5]. Миші з дефіцитом апеліну мають знижену чутливість до інсуліну за даними проведених тестів. Також встановлено гіперінснулінемію, гіпоадипонектинемію, що підтверджує безпосередній вплив апеліну на сигнальний шлях інсуліну [46]. Введення апеліну мишам призвело до поліпшення чутливості до глюкози, що підтверджено глюкозотолерантним тестом [15, 20]. Це є свідченням, що апелін має властивості покращувати чутливість до інсуліну, а експресія апеліну, що спостерігається при інсулінорезистентності, має компенсаторний характер.
Декілька досліджень показали зв’язок між рівнем апеліну та ЦД 2–го типу [8, 38]. Soriguer і співавт. [40] показали зв’язок між рівнем апеліну й концентрацією глюкози та чутливістю до інсуліну у хворих на ЦД, пропонуючи роль апеліну в патогенезі ЦД. Цікаво те, що рівень апеліну суттєво зростає після навантаження глюкозою у здорових людей, хворих із документованою ІР та пацієнтів із ЦД 2-го типу [27], а також у хворих з ожирінням без супутнього ЦД [47]. Крім того, у мишей із діабетом встановлено пригнічення рецепторів апеліну і зниження еластичних властивостей аорти [45]. Тим не менше Rittig і співавт. [36] вивчали зв’язок апеліну та атеросклерозу за показниками товщини інтими-медії у 344 пацієнтів із підвищеним ризиком розвитку ЦД 2-го типу. Але вірогідного зв’язку активації апеліну з ризиком розвитку діабету не було встановлено [36].
Активність апеліну вивчалася на моделі ЦД, відтвореного на моделях тварин. Було встановлено, що інтрацеребральне введення апеліну мишам призводить до поліпшення гомеостазу глюкози за допомогою NO-залежного шляху [16]. Ін’єкції апеліну-13 (400 пмоль/кг) протягом 10 тижнів значно знизили показники обтяження ендоплазматичної мережі підшлункової залози у мишей Акіта (модель ЦД 1–го типу), що призводить до змін острівцевого апарату підшлункової залози і збереження рівня інсуліну [9]. Цей важливий ефект апеліну-13 на моделі ЦД 1-го типу був опосередкований інгібуванням ферменту інозитол 1 та JNK шляху, припускається, що апелін впливає на механізми розвитку ендоплазматичного стресу та клітинного апоптозу [9]. Існує думка, що у хворих із метаболічним синдромом надмірний рівень апеліну на 80 % зумовлений активною продукцією останнього саме адипоцитами [46]. При цьому апелін забезпечує утилізацію глюкози тканинами за рахунок фосфорилювання компонентів інсулінозалежного транспорту Akt-сигнальної системи [15]. У мишей із метаболічним синдромом апелін сприяє відновленню толерантності до глюкози й підвищенню рівня її утилізації [15]. Глюкозозалежна секреція інсуліну клітинами підшлункової залози знижується в присутності апеліну та має негативний обернений зв’язок [19, 40]. Лікування апеліном позитивно впливає на функцію судин у мишей із ЦД. Систематичне введення апеліну відновлює реактивність аорти, що була змодульована застосуванням ангіотензину ІІ та ацетилхоліну у мишей із ЦД 2-го типу за рахунок збільшення фосфорилювання Akt та eNOS [43]. Можливо, поліпшення глікемічного профілю, підвищення чутливості до інсуліну, відновлення судинної функції у хворих на ЦД опосередковане дією апеліну.
У когорті пацієнтів із вперше діагностованим ЦД 2–го типу концентрація циркулюючого апеліну була нижча від показників здорових людей [27]. Erdem і співавт. [17] також показали, що у 40 пацієнтів із вперше діагностованим ЦД 2-го типу без супутньої патології до проведення будь-якої терапії рівень апеліну в плазмі був нижчим порівняно з контрольною групою. Встановлено вірогідне зниження концентрації апеліну порівняно з групою контролю поряд із підвищеним рівнем інсуліну. Апелін вірогідно негативно корелював із рівнем глюкози натще та індексом HOMA.
Для вивчення активності апеліну залежно від вираженості вуглеводних порушень [3, 12, 13] нами обстежено 136 пацієнтів з ГХ, 76 жінок (55,9 %) та 60 чоловіків (44,1 %) віком від 34 до 70 років. У 40 (34,46 %) пацієнтів з ГХ встановлено коморбідний стан — асоціація ГХ та ЦД 2-го типу. При дослідженні вуглеводного обміну у 37 (31,92 %) пацієнтів із ГХ виявлено супутній предіабет. Хворі розподілені на 3 групи: перша група — 39 (33,62 %) пацієнтів з ГХ без супутніх порушень вуглеводного обміну; друга група — 37 (31,92 %) пацієнтів з ГХ із супутнім предіабетом; третя група — 40 (34,46 %) пацієнтів із ГХ із ЦД 2-го типу. Аналіз апеліну залежно від наявності порушень вуглеводного обміну показав максимальний рівень в групі пацієнтів із ГХ та ЦД 2-го типу (0,31 (0,19–0,49) нг/мл, р < 0,001 (Kruskal-Wallis ANOVA)) порівняно з групою контролю. Менша активність апеліну порівняно з третьою групою зафіксована в групі пацієнтів з ГХ без супутніх порушень вуглеводного обміну (0,29 (0,22–0,49) нг/мл, р < 0,001 (Kruskal-Wallis ANOVA)), порівняно з групою контролю та р > 0,05 порівняно з третьою групою. Помірна експресія адипокіну виявлена у пацієнтів з ГХ з предіабетом (0,18 (0,14–0,32) нг/мл, р < 0,001 (Kruskal-Wallis ANOVA)), порівняно з групою контролю та показниками хворих першої групи. Кореляційний аналіз показав множинні вірогідні взаємозв’язки пептиду апеліну з компонентами вуглеводного обміну. Так, у групі пацієнтів із ГХ без порушень вуглеводного обміну встановлено пряму вірогідну залежність активності адипокіну й рівня HbA1c (r = 0,52; р < 0,05). У другій групі хворих виявлено вірогідну залежність апеліну від рівня глюкози після перорального глюкозотолерантного тесту (ПГТТ) (r = 0,77; р < 0,05) та інсуліном після проведення ПГТТ (r = 0,66; р < 0,05). У третій групі встановлено вірогідну кореляційну залежність апеліну з рівнем інсуліну натще (r = 0,33; р < 0,05).
Отже, низка досліджень апеліну показала зв’язок адипокіну з інсуліновим шляхом, але фізіологічна й патофізіологічна роль адипокіну неоднозначна. Внутрішньоклітинні механізми, що регулюють апелінзалежні зміни рівнів глюкози й інсулінового сигнального каскаду, досі не повністю з’ясовані. Кореляційні залежності апеліну з компонентами вуглеводного обміну підтверджують факт впливу на глюкометаболічні прояви. Існує різноспрямованість даних щодо активності пептиду у людей та тварин з ожирінням, інсулінорезистентністю, ЦД 2-го типу. Точна роль апеліну в патогенезі порушень вуглеводного обміну потребує подальшого ретельного вивчення на клінічному рівні, що дасть можливість використовувати апелін як терапевтичну мішень для корекції глюкометаболічних змін.
1. Демиденко Г.В. Активність апеліну у хворих на гіпертонічну хворобу: вікові та гендерні особливості / Г.В. Демиденко, О.М. Ковальова // Український кардіологічний журнал. — № 6. — 2013. — С. 35–39.
2. Демиденко А.В. Апелин как маркер инсулинорезистентности у больных гипертонической болезнью // Сборник статей по материалам XXVI международной научно-практической конференции «Современная медицина: актуальные вопросы». — Новосибирск (Россия), 16 декабря 2013 г. — С. 15–25.
3. Демиденко А.В. Инсулинорезистетность и риск развития сахарного диабета 2 типа у больных с гипертонической болезнью // Материалы ІІІ Евразийского конгрессв кардиологов, 20–21 февраля 2014 г., Москва (Россия). — С. 102.
4. Ковалева О.Н. Предиабет — диагностические критерии и клиническая значимость в кардиологии // Здоров’я України. — 2012. — 1. — С. 24–25.
5. Attane C. Apelin stimulates glucose uptake but not lipolysis in human adipose tissue ex vivo / C. Attane, D. Daviaud, C. Dray et al. // J. Mol. Endocrinol. — 2011. — 46(1). — Р. 21–28.
6. Barnes G. Translational promise of the apeline — APJ system / G. Barnes, A.G. Japp, D.E. Newby // Heart. — 2010. — Vol. 96. — P. 1011–1016.
7. Boucher J.А. Newly Identified Adipokine Up-Regulated by Insulin and Obesity / J. Boucher, B. Masri, D. le Daviaud et. al. // Endocrinology. — 2005. — 146(4). — Р. 1764–1771.
8. Castan-Laurell I. Apelin, diabetes, and obesity // I. Castan-Laurell, C. Dray, C. Attané et al. // Endocrine. — 40 (1). — 2011. — P. 1–9.
9. Chen H. Apelin alleviates diabetes-associated endoplasmic reticulum stress in the pancreas of akita mice / H. Chen, C. Zheng, X. Zhang et al. // Peptides. — 2011. — 32(8). — P. 1634–1639.
10. Chun H.J. Apelin signaling antagonizes Ang II effects in mouse models of atherosclerosis / Chun H.J., Ali Z.A., Kojima Y. et al. // J. Clin. Invest. — 2008. — 118(10). — Р. 3343–3354.
11. Colwell J.A. Type 2 Diabetes, Pre-Diabetes, and the Metabolic Syndrome // JAMA. — 2011. — 306(2). — P. 215.
12. Demydenko G. Apelin as a marker of an insulinresistance in patients with essential hypertension / G. Demydenko, O. Kovalyova // 16th European Congress of Endocrinology 3–7 May 2014, Wroclaw (Poland). Endocrine Abstracts. — 2014 (Vol. 35). — P. 193.
13. Demydenko G. Apelin expression in patients with essential hypertension and prediabetes / Demydenko G., Kovalyova O. // 23rd European meeting on hypertension and cardiovascular protection. — Milan (Italy), June 14–17, 2013. — P. 323.
14. Demydenko G. Investigation of plasma apelin level in patients with essential hypertension corresponding to the type of obesity // Научные ведомости Белгородского государственного университета «Медицина и фармация». — 2014. — № 4(175). — С. 52–57.
15. Dray C. Apelin stimulates glucose utilization in normal and obese insulin–resistant mice / C. Dray, C. Knauf, D. Daviaud et al. // Cell. Metab. — 2008. — Vol. 8. — P. 437–445.
16. Duparc T. Central apelin controls glucose homeostasis via a nitric oxide-dependent pathway in mice / T. Duparc, A. Colom, P.D. Cani et al. // Antioxidants and Redox Signaling. — 2011. — 6(15). — P. 1477–1496.
17. Erdem G. Low Plasma Apelin Levels in Newly Diagnosed Type 2 Diabetes Mellitus / G. Erdem, T. Dogru, I. Tasci et al. // Exp. Clin. Endocrinol. Diabetes. — 2008. — 116(5). — Р. 289–292.
18. Glassford A.J. HIF-1 regulates hypoxia- and insulin-induced expression of apelin in adipocytes / A.J. Glassford, P. Yue, A.Y. Sheikh et al. // Am. J. Physiol. Endocrinol. Metab. — 2007. — 293(6). — Р. 1590–1596.
19. Guo L. Apelin inhibits insulin secretion in pancreatic β-cells by activation of PI3-kinase-phosphodiesterase 3B / L. Guo, Q. Li, W. Wang, Р. Yu et al. // Endocrine research. — 2009. — 34. — P. 142–154.
20. Higuchi K. Apelin, an APJ receptor ligand, regulates body adiposity and favors the messenger ribonucleic acid expression of uncoupling proteins in mice / K. Higuchi, T. Masaki, K. Gotoh et al. // Endocrinology. — 2007. — 148(6). — P. 2690–2697.
21. Ishida J. Regulatory roles for APJ, a seven-transmembrane receptor related to angiotensinogen-type 1 receptor in blood pressure in vivo / J. Ishida, T. Hashimoto, Y. Hashimoto et al. // J. Biol. Chem. — 2004. — 279. — P. 26274–26279.
22. Japp A.G. Vascular effects of apelin in vivo in man / A.G. Japp, N.L. Cruden, D.A. Amer et al. // J. Am. Coll.Cardiol. — 2008. — 52. — P. 908–13.
23. Jia Y.X. Apelin protects myocardial injury induced by isoproterenol in rats / Y.X. Jia, C.S. Pan, J. Zhang et al. // Regul. Pept. — 2006. — 15(133(1–3)). — P. 147–154.
24. Kleinz M.J. Emerging roles of apelin in biology and medicine / M.J. Kleinz, A.P. Davenport // Pharmacol. Ther. — 2005. — 107(2). — P. 198–211.
25. Langelaan D.N. Structural insight into G-protein coupled receptor binding by apelin / D.N. Langelaan, E.M. Bebbington, T. Reddy, J.K. Rainey // Biochemistry. — 2009. — 48. — P. 537–48.
26. Leeper N.J. Apelin prevents aortic aneurysm formation by inhibiting macrophage inflammation / N.J. Leeper, M.M. Tedesco, Y. Kojima et al. // Am. J. Physiol. Heart Circ. Physiol. — 2009. — 296(5). — Р. 1329–1335.
27. Li L. Changes and relations of circulating visfatin, apelin, and resistin levels in normal, impaired glucose tolerance, and type 2 diabetic subjects / L. Li, G. Yang, Q. Li et al. // Exp. Clin. Endocrinol. Diabetes. — 2006. — 114. — P. 544–548.
28. Margathe J.–F. Structure–Activity Relationship Studies toward the Discovery of Selective Apelin Receptor Agonists // J.-F. Margathe X. Iturrioz, R. Alvear-Perez, et al. // Journal of Medicinal Chemistry. — 2014. — 57(7). — P. 2908–2919.
29. Mesmin C. Liquid chromatography/tandem mass spectrometry assay for the absolute quantification of the expected circulating apelin peptides in human plasma / C. Mesmin, M. Dubois, F. Becher et al. // Rapid.Commun. Mass Spectrom. — 2010. — Vol. 24 (19). — P. 2875–2884.
30. Mesmin C. Identification and characterization of apelin peptides in bovine colostrum and milk by liquid chromatography-mass spectrometry / C. Mesmin, F. Fenaille, F. Becher et al. // J. Proteome Res. — 2011. — 10(11). — P. 5222–5231.
31. O’Shea M. Inhibitory effect of apelin-12 on nocturnal food intake in the rat / M. O’Shea, M.J. Hansen, K. Tatemoto, M.J. Morris // Nutr. Neurosci. — 2003. — 6(3). — P. 163–167.
32. Ouchi N. Adipokines in inflammation and metabolic disease / N. Ouchi, J.L. Parker, J.J. Lugus, K. Walsh // Nat. Rewiews. Immunology. — 2011. — 11. — P. 85–97.
33. Piya M.K. Adipokine inflammation and insulin resistance: the role of glucose, lipids and endotoxin / M.K. Piya, P.G. McTernan, S. Kumar // J. of Endocrinology. — 2013. — 216. — P. 1–15.
34. Przewlocka-Kosmala M. Reduced circulating apelin in essential hypertension and its association with cardiac dysfunction / M. Przewlocka-Kosmala, T. Kotwica, A. Mysiak, W. Kosmala // J. Of Hypertension. — 2011. — 5(29). — Р. 971–979.
35. Ringstroem C. Apelin is a novel islet peptide / C. Ringstroem, M.D. Nitert, H. Bennet et al. // Reg. Peptides. — 2010. — 162. — P. 44–51.
36. Rittig K. Apelin serum levels are not associated with early atherosclerosis or fat distribution in young subjects with increased risk for type 2 diabetes / K. Rittig, U. Hildebrandt, C. Thamer et al.// J. Exper. and Clin. Endocrinol. and Diabetes. — 2011. — 119 (6). — P. 358–361.
37. Sawane M. Apelin inhibits diet-induced obesity by enhancing lymphatic and blood vessel integrity / M. Sawane, K. Kajiya, H. Kidoya et al. // Diabetes. — 2013. — 62(6). — P. 1970–1980.
38. Seyyed M.R. Targeting the ACE2 and Apelin Pathways Are Novel Therapies for Heart Failure: Opportunities and Challenges / M.R. Seyyed, Kazemi-Bajestani, B. Vaibhavet al. // Cardiology Research and Practice. — 2012. — Vol. 2012. — P. 1–11.
39. Sgourakis N.G. Prediction of the coupling specificity of GPCRs to four families of G-proteins using hidden Markov models and artificial neural networks / N.G. Sgourakis, P.G. Bagos, S.J. Hamodrakas // Bioinformatics. — 2005. — 21(22). — P. 4101–4106.
40. Soriguer F. Apelin levels are increased in morbidly obese subjects with type 2 diabetes mellitus / F. Soriguer, L. Garrido-Sanchez, S. Garcia-Serrano et al. // Obesity Surgery. — 2009. — 19 (11). — P. 1574–1580.
41. Steinberg G.R. AMPK in Health and Disease / G.R. Steinberg, B.E. Kemp // Physiol. Rev. — 2009. — 89(3). — P. 1025–1078.
42. Suzuki T. Interleukin-6 enchances glucose-stimulated insulin secretion from pancreatic β-cells: potential involvement of the PLC-IP3-dependent pathway / T. Suzuki, J. Imai, T. Yamada et al. // Diabetes. — 2011. — 60. — P. 537–547.
43. Than A. Apelin Attenuates Oxidative Stress in Human adipocytes / A. Than, X. Zhang, M. Khee-ShingLeow // Biol. Chem. — 2014. — 289. — P. 3763–3774.
44. Wang G. Ontogeny of apelin and its receptor in the rodent gastrointestinal tract / G. Wang, R. Kundu, S. Han et al. // Regul. Pept. — 2009. — 158(1–3). — P. 32–39.
45. Xu S. Apelin and insulinresistance: another arrow for the quiver? / S. Xu, P.S. Tsao, P. Yue // J. Diabetes. — 2011. — 3(3). — Р. 225–231.
46. Yue P. Apelin decreases lipolysis via G(q), G(i), and AMPK-Dependent Mechanisms / P. Yue, H. Jin, S. Xu et al. // Endocrinology. — 2011. — 152(1). — P. 59–68.
47. Yue P. Apelin is necessary for the maintenance of insulin sensitivity / P. Yue, H. Jin, M. Aillaud-Manzanera et al. // Amer. J. Physiol. Endocrinol. Metab. — 2009. — 298. — P. 59–67.
48. Zhu S. Apelin stimulates glucose uptake through the PI3K/Akt pathway and improves insulin resistance in 3T3-L1 adipocytes / S. Zhu, F. Sun, W. Li et al. // Mol. Cell Biochem. — 2011. — 353(1–2). — Р. 305–313.

/104/104.jpg)
/105/105.jpg)
/106/106.jpg)