Международный эндокринологический журнал 5 (61) 2014
Вернуться к номеру
Досвід застосування препаратів генно-інженерних інсулінів виробництва компанії «Фармак» у хворих на цукровий діабет 2-го типу
Авторы: Орленко В.Л., Єфімов А.С., Іваськіва К.Ю. - ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Стаття присвячена одній з актуальних і важливих соціально-економічних проблем клінічної ендокринології — цукровому діабету (ЦД). При прогресуванні ЦД захворюванням важче керувати; щодо цього інсулін дає додаткові переваги. Наведені дані дослідження з вивчення довготривалої ефективності та переносимості усіх типів препаратів Фармасулін у хворих на ЦД 2-го типу.
Статья посвящена одной из актуальных и важных социально-экономических проблем клинической эндокринологии — сахарному диабету (СД). При прогрессировании СД заболеванием тяжелее управлять; в этом плане инсулин дает дополнительные преимущества. Представлены данные исследования по изучению длительной эффективности и переносимости всех типов препаратов Фармасулин у больных с СД 2-го типа.
The article deals with one of the most urgent and important socio-economic problems of clinical endocrinology — diabetes mellitus (DM). With the progression of DM, it is harder to control the disease; in this regard, insulin provides additional benefits. The findings of the study on the long-term efficacy and tolerability of all types of Farmasulin preparations in patients with diabetes mellitus type 2 are provided.
цукровий діабет, інсулінотерапія, Фармасулін.
сахарный диабет, инсулинотерапия, Фармасулин.
diabetes mellitus, insulin therapy, Farmasulin.
Статья опубликована на с. 69-74
Однією з актуальних і важливих соціально-економічних проблем клінічної ендокринології є цукровий діабет (ЦД). Це захворювання належить до пріоритетних у клінічній ендокринології, адже, за визначенням ВООЗ, ЦД називають неінфекційною епідемією XXI століття. В економічно розвинутих країнах світу 4–6 % людей хворіє на ЦД. За прогнозами ВООЗ, до 2030 року кількість хворих на ЦД у світі може збільшитись до 552 млн [1].
В Україні захворюваність на ЦД, як і в інших країнах світу, теж щорічно зростає. На даний час налічується понад 1,3 млн хворих на ЦД. Але наведені дані не відображають справжню поширеність захворювання. Чітко показано, що поряд із кожним зареєстрованим є 2–3 недіагностованих хворих, причому це стосується в основному хворих на ЦД 2-го типу [2].
Високому рівню захворюваності на ЦД сприяють багато чинників, серед яких головне місце посідають особливості харчування, надмірний вплив стресових факторів, низька фізична активність, що призводять до розвитку метаболічного синдрому, одним із компонентів якого є порушена толерантність до глюкози, або ЦД 2-го типу в поєднанні із гіперліпідемією, артеріальною гіпертензією, ожирінням [3, 4].
Одна з проблем, що є актуальною на цей час в Україні, — це рівень компенсації хворих на ЦД 2-го типу. За орієнтовними даними, компенсованими є лише 10–15 % хворих на ЦД 2-го типу. Однією з суттєвих причин такого стану проблеми є пізнє призначення інсулінів. Метааналіз багатоцентрових досліджень (ACCORD, ADVANS, UKPDS, VARD) показав, що своєчасний початок інсулінотерапії забезпечує оптимальний контроль глікемії і відповідно покращує прогноз ЦД 2-го типу, уповільнюючи розвиток хронічних ускладнень ЦД, а інсулінотерапія у хворих на ЦД 2-го типу повинна призначатися вчасно та інтенсифікуватися. За даними літератури, кількість пацієнтів із ЦД 2-го типу, яким своєчасно вперше призначається інсулін, становить лише 5 %. У середньому інсулін таким хворим призначається за 8 років від моменту виявлення захворювання [5].
В українському дослідженні CREDIT за участю 149 пацієнтів із ЦД 2-го типу показано поліпшення всіх параметрів глікемічного контролю після переходу на інсулінотерапію, а у 26 % хворих вдалося досягти рівня глікозильованого гемоглобіну (HbA1c) менше ніж 7 % при початковому 10,1 %. При прогресуванні ЦД захворюванням важче управляти; щодо цього інсулін дає додаткові переваги, оскільки його дія не залежить від залишкової секреторної активності бета-клітин [6, 7].
Часто і пацієнти, і лікарі уникають призначення інсуліну внаслідок страхів гіпоглікемії і неправильного тлумачення сенсу інсулінотерапії, що призводить до тривалого періоду декомпенсації і збільшення ризику розвитку мікро- і макросудинних ускладнень [8].
Основними бар’єрами на шляху до старту інсулінотерапії є ризик розвитку гіпоглікемій і збільшення маси тіла, виникнення додаткових незручностей при виконанні ін’єкцій та ускладнення режиму дня. Таким чином, сучасний алгоритм лікування ЦД 2-го типу передбачає порівняно ранній початок інсулінотерапії при неможливості досягти компенсації ЦД на максимальних дозах пероральних цукрознижуючих препаратів, що можна вважати найбільш оптимальним підходом. Це дозволяє, зокрема, зменшити негативні наслідки декомпенсації ЦД стосовно розвитку макро- і мікросудинних ускладнень [9, 10].
В останні роки відбулися зміни в підходах до інсулінотерапії у хворих на ЦД 2-го типу. Зокрема, для багатьох пацієнтів із ЦД 2-го типу інсулінотерапія є не останньою надією, а оптимальним варіантом терапії серед наявних в арсеналі. Це пов’язано з тим, що адекватне зниження рівня глікемії сприяє зниженню процесів глюконеогенезу в печінці, зменшенню рівня HbA1c, процесів глюкозотоксичності і навантаження на бета-клітини підшлункової залози, що зрештою призведе до зниження ризику макро- і мікросудинних ускладнень [11].
Сьогодні багато говорять про індивідуалізацію гіпоглікемічної терапії для кожного пацієнта з урахуванням віку, тривалості перебігу ЦД 2-го типу, рівня глікемії й показників HbA1c. При цьому у веденні таких пацієнтів важливо не допускати епізодів гіпоглікемії, що прямо корелюють зі смертністю [12].
На сьогодні на світовому фармацевтичному ринку наведено безліч препаратів інсуліну, що надає лікареві можливість індивідуалізувати та оптимізувати інсулінотерапію в кожного пацієнта для досягнення адекватного глікемічного контролю.
Метою нашого дослідження було вивчення довготривалої ефективності та переносимості всіх типів препаратів Фармасулін у хворих на ЦД 2-го типу.
Матеріали і методи дослідження
Під спостереженням перебували 50 хворих, які знаходились на стаціонарному лікуванні в діабетологічному відділенні ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України». Хворі для проходження курсу лікування надходили 1 раз на рік. Період спостереження за хворими становив від 1,5 до 3,3 року, у середньому — 2,8 ± 1,2 року.
Пацієнти були розподілені на дві групи: першу — 30 хворих, які приймали Фармасулін Н та Фармасулін Н NP, та другу — 20 пацієнтів, які лікувалися препаратом Фармасулін Н 30/70.
До першої групи увійшли 8 чоловіків та 22 жінки віком 49–70 років (у середньому 64,06 ± 3,84 року) з тривалістю ЦД від 0,1 місяця до 23 років (у середньому 15,25 ± 2,28 року). Індекс маси тіла (ІМТ) у цій групі становив 27,85 ± 1,14 кг/м2 (від 16 до 38 кг/м2). Другу групу сформували 9 чоловіків та 11 жінок віком від 54 до 70 років (середній вік — 68,40 ± 3,08 року), середня тривалість захворювання дорівнювала 13,50 ± 1,71 року (коливання цього показника знаходились у межах від 5 до 24 років), ІМТ зафіксовано в межах від 24 до 38 кг/м2, середній показник — 29,40 ± 2,56 кг/м2. Супутня патологія представлена такими нозологічними одиницями: ІХС, атеросклероз аорти та коронарних судин у 26 пацієнтів, хронічний пієлонефрит у стадії стійкої ремісії у 6 хворих, гіпертонічна хвороба — у 29 осіб, у 6 хворих була патологія щитоподібної залози у вигляді змішаного зоба в стані еутиреозу.
Пацієнтам, які раніше приймали інсуліни, призначали відповідну дозу досліджуваних препаратів Фармасулін Н, Фармасулін Н NP, Фармасулін Н 30/70. Контролювався режим харчування хворих, не допускалися пропуски прийому їжі. Крім того, контролювався режим фізичних навантажень. За необхідності добова доза препаратів і режим їх введення корегувалися в ту або іншу сторону. Корекція дози проводилася під постійним контролем рівня глікемії, глюкозурії, кетонурії і здійснювалася поступово до досягнення адекватних показників глікемії.
Питання про корекцію дози препаратів розглядалося в таких випадках:
— погіршення загального стану хворих (гіперглікемія, полідипсія, поліурія, ніктурія, свербіння шкіри і геніталій); гіпоглікемічні стани;
— кетонурія; зміна маси тіла хворого; зміни способу життя хворого;
— інші чинники, що могли б призвести до підвищення ризику виникнення гіпо– або гіперглікемій.
14 пацієнтам першої групи та 13 пацієнтам другої групи інсулін був призначений уперше.
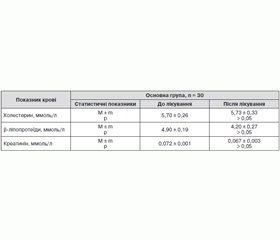
У пацієнтів визначалися такі параметри: глікемія натще; глікемія постпрандіальна; глікемічний профіль (4 рази за період дослідження, за необхідності — частіше у хворих, яким вперше призначений інсулін); HbA1c, добова глюкозурія, кетонурія, відносна щільність cечі, діурез; загальний аналіз крові; біохімічні показники: креатинін, холестерин, b-ліпопротеїди. Зміни лабораторних показників протягом періоду спостереження (вище або нижче від межі норми) розцінювалися як побічна дія.
Лабораторні показники були оброблені статистично на ПК із використанням критерію Стьюдента (t) з визначенням показників вірогідності розбіжностей (p). Різниця показників вважалася вірогідною при p < 0,05.
Результати дослідження та їх обговорення
Основні показники динаміки вуглеводного обміну у хворих обох груп наведені в табл. 1 та 2.
Аналіз показників, наведених у табл. 1, показує, що в першій групі хворих спостерігається вірогідне зниження показників глікемії натще після першого року спостереження, потім утримується практично без змін упродовж всього спостереження. Постпрандіальна глікемія вірогідно знижується після першого року лікування, на другий рік підвищується й залишається в межах початкового рівня до кінця спостереження. Добова глюкозурія вірогідно знижується через рік після лікування і залишається в межах 1 % протягом трьох років. Діурез вірогідно не змінився протягом усіх років спостереження. Показник HbA1c вірогідно зменшився після першого року лікування, після другого дещо підвищився й залишався в середньому близько 9 % протягом трьох років. Добова доза інсуліну вірогідно була підвищена лише на другий рік лікування і до кінця спостереження залишалася практично без змін. Саме неадекватно підібраною дозою препаратів інсуліну можна пояснити недосягнення адекватної компенсації деякої частини хворих, включених у дослідження.
ІМТ поступово підвищувався протягом усього періоду дослідження, досягнувши вірогідного збільшення після двох років прийому препарату, і залишався практично незмінним протягом третього року застосування інсуліну.
Аналіз показників, наведений у табл. 2, показує, що у другій групі хворих, які приймали фіксовану суміш інсулінів, відзначається вірогідне зниження показників глікемії натще після першого року спостереження, потім утримується практично без змін протягом усього спостереження. Така ж закономірність спостерігається стосовно рівня постпрандіальної глікемії. Постпрандіальна глікемія вірогідно знижується після першого року лікування і залишається в межах зниженого рівня до кінця спостереження. Добова глюкозурія вірогідно знижується через рік після лікування і залишається в межах 1 % протягом усіх трьох років. Діурез вірогідно не змінився протягом всіх років спостереження. Показник HbA1c вірогідно зменшився після першого року лікування, а протягом трьох років лікування залишався в середньому близько 8 %. Добова доза інсуліну вірогідно не змінювалася протягом усього дослідження. ІМТ поступово підвищувався впродовж усього періоду дослідження, досягнувши вірогідного збільшення після двох років прийому препарату, і залишався практично незмінним протягом третього року застосування інсуліну.
Нами була виділена окремо група хворих, яким уперше був призначений інсулін, — 14 пацієнтів першої групи та 13 пацієнтів другої групи. Проаналізована динаміка глікемії протягом доби упродовж 21 дня.
Аналіз динаміки рівня глікемії протягом доби та вірогідне зниження показників глікемії після лікування в обох групах свідчать про ефективну гіпоглікемічну активність застосованих препаратів інсуліну. Середня добова доза становила у хворих першої групи 42,53 ± 3,13 ОД/добу, другої групи — 44,14 ± 3,04 ОД/добу. Аналіз прикінцевого рівня глікемії (21-й день лікування) не мав вірогідної різниці в обох групах пацієнтів, що є ознакою спорідненої гіпоглікемізуючої ефективності випробовуваних інсулінів.
Гіпоглікемії як критерій ефективності інсуліну Фармасулін Н, зафіксовані у 7 хворих, підтверджені лабораторно й супроводжувалися суб’єктивними та об’єктивними проявами (виникнення раптового відчуття голоду, тремору, оніміння кінчика язика, пітливість, слабкість). Рівень глікемії при цьому перебував у межах від 1,8 до 3,5 ммоль/л. З 13 хворих, які отримували Фармасулін Н 30/70, гіпоглікемії зафіксовані у 3 і супроводжувалися аналогічною симптоматикою та відповідали рівню глікемії від 1,9 до 4,0 ммоль/л. Майже у всіх випадках ступінь тяжкості гіпоглікемій розцінений як легкий, оскільки не потребував втручання інших осіб і корегувався вживанням вуглеводів. Тільки одній хворій було введено 40 мл 10% глюкози внутрішньовенно (глікемія 1,9 ммоль/л). ЦД у цієї пацієнтки був ускладнений діабетичною вегетативною полінейропатією, яка може маскувати прояви гіпоглікемій.
Дані лабораторних показників, наведених вище, підтверджувалися зменшенням кількості й вираженості характерних для ЦД скарг, а саме: зменшенням або зникненням спраги, відчуття сухості в роті, поліурії, загальної слабкості та швидкості стомлюваності.
Показники загального аналізу крові до і після лікування препаратами наведені в табл. 5 і 6. Величини цих показників перебували в межах норми та істотно не змінилися протягом випробувань.
Показники біохімічного аналізу крові пацієнтів обох груп за період дослідження вірогідно не змінилися.
У загальному аналізі сечі в обох групах пацієнтів найбільш істотними були зміни показників глюкозурії й відносної щільності, а саме: відзначалося зниження рівня цукру з 64,0 г/л (максимальний показник) на початку лікування до аглюкозурії (мінімальний показник у 12 хворих першої та 10 хворих другої груп) після лікування. Спостерігалося зменшення відносної щільності з 1035 до 1008 в основній та з 1038 до 1010 — у контрольній групах. Вірогідність змін із боку протеїнурії, лейкоцитурії, еритроцитурії, мікроскопії осаду до і після лікування препаратами в більшості хворих не відзначалося.
Динаміка скарг, характерних для ускладнень ЦД і не характерних для ЦД взагалі, в обох групах пацієнтів була також позитивною на тлі супутньої терапії.
Стосовно ускладнень ЦД слід відзначити, що за період трирічного спостереження двоє хворих першої групи перенесли інфаркт міокарда, в однієї хворої другої групи був констатований синдром діабетичної стопи з виразкою на великому пальці, яка за один місяць загоїлася. Відміни інсулінів або значної зміни дози інсулінів у цих хворих не було.
Переносимість препаратів Фармасулін Н та Фармасулін Н NP, Фармасулін Н 30/70 оцінювалась на підставі суб’єктивних скарг хворих, даних клінічного обстеження органів та систем пацієнтів з урахуванням динаміки лабораторних показників, наявності та характеру побічних явищ.
При проведенні аналізу застосування препаратів Фармасулін Н та Фармасулін Н NP, Фармасулін Н 30/70 будь-яких алергічних, гастроентерологічних, гематологічних, неврологічних побічних явищ зареєстровано не було.
Отже, сукупність наведених даних дає можливість стверджувати про безпеку препаратів Фармасулін Н та Фармасулін Н NP, Фармасулін Н 30/70 при лікуванні хворих на ЦД 2-го типу, яким необхідне проведення інсулінотерапії.
1. IDF (International Diabetes Federation). Diabetes Atlas. — 5th Edition. — 2011.
2. Unwin N., Whiting D., Roglic G. Social determinants of diabetes and challenges of prevention // Lancet. — 2010. — 375(9733). — 2204–2205.
3. Mercer B.N., Morais S., Cubbon R.M., Kearney M.T. Diabetes mellitus and the heart // Int. J. Clin. Pract. — 2012. — 66(7). — 640–647.
4. Паньків В.І. Індивідуальний підхід до лікування цукрового діабету 2–го типу: коли, кому і які альтернативні варіанти, окрім метформіну // Міжнародний ендокринологічний журнал. — 2013. — № 8 (56). — С. 36–39.
5. Stration M., Adlet A.I., Neil H.A. et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35) // BMJ. — 2000. — 321. — 405–412.
6. Полторак В.В., Красова Н.С., Горшунская М.Ю. Гликемическая память как патогенетическое основание для формирования алгоритма современной антидиабетической терапии // Международный эндокринологический журнал. — 2014. — № 3(59). — С. 15–21.
7. Inzucchi S.E., Bergenstal R.M., Buse J.B. et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care. — 2012. — 35(6). — 1364–1379.
8. Паньків В.І. Ефективний і безпечний контроль глікемії у хворих на цукровий діабет 2-го типу при застосуванні фіксованої комбінації пероральних цукрознижувальних препаратів / В.І. Паньків // Міжнародний ендокринологічний журнал. — 2013. — № 4. — С. 11–16.
9. Vaag A., Lund S.S. Insulin initiation in patients with type 2 diabetes mellitus: treatment guidelines, clinical evidence and patterns of use of basal vs premixed insulin analogues // Eur. J. Endo–crinol. — 2012. — 166(2). — 159–170.
10. Dale J., Martin S., Gadsby R. Insulin initiation in primary care for patients with type 2 diabetes: 3-year follow-up study. Primary Care // Diabetes. — 2010. — 4. — 85–89.
11. Ringborg A., Lindgren P., Yin D.D. et al. Time to insulin treatment and factors associated with insulin prescription in Swedish patients with type 2 diabetes // Diabetes and Metabolism. — 2010. — 36. — 198–203.
12. Инсулинотерапия при СД 2 типа: доказанные преимущества против надуманных барьеров. Avalable at http//www.dianews.ru/04/03/articles/04/01.shtm

/71/71.jpg)
/72/72.jpg)
/73/73.jpg)
/73/73_2.jpg)