Международный эндокринологический журнал 5 (61) 2014
Вернуться к номеру
Проблема сочетанного дефицита йода и селена в развитии заболеваний щитовидной железы
Авторы: Панькив В.И. - Украинский научно-практический центр эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины, г. Киев
Рубрики: Эндокринология
Версия для печати
В статье систематизированы научные данные о роли дефицита йода и селена в функционировании щитовидной железы (ЩЖ), его значимости в развитии тиреопатий. Приведены маркеры для определения обеспеченности организма йодом и селеном, дефицитные состояния, связанные с данными микроэлементами, и рекомендованы их физиологические суточные дозы. Сделан вывод о том, что применение соединений селена (в среднем 75 мкг/сутки) и йода (в среднем 150 мкг/сутки) с профилактической или лечебной целью в физиологических дозах безопасно, способно уменьшить выраженность или приостановить патологические процессы в ЩЖ, в том числе улучшить течение аутоиммунных заболеваний.
У статті систематизовано наукові дані про роль дефіциту йоду та селену у функціонуванні щитоподібної залози (ЩЗ), його значущість у розвитку тиреопатій. Наведено маркери для визначення забезпеченості організму йодом і селеном, дефіцитні стани, пов’язані з цими мікроелементами, та рекомендовано їх фізіологічні добові дози. Зроблено висновок про те, що застосування сполук селену (у середньому 75 мкг/до-
бу) і йоду (у середньому 150 мкг/добу) з профілактичною або лікувальною метою у фізіологічних дозах безпечно, здатне зменшити вираженість або призупинити патологічні процеси в ЩЗ, у тому числі покращити перебіг автоімунних захворювань.
The article organizes data on the role of iodine and selenium deficiency in the functioning of the thyroid gland (TG), its importance in the development of thyropathies. Markers needed to determine the provision of the organism with iodine and selenium are given, as well as deficiency conditions associated with these trace elements, and their physiological daily doses are recommended. It was concluded that the use of selenium compounds (average dose 75 μg/day) and iodine (average dose 150 μg/day) with the purpose of prevention or treatment in physiological doses is safe, can reduce the severity or inhibit pathological processes in TG, including improving the course of autoimmune diseases.
щитовидная железа, йод, селен, физиологические дозы, йододефицитные заболевания, тиреоглобулин, гипотиреоз, гипертиреоз, аутоиммунный тиреоидит.
щитоподібна залоза, йод, селен, фізіологічні дози, йододефіцитні захворювання, тиреоглобулін, гіпотиреоз, гіпертиреоз, автоімунний тиреоїдит.
thyroid gland, iodine, selenium, physiological doses, iodine deficiency disorders, thyroglobulin, hypothyroidism, hyperthyroidism, autoimmune thyroiditis.
Статья опубликована на с. 75-80
Заболевания щитовидной железы (ЩЖ), связанные с дефицитом йода, являются глобальной медико-социальной проблемой. К сожалению, население Украины в значительной степени подвержено патологическому влиянию йодного дефицита [1–5]. В ходе общенационального репрезентативного исследования обеспеченности населения микронутриентами, проведенного ГУ «Институт эндокринологии и обмена веществ имени В.П. Комиссаренко НАМН Украины», Институтом медицины труда НАМН Украины совместно с Детским фондом ООН, доказана актуальность проблемы йодного дефицита для всей территории Украины [1]. В последние годы мы наблюдаем четкие статистические закономерности роста патологии ЩЖ у лиц молодого трудоспособного возраста (20–50 лет), в первую очередь у женщин [4–6]. Данный факт имеет особое значение, так как функциональное состояние ЩЖ находится в прямой взаимосвязи с обеспечением репродуктивной функции. По картографическим данным ВОЗ, дефицит йода (от легкого до умеренного) выявляется на всей территории Украины [2]. Поэтому в настоящее время в Украине нет территорий, благополучных по обеспеченности йодом [1–4]. К тому же отсутствует национальная программа ликвидации йодного дефицита на государственном уровне.
Существует несколько общепринятых методов мониторинга йодного статуса населения. Поскольку 90 % поступившего в организм йода выводится почками, его концентрация в моче служит биомаркером количества йода, принятого незадолго до этого с пищей [2, 7]. Средняя концентрация йода в моче (медиана йодурии) может применяться исключительно для оценки йодного статуса населения на определенной территории в рамках общенациональных и субпопуляционных программ. Для оценки медианы йодурии исследование проводят в когорте детей школьного возраста, поскольку они в наибольшей степени отражают среднее потребление йода на данной территории в популяции в целом [2–4, 7]. Согласно рекомендации ВОЗ, суточная потребность в йоде составляет 150 мкг для взрослого (для беременных — 250 мкг/сут) [7, 8]. Достаточным считается обеспечение йодом при медиане йодурии 100–299 мкг/л у детей школьного возраста и > 150 мкг/л у беременных [2, 7].
Однако этот метод не применим для определения индивидуального йодного статуса пациентов по причине значительной вариабельности показателя медианы йодурии и трудоемкости исследования.
Достоверным методом оценки индивидуального йодного статуса является определение уровня тиреоглобулина (ТГ) в крови [7, 10]. ТГ — белок (гликопротеин), который концентрируется в ткани ЩЖ, является переносчиком йода и основой для синтеза тироксина (Т4) и трийодтиронина (Т3). ТГ — это строго специфичный компонент, который синтезируется только тканями ЩЖ. В тиреоцитах и в фолликулах ЩЖ он находится в разной стадии йодирования, где путем последовательных модификаций превращается в готовые молекулы гормонов. В норме ТГ не секретируется в кровь и у здоровых лиц в сыворотке крови может присутствовать лишь в ничтожно малых количествах. Синтез ТГ, его транспорт и расщепление регулируют тиреотропный гормон гипофиза (ТТГ) [11]. Таким образом, уровень концентрации ТГ в крови — это первый, наиболее чувствительный и специфичный маркер, позволяющий оценить функциональную активность ЩЖ и выявить нарушения еще на стадии начальных изменений, т.е. в фазе компенсации, когда уровень ТТГ и свободных (Т3) и (Т4) в крови находится в пределах нормы.
Нормальный уровень ТГ в сыворотке крови у здоровых лиц ≤ 10 нг/мл. Однако при наличии йодного дефицита и развитии зоба концентрация ТГ в крови резко возрастает. ТГ является одним из маркеров зобной эндемии, рекомендованных ВОЗ и ЮНИСЕФ для индивидуальной оценки текущего йодного статуса и мониторинга динамики улучшения обеспеченности организма йодом (табл. 1) [7, 10].
В условиях дефицита йода снижаются синтез и секреция гормонов ЩЖ Т4 и Т3, для которых йод является субстратом, что по принципу обратной связи приводит к повышению секреции ТТГ гипофиза. Путем ТТГ-зависимой стимуляции ЩЖ захватывает из крови все большее количество экзогенного (поступающего в организм с пищей и водой) йода и оптимизирует повторное использование эндогенного (содержащегося в организме) йода, т.е. включает компенсаторные механизмы для обеспечения эффективного синтеза тиреоидных гормонов. В связи с этим целесообразно упомянуть работу G.A. Bray [12], в которой показано, что одним из факторов, определяющих эффективность стимулирующего действия ТТГ в процессе тиреоидного гормонопоэза, является насыщенность йодом фолликулярных структур железы. Клетки с пониженным содержанием йода характеризуются повышенной чувствительностью к действию ТТГ даже при его содержании в крови на уровне нормальных значений. В этом отношении следует отметить, что нормальное морфологическое строение железы в регионах зобной эндемии не является доказательством ее нормального функционирования [12, 13, 18] в силу запуска ТТГ-стимулированных компенсаторных механизмов в ЩЖ — увеличения скорости обмена йода в быстро обменивающемся йодном пуле, повышения эффективности использования вновь поступающего йода и высвобождающегося в процессе метаболизма тиреоидных гормонов (отщепление йода при переходе Т4 в Т3). После истощения функциональных компенсаторных механизмов под влиянием ТТГ развиваются морфологические проявления зобной патологии — гипертрофия (увеличение в размерах) и гиперплазия (увеличение количества фолликулярных клеток) ЩЖ. Таким образом, формирование зоба является и компенсаторной реакцией ЩЖ, направленной на поддержание постоянной концентрации тиреоидных гормонов в организме [3, 7, 12–15].
Один из вариантов ТТГ-стимулированной адаптации ЩЖ в условиях йодного дефицита — преимущественный синтез и секреция Т3 (т.к. для его синтеза требуется не 4, а 3 атома йода). Дальнейшее повышение концентрации Т3 в крови, представляющего собой активную форму тиреоидного гормона, клинически проявляется синдромом гипертиреоза — казалось бы, состояния, прямо противоположного дефициту тиреоидных гормонов, однако по классификации ВОЗ закономерно относящегося к йододефицитным заболеваниям [11, 13, 16].
Нельзя не учитывать тот факт, что содержание стабильного йода определяет распределение и включение радиоактивного йода в тиреоидную ткань [7, 17]. Активно включающими радиоактивный йод являются фолликулы ЩЖ, которые менее всего насыщены йодом [17]. Обстоятельства ряда аварийных ситуаций и внештатных инцидентов демонстрируют высокую вероятность поступления радиоактивных элементов, ионизирующего излучения в окружающую среду и в организм человека. На этом основаны принципы аварийной йодной профилактики для защиты ЩЖ от воздействия радиоактивных изотопов [7].
Стабильный йод также определяет концентрации других микроэлементов в ЩЖ (участки депонирования кальция, избыточное накопление галогенов, в первую очередь брома). В этом отношении обращают на себя внимание научные работы, подтверждающие, что избыточные поступления некоторых микроэлементов в ЩЖ происходят в структуры, обедненные йодом [12, 13]. В результате формируются очаги локальной концентрации микроэлементов, в которых биохимические процессы, клеточная пролиферация, процессы мутагенеза и канцерогенеза могут протекать более интенсивно. Это является иллюстрацией сложных элементных соотношений в железе, которыми достигаются оптимальные условия интратиреоидного гормонопоэза. Истощение компенсаторных возможностей ЩЖ приводит к формированию явного или субклинического гипотиреоза, узлового зоба, функциональной автономии, а в отдельных случаях — к развитию злокачественных новообразований [5, 7, 11, 13, 14].
До середины прошлого века считалось, что эндемичные формы патологии ЩЖ обусловлены только дефицитом йода. Из этого следовало, что монотерапия препаратами йода является достаточной и высокоэффективной мерой. Тем не менее широкая пропаганда йодирования пищевой соли, дополнительного приема препаратов йода и продуктов, обогащенных этим микроэлементом, не оказала значительного влияния на рост заболеваемости, что дает основания обратить внимание на другие факторы, влияющие на развитие патологии ЩЖ [4, 9, 13, 15, 19].
В настоящий момент десятки тысяч фундаментальных исследований по биохимии, молекулярной фармакологии и клинической медицине позволяют подтвердить, что в профилактике и терапии йододефицитных состояний следует учитывать неразрывную связь метаболизма йода с метаболизмом других микроэлементов — в первую очередь селена, как основного молекулярного синергиста йода, имеющего важнейшее значение в функционирования ЩЖ [7, 9, 11, 13, 19–28].
Исследования влияния селена на ЩЖ широко проводятся во всем мире (Греция, Турция, Египет, Бразилия, Шри-Ланка, Китай, Япония) [9, 25, 26]. Важность не только йода, но и селена в лечении и профилактике заболеваний ЩЖ признают все специалисты, изучающие эту проблему [7, 9, 11, 13, 19–28]. На сегодняшний день достоверно установлено, что дефицит селена является одним из факторов развития тиреопатий. Снижение уровня селена в сыворотке крови ассоциируется с такими патологическими изменениями ЩЖ, как увеличение объема, изменение эхогенности, наличие узловых или коллоидных образований, лимфоидной инфильтрации. Кроме того, селен принимает участие в антиоксидантной защите тиреоцитов и активации тиреоидных гормонов, регулирует процессы апоптоза. Экспериментальными исследованиями доказано, что даже в условиях достаточного поступления йода длительный дефицит селена приводит к некрозу и фиброзу ЩЖ [7, 9, 22, 23].
Биологические эффекты селена на эндокринную систему проявляются посредством экспрессии порядка 30 селенопротеинов, активным центром которых является селен. Механизмы влияния большинства селенопротеинов на функцию ЩЖ расшифрованы относительно недавно (табл. 2) [19–23, 29, 30].
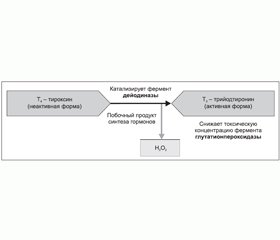
Особый интерес в плане рассматриваемой проблемы представляют биохимические и метаболические взаимодействия между йодом и селеном в процессе метаболизма тиреоидных гормонов (рис. 1) [19–23, 29, 30]. Одной из причин невозможности полной ликвидации эндемического зоба и кретинизма путем добавления в рацион йода в йододефицитных регионах является то, что недостаток селена обусловливает снижение синтеза ферментов, принимающих участие в активации и регуляции баланса тиреоидных гормонов, и добавление йода не компенсирует этот дефект. В результате полученных данных становится понятным, почему в экспериментальных исследованиях с селеновой недостаточностью снижалась конверсия Т4 в Т3, что приводило к развитию симптомов гипотиреоза [31, 32]. Зная механизм действия дейодиназ, можно сделать вывод, что прием левотироксина с целью восполнения дисбаланса тиреоидных гормонов на фоне дефицита селена будет менее эффективен, т.к. селен необходим для периферической активации Т4 [20–22].
В условиях селенодефицита возрастает цитотоксическое действие перекиси водорода, как побочного продукта синтеза тиреоидных гормонов, на ткань ЩЖ (рис. 1). Влияние данного патологического фактора может провоцировать рост титра антитиреоидных антител (АТ-ТПО и АТ-ТГ) и в конечном счете приводить к развитию аутоиммунных тиреопатий, что было продемонстрировано рядом исследований [24, 33, 34], анализирующих долгосрочные результаты йодопрофилактики с помощью йодированной соли без восполнения дефицита селена.
В частности, в итальянском исследовании [34] проведен анализ 15-летнего наблюдения (n = 1148) результатов добровольной йодной профилактики (1995–2010 гг.). Безусловно, значительный позитивный эффект был отмечен в плане влияния на развитие зоба — в 2010 году его распространенность была достоверно ниже, чем в 1995 году (25,8 % против 46,1 %, р < 0,0001), в основном за счет сокращения случаев диффузного зоба (10,3 % против 34,0 %, р < 0,0001), функциональной автономии ЩЖ (0,5 % в 2010 г. против 2,5 % в 1995 г., р = 0,004). Случаи гипертиреоза также выявлялись значительно реже (1,4 % в 2010 г. по сравнению с 4,5 % в 1995 г., р = 0,03). Однако выявление в сыворотке крови аутоантител к ЩЖ (19,5 % в 2010 г. против 12,6 % в 1995 г., р < 0,0001) и распространенность аутоиммунного тиреоидита (АИТ) (14,5 % против 3,5 %; р < 0,0001) были более частыми в 2010, чем в 1995 году.
В контексте данной проблемы большинство специалистов расценивают селен как недостающее звено для успешного лечения и профилактики тиреопатий, связанных с дефицитом йода [9, 29–32, 35–38]. Дополнительный прием селена в физиологических дозах до 75 мкг/сут на протяжении 6–12 месяцев [9, 20–23, 25, 26, 28–30, 35, 36] ассоциируется с достоверным снижением титра антитиреоидных антител (АТ-ТПО), способствует угнетению аутоиммунного процесса и улучшению эхогенной структуры по данным УЗИ. Сочетанный прием йода и селена позволяет обезопасить пациента от риска развития АИТ и рекомендован Европейской тиреоидной ассоциацией (European Thyroid Association) с целью полноценной йодной профилактики в условиях природного дефицита йода [25].
Украина, как континентальное государство, находится в зоне постоянного влияния дефицита селена в почве [20–23, 39]. Ситуация усугубляется системой ведения сельского хозяйства с использованием синтетических удобрений на основе серы и фосфора, которые еще больше обедняют почву по содержанию селена, таким образом, восполнить дефицит данного микроэлемента с помощью продуктов питания крайне затруднительно. По рекомендации FDA (Food and Drug Administration — Управление по контролю качества пищевых продуктов и медикаментов в США) в организм взрослого человека должно поступать в среднем 70 мкг/сутки селена для взрослых мужчин и 55 мкг/сутки — для женщин. Большинством исследователей величина до 350–400 мкг рассматривается как безопасная суточная доза селена.
Согласно данным исследования [39], проведенного Европейской организацией по содействию профилактике рака (The European Organisation for Cooperation in Cancer Prevention Studies) в 10 странах Европы (n = 502), показатель уровня селена в сыворотке крови находится в пределах 63–100 мкг/л (при норме 120 мкг/л), что соответствует умеренному дефициту селена на европейском континенте. Исследования этого вопроса, проведенные на региональном уровне, подтвердили дефицит селена в Волынской, Ивано-Франковской, Сумской, Черниговской и Киевской областях [22, 23, 27, 28, 40]. Масштабные эпидемиологические исследования данного показателя в Украине проводились еще во времена Советского Союза, когда был выявлен умеренный дефицит селена [22]. Вторая проблема заключается в крайне низкой информированности населения о существовании дефицита селена и его последствиях в плане влияния на функцию ЩЖ и организм в целом. Понимание существующей проблемы на уровне научного и профессионального сообщества совершенно необходимо для разработки плана мероприятий, направленных на ее устранение.
Сочетанный дефицит йода и селена усугубляет проблему йодной недостаточности и результирующей зобной эндемии в Украине, что находит свое отражение в структуре заболеваемости ЩЖ: в настоящий момент мы наблюдаем рост не только гипертрофических и гиперпластических процессов в ЩЖ, но и аутоиммунных тиреопатий [6]. В данном контексте представляют интерес проведенные в Украине исследования [22, 27, 28], которые подтверждают перспективность комбинированного приема йода и селена как способа лечения и профилактики йододефицитных заболеваний, позволяющего оказывать влияние на механизм антиоксидантной защиты ЩЖ и конверсии Т4 в Т3. В рамках исследования [27] у пациентов с патологией ЩЖ (n = 54, Киевская и Черниговская области) было подтверждено снижение уровня селена в сыворотке крови пациентов. Основной причиной развития диффузного зоба у данной категории пациентов является йододефицит, а дефицит селена выступает в роли дополнительного отягощающего фактора данного заболевания. Сочетанное применение йода и селена в лечении диффузного зоба приводит к улучшению течения заболевания и уменьшению размеров зоба у пациентов, принимавших участие в исследовании.
В другом исследовании (n = 121, Прикарпатье) [28] изучались особенности течения беременности на фоне аутоиммунной тиреопатии и природного дефицита йода. Впервые было установлено, что у беременных с умеренным и легким йододефицитом прием препаратов йода в дозе 200 мкг/сут вызывает ожидаемый рост экскреции йода с мочой, но не приводит к достижению вероятного клинического эффекта. Доказано, что повышенный уровень антител к ТПО является фактором высокого риска развития осложнений беременности. Разработан алгоритм тактики ведения беременных с повышенным титром АТ-ТПО и угрозой прерывания беременности в условиях йодной эндемии на фоне аутоиммунных тиреопатий и природного дефицита йода с включением препаратов йода и селена.
Таким образом, мы можем заключить, что сочетанный дефицит йода и селена усиливает нарушение функции ЩЖ, возникающее на фоне йодной недостаточности. При этом Украина остается в числе тех стран, где решение вопроса отсутствует на государственном уровне, а степень осознания важности данной проблемы делает комментарии ситуации излишними, что требует мобилизации медицинской общественности с целью разработки и принятия адекватных стандартов оказания медицинской помощи населению. В частности, не следует пренебрегать проведением анализа на ТГ как прямой возможностью подтверждения факта йододефицита у конкретного пациента, что переводит адекватную йодную профилактику из профилактических мер в категорию обоснованной и необходимой терапии. Наш собственный опыт в данном вопросе демонстрирует крайне печальные факты: в абсолютном большинстве случаев у пациентов с патологией ЩЖ этот показатель значительно повышен, встречаются пациенты с уровнем ТГ 400–500 нг/мл (при норме 10 нг/мл), и это далеко не редкость. В контексте рассматриваемой проблемы сочетанного дефицита актуальным является назначение лечебно-профилактических средств, обеспечивающих одновременное поступление в организм йода и селена в пределах норм суточной физиологической потребности и в соотношении, которое обеспечивает сбалансированное образование тиреоидных гормонов и антиоксидантную защиту ЩЖ.
1. Звіт «Про національне дослідження вживання населенням харчових мікронутрієнтів». — Київ: Прем’єрМедіа, 2004. — 64 с.
2. Pearce E.N., Andersson M., Zimmermann M.B. Глобальная ситуация с обеспечением йодом в 2013 году // Здоров’я України. Тематичний номер «Ендокринологія». — Червень 2013. — С. 34–35.
3. Зелинская Н.Б., Маменко М.Е. Йододефицитные заболевания в Украине: современное состояние проблемы и возможные пути ее решения // Здоровье Украины. — Ноябрь 2007. — № 22(11).
4. Бруно Де Бенуа, Швец О.В. Устранение дефицита йода — одна из ключевых задач здравоохранения // Международный эндокринологический журнал. — 2011. — № 6(38).
5. Коваленко А.Е., Омельчук А.В., Давыдова Ю.В. Хирургическое лечение заболеваний щитовидной железы у беременных // Здоров’я України. Тематичний номер «Ендокринологія». — Жовтень 2009. — С. 40–42.
6. Чернобров А.Д. Динаміка захворюваності населення України на тиреоїдну патологію у 2000–2009 роках // Ендокринологія. — 2010. — Т. 15, № 2. — С. 350–351.
7. Стандарти надання медичної допомоги хворим з патологічними станами щитоподібної залози в умовах дії негативних чинників довкілля: Методичний посібник / Камінський О.В., Афанасьєв Д.Є., Коваленко О.М. — К.: ТОВ «День печати», 2012. — 164 с.
8. UNICEF/WHO. Reaching Optimal Iodine Nutrition in Pregnant and Lactating Women and Young Children. Dept. of Nutrition for Health and Development, World Health Organization, Geneva, Switzerland, 2007.
9. Jaminet P. Iodine and Hashimoto’s Thyroiditis. Part 2. Perfect Health diet. — May 2011 // http://perfecthealthdiet.com
10. Власенко М.В., Паламарчук А.В., Прудіус П.Г. та ін. Протокол діагностики та лікування хворих із вузловою формою зоба (методичні рекомендації) // Вінниця: ТОВ «Меркьюрі-Поділля», 2003. — 71 с.
11. Щитовидная железа. Фундаментальные аспекты / Под ред. проф. А.И. Кубарко и проф. S. Yamashita. — Минск; Нагасаки, 1998. — 368 с.
12. Bray G.A. Increased sensitivity of the thyroid in iodinedepleted rats to the goitrogenic effects of thyrotropin // J. Clin. Invest. — 1968. — Vol. 47. — P. 1640–1647.
13. Сушко С.Н., Маленченко А.Ф., Бажанова Н.Н., Шафорост А.С., Миронов В.П., Кудина О.П. Микроэлементы щитовидной железы жителей г. Минска и Гомельской области // Экологический вестник. — 2013. — № 1(23). — С. 47–54.
14. Laurberg P., Bulow Pedersen I., Knudsen N., Ovesen L. & Andersen S. Environmental iodine intake affects the type of nonmalignant thyroid disease // Thyroid. — 2001. — 11. — Р. 457–469.
15. МаменкоМ.Є., Єрохіна О.І., Головченко Н.М. Профілактика та лікування ендемічного зоба в регіонах із високою поширеністю поєднаного дефіциту йоду та заліза // Український медичний альманах. — 2008. — Т. 11, № 5. — С. 101–104.
16. Фадеев В., Перминова С., Назаренко Т. и др. Патология щитовидной железы и беременность // Врач. — 2008. — № 5. — С. 11–16.
17. Меркулов М.Ф. Применение радиоактивных изотопов в клинических и экспериментальных исследованиях / М.Ф. Меркулов. — М., 1958. — 126 с.
18. Canaris G.J., Manowitz N.R., Mayor G., Ridgway E.C. The Colorado thyroid disease prevalence study // Arch. Intern. Med. — 2000. — Vol. 160. — P. 526–534.
19. Громова О.А., Торшин И.Ю., Кошелева Н.Г. Молекулярные синергисты йода: новые подходы к эффективной профилактике и терапии йоддефицитных заболеваний у беременных // РМЖ: Мать и дитя. Акушерство и гинекология. —2011. — Т. 1.
20. Хохлова Е.А. Селен и щитовидная железа: точка зрения // Новая аптека. — 2013. — № 6. — C. 82–84.
21. Холодова Е.А., Коломиец Н.Д., Мохорт Е.Г. Влияние дефицита селена на функцию щитовидной железы в подростковом возрасте // Клиническая и экспериментальная тиреоидология. — 2006. — Т. 2, № 2. — C. 43–47.
22. Гончарова О.А., Прилуцкий А.С. Роль препаратов селена в терапии аутоиммунного тиреоидита // Здоровье Украины. Тиреоидология. — 2012. — № 2(69).
23. Коржинський Ю.С., Слівінська-Курчак Х.Б. Cелен: біологічна роль і потреба дитячого організму // Медицина транспорту України. — 2011. — № 4.
24. Zois C., Stavrou I., Kalogera C. et al. High prevalence of autoimmune thyroiditis in schoolchildren after elimination of iodine deficiency in northwestern Greece // Thyroid. — 2003. — Vol. 13, № 5. — P. 485–489.
25. Hennemann G. Report of the 29th Annual Meeting of the European Thyroid Association, Edinburgh, Scotland, 2004. Accessed at Hot Thyroidology // www.hotthyroidology.com
26. Duntas L.H., Mantzou E., Koutras D.A. Effects of six–month treatment selenium in patients with autoimmune thyroiditis // Eur. J. Endocrinol. — 2003. — Vol. 148. — P. 389–393.
27. Тронько М.Д., Кравченко В.І., Постол С.В., Осадців О.І. Спосіб лікування йодозалежних захворювань щитоподібної залози: Патент № 85798 / ДУ «Інститут едокринології та обміну речовин ім. В.П. Комісаренка НАМН України». — 01/2006.
28. Тимків І.С. Вплив тиреоїдної дисфункції на виношування вагітності в умовах ендемічної місцевості: Автореф. дис... канд. мед. наук / Тернопільський державний медичний університет ім. І.Я. Горбачевського. — Тернопіль, 2007.
29. Шабалина Е.А., Моргунова Т.Б., Орлова С.В., Фадеев В.В. Cелен и щитовидная железа // Клиническая и экспериментальная тиреоидология. — 2010. — T. 7, № 2. — С. 7–18.
30. Ляхнович Н.А., Гутикова Л.В. Роль йода и селена в гормональной регуляции функции щитовидной железы при беременности // Медико-биологические проблемы жизнедеятельности. — 2013. — № 2(10). — С. 13–23.
31. Bates J.M., Spate V.L., Morris J.S. et al. Effects of selenium deficiency on tissue selenium content, deiodinase activity, and thyroid hormone economy in the rat during development // Endocrinol. — 2000. — Vol. 141. — P. 2490–2500.
32. St. Germain D.L., Hernandez A., Schneider M.J. et al. Insights intothe role of deiodinasesfrom studies of genetically modified animals // Thyroid. — 2005. — Vol. 15. — Р. 905–916.
33. Emral R., Baştemir M., Erdoğan G., Güllü S. High prevalence of thyroid dysfunction and autoimmune thyroiditis in adolescents after elimination of iodine deficiency in Eastern Black Sea Region of Turkey // Turkish Journal of Endocrinology and Metabolism. — 2006. — Р. 13–20.
34. Aghini Lombardi F., Fiore E., Tonacchera M. et al. The Effect of Voluntary Iodine Prophylaxis in a Small Rural Community: The Pescopagano Survey 15 Years Later // J. Clin. Endocrinol. Metab. — 2013. — Vol. 98(3). — Р. 1031–1039.
35. Kohrle J. The selenoenzyme family of deiodinase is ozymes controls local thyroid hormone availability [Text] / J. Kohrle // Rev. Endocr. Metab. Disord. — 2000. — № 1. — P. 49–58.
36. Gartneretal R. Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations [Text] // J. Clin. Endocrinol. Metab. — 2002. — Vol. 87. — P. 1687–1691.
37. Turker O., Kumanlioglu K., Karapolat I. et al. Selenium treatment in autoimmune thyroiditis: 9-month follow-up with variable doses // Journal of Endocrinology. — 2006. — Vol. 190. — Р. 151–156.
38. Tou K.A. Toulis, Anastasilakis A.D., Tzellos T.G. et al. Selenium supplementation in the treatment of Hashimoto's thyroiditis: a systematic review and a meta-analysis // Thyroid. — 2010. — № 20. — Р. 1163–1173.
39. Thorling E.B. et al. Selenium status in Europe-human data. A multicenter study // Ann. Clin. Res. — 1986. — Vol. 18(1). — Р. 3–7.
40. Караченцев Ю.И., Гончарова О.А., Подорога Е.И. и др. Обеспеченность селеном отдельных регионов Сумской области и особенности частоты патологии щитовидной железы // Международный эндокринологический журнал. — 2013. — № 5(53).

/76/76.jpg)
/77/77.jpg)
/78/78.jpg)