Международный эндокринологический журнал 5 (61) 2014
Вернуться к номеру
Адипонектин та цукровий діабет 2-го типу (патогенетичні аспекти як підґрунтя для оптимізації антидіабетичної фармакотерапії)
Авторы: Полторак В.В. - ДУ «Інститут проблем ендокринної патології імені В.Я. Данилевського НАМН України»;
Горшунська М.Ю. - Харківська медична академія післядипломної освіти; Красова Н.С. - ДУ «Інститут проблем ендокринної патології імені В.Я. Данилевського НАМН України»
Рубрики: Эндокринология
Версия для печати
Огляд присвячено ролі дисфункції жирової тканини, в першу чергу гіпоадипонектинемії, у розвитку цукрового діабету 2-го типу та його кардіоваскулярних ускладнень. Акцентуються переваги пероральних препаратів, яким притаманний реабілітуючий вплив на рівні адипонектину в циркуляції, при формуванні алгоритму сучасної антидіабетичної фармакотерапії.
Обзор посвящен роли дисфункции жировой ткани, в первую очередь гипоадипонектинемии, в развитии сахарного диабета 2-го типа и его кардиоваскулярных осложнений. Акцентируются преимущества пероральных препаратов, которым присуще реабилитирующее влияние на уровни адипонектина в циркуляции, при формировании алгоритма современной антидиабетической фармакотерапии.
The review deals with the role of adipose tissue dysfunction, primarily hypoadiponectinemia, in the development of diabetes mellitus type 2 and its cardiovascular complications. There are accentuated the benefits of oral medications, which have the rehabilitative effect on adiponectin levels in the circulation, during the formation of modern antidiabetic pharmacotherapy algorithm.
адипонектин, цукровий діабет 2-го типу, глімепірид.
адипонектин, сахарный диабет 2-го типа, глимепирид.
adiponectin, diabetes mellitus type 2, glimepiride.
Статья опубликована на с. 95-104
Останніми десятиріччями зафіксовано критичне збільшення частоти ожиріння внаслідок сучасного способу життя як у розвинених країнах, так і у країнах, що розвиваються [1]. Сьогодні у всьому світі налічують близько 1,5 млрд дорослих із надлишковою вагою, серед яких понад 500 млн мають ожиріння [2]. Результати клінічних та експериментальних досліджень підкреслюють зв’язок ожиріння з такими хронічними захворюваннями, як цукровий діабет 2-го типу (ЦД2), атеросклероз та кардіоваскулярна хвороба (КВХ) [3].
Слід зазначити, що жирова тканина складається не тільки з адипоцитів, а й включає судинно-стромальну фракцію, у якій представлені макрофаги, фібробласти, ендотеліальні клітини та преадипоцити [4]. Первинна та класична роль жирової тканини — це ізоляція та амортизація тіла, зберігання вільних жирних кислот (ВЖК) після прийому їжі та їх вивільнення натще для забезпечення енергією. У постпрандіальній фазі ВЖК мобілізуються з крові в жирову тканину після гідролізу тригліцеридів (ТГ) з багатих на ТГ ліпопротеїнів за допомогою ліпопротеїнліпази (ЛПЛ), а мобілізація цих резервів відбувається внаслідок гідролізу ТГ адипоцитів за допомогою гормон-чутливої ліпази (ГЧЛ). Інсулін є основним регулятором складу жиру адипоцитів з огляду на те, що він є основним регулятором ГЧЛ та важливим активатором ЛПЛ, підвищуючи у такий спосіб засвоєння ВЖК та синтез ТГ в адипоцитах.
Таким чином, зберігання енергії визначалося як первинна роль білої жирової тканини окремо від забезпечення температурної та механічної ізоляції [5]. Але погляди на жирову тканину протягом останніх 25 років суттєво змінилися. Так, у середині 1980-х років у дослідженнях лабораторій Spiegelman та Flier [6] уперше було виявлено, що адипоцити є джерелом специфічних секреторних білків — адипсину та фактора комплементу D. Однак ключовим моментом, що вплинув на формування сучасного погляду на жирову тканину як місце секреції протеїнових сигналів, стало відкриття лептину [7]. Лептин — цитокіноподібний гормон із широким спектром біологічних функцій, представив адипоцити як ендокринні клітини, а білу жирову тканину як гормонопродукуючий орган. Приблизно в той самий час ряд авторів описали білок, спочатку названий Acrp30, а потім відомий як адипонектин [8–10].
Сьогодні доведено, що жирова тканина є активним ендокринним органом, який секретує безліч субстанцій регуляції метаболічних та фізіологічних процесів [2, 11]. Ці хімічні месенджери, колективно названі адипоцитокінами внаслідок їх структурної подібності до цитокінів, або «адипокінами», включають фактор некрозу пухлини a (ФНП-a), адипонектин, лептин, резистин, вісфатин, ретинолзв’язуючий протеїн-4, васпін, оментин тощо [11–15]. Використовуючи адипокіни як один з основних засобів комунікації, адипоцити впливають на печінку, м’язи, мозок, репродуктивну систему, панкреатичні b-клітини та судини [16]. З іншого боку, порушена функція адипоцитів бере участь в генезі хронічного прозапального стану, асоційованого з ожирінням [17]. Так, гіпертрофія адипоцитів призводить до дисбалансу між про-/антизапальними адипокінами. З іншого боку, жирова тканина є важливим запальним джерелом за ожиріння та ЦД2 не тільки завдяки адипоцитокінам, а й у зв’язку з її інфільтрацією макрофагами [18], оскільки не тільки адипоцити, але й кількість макрофагів у жировій тканині збільшується при ожирінні. Завдяки тому, що низка адипокінів суттєво впливає на чутливість до інсуліну, глюкозний та ліпідний метаболізм, запалення та атеросклероз, вони можуть забезпечувати молекулярний зв’язок між ожирінням та розвитком метаболічного синдрому, ЦД2 та КВХ.
Серед усіх адипокінів, що секретуються жировою тканиною, особливу увагу привертає адипонектин, який продукується виключно адипоцитами [9–11] і відіграє детермінуючу роль у забезпеченні енергетичного та метаболічного гомеостазу за рахунок унікального поєднання притаманних йому плейотропних ефектів (антиатерогенних, антизапальних, інсуліносенситайзерних, інсуліноміметичних та антионкогенних) [19]).
Адипонектин є генним продуктом найбільш поширеного жирового генного транскрипта-1 (арМ1) [10]. Цей адипокін, також відомий під назвою Асr30 [8], AdipoQ [9], apM1 [10] або GBP28 [20], був незалежно ідентифікований чотирма групами дослідників із використанням різних методичних підходів. Адипонектин являє собою колагеноподібний протеїн, що синтезується виключно в білій жировій тканині під час диференціації адипоцитів та циркулює у відносно високій концентрації в сироватці. Наявні сьогодні дані дозволяють говорити, що адипонектин відіграє важливу роль у модуляції метаболізму глюкози та ліпідів в інсуліночутливих тканинах людини і тварин.
Адипонектин — білок (244 амінокислоти), що складається із чотирьох доменів (N-кінцева сигнальна послідовність, варіабельна ділянка, колагеновий домен та С-кінцевий глобулярний домен) [8, 21, 22]. За первинною амінокислотною послідовністю та структурою глобулярного домену він подібний до Cq1-члена комплемент-спорідненої родини білків [23, 24]. Більше того, кристалографічно доведена структурна гомологія глобулярного фрагменту із ФНП-a наводить на думку щодо еволюційного зв’язку між ФНП-a та адипонектином [21]. Блоком адипонектину є тример, що формується шляхом асоціації трьох мономерів у глобулярних доменах. Адипонектин у циркуляції людини або мишей, а також адипонектин, експресований у NIH-3T3 фібробластах або E.coli, утворює широкий спектр мультимерів: тример низької молекулярної маси (НММ), гексамер середньої молекулярної маси та 12–18-мерний адипонектин високої молекулярної маси (ВММ) [25, 26]. У плазмі людей та в середовищі культури адипоцитів адипонектин існує головним чином як гексамери НММ (близько 190 кДа) та мультимери ВММ (більше ніж 310 кДа) [19, 26] і циркулює в концентрації від 5 до 30 мкг/мл [8, 21, 27].
Сьогодні зафіксовано взаємозв’язок адипонектину та його циркулюючих мультимерних форм із клінічними і метаболічними характеристиками метаболічного синдрому при дослідженні хворих із включенням пацієнтів із ЦД2 [28–31], а за результатами 7-річного амбулаторного спостереження хворих на ішемічну хворобу серця (ІХС) рівні адипонектину ВММ були обернено асоційовані із тяжкістю ІХС та являли собою потужний предиктор вторинних кардіоваскулярних подій [32]. Збільшення співвідношення ВММ/загальний адипонектин асоційоване із стабільним станом товщини комплексу інтима-медіа [33], а форми адипонектину ВММ були найбільш асоційованими із затримкою розвитку ІХС на початкових стадіях та зниженням маси тіла [34] і діяли як інсулін-сенситайзери [35]. Іn vitro доведено, що адипонектин ВММ являє собою єдину мультимерну форму, що запобігає апоптозу судинних ендотеліальних клітин [34].
Kлінічні дослідження доводять селективне зменшення рівнів адипонектину ВММ у хворих на ЦД2 і IXC, а зменшення маси тіла збільшує рівень адипонектину ВММ, не впливаючи на комплекси НММ [34–36]. Так, модифікація способу життя (збільшення фізичного навантаження та обмеження калоражу) протягом трьох місяців поряд із зменшенням індексу маси тіла та окружності талії підвищувала рівні адипонектину ВММ, але не загального адипонектину в 16 японських чоловіків із метаболічним синдромом [37]. За результатами великого дослідження «випадок — контроль» (Nurses Health Study) початково здорових жінок, у яких протягом 12–річного амбулаторного спостереження розвинувся ЦД2 (1038 осіб), та 1136 осіб групи контролю показано, що високі базальні рівні загального та ВММ адипонектину були асоційовані з суттєво меншим ризиком ЦД2 [38].
Доведено, що адипонектин стимулює тирозинкіназну активність без прямого контакту з інсуліновими рецепторами, сприяє фосфорилюванню за тирозином субстрату-1 та субстрату-2 інсулінового рецептора та активує синтез глікогену через множинні внутрішньоклітинні сигнали [39]. Крім того, наявні повідомлення щодо підвищення під впливом адипонектину фосфориляції та активності 5’-АМФ-активованої протеїнкінази та одночасного підвищення поглинання глюкози міоцитами та клітинами печінки, що безпосередньо регулює глюкозний метаболізм та чутливість до інсуліну [40].
Адипонектин також інгібує запальний процес та атерогенез шляхом пригнічення міграції моноцитів/макрофагів і їх трансформації в пінисті клітини [39–43]. Рівень його парадоксально зменшується за наявності вісцерального ожиріння. Так, низькі циркуляторні рівні адипонектину визначено в мишей із генетичним або викликаним дієтою ожирінням [44] та в людей з аліментарним ожирінням [45]. У людей рівні адипонектину значуще нижчі за наявності інсулінорезистентності та ЦД2 [46–48] і можуть суттєво підвищуватися під впливом терапії тіазолідиндіонами (ТЗД) — агоністами рецепторів РРАR-y (peroxisome proliferator-activated receptor-y, активований проліфератором пероксисом рецептор y), функцією яких у жировій тканині є індукція проліферації адипоцитів [49–53], а також після швидкої втрати ваги. Наприклад, після баріатричної хірургічної операції та гіпокалорійної дієти [54].
Обернена асоціація між загальним адипонектином та ризиком ЦД2 доведена у проспективних дослідженнях багатьох популяцій, а саме: індіанців Pima [55], європейців [56–58], азіатів [59–61] та американців японського походження [62]. Так, у проспективному дослідженні 3599 людей без ЦД впродовж 5 років низький адипонектин був асоційований із збільшеним ризиком ЦД2 навіть після корекції традиційних чинників ризику [55]. Подібні результати отримані в 9-річних дослідженнях 10 275 учасників Atherosclerosis Risk in Communities Study та Hoorn Study (афроамериканці та европеоїди) [58, 63]. Більше того, у групі родичів першого ступеня пацієнтів із ЦД2 знайдена більш виражена інсулінорезистентність та значущо менші рівні мРНК адипонектину в жировій тканині [64]. Ці дані формують уявлення, що відносно розвитку ЦД2 дисрегуляція експресії гена адипонектину передує інсулінорезистентності.
Низькі рівні адипонектину асоційовані з розвитком гіпертензії [65] та ІХС [66, 67] і корелювали з негнучкістю а.саrotis у хворих на ЦД2 [68]. Обернений зв’язок між рівнями адипонектину в плазмі крові та швидкістю пульсової хвилі в аорті верифіковано у хворих з артеріальною гіпертензією (АГ) [69], а рівні адипонектину у хворих на ЦД2 з ІХС нижчі, ніж у хворих на діабет без ІХС, що свідчить про антиатерогенні властивості цього гормону [70]. Зокрема, концентрація адипонектину була обернено асоційована з об’ємом бляшок в коронарній артерії [71]. Повідомлено також про експериментально визначену пригнічуючу дію адипонектину на ангіогенез [72], зменшення атеросклерозу [73] та гальмування гіпертрофії серця [74]. Крім того, адипонектин гальмує проліферацію гладеньком’язових судинних клітин [27] і накопичується в інтимі ушкоджених катетером судин [75]. Додатково адипонектин проявляє антиатерогенну активність завдяки регуляції поляризації макрофагів [76]. Так, унаслідок стимуляції адипонектином моноцити людини диференціюються у протизапальні макрофаги М2 замість трансформації у класичний активований фенотип М1.
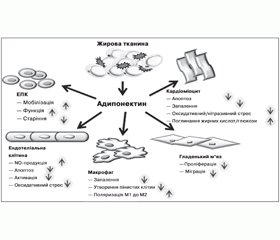
Результати низки клінічних досліджень засвідчують асоціацію низьких рівнів адипонектину з атерогенним ліпідним профілем [70, 77], ожирінням, інсулінорезистентністю, ІХС та дисліпідемією, що вказує на потенційну роль зниження рівня цього адипоцитокіну в генезі метаболічного синдрому, ЦД2 та асоційованого передчасного атеросклерозу (рис. 1).
Крім того, за останніми даними, низькі рівні адипонектину після пологів у жінок із гестаційним ЦД втричі підвищують ризик розвитку ЦД2 протягом наступних двох років незалежно від наявності інших чинників ризику, таких як ожиріння, інтенсивність лактації тощо [79].
Таким чином, доведені сьогодні виражені антидіабетичні [21, 40, 44, 80] та антиатерогенні [27, 81–83] властивості адипонектину як in vitro, так і in vivo в поєднанні з клінічними доказами гіпоадипонектинемії в осіб з інсулінорезистентністю [48, 70] та ІХС [81], участь генетичних мутацій гена адипонектину у формуванні низьких циркуляторних рівнів адипонектину за наявності синдрому інсулінорезистентності [84], а також предикторна роль гіпоадипонектинемії щодо розвитку ЦД2 у індіанців Pima [55], як і передування зменшеної секреції адипонектину розвитку гіперінсулінемії та гіперглікемії у мавп із моделлю діабету, індукованого надлишковим споживанням їжі [85], обґрунтовують перспективність терапії, що може збільшувати продукцію та секрецію адипонектину за умов різного ступеня проявів синдрому інсулінорезистентності, включаючи інсулінорезистентний ЦД2 та атеросклероз.
Слід зазначити, що сучасна терапевтична стратегія менеджменту глікемічного контролю у хворих на ЦД2 спрямована переважно на зменшення резистентності до інсуліну, а не на надфізіологічне стимулювання секреції інсуліну [86], зважаючи на домінантну роль порушення інсулінового сигналінгу в генезі більшості випадків ЦД2 та асоційованих макросудинних захворювань (атеросклероз, гіпертонічна хвороба). Надалі за умов недостатньої ефективності препаратів першої лінії, що підвищують чутливість до інсуліну, рекомендовано поєднання із секретагогами (патологічно обґрунтована перевага препаратів з ощадливою стимуляцією панкреатичних b-клітин). На жаль, нові інсулін-сенситайзери, такі як ТЗД, при тривалому використанні асоційовані з підвищенням небажаних кардіоваскулярних подій (інфаркт міокарда, інсульт та хронічна серцева недостатність) [87, 88]. Однак слід зауважити, що висновок стосовно кардіоваскулярної токсичності представника ТЗД розиглітазону (підвищення на 43 % випадків інфаркту міокарда) [89] не збігається з результатом двох завершених досліджень (ADOPT, DREAM) [90, 91] та одного, що триває (RECORD) [92].
З іншого боку, за даними ретроспективного аналізу американської бази даних (історії хвороби хворих на ЦД2) доведено зв’язок значущого збільшення кардіоваскулярних подій (інфаркт міокарда та інсульт) у діабетичного загалу (група високого ризику) на тлі терапії розиглітазоном та відсутність такого несприятливого ефекту в піоглітазону [88]. Суперечливість наведених результатів обґрунтовує думку про необхідність подальшого спостереження та метааналізу всіх наявних результатів для кінцевого висновку щодо кардіоваскулярної токсичності/безпеки ТЗД, зокрема розиглітазону [88, 93].
У той же час необхідно відзначити дані метааналізу великої (2 157 608 осіб) когорти пацієнтів, що свідчать про підвищення ризику розвитку раку сечового міхура у хворих на ЦД2 за умов терапії піоглітазоном [94], а нещодавні експериментальні роботи на мишах продемонстрували зростання поглинання їжі та збільшення маси тіла, незважаючи на поліпшення чутливості до інсуліну та лептину в гіпоталамусі тварин з ожирінням, яких лікували піоглітазоном [95].
Слід зазначити, що увага до ТЗД обумовлена тим, що сьогодні наявні клінічні докази щодо спільного підвищення рівнів адипонектину в циркуляції та зниження інсулінорезистентності тільки трьома видами фармакологічного терапевтичного втручання, а саме: сартанами в пацієнтів із гіпертонічною хворобою [96], ТЗД [97–99] та глімепіридом [39, 96, 100–102] у хворих на ЦД2.
Необхідно наголосити, що 12-тижнева терапія глімепіридом літніх хворих на ЦД2 покращувала метаболізм глюкози (зниження HbA1c від 8,4 ± 1,9 % до 6,9 ± 1,0 %; підвищення метаболічного кліренсу глюкози від 3,92 ± 1,09 до 5,73 ± 1,47 мг/кг–1/хв–1) без стимуляції панкреатичної секреції інсуліну, визначеної за НОМА-b та вмістом С-пептиду в добовій сечі, за наявного значущого зниження інсулінорезистентності за НОМА-IR та концентрації ФНП-a на тлі збільшення рівнів адипонектину в циркуляції (з 6,61 ± 3,06 мкг/мл до 10,2 ± 7,14 мкг/мл, М ± SD) [100]. Вищевикладене, на думку авторів, обґрунтовує перевагу глімепіриду над іншими препаратами сульфонілсечовини, оскільки покращення глюкозного метаболізму за умови їх використання обумовлено переважно вираженою стимуляцією секреції інсуліну. Надмірна (нефізіологічна) стимуляція секреції інсуліну пов’язана не тільки з ризиком гіпоглікемії, але може індукувати розвиток так званої вторинної неефективності сульфонілсечовини. Окрім того, вона асоційована із збільшенням фракції проінсуліну в циркуляції, що являє собою більш релевантний чинник атеросклерозу, ніж гіперінсулінемія [103]. Слід наголосити, що покращення глікемічного контролю та підвищення адипонектинемії у хворих на ЦД2 глімепіридом було верифіковано на тлі стабільної маси тіла [96, 100]. Відсутність при цьому прогресування ендогенної гіперінсулінемії висвітлює потенційні переваги глімепіриду, пов’язані із зменшенням чинників ризику атеросклерозу.
Доречно акцентувати, що підвищення циркуляторних рівнів адипонектину внаслідок тривалої 28-тижневої терапії глімепіридом хворих на ЦД2 на відміну від терапії глібенкламідом або інсуліном за умов подібного покращення глікемічного контролю, але відсутності впливу на адипонектинемію було асоційоване не тільки із значущим зменшенням біохімічних показників атеросклеротичного процесу (підвищені рівні ФНП-a, інтерлейкіну-6, високочутливого С-реактивного білка, НОМА-IR), але також з інструментальними доказами зниження склерозу артеріальної стінки, викликаного ендотеліальною дисфункцією, на ранній стадії атеросклерозу [39].
Оскільки інсулін здатен гальмувати експресію гена адипонектину та секрецію цього гормону in vitro та in vivo [104, 98], зменшення гіперінсулінемії глімепіридом може частково пояснювати збільшення циркуляторних рівнів адипонектину у хворих на ЦД2.
Слід зауважити, що однією із суттєвих характеристик сульфонілсечовинного препарату третьої генерації глімепіриду є помірний стимулюючий ефект на секрецію інсуліну з еквівалентним глібенкламіду цукро-знижуючим ефектом [105], пов’язаним зі зниженням інсулінорезистентності не визначеними повною мірою механізмами [106, 107]. Разом із тим при використанні методу гіперінсулінемічного еуглікемічного затискача в інсулінорезистентних осіб із сімейною обтяженістю за ЦД2 та в осіб із нормальною толерантністю до глюкози доведено покращення периферичної чутливості до інсуліну глімепіридом [108].
Оскільки адипонектин специфічно гальмує експресію макрофагами прозапального цитокіну ФНП-a[109], що зменшує чутливість до інсуліну [110], то логічно відносити підвищення рівнів адипонектину в циркуляції у хворих на ЦД2 за умов зниження рівнів ФНП-a після 28-тижневої терапії глімепіридом до каузальних чинників зниження інсулінорезистентності [39, 100]. У той же час відомо, що адипонектину притаманні інсулінсенсибілізуючі властивості [85].
Механізм збільшення адипонектинемії глімепіридом залишається нез’ясованим. Сьогодні відомі два біосинтетичних шляхи підвищення продукції адипонектину: а) пряма стимуляція продукції адипонектину через внутрішньоядерний рецептор у складі промоторної зони гена адипонектину (PРAR-y); б) збільшення адипонектинемії через зменшення ФНП-a, який справляє гальмуючий ефект на продукцію адипонектину. Слід зазначити, що вищевказані адипоцитокіни (адипонектин та ФНП-a) гальмують один одного і конкурують під час біосинтетичної фази в жировій тканині та у периферичних тканинах [81]. Окрім того, наявні повідомлення, що засвідчують підвищення експресії адипонектину в адипоцитах глімепіридом [111] та пряму реалізацію цієї дії через PРAR-y [101]. Максимальний підвищувальний ефект глімепіриду щодо активності PРAR-y становив 20 % від дії 0,1 мкмоль піоглітазону. На противагу цьому PРAR-yстимулюючий ефект відсутній за аналогічних умов у глібенкламіду [112]. Саме ця різниця може бути причиною значущого збільшення адипонектинемії глімепіридом та відсутності реабілітуючого впливу глібенкламіду на гіпоадипонектинемію за умов досягнення подібного глікемічного контролю у хворих на ЦД2 [39].
Доречно зауважити, що ТЗД (клас інсулін-сенситайзерних препаратів) також збільшували циркуляторні рівні адипонектину (до трьох разів) в опасистих хворих на ЦД2 із неефективною терапією сульфонілсечовинними препаратами за рахунок збільшення його синтезу в підшкірних абдомінальних адипоцитах на відміну від метформіну, що не впливав на ці показники за умов подібного покращення глікемічного контролю [97]. Це засвідчує різні механізми інсулін-сенситайзерної дії ТЗД та бігуанідів. Так, метформін покращує периферичну чутливість до інсуліну та збільшує інсулінопосередковане поглинання глюкози в скелетних м’язах хворих на ЦД2 [113], імовірніше за все, через стимуляцію АМФ-активованої протеїнкінази [114]. У той же час інсуліносенситизуюча дія ТЗД була пов’язана з підвищеним синтезом та секрецією адипонектину адипоцитами, але не з покращенням глікемічного контролю [97].
Визначені антиатерогенні та інсуліносенситайзерні властивості адипонектину за фізіологічних умов у поєднанні з доведеною значущою роллю цього адипоцитокіну за умови його недостатності у формуванні інсулінорезистентності та атеросклеропатії суттєво модифікували терапевтичне ведення хворих на ЦД2. Річ у тому, що досягнення глікемічного контролю являє собою критичну метаболічну мету, оскільки гіперглікемія задіяна в прогресуванні ЦД2 за рахунок пошкодження функції b-клітин та чутливості до інсуліну [115]. Однак у клінічній практиці досягнення довгострокового зниження глюкози, що являє собою важливий аспект терапії, не досягається у багатьох хворих комбінацією великих доз екзогенного інсуліну з несульфонілсечовинними препаратами [90]. Нова терапевтична парадигма, спрямована на зниження інсулінорезистентності, може являти собою більш дієвий засіб для зменшення дози інсуліну. Останнє обґрунтовано, зважаючи на потенційне збільшення ризику атеросклерозу та раку за умови ендогенної та екзогенної гіперінсулінемії [116], а також застереження багатьох лікарів щодо гіпоглікемії та збільшення маси тіла за умов інтенсивної інсулінотерапії [117]. Комбінації інсуліну з похідними сульфонілсечовини другої генерації, такими як глібенкламід та гліклазид, суттєво покращують глікемічний контроль за зменшенням добової дози інсуліну [118]. Ефективність сульфонілсечовини в комбінації з інсуліном обумовлена тим, що підвищення рівнів інсуліну в портальному кровотоці препаратами сульфонілсечовини більшою мірою гальмує виділення глюкози печінкою і в такий спосіб краще знижує глікемію натще порівняно з підшкірним уведенням інсуліну.
Слід зазначити, що багато похідних сульфонілсечовини успішно застосовують з інсуліном, однак тільки глімепірид схвалений FDA (США) для комбінованої терапії. Зокрема, це пов’язано з відсутністю блокування захисного феномену ішемічного прекондиціювання за умови використання глімепіриду на противагу глібуриду та гліпізиду [119, 120]. Більше того, із залученням великої когорти пацієнтів отримані клінічні докази тенденції до збільшення ризику загальної смертності глібуридом та гліпізидом порівняно з глімепіридом в осіб із документованою КВХ [121]. Сьогодні отримані нові докази перспективності такої комбінованої терапії (інсулін + глімепірид), що ґрунтуються на доведеному залученні гормональної активності вісцеральної жирової тканини, а саме підвищенні циркуляторних рівнів адипонектину ВММ [102]. Саме адипонектин ВММ, як було зазначено вище, являє собою головну активну форму гормону та відіграє релевантну роль у підвищенні чутливості до інсуліну та попередженні розвитку ЦД [122]. Нещодавно отримані результати свідчать, що доповнення інсулінотерапії хворих на ЦД2 з поганим контролем глімепіридом протягом 24 тижнів призводило до більш значного покращення глікемічного контролю з меншою добовою дозою інсуліну, особливо у хворих на ЦД2 з абдомінальним ожирінням та більш низькими рівнями адипонектину ВММ перед лікуванням [102]. Доповнена глімепіридом терапія була асоційована з меншою частотою гіпоглікемічних епізодів порівняно з діагностованою в групі хворих, які отримували тільки зростаючі дози інсуліну для досягнення порівнянного покращення глікемічного контролю.
Важливо наголосити доведену від’ємну кореляцію між збільшенням рівнів адипонектину ВММ та змінами HbA1c після терапії глімепіридом (r = –0,452; p = 0,02), а також вищий відсоток (52 %) хворих із HbA1c ≤ 7 % на момент завершення дослідження в групі пацієнтів на комбінованій терапії порівняно з діагностованим у хворих виключно на інсулінотерапії (30 %). Це обґрунтовує думку про пряму участь збільшених рівнів адипонектину ВММ у покращенні глікемічного контролю. Вищезазначені сприятливі ефекти глімепіриду верифіковані на тлі відсутності значущого зростання ваги, що може бути пов’язано із зменшенням дози інсуліну за цих умов (32,3 ± 14,9 ОД/добу проти 86,2 ± 18,9 ОД/добу в групі хворих виключно на інсулінотерапії) та обґрунтовує перевагу вказаного сульфонілсечовинного препарату третьої генерації, зважаючи на доведену пряму кореляцію ожиріння з діабетогенними, атерогенними, протромботичними та прозапальними чинниками КВХ [123]. На противагу цьому навіть невелике, але значуще збільшення маси тіла в групі хворих виключно на інсулінотерапії (69,8 ± 16,5 кг проти 67,2 ± 11,9 кг; р < 0,04) може розглядатися як пошкоджуюче, оскільки воно асоційоване зі зростанням смертності та тяжкими коморбідними захворюваннями, такими як гіпертензія, гіперліпідемія та КВХ [102]. Вищенаведені результати дослідження Ch.-J. Li та співавт. (2014) додатково ілюструють та наголошують необхідність відповідності механізмів дії фармакологічної композиції патогенетичному підґрунтю захворювання. У цьому дослідженні наведені переваги комбінованої терапії: поєднання інсуліну з глімепіридом — похідним сульфонілсечовини третьої генерації, якому притаманна ощадлива стимуляція секреції інсуліну з підвищенням чутливості до останнього та зменшення гіпоадипонектинемії, тобто комплекс ефектів, що знижує атерогенний ризик у хворих на ЦД2.
Отже, наявні на сьогодні експериментальні та клінічні докази суттєвої ролі дисрегуляції функції білої жирової тканини, перш за все гіпоадипонектинемії, у генезі ЦД2 та асоційованого передчасного розвитку атеросклерозу доводять необхідність урахування патогенетичного підґрунтя для оптимізації фармакологічного алгоритму сучасної персоналізованої антидіабетичної терапії.
1. Mello M.M. Obesity — the new frontier of public health law [Text] / M.M. Mello, D.M. Studdert, T.A. Brennan // N. Engl. J. Med. — 2006. — Vol. 354. — P. 2601–2610.
2. Brockman D.A. Proteomics in the characterization of adipose dysfunction in obesity [Text] / D.A. Brockman, X. Chen // Adipocyte. — 2012. — Vol. 1, № 1. — P. 25–37.
3. Hossain P. Obesity and diabetes in the developing world a growing challenge [Text] / P. Hossain, B. Kawar, M.El Nahas // N. Engl. J. Med. — 2007. — Vol. 356. — P. 213–215.
4. Otto T.C. Adipose development: from stem cell to adipocyte [Text] / T.C. Otto, M.D. Lane // Crit. Rev. Biochem. Mol. Biol. — 2005. — Vol. 40. — P. 229–242.
5. Trayhurn P. Adipokines: inflammation and the pleiotropic role of white adipose tissue [Text] / P. Trayhurn, I.S. Wood // British Journal of Nutrition. — 2004. — Vol. 92. — P. 347–355.
6. Adipsin: a circulating serine protease homolog secreted by adipose tissue and sciatic nerve [Text] / K.S. Cook, H.Y. Min, D. Johnson, R. Chaplinsky [et al.] // Science. — 1987. — Vol. 237. — P. 402–405.
7. Positional cloning of the mouse obese gene and its human homologue [Text] / Y. Zhang, R. Proenca, M. Maffei [et al.] // Nature. — 1994. — Vol. 372. — P. 425–432.
8. A novel serum protein similar to C1q, produced exclusively in adipocites [Text] / P.E. Scherer, S. Willams, M. Fogliano [et al.] // J. Biol. Chem. — 1995. — Vol. 270. — P. 26746–26749.
9. Hu E. AdipoQ is a novel adipose-specific gene dysregulated in obesity [Text] / E. Hu, P. Liang, B.M. Spiegelman // J. Biol. Chem. — 1996. — Vol. 271. — P. 10697–10703.
10. cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1 AdiPose Most abundant Gene transcript [Text] / K. Maeda, K. Okubo, I. Shimomura [et al.] // Biochem. Biophys. Res. Commun. — 1996. — Vol. 221, № 2. — P. 286–289.
11. Trayhurn P. Physiological role of adipose tissue: white adipose tissue as an endocrine and secretory organ [Text] / P. Trayhurn, J.H. Beattie // Proc. Nutr. Soc. — 2001. — Vol. 60. — P. 329–339.
12. A family of tissue-specific resistin-like molecules [Text] / C.M. Steppan, E.J. Brown, C.M. Wright [et al.] // Proc. Natl. Acad. Sci. USA. — 2001. — Vol. 98. — P. 502–506.
13. Trujillo M.E. Adipose tissue-derived factors: impact on health and disease [Text] / M.E. Trujillo, P.E. Scherer // Endocr. Rev. — 2006. — Vol. 27. — P. 762–778.
14. Kowalska I. Role of adipose tissue in the development of vascular complications in type 2 diabetes mellitus [Text] / I. Kowalska // Diabetes Res. Clin. Pract. — 2007. — Vol. 78. — P. 14–22.
15. Inadera H. The usefulness of circulating adipokine levels for the assessment of obesity-related health problems [Text] / H. Inadera // Int. J. Med. Sci. — 2008. — Vol. 5, № 5. — P. 248–262.
16. Scherer P.E. Adipose tissue: from lipid storage compartment to endocrine organ [Text] / P.E. Scherer // Diabetes. — 2006. — Vol. 55. — P. 1537–1545.
17. Skurk T. Relationship between adipocyte size and adipokine expression and secretion. [Text] / T. Skurk, C. Alberti-Huber, C. Herder [et al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 1023–1033.
18. Fernandez-Real J.M. Innate immunity, insulin resistance and type 2 diabetes [Text] / J.M. Fernandez-Real, J.C. Pickup // Trends. Endocrinol. Metab. — 2008. — Vol. — 19. — P. 10–16.
19. Oh D.K. Adiponectin in health and disease [Text] / D.K. Oh, T. Ciaraldi, R.R. Henry // Diabete. Obes. Metabol. — 2007. — Vol. 9. — P. 282–289.
20. Isolation and characterization of GBP28, a novel gelatin-binding protein purified from human plasma [Text] / Y. Nakano, T. Tobe, N.H. Choi-Miura [et al.] // J. Biochem. — 1996. — Vol. 120, № 4. — P. 803–812.
21. Acrp/30 adiponectin: an adipocytokine regulating glucose and lipid metabolism [Text] / A.H. Berg, T.P. Combs, P.E. Sherer [et al.] // Trends. Endocrinol. Metabol. — 2002. — Vol. 89. — P. 13–84.
22. Trujillo M.E. Adiponectin-journey from an adipocyte secretory protein to biomarker of the metabolic syndrome [Text] / M.E. Trujillo, P.E. Scherer // J. Intern. Med. — 2005. — Vol. 257. — P. 167–175.
23. The crystal structure of a complement-1q family protein suggests an evolutionary link to tumor necrosis factor [Text] / L. Shapiro, P.E. Scherer // Curr. Biol. — 1998. — Vol. 8. — P. 335–338.
24. Adiponectin is a new member of the family of soluble defense collagens, negatively regulates the growth of myelomonocytic progenitors and the functions of macrophages [Text] / T. Yokota, K. Oritani, I. Takashi [et al.] // Blood. — 2000. — Vol. 96. — P. 1723–1732.
25. Impaired multimerization of human adiponectin mutants associated with diabetes: Molecular structure and multimer formation of adiponectin [Text] / H. Waki, T. Yamauchi, J. Kamon [et al.] // J. Biol. Chem. — 2003. — Vol. 278. — P. 40352–40363.
26. Structure function studies of the adipocyte-secreted hormone Acrp/30 adiponectin [Text] / U.B. Pajvani, X. Du, T.P. Combs [et al.] // J. Biol. Chem. — 2003. — Vol. 278. — P. 9073–9085.
27. Adipocyte-derived plasma protein adiponectin acts as a platelet-derived growth factor-BB-binding protein and regulates growth factor-induced common postreceptor signal in vascular smooth muscle cell [Text] / Y. Arita, S. Kihara, N. Ouchi [et al.] // Circulation. — 2002. — Vol. 105. — P. 2893–2898.
28. Serum high molecular weight complex of adiponectin correlates better with glucose tolerance than total serum adiponectin in Indo-Asian males [Text] / F.F. Fisher, M.E. Trujillo, W. Hanif [et al.] // Diabetologia. — 2005. — Vol. 48. — P. 1084–1087.
29. Adiponectin multimeric complexes and the metabolic syndrome trait cluster [Text] / C. Lara-Castro, N. Luo, P. Wallance [et al.] // Diabetes. — 2006. — Vol. 55. — P. 249–259.
30. Mechanisms of early insulin-sensitizing effects to thiazolidinediones in type 2 diabetes [Text] / J. Tonelli, W. Li, P. Kishore [et al.] // Diabetes. — 2004. — Vol. 53. — P. 1621–1629.
31. Горшунська М.Ю. Загальний та високої молекулярної ваги адипонектин у хворих на цукровий діабет 2 типу за урахуванням статі, глікемічного контролю та ступеня інсулінорезистентності (огляд літератури та власні дані) [Текст] / М.Ю. Горшунська // Пробл. ендокр. патології. — 2012. — № 2. — С. 91–107.
32. High molecular adiponесtin as a predictor of longterm clinical outcome in patients with coronary artery disease [Text] / T. Inoue, N. Kootoka, T. Morooka [et al.] // Am. J. Cardiol. — 2007. — Vol. 100. — P. 569–574.
33. Progression of atherosclerosis in hemodialysis patients: effect of adiponectin on carotid intima media thickness [Text] / M. Tsushima, Y. Terayama, A. Momose [et al.] // J. Atheroscler. Thromb. — 2008. — Vol. 15. — P. 213–218.
34. Selective suppression of endothelial cell apoptosis by the high molecular weight form of adiponectin [Text] / H. Kobayashi, N. Ouchi, S. Kihara [et al.] // Circ. Res. — 2004. — Vol. 94. — P. 27–31.
35. Pajvani U.B. Complex distribution, no absolute amount of adiponectin correlates with thiazolidinedione-mediated improvement in insulin sensitivity [Text] / U.B. Pajvani, M. Hawkins, T.P. Combs // J. Biol. Chem. — 2004. — Vol. 279. — P. 12152–12163.
36. Comparison of serum high-molecular weight (HMW) adiponectin concentration in type 2 diabetic patients with coronary artery disease using a novel enzyme-linked immunosorbent assay to detect HMW adiponectin [Text] / Y. Aso, R. Yamamoto, S. Wakabayashi [et al.] // Diabetes. — 2006. — Vol. 55. — P. 1954–1960.
37. Serum high molecular weight as a marker for the evaluation and care of subjects with metabolic syndrome and related disorder [Text] / H. Hirose, Y. Yamamoto, Y. Seino–Yosnihara [et al.] // J. of Atheroscler. and Thrombosis. — 2010. — Vol. 17. — P. 1201–1221.
38. Total and high-molecular-weight adiponectin and resistin in relation to the risk for Type 2 Diabetes in women [Text] / Ch. Heidemann, Qi Sun, M. Rob [et al.] // Ann. Intern. Med. — 2008. — Vol. 149, № 5. — P. 307–316.
39. Efficacy of glimepiride on insulin resistance, adipocytokines, and atherosclerosis [Text] / K. Koshiba, M. Nomura, Y. Nakaya, S. Ito // J. Med. Invest. — 2006. — Vol. 53. — P. 87–94.
40. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase [Text] / T. Yamauchi, J. Kamon, Y. Minokoshi [et al.] // Nat. Med. — 2002. — Vol. 8, № 11. — P. 1288–1295.
41. Implications of plasma concentrations of adiponectin in patients with coronary artery disease [Text] / Y. Nakamura, K. Shimada, D. Fukuda [et al.] // Heart. — 2004. — Vol. 90. — P. 528–533.
42. The adipocyte-secreted protein Acrp30 enhances hepatic insulin action [Text] / A.H. Berg, T.P. Combs, X. Du [et al.] // Nat. Med. — 2001. — Vol. 7, № 8. — P. 947–953.
43. Enhanced muscle fat oxidation and glucose transport by ACR30 globular domain: acetyl-CoA carboxylase inhibition and AMP-activated protein kinase activation [Text] / E. Tomas, T.S. Tsao, A.K. Saha [et al.] // Proc. Natl. Acad. Sci. USA. — 2002. — Vol. 99. — P. 16309–16313.
44. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity [Text] / T. Yamauchi, J. Kamon, H. Waki [et al.] // Nat. Med. — 2001. — Vol. 7. — P. 941–946.
45. Paradoxycal decrease of an adipose-specific protein adiponectin in obesity [Text] / Y. Arita, S. Kihara, N. Ouchi [et al.] // Biochem. Biophys. Res. Commun. — 1999. — Vol. 257. — P. 79–83.
46. Hypoadiponectinemia in obesity and type 2 diabetes: close association with insulin resistance and hyperinsulinemia [Text] / C. Weyer, T. Funahashi, S. Tanaka [et al.] // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86. — P. 1930–1935.
47. Decreased plasma adiponectin levels in young obese males [Text] / T. Hara, H. Fujiwara, T. Shoji [et al.] // J. Atheroscler. Thromb. — 2003. — Vol. 10. — P. 234–238.
48. Рівні адипонектину у хворих на цукровий діабет 2 типу за зіставленням з класичними та новітніми чинниками атерогенезу [Текст] / М.Ю. Горшунська, Ю.І. Караченцев, Н.С. Красова [та ін.] // Ендокринологія. — 2007. — Т. 12. — С. 252–261.
49. PPARgamma ligands increase expression and plasma concentrations of adiponectin, an adipose-derived protein [Text] / N. Maeda, M. Takahashi, T. Funahashi [et al.] // Diabetes. — 2001. — Vol. 50. — P. 2094–2099.
50. Induction of adipocyte complement-related protein of 30 kilodaltons by PPARgamma agonists: a potential mechanism of insulin sensitization [Text] / T.P. Combs, J.A. Wagner, J. Berger [et al.] // Endocrinology. — 2002. — Vol. 143. — P. 998–1007.
51. Effects of pioglitazone on metabolic parameters, body fat distribution, and serum adiponectin levels in Japanese male patients with type 2 diabetes [Text] / H. Hirose, T. Kawai, Y. Yamamoto [et al.] // Metabolism. — 2002. — Vol. 51. — P. 314–317.
52. Synthetic peroxisome proliferator-activated receptor-gamma agonist, rosiglitazone, increases plasma levels of adiponectin in type 2 diabetic patients [Text] / W.S. Yang, C.Y. Jeng, T.J. Wu [et al.] // Diabetes Care. — 2002. — Vol. 25. — P. 376–380.
53. The effect of thiazolidindiones on plasma adsponectin levels in normal, obese, and type 2 diabetic subjects [Text] / J.G. Yu, S. Javorschi, A.L. Hevener [et al.] // Diabetes. — 2002. — Vol. 51. — P. 2968–2974.
54. Early, rapid weight loss and very low calorie diet after bariatric surgery uncouples changes in total and HMW adiponectin [Text] / L.K. Meyer, A.C. Wittgrove, T. Martinez [et al.] // Abst. of the 74th scientific sessions of American Diabetes Association. — June 13–17, 2014. — San Francisco, USA. — P. A522.
55. Adiponectin and development of type 2 diabetes in the Pima Indian population [Text] / R.S. Lindsay, T. Funahashi, R.L. Hanson [et al.] // Lancet. — 2002. — Vol. 360. — P. 57–58.
56. Adiponectin and protection against type 2 diabetes mellitus [Text] / J. Spranger, A. Kroke, M. Mohling [et al.] // Lancet. — 2003. — Vol. 361. — P. 226–228.
57. Serum concentrations of adiponectin and risk of type 2 diabetes mellitus and coronary disease in apparently healthy middle-aged men: results from the 18–year follow up of a large cohort from southern Germany [Text] / W. Koenig, N. Khuseinova, J. Baumert [et al.] // J. Am. Cardiol. — 2006. — Vol. 48. — P. 1369–1377.
58. Associations of adiponectin levels with incident impaired glucose metabolism and type 2 diabetes in older men and women: The Hoorn Study [Text] / M.B. Snijder, R.J. Heine, J.C. Seidell [et al.] // Diabetes Care. — 2006. — Vol. 29. — P. 2498–2503.
59. Plasma adiponectin is an independent predictor of type 2 diabetes in Asian Indians [Text] / C. Snehalatha, B. Mukesh, M. Simon [et al.] // Diabetes Care. — 2003. — Vol. 26. — P. 3226–3229.
60. Daimon M. Decreased serum levels of adiponectin are a risk factor for the progression to type 2 diabetes in the Japanese population: the Funagata study [Text] / M. Daimon, T. Ozumi, T. Saitoh // Diabetes Care. — 2003. — Vol. 26. — P. 2015–2020.
61. Serum adiponectin concentrations predict the developments of type 2 diabetes and the metabolic syndrome in eldery Koreans [Text] / K.M. Choi, J. Lee, K.W. Lee [et al.] // Clin. Endocrinol. — 2004. — Vol. 61. — P. 75–80.
62. Decreased total and high molecular weight adiponectin are independent risk factors for the development of type 2 diabetes in Japanese-Americans [Text] / R. Nakashima, N. Kamei, K. Yamane [et al.] // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91. — P. 3873–3877.
63. Adiponectin and the development of type 2 diabetes: the atherosclerosis risk in communities study [Text] / B.B. Duncan, M.I. Schmidt, J.S. Pankow [et al.] // Diabetes. — 2004. — Vol. 53. — P. 2473–2478.
64. Adiponectin expression in adipose tissue is reduced in first-degree relatives of type 2 diabetic patients [Text] / A.S. Lihn, T. Ostergard, B. Nyholm [et al.] // Am. J. Physiol. Endocrinol. Metabol. — 2003. — Vol. 284. — P. E443–E448.
65. Hypoadiponectinemia as a predictor for the development of hypertension: a 5-year prospective study [Text] / W.S. Chow, B.M. Cheung, A.W. Tso [et al.] // Hypertension. — 2007. — Vol. 49. — P. 1455–1461.
66. Plasma adiponectin levels and risk of myocardial infarction in men [Text] / T. Pischon, C.J. Girman, G.S. Hotamisligil [et al.] // JAMA. — 2004. — Vol. 291. — P. 1730–1737.
67. Adiponectin, metabolic risk factors, and cardiovascular event among patients with end stage renal disease [Text] / C. Zocalli, F. Mallamaci, G. Tripepi [et al.] // J. Am. Soc. Nephol. — 2002. — Vol. 13. — P. 134–141.
68. The association of plasma adiponectin level with carotid arterial stiffness [Text] / T. Araki, M. Emoto, H. Yokoyama [et al.] // Metabolism. — 2006. — Vol. 55. — P. 587–592.
69. Mahmud A. Adiponectin and arterial stiffness [Text] / A. Mahmud, J. Feely // Am. J. Hypertens. — 2005. — Vol. 18. — P. 1543–1548.
70. Plasma concentrations of a novel, adipose-specific protein, adiponectin, in type 2 diabetic patients [Text] / K. Hotta, T. Funahashi, Y. Arita [et al.] // Arterioscler. Thromb. Vasc. Biol. — 2000. — Vol. 20. — P. 1595–1599.
71. Relationship between metabolic syndrome and early stage coronary atherosclerosis [Text] / T. Hitsumoto, M. Takahashi, T. Lzuka [et al.] // J. Atheroscler. Thromb. — 2007. — Vol. 14. — P. 294–302.
72. Adiponectin stimulates angiogenesis by promoting cross-talk between AMP-activated protein kinase and Akt signaling in endothelial cells [Text] / N. Ouchi, H. Kobayashi, S. Kihara [et al.] // Biol. Chem. — 2004. — Vol. 279. — P. 1304–1309.
73. Adiponectin reduces atherosclerosis in apolipoprotein E-deficient mice [Text] / Y. Okamoto, S. Kihara, N. Ouchi [et al.] // Circulation. — 2002. — Vol. 106, № 22. — P. 2767–2770.
74. Adiponectin primes human monocytes into alternative anti-inflammatory M2 macrophages [Text] / F. Lovren, Y. Pan, A. Quan [et al.] // Am. J. Physiol. Heart Circ. Physiol. — 2010. — Vol. 299. — P. H656–H663.
75. Adiponectin-mediated modulation of hypertrophic signals in the heart [Text] / R. Shibata, N. Ouchi, M. Ito [et al.] // Nat. Med. — 2004. — Vol. 10. — P. 1384–1389.
76. An adicyte-derived plasma protein, adiponectin, adheres to injured vascular walls [Text] / Y. Okamoto, Y. Arita, M. Nishida [et al.] // Horm. Metabol. Res. — 2000. — Vol. 32. — P. 47–50.
77. Matsubara M. Inverse relationship between plasma adiponectin and leptin concentrations in normal-weight and obese women [Text] / M. Matsubara, S. Maruoka, S. Katayose // Europ. J. Endocrinol. — 2002. — Vol. 147. — P. 173–180.
78. Adiponectin and cardiovascular health: an update [Text] / X. Hui, K.S.L. Lam, M. Vanhoutte, A. Xu // British J. Pharmacol. — 2012. — Vol. 165. — P. 574–590.
79. Plasma adipokines at 6–9 weeks postpartum and progression to incident diabetes within two years after GDM pregnancy: SWIFT [Text] / X. Ning, C. Kim, M.–F. Hivert [et al.] // Abst. of the 74th scientific sessions of American Diabetes Association. — June 13–17, 2014. — San Francisco, USA. — P. A336.
80. Diet-induced insulin resistance in mice lacking adiponectin/ACRP30 [Text] / N. Maeda, I. Shimomura, K. Kishida [et al.] // Nat. Med. — 2002. — Vol. 8. — P. 731–737.
81. Novel modulator for endothelial adhesion molecules: adipocite-derived plasma protein adiponectin [Text] / N. Ouchi, S. Kihara, Y. Arita [et al.] // Circulation. — 1999. — Vol. 100. — P. 2473–2476.
82. Adiponectin, an adipocite-derived plasma protein, inhibits endothelial NF-kappaB signaling through a cAMP-dependent pathway [Text] / N. Ouchi, S. Kihara, Y. Arita [et al.] // Circulation. — 2000. — Vol. 102. — P. 1296–1301.
83. Adipocite-derived plasma protein, adiponectin, suppresses lipid accumulation and class A scavenger receptor expression in human monocyte-derived macrophages [Text] / N. Ouchi, S. Kihara, Y. Arita [et al.] // Circulation. — 2001. — Vol. 103. — P. 1057–1063.
84. Association of adiponectin mutation with type 2 diabetes: a candidate gene for the insulin resistance syndrome [Теxt] / H. Kondo, I. Shimomura, Y. Matsukawa [et al.] // Diabetes. — 2002. — Vol. 51, № 7. — Р. 2325–2328.
85. Circulation concentrations of the adipocyte protein adiponectin are decreased in parallel with reduced insulin sensitivity during the progression to type 2 diabetes in rhesus monkeys [Text] / K. Hotta, T. Funahashi, N.L. Bodkin [et al.] // Diabetes. — 2001. — Vol. 50. — P. 1126–1133.
86. Summary of revisions to the 2014 clinical practice recommendations [Text] / American Diabetes Association // Diabetes Care. — 2014. — Vol. 37, Suppl. 1. — P. S4–S80.
87. Pioglitazone and risk of cardiovascular vents in patients with type 2 diabetes mellitus: a meta-analysis of a randomized trials [Text] / A.M. Lincoff, K. Wolski, S.J. Nicholls, S.E. Nissen // JAMA. — 2007. — Vol. 298. — P. 1180–1188.
88. Thiazolidinediones and cardiovascular events in high-risk patients with type-2 diabetes mellitus. A comparison with other oral antidiabetic agents [Text] / F.T. Shaya, Z. Lu, K. Sohn, M.R. Weir // P&T. — 2009. — Vol. 34, № 9. — P. 490–500.
89. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes [Text] / S.E. Nissen, K. Wolski // N. Eng. J. Med. — 2007. — Vol. 356. — P. 2457–2471.
90. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy [Text] / S.E. Kahn, S.M. Haffner, M.A. Heise [et al.] // N. Eng. J. Med. — 2006. — Vol. 355. — P. 2427–2443.
91. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomised controlled trial [Text] / DREAM Trial Investigators // Lancet. — 2006. — Vol. 368. — P. 1096–1105.
92. Home P.D. Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes (RECORD): study design and protocol [Text] / P.D. Home, S.J. Pocock, H. Beck-Nielsen // Diabetologia. — 2005. — Vol. 48. — P. 1726–1735.
93. Krall R.L. Cardiovascular safety of rosiglitazone [Text] // Lancet. — 2007. — Vol. 369. — P. 1995–1996.
94. Pioglitazone therapy and bladder cancer risk in type 2 diabetes: a meta-analysis of major trials [Text] / J. Wang, B. Liu, J. Zhou [et al.] // Abst. of the 74th scientific sessions of American Diabetes Association. — June 13–17, 2014. — San Francisco, USA. — P. A579.
95. Pioglitazone increases food intake and adiposity via enhanced AMPK phosphorilation in the hypothalamus of Dio mice [Text] / P.G.F. Quaresma, N. Reencober, A.C. Santos [et al.] // Abst. of the 74th scientific sessions of American Diabetes Association. — June 13–17, 2014. — San Francisco, USA. — P. A289.
96. Effect of glimepiride on serum adiponectin level in subjects with type 2 diabetes [Text] / S. Nagasaka, A. Taniguchi, Y. Aiso [et al.] // Diabetes Care. — 2003. — Vol. 26. — P. 2215–2216.
97. Modulation of circulating and adipose tissue adiponectin levels by antidiabetic therapy [Text] / S.A. Phillips, T.P. Ciaraldi, A.P.S. Kong [et al.] // Diabetes. — 2003. — Vol. 52. — P. 667–674.
98. The effect of thiazolidinediones on plasma adiponectin levels in normal, obese, and type 2 diabetic subjects [Text] / J.G. Yu, S. Javorschi, A.L. Hevener [et al.] // Diabetes. — 2002. — Vol. 51. — P. 2968–2974.
99. Synthetic peroxisome proliferator-activated receptor agonist, rosiglitazone, increases plasma levels of adiponectin in type 2 diabetic patients [Text] / W.S. Yang, C.Y. Jeng, T.J. Wu [et al.] // Diabetes Care. — 2002. — Vol. 25. — P. 376–380.
100. Plasma adiponectin plays an important role in improving insulin resistance with glimepiride in elderly type 2 diabetic subjects [Text] / T. Tsunekawa, T. Hayashi, Y. Suzuki [et al.] // Diabetes Care. — 2003. — Vol. 26. — P. 285–289.
101. Sulfonylurea agents exhibit peroxisome proliferator-activated receptor-gamma agonistic activity [Text] / S. Fukuen, M. Iwaki, A. Yasui [et al.] // J. Biol. Chem. — 2005. — Vol. 280. — P. 23653–23659.
102. Adding glimepiride ti current insulin therapy increases high-molecular weight adiponectin levels to improve glycemic control in poorly controlled type 2 diabetes [Text] / Ch.-J. Li, J.-Y. Zhang, D.-M. Yu, Q.-M. Zhang // Diabetology & Metab. Syndrome. — 2014. — Vol. 6. — Article 41, 7 pages.
103. Jandeleit-Dahm K.A. Insulin and cardiovascular disease: biomarker or association? [Text] / K.A. Jandeleit–Dahm, S.P. Gray // Diabetologia. — 2012. — Vol. 55, № 12. — P. 3145–3151.
104. Hormonal regulation of adiponectin gene expression in 3T3-L1 adipocytes [Text] / M. Fasshauer, J. Klein, S. Neumann [et al.] // Biochem. Biophys. Res. Commun. — 2002. — Vol. 290, № 3. — P. 1084–1089.
105. Rosak C. The pathophysiologic basis of efficacy and clinical experience with the new oral antidiabetic agents [Text] / C. Rosak // J. Diabetes Complications. — 2002. — Vol. 16. — P. 123–132.
106. Clark H.E. The effect of glimepiride on pancreatic β-cell function under hyperglycaemic clamp and hyperinsulinaemic, euglicaemic clamp conditions in non-insulin-dependent diabetes mellitus [Text] / H.E. Clark, D.R. Mattews // Horm. Metab. — 1996. — Vol. 28. — P. 445–450.
107. Muller G. The molecular mechanism of the insulin-mimetic/sensitizing activity of the antidiabetic sulfonylurea drug amaryl [Text] / G. Muller // Mol. Med. — 2000. — Vol. 6. — P. 907–933.
108. Glimepiride: effects on peripheral insulin sensitivity [Text] / A. Volk, E. Maerker, K. Rett [et al.] // Diabetologia. — 2000. — Vol. 43, Suppl. 1. — P. A39.
109. Adiponectin, a new member of the family of soluble defense collagens, negatively regulates the growth of myelomonocytic progenitors and the functions of macrophages [Text] / T. Yokota, K. Oritani, I. Takahashi [et al.] // Blood. — 2000. — Vol. 96. — P. 1723–1732.
110. Hotamisligi G.S. Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance [Text] / G.S. Hotamisligi, N.S. Shargill, B.M. Spigelman // Science. — 1993. — Vol. 259. — P. 87–91.
111. Effect of sulfonylurea drugs on adiponectin production from 3T3-L1 adipocytes: implication of different mechanisms from pioglitazone [Text] / Y. Kanda, M. Matsuda, K. Tawaromoto [et al.] // Diabetes Res. Clin. Pract. — 2008. — Vol. 81. — P. 13–18.
112. Glimepiride enhances intrinsic peroxisome proliferator–activated receptor-gamma activity in 3T3-L1 adipocytes [Text] / K. Inukai, M. Watanabe, Y. Nakashima [et al.] // Biochem. Biophys. Res. Commun. — 2005. — Vol. 328. — P. 484–490.
113. Cusi K. Metformin: a review of its metabolic effects [Text] / K. Cusi, R.A. DeFronzo // Diabetes Rev. — 1998. — Vol. 6. — P. 89–131.
114. Role AMP-activated protein kinase in the mechanism of metformin action [Text] / G. Zhou, R. Myers, Y. Li [et al.] // J. Clin. Invest. — 2001. — Vol. 108. — P. 1167–1174.
115. Rossetti L. Glucose toxicity [Text] / L. Rossetti, A. Giaccari, R.A. DeFronzo // Diabetes Care. — 1990. — Vol. 13. — P. 610–630.
116. Holden S.E. Dogenous hyperinsulinaemia and exogenous insulin: a common theme between atherosclerosis, increased cancer risk and other morbidities [Text] / S.E. Holden, C.J. Currie // Atherosclerosis. — 2012. — Vol. 222. — P. 26–28.
117. Weight changes and their predictors amongst 11140 patients with type 2 diabetes in the ADVANCE trial [Text] / S. van Dieren, S. Czernichow, J. Chalmers [et al.] // Diabetes Obes. Metab. — 2012. — Vol. 14. — P. 464–469.
118. Johnson J.L. Efficacy of insulin and sulfonylurea combination therapy in type II diabetes. A meta-analysis of the randomized placebo-controlled trials [Text] / J.L. Johnson, S.L. Wolf, U.M. Kabadi // Arch. Intern. Med. — 1996. — Vol. 12. — P. 259–264.
119. Glimepiride, a novel sulfonylurea, does not abolish myocardial protectionafforded by either ischemic preconditioning or diazoxide [Text] / M.M. Mocanu, H.L. Maddoc, G.F. Baxter [et al.] // Circulation. — 2001. — Vol. 103. — P. 3111–3116.
120. Lee T.M. Impairment of myocardial protection in type 2 diabetic patients // Lee T.M., Chou T.F. // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88, № 2. — P. 531–537.
121. The risk of overall mortality in patients with type 2 diabetes receiving glipizide, gliburide, or glimepiride monotherapy: a retrospective analysis [Text] / K.M. Pantalone, M.W. Kattan, C. Yu [et al.] // Diabetes Care. — 2010. — Vol. 33. — P. 1224–1229.
122. Liu M. Regulation of adiponectin multimerization, signaling and function [Text] / M. Liu, F. Liu // J. Clin. Invest. — 2006. — Vol. 116. — P. 1784–1792.
123. Kishida K. Clinical importance of assessment of type 2 diabetes mellitus with visceral obesity. A Japanese perspective [Text] / K. Kishida, T. Funacashi, I. Shimomura // Curr. Diabetes Rev. — 2012. — Vol. 8. — P. 84–91.

/97/97.jpg)