Международный эндокринологический журнал 6 (62) 2014
Вернуться к номеру
Взгляд патофизиолога-эндокринолога на проблему возрастного дефицита андрогенов у мужчин (LOH-синдром)
Авторы: Резников А.Г. - академик НАМН Украины, член-корреспондент НАН Украины; ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», г. Киев
Рубрики: Эндокринология
Версия для печати
В статье представлен патофизиологический анализ синдрома возрастного дефицита андрогенов у мужчин (LOH-синдрома) с позиций современных взглядов на молекулярные механизмы действия тестостерона и андрогенную регуляцию структуры и функции органов и систем мужского организма. Подчеркивается этиологическая и патогенетическая роль стресса в данной патологии. Изложена авторская концепция причинно-следственных связей между хроническим стрессом, метаболическим синдромом и LOH-синдромом.
У статті наведено патофізіологічний аналіз синдрому дефіциту андрогенів у чоловіків (LOH-синдрому) з позицій сучасних поглядів на молекулярні механізми дії тестостерону та андрогенну регуляцію будови та функції органів і систем чоловічого організму. Підкреслюється етіологічна та патогенетична роль стресу в даній патології. Викладено авторську концепцію причинно-наслідкових зв’язків між хронічним стресом, метаболічним синдромом і LOH-синдромом.
The paper presents a pathophysiological analysis of age-related androgen deficiency syndrome in men (LOH-syndrome) with special reference to current knowledge of molecular mechanisms of testosterone effects and androgen regulation of the structure and function of organs and systems of the male body. There is emphasized etiological and pathogenetic role of stress in this pathology. There is presented author’s concept of cause-effect relations between chronic stress, metabolic syndrome and LOH-syndrome.
LOH-синдром, андрогены, андропауза, стресс.
LOH-синдром, андрогени, андропауза, стрес.
LOH-syndrome, androgens, andropause, stress.
Статья опубликована на с. 11-18
Постепенное снижение тестикулярной продукции тестостерона и возрастные изменения его циркуляторного транспорта и метаболизма являются естественным физиологическим процессом в стареющем организме мужчины [1]. Они развиваются параллельно с комплексом нейропсихических и соматических изменений и во многом служат их причиной, в особенности при ускоренном снижении секреции тестостерона. Это касается угасания психофизиологических функций, сексуальной активности, атрофии мышц, остеопороза, анемии, сердечно–сосудистой патологии, появления избыточных жировых отложений и других метаболических расстройств [2–5].
Конкретные параметры физиологического снижения уровня тестостерона в крови существенно варьируют в зависимости от возраста, этнической принадлежности и других факторов. Принято считать, что оно начинается в возрасте 45–50 (реже — 30 лет) и происходит достаточно медленно, а именно около 1–1,5 % в год [6]. Что же касается свободной, то есть физиологически активной фракции тестостерона, то она снижается вдвое быстрее, опережая повышение уровня секс–стероидсвязывающего глобулина (СССГ), которое составляет 1,3 % в год.
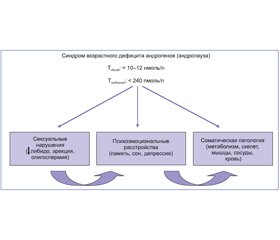
Патологическая возрастная инволюция репродуктивной системы мужчины характеризуется сочетанием клинических проявлений, которые в совокупности обозначаются как синдром возрастного дефицита андрогенов (TDS, testosterone deficiency syndrome), андропауза, мужской климакс, ADAM (androgen deficiency in the aging male) или PADAM (partial androgen deficiency in the aging male). В современной литературе чаще используют термин «поздний гипогонадизм», или LOH (late–onset hypogonadism) [7]. LOH–синдром развивается при уровне общего тестостерона ниже 10–12 нмоль/л [8] (по другим данным — ниже 8 нмоль/л, но этому критерию соответствовали только 2,1 % из обследованных 2966 мужчин в возрасте 40–79 лет [9]) и свободного — ниже 220–240 пмоль/л [8]. Эти показатели зарегистрированы у 5–7 % обследованных мужчин в возрасте 40–49 лет, 10 % в возрасте 50–59 лет, 20 % в возрасте 60–69 лет, 30 % в возрасте 70–79 лет и почти у половины в возрасте старше 80 лет [10]. Еще более информативно для диагностики LOH–синдрома определение уровня биодоступного тестостерона в плазме крови.
Проблема LOH–синдрома уже давно вышла за рамки эндокринологии и сексопатологии. Сегодня она приобрела междисциплинарный характер и входит в сферу интересов геронтологов, кардиологов, диабетологов и других специалистов. Медико–социальное значение LOH–синдрома определяется тем, что он не только негативно отражается на качестве жизни, но и признан как фактор риска смерти, прежде всего от сердечно–сосудистых заболеваний [11]. Это подтверждают и недавно опубликованные результаты проведенного Европейской группой по изучению старения мужчин проспективного исследования на 2599 мужчинах в возрасте 40–79 лет [12]. Смертность от общих причин, включая сердечно–сосудистую патологию, в группе лиц с тяжелым LOH–синдромом была в 5 раз выше, чем у эугонадных мужчин. С другой стороны, высокий уровень тестостерона в крови пожилых мужчин ассоциирован с уменьшением данного риска [13]. Этим, в частности, объясняется все возрастающее количество публикаций на данную тему, многие из которых принадлежат отечественным авторам [14–18]. Основной акцент в большинстве из них делается на клинических аспектах LOH–синдрома, тогда как вопросы патогенеза заслуживают не меньшего внимания.
Темп андрологического старения детерминирован прежде всего генетическими, то есть индивидуальными наследственными особенностями. Однако в этиологии LOH–синдрома неоспоримое значение имеют и другие эндогенные факторы, а также внешние негативные влияния физической, химической и социальной природы. Сопутствующие болезни и ожирение существенно влияют на развитие LOH, их профилактика и лечение позволяют замедлить снижение уровня тестостерона [1], так же как и здоровый образ жизни. Курение, алкоголизм, переедание, малоподвижный образ жизни, стрессовые ситуации в быту и на работе способствуют развитию возрастного гипогонадизма. Среди экологических факторов существенную роль играют радиационное воздействие, химические загрязнители окружающей среды — эндокринные дизрапторы [19–21], некачественные вода и продукты питания и многие другие. К эндокринным дизрапторам относят полихлорированные, полибромированные фенольные производные, диоксины, гербициды, пестициды (ДДТ), пластификаторы (фталаты), пластмассы и их субстраты (акриламид), бисфеноловые полихлориды, тяжелые металлы, фитоэстрогены, лекарственные средства (анаболические стероиды, нестероидные противовоспалительные средства, диэтилстильбестрол) и многие другие.
Составной частью программы старения мужского организма является атрезия клеток Лейдига [22] и замедление работы гипоталамического гонадолиберинового пульсового генератора, проявляющееся в исчезновении циркадианного ритма секреции тестостерона [1]. Гипоталамо–гипофизарный механизм лидирует в патогенезе LOH–синдрома у мужчин до 50–летнего возраста, после 70 лет большее значение имеет возрастная атрофия клеток Лейдига, а в диапазоне 50–70 лет важную роль играют оба эти фактора [23]. В физиологических условиях поддержание количества клеток Лейдига происходит за счет тестикулярного пула стволовых клеток. Преждевременное истощение пула этих клеток приводит к ускоренному снижению числа клеток Лейдига ввиду неполноценного замещения. Вследствие реципрокных взаимоотношений между секрецией тестостерона и гипофизарными гонадотропинами уменьшение тестикулярной продукции тестостерона сопровождается увеличением секреции ЛГ, которое указывает на первичную роль половых желез в их старении. Однако повышенная секреция ЛГ не в состоянии в полной мере обеспечить полноценную стимуляцию клеток Лейдига. Отчасти это обусловлено возрастным снижением чувствительности последних к ЛГ.
О ведущей роли дефицита тестостерона в патогенезе LOH–синдрома свидетельствует ослабление выраженности ряда клинических симптомов, а именно усиление либидо, эрекции, улучшение когнитивной функции мозга, липидного профиля крови, повышение минеральной плотности костной ткани, уменьшение утомляемости, избыточной массы жировой ткани и повышение мышечной силы, а в целом — улучшение качества жизни.
Как известно, механизмы развития заболеваний имеют в своей основе биологические процессы нормальной жизнедеятельности, характер нарушения которых и определяет специфику патологического процесса. Поэтому исходным пунктом для понимания патогенеза LOH–синдрома и его многочисленных клинических проявлений является та роль, которую тестостерон и другие андрогены играют в физиологических условиях.
Современная наука продолжает накапливать знания о механизмах реализации действия андрогенов. Например, с вступлением в эру стволовых клеток выяснилось, что противоположное влияние тестостерона на миоцито– и адипоцитогенез связано с ингибированием дифференцировки мезенхимальных стволовых клеток в адипоциты и усилением таковой в направлении мышечных клеток.
В органах–мишенях андрогены в ряде случаев «делегируют» многие из своих функций локальным паракринным ростовым факторам (EGF, FGF, NGF, VEGF, IGF–1, PDGF, TGF). Это свидетельствует о важности эпителиально–стромальных взаимоотношений в механизме действия андрогенов, что особенно наглядно видно на примере предстательной железы. На уровне клеточной регуляции основную роль играют специфические белки — цитоплазматические и ядерные рецепторы андрогенов (РА) [24], хотя в последние годы появились данные о существовании специфических рецепторов и в клеточной мембране.
Одним из важнейших открытий молекулярной эндокринологии стало установление факта, что собственно гормональную активность стероидных гормонов реализует не сам гормон, а его ядерный рецептор. Именно он функционирует как активатор или супрессор генов, то есть как фактор транскрипции, тогда как гормон выполняет лишь роль его проводника к соответствующему участку ДНК. Поэтому классическая триада механизма гормональной регуляции — «гормон — ген — фермент» применительно к стероидам может выглядеть как тетрада «гормон — рецептор — ген — фермент».
После конверсии тестостерона в дигидротестостерон (ДГТ) последний связывается с цитоплазматическим РА клетки–мишени. Синтез РА является следствием экспрессии гена, который находится в области q11–12 Х–хромосомы [25]. Белок (молекулярная масса 99 кДа) отличают слабокислые свойства, высокое сродство к андрогенам (Кас ДГТ = 1,9 × 109 М–1) и низкая емкость связывания. Он находится в комплексе с белками теплового шока, которые отщепляются после связывания с ДГТ. Таким образом, РА подвергается конформационным изменениям, благодаря которым гормон–рецепторный комплекс обретает способность проникать через ядерную мембрану и связываться с комплементарными участками ядерной ДНК (рис. 1). Помимо ДГТ, способностью связываться с РА обладают и менее активные андрогенные стероиды — тестостерон, андростендион и др. С–терминальный домен РА связывается с андрогеном, небольшой по количеству аминокислотных остатков центральный участок молекулы ядерного РА отвечает за связывание с ДНК, N–терминальный домен выполняет функцию регулятора промоторной активности ДНК (рис. 2).
Последующие события связаны с активацией ДНК– и РНК–полимеразной активности, синтеза белков. В андрогензависимых органах, прежде всего в предстательной железе, рецепторы опосредуют торможение андрогенами процесса апоптоза. Например, андрогены вызывают супрессию генов TRPM–2 и глутатион–S–трансферазы, запускающих процесс апоптоза в эпителии предстательной железы. В условиях дефицита андрогенов происходит активация этих генов. Гистохимический метод TUNEL дает возможность визуализировать апоптоз эпителиоцитов простаты по характерным разрывам нитей ДНК (рис. 3). Имеются, однако, отдельные сообщения, в которых описаны опосредованные РА биологические эффекты андрогенов, возникающие без вовлечения транскрипционных механизмов.
/13/13_2.jpg)
Клеточные РА имеются практически во всех тканях и органах. Это соответствует универсальному характеру роли андрогенов в регуляции физиологических функций (табл. 1).
Фактически все органы и системы мужского организма подвержены изменениям, связанным с возрастным дефицитом андрогенов (рис. 4). В урогенитальной сфере отмечаются дизурические нарушения, олигоспермия (вследствие недостаточной гормональной стимуляции сперматогенеза), изменение подвижности сперматозоидов, появление их патологических форм, в целом — ухудшение оплодотворяющей способности семенной жидкости.
Патогенез эректильной дисфункции, нарушений эякуляции (задержка или отсутствие), ослабления либидо и оргастических ощущений имеет более сложный, комплексный характер, поскольку включает ряд органических и функциональных изменений центральной и периферической нервной системы, магистральных и периферических сосудов и в особенности — психо–эмоционального статуса. Ослабление эрекции является результатом уменьшения активирующего влияния тестостерона на всех уровнях регуляции — коры головного мозга, среднего мозга, гладких мышц пениса, сосудистого эндотелия, в том числе в связи со снижением синтеза оксида азота. Большое значение имеют и атеросклеротические изменения периферических сосудов. Половые расстройства усугубляются депрессией, нарушением сна, ослаблением памяти, когнитивных функций, раздражительностью и т.д. [26, 27]. Эти психофизиологические нарушения сопровождаются повышенной утомляемостью, сниженной физической и умственной работоспособностью, рядом вегетососудистых расстройств: резкими колебаниями артериального давления, тремором пальцев рук, повышенной потливостью, внезапными приливами крови к голове, шее и верхней части туловища, приступами боли в области сердца, головокружением.
Подобные вегетососудистые эпизоды напоминают так называемые горячие приливы у женщин в состоянии менопаузального перехода (климакса) и имеют аналогичное происхождение, а именно перевозбуждение гипоталамической норадренергической регуляции из–за недостаточного торможения симпатической нервной системы половыми стероидами. Изменяется соотношение нейромедиаторов в нейроэндокринной системе. Ферментативные системы мозга не успевают метаболизировать большое количество норадреналина, выделяющегося из аксонов нейронов, принимающих участие в нейроэндокринной регуляции секреции половых стероидов в контуре отрицательной обратной связи гипоталамо–гипофизарно–тестикулярной системы. Нейромедиатор диффундирует в близлежащие нервные центры гипоталамуса, отвечающие за терморегуляцию, сосудистый тонус, энергетический метаболизм, другие вегетативные функции, и дезорганизует их деятельность с соответствующими нервными и соматическими последствиями.
Прямое отношение к нарушениям метаболизма при LOH–синдроме, прежде всего нарастанию жировой массы вплоть до ожирения, имеет усиление превращения тестостерона в эстрадиол, а андростендиона — в эстрон, катализируемое ароматазным ферментным комплексом. Сама жировая ткань располагает необходимыми для этого ферментами и осуществляет данный процесс пропорционально своей массе. Кстати, повышенной эстрогенизацией организма (как в абсолютном выражении — уровень эстрогенов в крови, так и в относительном — соотношение уровней эстрогенов и андрогенов) объясняется наблюдаемая в ряде случаев гинекомастия и болезненные ощущения в околососковой области. Но более важно, что эстрогены стимулируют в печени синтез СССГ, увеличивая его содержание в системной циркуляции и связывание тестостерона. Отсюда — уменьшение активной фракции свободного тестостерона, следовательно, углубление андрогенной недостаточности. С другой стороны, доказана положительная роль эстрогенов мужского организма в поддержании структуры и прочности костной ткани. Эстрогены сдерживают активность остеокластов, вызывающих резорбцию костной ткани, тогда как тестостерон активирует остеобласты, принимающие участие в построении костной ткани путем выработки компонентов органического матрикса. Поэтому остеопатия и остеопороз развиваются у стареющих мужчин не так стремительно, как у женщин в постменопаузе, когда быстро нарастает дефицит эстрогенов вследствие атрофии яичниковых фолликулов.
Один из путей увеличения андрогенной насыщенности организма при старении заключается в фармакологическом ингибировании его превращения в эстрогены. Согласно нашим неопубликованным данным, одним из результатов введения ингибитора ароматазы андрогенов стареющим крысам–самцам является существенное увеличение массы андрогензависимых органов — вентральной доли предстательной железы и других добавочных половых желез. Следует, однако, иметь в виду, что степень ингибирования ароматизации тестостерона не должна быть чрезмерной, чтобы избежать остеопороза.
Имеется еще один аспект взаимосвязи между LOH–синдромом, ожирением и ароматизацией тестостерона. Согласно результатам европейских исследований, ожирение у мужчин может быть не только следствием снижения уровня тестостерона, но и его причиной. Более того, подобные случаи встречаются чаще, чем первичное возрастное уменьшение продукции андрогенов. Симптомы LOH–синдрома обнаружены у 73 % мужчин с ожирением и избыточной массой тела [8]. Уровень тестостерона в сыворотке крови при ИМТ > 30 в среднем на 30 % ниже, чем при ИМТ < 25. Очевидно, развитие LOH–синдрома при этом обусловлено ингибиторным влиянием эстрогенов, лептина и цитокинов жировой ткани на гипоталамические механизмы регуляции секреции гипофизарных гонадотропинов. В этих случаях секреция ЛГ при LOH–синдроме не повышена, что свидетельствует о первичной роли гипоталамо–гипофизарных нарушений в его патогенезе, иными словами, о вторичном гипогонадизме.
При LOH–синдроме отмечается преимущественно центральный тип ожирения, который, как известно, индуцируется кортикостероидами. Это указывает на определенную роль стресса в метаболических расстройствах, когда активизируется гипоталамо–гипофизарно–адренокортикальная ось. Причем состояние стресса обусловлено не только психоэмоциональными причинами, но и возрастными сдвигами («стресс–возраст–синдром», по В.В. Фролькису [28]). И все же нужно признать, что механизмы накопления абдоминального жира при возрастном дефиците тестостерона во многом остаются невыясненными. Кстати, центральный тип ожирения у многих женщин в менопаузе развивается, напротив, на фоне повышения уровня в крови свободного тестостерона, то есть его активной фракции.
Дефицит тестостерона ассоциируется с высоким риском как метаболического синдрома, так и отдельных его проявлений — центрального ожирения, инсулинорезистентности (включая сахарный диабет 2–го типа), дислипидемии, артериальной гипертензии. Пусковым звеном синдрома является, по–видимому, ожирение и связанное с ним так называемое системное воспаление, характеризующееся повышением уровня фактора некроза опухоли a и других провоспалительных цитокинов в крови. Избыточная масса жировой ткани провоцирует инсулинорезистентность, гипергликемию, дислипидемию, гипертензию.
Таким образом, ожирение провоцирует дефицит тестостерона, а дефицит тестостерона приводит к ожирению, формируя порочный круг, который может быть разорван заместительным введением тестостерона.
Патогенетическая роль дефицита тестостерона в возникновении сахарного диабета 2–го типа подтверждается развитием инсулинорезистентности при андрогенной депривации у пациентов с аденокарциномой простаты [29] и улучшением течения диабета при заместительной терапии тестостероном у пациентов с LOH–синдромом [30]. Степень ожирения, уровень общего холестерина и липопротеинов низкой плотности снижаются под влиянием препаратов тестостерона при LOH–синдроме [31]. Таким образом, тестостеронотерапия больных с LOH–синдромом, сопровождающимся нарушениями метаболизма, является патогенетически оправданной и достаточно эффективной.
К типичным проявлениям андрогенного дефицита относят и анемию, которая развивается отчасти вследствие недостаточной андрогенной стимуляции синтеза эритропоэтина в почках и, следовательно, эритропоэза в костном мозгу.
Нужно иметь в виду, что патогномоничные клинические симптомы LOH–синдрома отсутствуют. Для его диагностики решающее значение имеют гормональные исследования в комплексе с клинической картиной заболевания, а многие проявления, такие, например, как эректильная недостаточность, атрофия мышечной ткани и снижение минеральной плотности костной ткани, связаны не только с дефицитом тестостерона, но и с возрастными изменениями нервной и сосудистой систем, метаболизма, ослаблением анаболических процессов, эндокринными и иными заболеваниями.
Возвращаясь к роли стресса в патогенезе LOH–синдрома, можно отметить следующее. В среднем и пожилом возрасте стрессовые нагрузки, которыми так изобилует современная жизнь, переносятся хуже, чем в молодом, особенно при сниженных резервах адаптации. В отношении связи LOH–синдрома со стрессом, по нашему мнению, имеется два важных аспекта.
Как известно, усиление секреции гипофизарного кортикотропина при остром и хроническом стрессе неизбежно сопровождается увеличением продукции бета–эндорфина, поскольку оба гормона образуются в ходе процессинга из одной и той же молекулы — про–опиомеланокортина. Бета–эндорфин и другие эндогенные опиоиды ингибируют синтез и секрецию гипоталамического ЛГ–рилизинг–гормона и, соответственно, секрецию ЛГ аденогипофизом. Это объясняет снижение гормонопродуцирующей активности клеток Лейдига, что служит непосредственной причиной уменьшения уровня тестостерона в крови при стрессе [32]. В этом есть определенная биологическая целесообразность, которая заключается в том, что во время войн, голода и других стрессовых ситуаций, ухудшающих условия для осуществления репродуктивной функции и выхаживания потомства, его воспроизводство отодвигается на второй план.
Другой аспект проблемы — связь между стрессом и метаболическим синдромом как фактором риска развития LOH–синдрома. Обзор публикаций по проблеме «хронический стресс и метаболический синдром» завершается выводом о высокой вероятности психосоциального стресса как одной из причин метаболического синдрома [33]. Предлагаемая нами схема (рис. 5) демонстрирует причинно–следственные связи в патогенезе LOH–синдрома (без детализации упомянутой выше роли избыточной массы жировой ткани и адипокинов).
Несмотря на то, что заместительная терапия пациентов с LOH–синдромом доказала свою эффективность во многих аспектах улучшения качества жизни, представляется целесообразным уделить больше внимания антистрессовой терапии в комплексном лечении данного недуга.
1. Basaria S. Reproductive aging in men // Endocrinol. Metab. Clin. North. Am. — 2013. — Vol. 42. — P. 255–270.
2. Дедов И.И., Калинченко С.Ю. Возрастной андрогенный дефицит у мужчин. — М.: Практическая медицина, 2006. — 239 с.
3. Singh P. Andropause: Current concepts // Indian J. Endocrinol. Metab. — 2013. — Vol. 17 (Suppl 3). — S621–S629.
4. Tsujimura A. The Relationship between testosterone deficiency and men's health // World J. Mens Health. — 2013. — Vol. 31. — P. 126–135.
5. Huhtaniemi I. Late–onset hypogonadism: Current concepts and controversies of pathogenesis, diagnosis and treatment // Asian J. Androl. — 2014. — Vol. 16. — P. 192–202.
6. Feldman H.A., Longcope C., Derby C.A. et al. Age trends in the level of serum testosterone and other hormones in middle–aged men: longitudinal results from the Massachusetts male aging study // J. Clin. Endocrinol. Metab. — 2002. — Vol. 87. — P. 589–598.
7. Wang C., Nieschlag E., Swerdloff R. et al. Investigation, treatment and monitoring of late–onset hypogonadism in males: ISA, ISSAM, EAU, EAA and ASA recommendations // Eur. J. Endocrinol. — 2008. — Vol. 159. — P. 507–514.
8. Wu F.C., Tajar A., Beynon J.M. et al. Identification of late–onset hypogonadism in middle–aged and elderly men // N. Engl. J. Med. — 2010. — Vol. 363. — P. 123–135.
9. Tajar A., Huhtaniemi I.T., O’Neill T.W. et al. Characteristics of androgen deficiency in late–onset hypogonadism: results from the European Male Aging Study (EMAS) // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97. — P. 1508–1516.
10. Harman S.M., Metter E.J., Tobin J.D. et al. Longitudinal effects of aging on serum total and free testosterone levels in healthy men // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86. — P. 724–731.
11. Shores M.M., Smith N.L., Forsberg Ch.W. et al. Testosterone treatment and mortality in men with low testoste–rone levels // J. Clin. Endocr. Metab. — 2012. — Vol. 97. — P. 2050–2058.
12. Pye S.R., Huhtaniemi I.T., Finn J.D. et al. Late–onset hypogonadism and mortality in aging men // J. Clin. Endocrinol. Metab. — 2014. — Vol. 99. — P. 1357–1366.
13. Ohlsson C., Barrett–Connor E., Bhasin Sh. et al. High serum testosterone is associated with reduced risk of cardiovascular events in elderly men // JACC. — 2011. — Vol. 58. — P. 1674–1681.
14. Горпинченко И.И., Имшенецкая Л.П. Андрологические проблемы пожилого возраста // Здоровье мужчины. — 2005. — № 2. — С. 26–36.
15. Лучицький Є.В., Лучицький В.Є. Сучасні погляди на віковий андрогенодефіцит у чоловіків // Ендокринологія. — 2012. — № 4. — С. 56–60.
16. Кирилюк М.Л. Віковий дефіцит андрогенів у чоловіків. Сучасні підходи до діагностики та лікування // Клін. ендокринол. та ендокр. хірургія. — 2013. — № 3 (44). — С. 61–68.
17. Поворознюк В.В. Андропауза і остеопороз (частина I) // Мистецтво лікування. — 2004. — № 7. — С. 30–36.
18. Поворознюк В.В. Андропауза і остеопороз (частина II) // Мистецтво лікування. — 2004. — № 8. — С. 46–52.
19. Резников А.Г. Репродуктивные мишени эндокринных дизрапторов // Репродуктивная эндокринология. — 2014. — № 3 (17). — С. 18–25.
20. Pinto A., Carvalho D. Human infertility: are endocrine disruptors to blame? // Endocr. Connect. — 2013. — Vol. 2. — P. 15–29.
21. Germaine M., Buck L. Persistent environmental pollutants and couple fecundity: an overview // Reprod. — 2014. — Vol. 147. — P. 97–104.
22. Matsumoto A.M. Andropause: clinical implications of the decline in serum testosterone levels with aging in men // J. Gerontol. A. Biol. Sci. Med. Sci. — 2002. — Vol. 57. — M76–M99.
23. Калинченко С.Ю. Возрастные изменения состояния гипоталамо–гипофизарно–тестикулярной системы у мужчин старшей возрастной группы // Международный эндокринологический журнал. — 2007. — № 4 (10). — С. 30–41.
24. Резников А.Г. Физиологические аспекты рецепции андрогенов // Физиология гормональной рецепции / Ред. В.Г. Шаляпина. — Л.: Наука, 1986. — С. 140–164.
25. Brown C.J., Goss S.J., Lubahn D.B. et al. Androgen receptor locus on the human X chromosome: regional localization to X q11–12 and description of a DNA polymorphism // Amer. Hum. Genet. — 1989. — Vol. 44. — P. 264–269.
26. Carnahan R.M., Perry P.J. Depression in aging men: the role of testosterone // Drugs Aging. — 2004. — Vol 21. — P. 361–376.
27. Cherrier M.M. Testosterone effects on cognition in health and disease // Front. Horm. Res. — 2009. — Vol. 37. — P. 150–162.
28. Фролькис В.В. Стресс–возраст–синдром // Физиол. журн. — 1991. — № 3. — С. 3–10.
29. Hamilton E.J., Gianatti E., Strauss B.J. et al. Increase in visceral and subcutaneous abdominal fat in men with prostate cancer treated with androgen deprivation therapy // Clin. Endocrinol. (Oxf.) — 2011. — Vol. 74. — P. 377–383.
30. Aversa A., Bruzziches R., Francomano D. еt al. Effects of testosterone undecanoate on cardiovascular risk factors and atherosclerosis in middle–aged men with late–onset hypogonadism and metabolic syndrome: results from a 24–month, randomized, double–blind, placebo–controlled study // J. Sex Med. — 2010. — Vol. 7. — P. 3495–3503.
31. Yassin D.J., Doros G., Hammerer P.G., Yassin A.A. Long–term testosterone treatment in elderly men with hypogonadism and erectile dysfunction reduces obesity parameters and improves metabolic syndrome and health–related quality of life // J. Sex Med. — 2014. — Vol. 11. — P. 1567–1576.
32. Барабой В.А., Резніков О.Г. Фізіологія, біохімія і психологія стресу. — К.: Інтерсервіс, 2013. — 314 с.
33. Bergmann N., Gyntelberg F., Faber J. The appraisal of chronic stress and the development of the metabolic syndrome: a systematic review of prospective cohort studies // Endocr. Connect. — 2014. — Vol. 3. — R55–R80.

/13/13.jpg)
/14/14.jpg)
/14/14_2.jpg)
/15/15.jpg)