Международный эндокринологический журнал 6 (62) 2014
Вернуться к номеру
Вірус-асоційоване ураження щитоподібної залози при вірусному гепатиті С (огляд літератури та власні дані)
Авторы: Мазур Л.П. - ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України»
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У статті висвітлено механізми ураження щитоподібної залози при вірусному гепатиті С. Описано прямий пошкоджуючий вплив вірусу на залозу, автоімунне ураження тиреоцитів та їх поєднання. Опрацьовано історії хвороби 46 хворих з активною формою вірусного гепатиту С (RNA+). За результатами УЗД було діагностовано неоднорідність структури залози в 10 (21,7 %) пацієнтів, а її збільшення до І ст. — у 12 (26,0 %) пацієнтів. Зростання рівнів антитіл до тиреопероксидази спостерігали у 12 (26,1 %) пацієнтів. Зміни Т4(в) і Т3(в) були незначними. У 4 (10,9 %) пацієнток виявлено клінічно значиме зростання рівня тиреотропного гормону та діагностовано гіпотиреоз та автоімунний тиреоїдит. Більш схильними до виникнення вірус-асоційованого ураження щитоподібної залози були особи жіночої статі.
В статье освещены механизмы поражения щитовидной железы при вирусном гепатите С. Описаны прямое повреждающее влияние вируса на железу, аутоиммунное поражение тиреоцитов и их сочетание. Проработаны истории болезни 46 больных с активной формой вирусного гепатита С (RNA+). По результатам УЗИ была диагностирована неоднородность структуры железы у 10 (21,7 %) пациентов, а ее увеличение до I ст. — у 12 (26,0 %) пациентов. Рост уровней антител тиреопероксидазы наблюдали у 12 (26,1 %) пациентов. Изменения Т4(в) и Т3(в) были незначительными. У 4 (10,9 %) пациенток выявлено клинически значимое повышение уровня тиреотропного гормона и диагностированы гипотиреоз и аутоиммунный тиреоидит. Более склонными к возникновению вирус-ассоциированного поражения щитовидной железы были лица женского пола.
The article covers the mechanisms of thyroid involvement in viral hepatitis C. Direct damaging effect of the virus on the gland, autoimmune destruction of thyrocytes and their combination are described. We revised case histories of 46 patients with active form of viral hepatitis C (RNA +). According to the results of ultrasound investigation we have detected heterogenous structure of the gland in 10 (21.7 %) patients, and its enlargement to I stage — in 12 (26.0 %) patients. Increased levels of thyroid peroxidase antibodies were observed in 12 (26.1 %) patients. Changes of fT4 and fT3 were not significant. In 4 (10.9 %) female patients we have detected clinically significant increased level of thyroid-stimulating hormone and diagnosed them with hypothyroidism and autoimmune thyroiditis. Female patients were more prone to the appearance of virus-associated thyroid involvement.
щитоподібна залоза, автоімунний тиреоїдит, вірусний гепатит С.
щитовидная железа, аутоиммунный тиреоидит, вирусный гепатит С.
thyroid gland, autoimmune thyroiditis, viral hepatitis C.
Статья опубликована на с. 102-107
Вступ
Відомо, що 130–170 мільйонів людей, що становить близько 3 % населення світу, хворіють на хронічний вірусний гепатит C (ВГС). Щорічно інфікується 3–4 мільйони осіб, а понад 350 000 людей помирає від хвороб, пов’язаних із гепатитом С [13]. Лише в невеликої кількості інфікованих вірусом гепатиту С спостерігається спонтанне вилікування. У переважній більшості випадків виникає хронічне інфікування з наявністю в крові антитіл до вірусу та персистуючою віремією. Поряд із характерним ураженням гепатобіліарної системи з розвитком хронічного гепатиту, цирозу та гепатоцелюлярної карциноми спостерігається поєднання вірусу гепатиту С зі значною кількістю різноманітних автоімунних захворювань, зокрема змішаною кріоглобулінемією, лімфопроліферативними розладами, дисфункцією щитоподібної залози (ЩЗ) автоімунного генезу, цукровим діабетом 1-го типу, утворенням низки автоантитіл та ідіопатичною тромбоцитопенічною пурпурою [15, 17, 19]. Також відзначено, що ураження ЩЗ може бути індуковане специфічним противірусним лікуванням ВГС із застосуванням інтерферонотерапії та рибавірину. При цьому ураження вірусом ЩЗ є особливо важливим, зважаючи на те, що вона може стати додатковим позапечінковим джерелом його реплікації, а також одним із майданчиків запуску вірус-асоційованих автоімунних процесів у цілому організмі [29].
Серед варіантів ураження ЩЗ у пацієнтів із ВГС виділяють хронічний тиреоїдит із гіпотиреозом, хронічний тиреоїдит із гіпертиреозом, субклінічний гіпотиреоз, субклінічний гіпертиреоз, гіпотиреоз, гіпертиреоз та хронічний тиреоїдит без порушення функції залози [27]. До особливостей ураження ЩЗ при ВГС можна віднести зростання концентрації в крові антитіл до тиреопероксидази (АТ-ТПО) та підвищення ризику розвитку гіпотиреозу в осіб із високим вмістом АТ-ТПО. Такі ж процеси розвиваються і при пошкодженні ЩЗ унаслідок проведення терапії α-інтерфероном.
Важливу роль у виникненні та особливостях прогресування автоімунного тиреоїдиту (АІТ) відіграють географічні передумови, генетичні особливості популяції, а також зовнішні впливи, такі як йодний дефіцит чи інші інфекційні чинники. Так, багатьма дослідниками ідентифіковані гени, що, ймовірно, пов’язані з АІТ — тиреоглобуліну (ТГ), рецепторів до тиреотропного гормону (ТТГ), CD40, CTLA-4, PTPN22 та варіанти послідовностей DR головного комплексу гістосумісності [23].
У дослідженні Xiao-Rong Mao et al., що проводилося в Китаї із залученням більше ніж 1000 пацієнтів із ВГС, було виявлено ураження ЩЗ у 26,5–28,3 % випадках із високою частотою виникнення субклінічного гіпотиреозу (понад 13 %) та хронічного тиреоїдиту без порушення функції ЩЗ (понад 10 %), тоді як частота гіпертиреозу була найнижчою [27]. У дослідженні Ganne-Сarrie et al. було виявлено, що частота захворювання на АІТ у пацієнтів із ВГС є вірогідно вищою, ніж у контролі (17 і 4 % відповідно) [18]. Вказують на наявність АІТ інфікування вірусом гепатиту С у 10 % випадків і порушення функції ЩЗ у 3 % пацієнтів [20, 33]. У дослідженні, проведеному A. Antonelli зі співавторами при обстеженні близько 550 осіб, інфікованих вірусом гепатиту С, діагностували переважний розвиток у них гіпотиреозу (13 %). Крім цього, з високою частотою виявляли в сироватці крові підвищення рівнів антитіл до ТГ — АТТГ (17 %) та АТ-ТПО (21 %) [6]. Групою дослідників під керівництвом D.A. Zarebska-Michaluk вивчалася поширеність позапечінкових проявів ВГС у 210 пацієнтів у Польщі. При цьому виявлена частота виникнення автоімунного ураження ЩЗ становила 16,2 %, а ЦД — 4,2 % випадків [37]. G. Indolfi із співдослідниками виявили субклінічний гіпотиреоз в 11,1 % і зростання титру антитіл до ТГ, у 5,6 % серед 36 дітей, інфікованих вірусом гепатиту С за негативних показників АТ-ТПО, тоді як у групі контролю ці показники становили 2,7 і 0,7 % відповідно [21].
За результатами численних проведених досліджень було запропоновано гіпотезу, згідно з якою ураження ЩЗ при ВГС можливе через два механізми: прямий цитопатичний вплив вірусу з посиленням процесів апоптозу тиреоцитів і вторинний індукований автоімунний процес або їх поєднання [32]. Запуск автоімунних механізмів пошкодження ЩЗ при інфікуванні вірусом гепатиту С реалізується через декілька механізмів: вірусна індукція змін в експресії власних антигенів або презентація прихованих епітопів; індукція місцевого запального процесу (наприклад, внаслідок дії цитокінів) з подальшою активацією автореактивних Т-клітин (bystander activation mechanism, «механізм стоячого поряд»); молекулярна мімікрія між антигенами вірусу та ЩЗ; стимуляція на тиреоцитах аберантної експресії молекул головного комплексу гістосумісності 2-го типу [22].
Значну роль автоімунного компонента підтверджують результати дослідження, оприлюднені у 2004 р. A. Antonelli та C. Ferri, в якому було порівняно частоту виникнення проявів автоімунного пошкодження ЩЗ у пацієнтів із ВГС і в пацієнтів, у яких при інфікуванні виникало інше позапечінкове автоімунне ускладнення гепатиту — змішана кріоглобулінемія. За наявності супутньої кріоглобулінемії підвищення рівнів АТ-ТПО виявлено у 28 % осіб, тоді як за її відсутності — в 14 %. Загалом у популяції пацієнтів, інфікованих вірусом гепатиту С, частота виявлення антитиреоїдних антитіл була втричі вищою, ніж у здорових осіб [9].
Нещодавно було продемонстровано, що в пацієнтів з АІТ та гіпотиреозом наявні високі рівні CXCL10 (γ-інтерферон-індуковані хемокіни). Також відомо, що Th1-асоційовані імунні реакції відіграють роль у патогенезі АІТ і дифузного токсичного зоба. Більше того, новітні дані свідчать про наявність у пацієнтів із хронічним перебігом інфекції вірусу гепатиту С власне у тканині ЩЗ, хоча ці дослідження не є численними та потребують підтвердження [16].
Ґрунтуючись на цих даних, було запропоновано гіпотезу, згідно з якою розвиток автоімунного процесу в тканині ЩЗ подібний до того, що спричиняє пошкодження гепатоцитів при ВГС. Вірус гепатиту С здійснює прямий вплив на ЩЗ шляхом стимуляції експресії генів CXCL10 і секреції їх тиреоцитами. Даний хемокін що зумовлює міграцію в тканину залози Th1-лімфоцитів, продукують γ-інтерферон і ФНП-α, які, у свою чергу, стимулюють продукцію тиреоцитами CXCL10. Унаслідок таких процесів виникає імунний каскад, що здатний спричинити розвиток АІТ у генетично схильних осіб [7, 16].
Ця гіпотеза нещодавно отримала підтвердження у двох дослідженнях під керівництвом A. Antonelli (2008), в яких було продемонстровано високий рівень CXCL10 у сироватці крові пацієнтів із ВГС і змішаною кріоглобулінемією. Також виявлено вищі рівні CXCL10 в осіб із супутнім тиреоїдитом. Для порівняння, вміст хемокіну CCL2, що продукується попередниками Th2-лімфоцитів, не відрізнявся вірогідно в осіб із тиреоїдитом і без нього. Тобто підвищений рівень CXCL10 є характерним для осіб, які мають значну експресію інтерферон-стимулюючих генів, а також не відповідають на введення екзогенного α-інтерферону [7, 16].
Багатьма вченими підтримується теорія, згідно з якою цитокіновий профіль дендритних клітин не має здатності поляризувати (відділити) реакції Т-клітин відносно реакції Т1-/Тс1-клітин і зумовлює неадекватну активацію клітин — природніх кілерів і природніх T-кілерів. Водночас інші дослідження показали, що прогресуюче ураження печінки при хронічному ВГС корелює із зростанням внутрішньопечінкової експресії Th1-асоційованих цитокінів.
Також виявлено, що в пацієнтів із ВГС, змішаною кріоглобулінемією та АІТ вірогідно зростає концентрація інтерлейкіну-6, тоді як вміст інтерлейкіну-1β та ФНП-α не асоціюється з ураженням ЩЗ [7].
Проведено низку досліджень, результати яких підтверджують наявність мімікрії між антигенами вірусу гепатиту С і тиреоцитами.
A. Martocchia та P. Falaschi (2007) вивчали подібність амінокислотних послідовностей поліпротеїнів ВГС та антигенів тиреоцитів, також вивчали вірусні антигени C, E1, E2, p7, NS2, NS3, NS4a, NS4b, NS5a та NS5b, досліджували п’ять тиреоїдних тканинно-специфічних антигенів: ТГ, тиреоїдну пероксидазу, рецептори до тиреотропіну, натріййодидний симпортер і пендрин. Було виявлено, що подібність між тиреоїдними та вірусними пептидами становить від 62,5 до 87,5 %. При включенні в аналіз консервативних замін гомологічність послідовностей амінокислот зростала до 100 %. При цьому подібність була характерною на тому чи іншому рівні для всіх антигенів вірусу гепатиту С і всіх п’яти тиреоїдспецифічних антигенів. Найвищу кількість гомологічностей щодо різноманітних вірусних пептидів мав ТГ. Найвищий ступінь подібності встановлено між натріййодидним симпортером і NS4a-протеїном у пацієнтів із генотипом ВГС1а. Спостерігали мімікрію між антигеном рецепторів до тиреотропіну та ділянками протеїну E2 у пацієнтів із генотипом ВГС1а. Виявлена гомологічність із вірусними протеїнами пояснює часте та раннє зростання рівнів ТГ у пацієнтів на початковому етапі розвитку АІТ, тоді як зростання АТ-ТПО демонструє глибше та більш агресивне ураження тиреоцитів [28].
В експериментальному дослідженні Nagako Akeno зі співавторами вивчали механізми прямого впливу ВГС на тканину ЩЗ [5]. Основою для проведення даного дослідження стало те, що раніше було показано наявність негативно-полярних ланцюгів РНК вірусу в периферичній крові, в гранулоцитах, моноцитах/макрофагах, дендритних клітинах і лімфоцитах [11]. Більше того, T. Laskus зі співавторами (1998) при морфологічному дослідженні виявили негативно-полярні ланцюги РНК вірусу гепатиту С безпосередньо в тиреоїдній тканині двох інфікованих пацієнтів [24]. У дослідженні J. Bartolome (2008) було доведено наявність геномної/антигеномної РНК ВГС у цитоплазмі тиреоцитів у серопозитивних пацієнтів із гепатитом С і вторинним набутим імунодефіцитом із використанням полімеразної ланцюгової реакції в режимі реального часу та гібридизації in situ [10].
Протеїн Е2 вірусу гепатиту С має здатність зв’язуватися з рецепторами до CD81, розміщеними на клітинах ЩЗ, і запускати вироблення інтерлейкіну-8 із подальшою активацією автоімунного процесу ЩЗ, що підтверджує гіпотезу «механізму стоячого поряд» (bystander activation mechanism) та можливість розвитку тиреоїдиту без інфікування тиреоцитів. Відмічено, що при інкубації тиреоцитів із протеїном Е2 ріст клітин не пригнічується (на відміну від гепатоцитів), що підтверджує переважну роль індукції цитокінового каскаду, а не апоптозу, в патогенезі ураження ЩЗ [5]. Водночас можливим є механізм запуску автоімунного ураження тиреоцитів через механізм індукції протеїном Е2 місцевих Т-лімфоцитів [35].
З метою вивчення взаємозв’язку між ВГС і ЩЗ на клітинному рівні було вивчено можливість інфікування клітинної лінії тиреоцитів людини (ML1) вірусом гепатиту С в умовах іn vitro. Використання методики високочутливої, специфічної ланцюгової полімеразної реакції зі зворотною транскрипцією дозволило виявити позитивно- і негативно-полярні ланцюги РНК вірусу гепатиту С в лізаті клітин ML1 та високі рівні ядерного антигену в супернатанті на 3, 7 та 14-й дні після інфікування. З допомогою методики вестерн-блотингу в лізаті клітин ML1 виявляли неструктурний білок NS5A. Було встановлено, що інфікування клітин ML1 вірусом гепатиту С стимулювалося такими факторами, як CD81 та SR-B1/CLA1, а реплікація вірусу гепатиту С в тиреоїдних клітинах гальмувалася дозозалежно α-інтерфероном. Використовуючи супернатант заражених вірусом гепатиту С клітин ML1-лінії, вдалося успішно інфікувати інтактні тиреоїдні клітини. Це дозволило висловити гіпотезу про можливість передачі вірусів від заражених до неінфікованих тиреоцитів в умовах in vivo. Також інфікування клітин ML1-лінії вірусом гепатиту С спричиняло підвищення експресії прозапального цитокіну інтерлейкіну-8 [12].
З’ясування наявності автоімунного процесу в ЩЗ та її функціональної активності в цілому відіграє значну роль при виборі лікувальної тактики в таких пацієнтів, оцінці можливої ефективності та побічних ефектів специфічної противірусної терапії і визначенні прогнозу в цілому.
Близько в 10–25 % пацієнтів із персистуючим вірусним гепатитом С виявляють тиреоїдні автоантитіла [19], зокрема тиреоїдні мікросомальні автоантитіла, антитіла до тиреоглобуліну та антитіла до тиреопероксидази, вміст яких не залежить від тяжкості ураження печінки [8, 14, 18]. Так, визначення тиреоїдних мікросомальних автоантитіл проводять перед призначенням терапії вірусного гепатиту С для діагностики латентного АІТ [18]. Зростання рівнів тиреоїдних автоантитіл слугує ознакою можливого розвитку інших дисфункцій ЩЗ, зокрема гіпертиреозу та гіпотиреозу [19]. Разом із тим наявність їх у крові не дозволяє відрізнити тиреоїдні розлади, індуковані вірусом гепатиту С, від первинних захворювань ЩЗ.
До асоційованих із вірусним гепатитом С захворювань ЩЗ, індукованих інтерферонотерапією, відносяться гіпертиреоз (хвороба Грейвса) й АІТ (тиреоїдит Хашимото) [25, 33]. Виявлення підвищеної концентрації АТ-ТПО в крові пацієнтів із ВГС перед початком лікування препаратами інтерферону дозволяє прогнозувати ймовірність розвитку в них інтерферон-індукованого автоімунного ураження ЩЗ. Також в пацієнтів із вірусним гепатитом С виявлено сильний кореляційний зв’язок між наявністю тиреоїдних розладів і підвищеним рівнем антитіл до печінково-ниркової мікротоми типу 1 [30, 31]. Тому наявність у сироватці крові цих антитіл дозволяє визначити їх як показник можливого виникнення захворювання ЩЗ, індукованого інтерферонотерапією.
У дослідженні, що проводилося в Китаї дослідниками під керівництвом R. Yang (2011), визначали рівні АТ-ТПО і АТТГ у 462 осіб та їх кореляцію з наявністю хронічного ВГС. Частота виявлення інфікування вірусом гепатиту С не відрізнялася вірогідно в групах осіб із нормальними і підвищеними рівнями тиреоїдних антитіл. Водночас у групі пацієнтів із ВГС частота виявлення АТ-ТПО й АТТГ становила близько 31 %, що суттєво вище порівняно з контрольною групою та пацієнтами, інфікованими вірусом гепатиту В. Такі результати ще раз підтверджують необхідність визначення тиреоїдних автоантитіл у пацієнтів із ВГС [36].
Установлено, що частка пацієнтів із середнім і високим рівнем експресії РНК вірусу гепатиту С була вірогідно вищою серед осіб з автоімунними захворюваннями ЩЗ порівняно з пацієнтами з нормальною тиреоїдною функцією. При середньому рівні експресії РНК вірусу гепатиту С переважно розвивався хронічний тиреоїдит із гіпотиреозом, тоді як при низькому її рівні — гіпотиреоз. Виявлені дані свідчать про визначальну роль автоімунних механізмів у розвитку ураження ЩЗ [27].
F. Mansour-Ghanaei зі співдослідниками оцінювали рівні трийодтироніну (Т3) у пацієнтів із вірус-асоційованим цирозом печінки. Було виявлено негативну кореляцію між ступенем ураження печінки за шкалами Чайльда — П’ю і MELD та концентрацією Т3 у крові. Тобто при наростанні функціональної недостатності печінки наростає і гіпофункція тиреоцитів [26]. Водночас при вивченні зміни тиреоїдних показників залежно від ступеня фіброзу не виявлено суттєвих коливань або тенденції до наростання вмісту АТ-ТГ, АТ-ТПО та ТГ на всіх стадіях фіброзу. Середньостатистичні показники ТТГ, Т3(в) та Т4(в) також вірогідно не змінювалися, хоча у тяжкій стадії фіброзу відзначалася тенденція до наростання загальних Т4 і Т3. Вказані коливання пов’язували патогенетично з гіперпродукцією в тяжкій стадії фіброзу тироксинзв’язуючого глобуліну [3].
Тропність вірусу гепатиту С до ЩЗ і специфічність її ураження при інфікуванні була доведена морфологічно в дослідженні H.A. Tran (2011). Було проведено патоморфологічне дослідження 108 пацієнтів із вірусним гепатитом С із метою вивчення стану щитоподібної, наднирникових залоз і гіпофіза. Ознаки тиреоїдиту було виявлено в 13 % випадків (тоді як в контрольній групі — в 7 %), що відповідало змінам, виявленим у пацієнтів прижиттєво. Водночас у жодного пацієнта не було знайдено ознак втягнення в патологічний процес тканини наднирників або гіпофіза [34].
Факт специфічного вірус-асоційованого ураження ЩЗ при ВГС є доведеним у численних дослідженнях. Проте значно різняться дані щодо частоти виявлення тиреоїдної патології та її лабораторної маніфестації.
Тому метою нашого дослідження було оцінити частоту та вираженість тиреоїдної патології, а також її клінічні та лабораторні прояви в пацієнтів із ВГС.
Матеріали та методи
Нами було опрацьовано історії хвороби 46 хворих із активною формою вірусного гепатиту С (RNA+), які перебували на стаціонарному лікуванні в КЗ ТОР «Тернопільська університетська лікарня» впродовж 2012–2014 рр. У всіх пацієнтів попередньо не було діагностовано будь-якої патології ЩЗ. Серед обстежених був 21 чоловік (45,6 %) та 25 жінок (54,4 %). Вік обстежених пацієнтів становив від 21 до 60 років, в середньому 42,6 ± 3,8 року. Тривалість основного захворювання (інфікування) становила в середньому 5,6 ± 0,6 року. Контрольну групу становили 15 практично здорових осіб-донорів.
Діагноз ВГС був підтверджений шляхом визначення його маркерів імуноферментним методом, а також шляхом якісного та кількісного визначення вірусу та генотипування вірусу гепатиту С у сироватці крові методом полімеразної ланцюгової реакції.
Усім хворим, окрім об’єктивного обстеження та рутинних загальноклінічних методів обстеження, проводили ультразвукове дослідження ЩЗ і визначення показників гормональної активності ЩЗ.
Вивчали вміст у сироватці крові рівнів ТТГ, АТ-ТПО, вільного тироксину (Т4(в)) і вільного трийодтироніну (Т3(в)). Визначення показників проводили з застосуванням біохімічного аналізатора StatFах 3200 (США) методом імуноферментного аналізу. Використовували набори для ІФА виробництва Pliva Lachema (Чехія).
Аналіз результатів дослідження здійснювали за допомогою пакета програм Statistica і таблиць Exсel із застосуванням параметричних і непараметричних статистичних методів. Статистичне опрацювання показників проводили методом варіаційної статистики Fisher-Student для 95% довірчого інтервалу.
Результати та їх обговорення
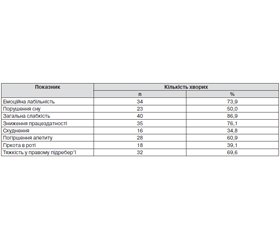
Усі обстежені пацієнти мали низку скарг, частина з яких не є специфічними і можуть виникати унаслідок як ураження печінки, так і порушення функції ЩЗ (табл. 1).
При об’єктивному обстеженні в пацієнтів не виявлено пальпаторно збільшення чи болючості, змін консистенції ЩЗ. За результатами УЗД було діагностовано неоднорідність структури залози в 10 (21,7 %) пацієнтів, а її збільшення до І ст. — у 12 (26,0 %) пацієнтів.
Було виявлено вірогідне зростання рівнів АТ-ТПО в групі хворих на ВГС загалом майже втричі. Проте цей показник не виходив за межі норми. Виявлена також виражена тенденція до зростання ТТГ у сироватці обстежених хворих. Підвищення ТТГ не було вірогідним порівняно з контролем, проте його рівні перевищили межі оптимальних (до 2,5 мкМО/мл). Зміни Т4(в) і Т3(в) були незначними.
Зростання рівнів АТ–ТПО спостерігали в 12 (26,1 %) пацієнтів, зокрема в 8 (32,0 %) жінок і 4 (19,0 %) чоловіків. У 4 (10,9 %) пацієнток виявлено клінічно значуще зростання рівня ТТГ. У 3 (6,5 %) пацієнток підвищення ТТГ супроводжувалося підвищеним вмістом АТ-ТПО, що за наявності специфічної УЗ-картини дозволило вперше встановити в них діагноз АІТ зі зниженою функцією ЩЗ. В однієї (2,2 %) пацієнтки підвищення рівня ТТГ було ізольованим, вміст Т3(в), Т4(в) і АТ–ТПО був у межах норми. Тому був установлений діагноз субклінічного гіпотиреозу. Усім вказаним пацієнткам призначили відповідне лікування, зокрема замісну терапію L-тироксином із поступовим підвищенням його дози до клінічно ефективної. У жодного пацієнта чоловічої статі не було діагностовано захворювання ЩЗ.
Установлені нами в рамках дослідження дані свідчать про досить високу частоту недіагностованої до цього часу клінічно значущої патології ЩЗ у межах 10 %. Ізольоване зростання рівнів АТ-ТПО у хворих на ВГС відзначено в більше ніж 25 % випадків, що не суперечить даним інших досліджень [6, 21, 37]. Отримані дані дозволяють виділити групу пацієнтів із ВГС, що потребують ретельного спостереження та лікування ендокринологом.
Призначення специфічної противірусної терапії хворим із ВГС здійснювалося згідно з Керівництвом Європейської асоціації з вивчення захворювань печінки (лікування інфекції вірусного гепатиту С) [4]. У пацієнток із діагностованими захворюваннями ЩЗ питання призначення даного лікування розглядалося після досягнення компенсації функціонального стану ЩЗ. Подальше спостереження, клінічний, лабораторний та УЗ-контроль за станом щитоподібної залози в усіх пацієнтів здійснювалися згідно з вимогами цього Керівництва.
Висновки
1. Ураження щитоподібної залози при вірусному гепатиті С виникає внаслідок поєднаної взаємообтяжуючої дії різноманітних патогенетичних чинників, що включають прямий вплив вірусу на залозу та багатокомпонентне автоімунне пошкодження тиреоцитів.
2. В інфікованих вірусом гепатиту С пацієнтів виявляється зростання рівнів антитиреоїдних антитіл — у більше ніж 25 % пацієнтів, а розвиток гіпотиреозу — в 10,9 % випадків. Більш схильними до виникнення вірус–асоційованого ураження щитоподібної залози є особи жіночої статі.
1. Боброва І.А. Динаміка змін щитоподібної залози при лікуванні хронічного гепатиту С / І.А. Боброва // Лікарські засоби. — 2010. — № 2(52). — С. 61–64.
2. Гук-Лешневська З.О. Особливості перебігу та позапечінкові прояви хронічних вірусних гепатитів В і С / З.О. Гук-Лешневська, І.І. Чубучна // Теорія та практика сімейної медицини. — 2008. — № 3. — С. 63–66.
3. Рукина Н.Ю. Состояние щитовидной железы у больных хроническим гепатитом С на разных стадиях фиброза / Рукина Н.Ю., Пастушенков В.Л., Гусев Д.А., Астахова А.О. // Дальневосточный медицинский журнал. — 2004. — № 4. — С. 53–55.
4. Руководство Европейской ассоциации по изучению заболеваний печени: лечение инфекции вирусного гепатита С // Сучасна гастроентерологія. — 2012. — № 1(63). — С. 7–16.
5. Akeno N. HCV E2 protein binds directly to thyroid cells and induces IL-8 production: a new mechanism for HCV induced thyroid autoimmunity / N. Akeno, J.T. Blackard, Y. Tomer // J. Autoimmun. — 2008 December. — 31(4). — 339–344.
6. Antonelli A. HCV infection: pathogenesis, clinical manifestations and therapy / Antonelli A., Ferri C., Galeazzi M. et al. // Clin. Exp. Rheumatol. — 2008. — 26. — 39–47.
7. Antonelli A. The presence of autoimmune thyroiditis in mixed cryoglobulinemia patients is associated with high levels of circulating interleukin-6, but not of tumor necrosis factor-alpha / A. Antonelli, C. Ferri, S.M. Ferrari et al. // Clin. Exp. Rheumatol. — 2011. — 29. — 17–22.
8. Antonelli A. Thyroid disorders in chronic hepatitis C / A. Antonelli, C. Ferri, A. Pampana et al. // American Journal of Medicine. — 2004. — Vol. 117, № 1. — 10–13.
9. Antonelli A. Thyroid involvement in patients with overt HCV-related mixed cryoglobulinaemia / A. Antonelli, C. Ferri, P. Fallahi et al. // QJM. — 97. — 499–506.
10. Bartolomé J. Detection of hepatitis C virus in thyroid tissue from patients with chronic HCV infection / J. Bartolomé, E. Rodríguez-Iñigo, P. Quadros et al. // J. Med. Virol. — 2008 Sep. — 80(9). — 1588–94.
11. Blackard J.T. Extrahepatic replication of HCV: insights into clinical manifestations and biological consequences / J.T. Blackard, N. Kemmer, K.E. Sherman // Hepatology. — 2006. — 44(1). — 15–22.
12. Blackard J.T. Hepatitis C virus infection of a thyroid cell line: implications for pathogenesis of hepatitis C virus and thyroiditis / J.T. Blackard, L. Kong, A.K. Huber, Y. Tomer // Thyroid. — 2013 Jul. — 23(7). — 863–70.
13. Cui Y. Update on epidemiology of hepatitis B and C in China / Y. Cui, J. Jia // J. Gastroenterol. Hepatol. — 2013. — 28(Suppl. 1). — 7–10.
14. Deutsch M. Thyroid abnormalities in chronic viral hepatitis and their relationship to interferon alfa therapy / M. Deutsch, S. Dourakis, E.K. Manesis et al. // Hepatology. — 1997. — Vol. 26, № 1. — 206–210.
15. El-Serag H.B. Extrahepatic manifestations of hepatitis C among United States male veterans / H.B. El–Serag, H. Hampel, C. Yeh, L. Rabeneck // Hepatology. — 2002. — 36. — 1439–1445.
16. Fallahi P. Cytokines and HCV-related disorders / P. Fallahi, C. Ferri, S.M. Ferrari et al. // Clin. Dev. Immunol. — 2012. — 468107.
17. Fallahi P. Thyroid involvement in hepatitis C — associated mixed cryoglobulinemia / P. Fallahi, S.M. Ferrari, D. Giuggioli et al. // Hormones (Athens). — 2014 Jan — Mar. — 13(1). — 16–23.
18. Ganne–Carrie N. Latent autoimmune thyroiditis in untreated patients with HCV chronic hepatitis: a case–control study / N. Ganne–Carrie, A. Medini, E. Coderc et al. // Journal of Autoimmunity. — 2000. — Vol. 14, № 2. — 189–193.
19. Himoto T. Extrahepatic manifestations and autoantibodies in patients with hepatitis C virus infection / T. Himoto, T. Masaki // Clin. Dev. Immunol. — 2012. — 871401.
20. Hsieh M.C. Virologic factors related to interferon-alpha-induced thyroid dysfunction in patients with chronic hepatitis C / M.C. Hsieh et al. // Eur. J. Endocrinol. — 2000. — 142. — 431–437.
21. Indolfi G. Thyroid function and anti-thyroid autoantibodies in untreated children with vertically acquired chronic hepatitis C virus infection / G. Indolfi, S. Stagi, E. Bartolini et al. // Clin. Endocrinol. (Oxf). — 2008 Jan. — 68(1). — 117–21.
22. Jadali Z. Autoimmune diseases co-existing with hepatitis C virus infection / Z. Jadali, S.M. Alavian // Iran. J. Allergy Asthma Immunol. — 2010 Dec. — 9(4). — 191–206.
23. Jacobson E.M. The CD40, CTLA-4, thyroglobulin, TSH receptor, and PTPN22 gene quintet and its contribution to thyroid autoimmunity: Back to the future / E.M. Jacobson, Y. Tomer // J. Autoimmun. — 2007. — 28. — 85–98.
24. Laskus T. Search for hepatitis C virus extrahepatic replication sites in patients with acquired immunodeficiency syndrome: specific detection of negative-strand viral RNA in various tissues / T. Laskus, M. Radkowski, L.F. Wang et al. // Hepatology. — 1998. — 28(5). — 1398–1401.
25. Mandac J.C. The clinical and physiological spectrum of interferon-alpha induced thyroiditis: toward a new classification / J.C. Mandac, S. Chaudhry, K.E. Sherman, Y. Tomer // Hepatology. — 2006. — Vol. 43, № 4. — 661–672.
26. Mansour-Ghanaei F. Decreased serum total T3 level in hepatitis B and C related cirrhosis by severity of liver damage / F. Mansour-Ghanaei, M. Mehrdad, S. Mortazavi et al. // Ann. Hepatol. — 2012 Sep — Oct. — 11(5). — 667–71.
27. Mao X.R. Possible factors affecting thyroid dysfunction in hepatitis C virus-infected untreated patients / X.R. Mao, L.T. Zhang, H. Chen, P. Xiao, Y.C. Zhang // Exp. Ther. Med. — 2014 Jul. — 8(1). — 133–140.
28. Martocchia A. Amino acid sequence homologies between HCV polyprotein and thyroid antigens / A. Martocchia, P. Falaschi // Intern. Emerg. Med. — 2007 Mar. — 2(1). — 65–7.
29. Mori K. Viral infection in induction of Hashimoto's thyroiditis: a key player or just a bystander? / K. Mori, K. Yoshida // Curr. Opin. Endocrinol. Diabetes Obes. — 2010 Oct. — 17(5). — 418–24.
30. Muratori L. Susceptibility to thyroid disorders in hepatitis C / L. Muratori, D.P. Bogdanos, P. Muratori et al. // Clinical Gastroenterology and Hepatology. — 2005. — Vol. 3, № 6. — 595–603.
31. Nishioka M. Frequency and significance of antibodies to P450IID6 protein in Japanese patients with chronic hepatitis C / M. Nishioka, S.A. Morshed, K. Kono et al. // Journal of Hepatology. — 1997. — Vol. 26, № 5. — 992–1000.
32. Piszko P. Endocrine disorders in HCV infection / P. Piszko, K. Fleischer, K. Simon, S. Serafińska // Przegl. Epidemiol. — 2006. — 60(4). — 707–14.
33. Prummel M.F. Interferon-alpha and autoimmune thyroid disease / M.F. Prummel, P. Laurberg // Thyroid. — 2003. — 13. — 547–551.
34. Tran H.A. Histopathologic findings of autoimmunity in thyroid, pituitary, and adrenal diseases in chronic hepatitis C postmortem cases / H.A. Tran, G.E. Reeves, T.J. Lyons, J.R. Attia // Endocr. Pract. — 2010 Jul — Aug. — 16(4). — 566–9.
35. Wack A. Binding of the hepatitis C virus envelope protein E2 to CD81 provides a co-stimulatory signal for human T cells / A. Wack, E. Soldaini, C. Tseng et al. // Eur. J. Immunol. — 2001. — 31(1). — 166–175.
36. Yang R. Prevalence of thyroid autoantibodies in hepatitis C and hepatitis B infection in China / R. Yang, Z. Shan, Y. Li et al. // Intern. Med. — 2011. — 50(8). — 811–5.
37. Zarebska-Michaluk D.A. Extrahepatic manifestations associated with chronic hepatitis C infections in Poland / D.A. Zarebska-Michaluk, D.M. Lebensztejn, W.M. Kryczka, E. Skiba // Adv. Med. Sci. — 2010. — 55. — 67–73.

/105/105.jpg)