Международный эндокринологический журнал 6 (62) 2014
Вернуться к номеру
Ендокринна офтальмопатія при автоімунних захворюваннях щитоподібної залози
Авторы: Пашковська Н.В. - Буковинський державний медичний університет, м. Чернівці
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У статті наведено сучасні дані щодо чинників ризику, механізмів розвитку, клінічних особливостей ендокринної офтальмопатії, а також інформація щодо сучасних підходів до діагностики, лікування та профілактики цього захворювання згідно з останніми світовими рекомендаціями, розробленими з позицій доказової медицини.
В статье приведены современные данные относительно факторов риска, механизмов развития, клинических особенностей эндокринной офтальмопатии, а также информация о современных подходах к диагностике, лечению и профилактике этого заболевания согласно последним мировым рекомендациям, разработанным с позиций доказательной медицины.
The article presents modern data about risk factors, mechanisms of development, clinical features of endocrine ophthalmopathy, as well as information regarding current approaches to diagnosis, treatment and prevention of this disease according to the latest global recommendations developed from the position of evidence-based medicine.
ендокринна офтальмопатія, автоімунні захворювання щитоподібної залози.
эндокринная офтальмопатия, аутоиммунные заболевания щитовидной железы.
endocrine ophthalmopathy, autoimmune thyroid diseases.
Статья опубликована на с. 169-173
На сьогодні в ендокринології та офтальмології все більш актуальною стає проблема ендокринної офтальмопатії (ЕОП, офтальмопатія Грейвса, автоімунна офтальмопатія, орбітопатія).
ЕОП є органоспецифічним автоімунним захворюванням, яке характеризується набряком, лімфоцитарною інфільтрацією ретробульбарної клітковини, екстраокулярних м’язів, що проявляється різним ступенем екзофтальму й офтальмопарезу.
Клінічні прояви ЕОП уперше були описані ще в XII столітті іранським лікарем Ісмаїлом ібн Хасаном Джурджані в медичній енциклопедії Zakhīrahi Khvārazm’Shāhī («Скарб Хорезмшаха», близько 1100–1199 н.е.). Однак ще раніше, у період між 1000 і 1100 рр. н.е., видатний перський лікар і філософ Авіценна описав збільшення шиї та випинання очних яблук у хворих із підвищеним апетитом, виклавши його у своєму «Каноні медицини».
У 1786 році Калеб Перрі звернув увагу на зв’язок між зобом та екзофтальмом. У 1835 році Роберт Джеймс Грейвс і в 1840 році Карл Адольф фон Базедов незалежно один від одного описали випадки дифузного токсичного зоба (ДТЗ), що супроводжувався офтальмопатією. Більш детально ЕОП почали вивчати наприкінці 40-х років ХХ століття.
ЕОП є найбільш поширеним захворюванням орбіт, що супроводжує 25–50 % всіх випадків ДТЗ [22]. Від неї страждають головним чином особи віком від 30 до 50 років. ЕОП — найбільш частий і значущий екстратиреоїдний прояв ДТЗ. У переважній більшості випадків офтальмопатія асоційована з хворобою Грейвса (90 %), але також трапляється при автоімунному тиреоїдиті (АІТ) (5 %). У 5 % випадків ЕОП розвивається при відсутності тиреоїдної дисфункції (так звана еутиреоїдна хвороба Грейвса). Приблизно 25–50 % пацієнтів із ДТЗ мають клінічні прояви ЕОП на момент установлення діагнозу, водночас вважається, що застосування діагностичних методів візуалізації (КТ, МРТ) може дозволити встановити діагноз ЕОП у більшості пацієнтів із цим захворюванням. Ураження очей найчастіше реєструється на перших роках захворювання ДТЗ (протягом перших трьох років після дебюту — у 86 % випадків, через 3–6 років — в 40 %, через 6–8 років — в 10 % і понад 8 років — в 7 % випадків відповідно). У більшості пацієнтів ЕОП має легкий перебіг і схильна до мимовільної ремісії. Лише в 3–5 % розвивається тяжка форма захворювання, що загрожує зору. У 5–10 % ЕОП має однобічний характер.
Чинниками ризику розвитку ЕОП вважається жіноча стать (жінки хворіють частіше за чоловіків у 5 разів, водночас для останніх характерний більш пізній початок і поганий прогноз ЕОП), належність до білої раси, систематичне куріння, порушення функції щитоподібної залози (ЩЗ), неодноразові стреси, хронічні інфекції верхніх дихальних шляхів. Зокрема, встановлено, що в тих, хто палить, перебіг ЕОП більш тяжкий і погіршується із зростанням кількості викурених сигарет [21]. Крім того, у курців із ЕОП рівень антитіл до рецептора тереотропного гормона (АТ-рТТГ) вірогідно вищий, ніж у тих, хто не палить. Куріння негативно впливає на наслідки лікування, зокрема, підвищує ризик прогресування ЕОП після лікування тиреотоксикозу радіоактивним йодом.
Тиреоїдна дисфункція суттєво погіршує перебіг ЕОП. Зокрема, доведено, що в пацієнтів із порушеною функцією ЩЗ, причому як із тиреотоксикозом, так і з гіпотиреозом, частіше розвивається тяжка ЕОП, ніж у пацієнтів з еутиреозом. Слід зазначити, що дослідження останніх років не довели залежність перебігу ЕОП від методів лікування ДТЗ. Показано, що ані тиреостатики, ані тиреоїдектомія не впливають на перебіг ЕОП, хоча роль останньої вимагає подальших досліджень [10]. Водночас перебіг ЕОП може погіршуватися після проведення радіойодотерапії [9].
Унікальною особливістю ЕОП як автоімунного захворювання є двофазність перебігу, здатність до спонтанної ремісії активної фази та визначальна роль росту м’яких тканин, а не їх деструкції.
Вважається, що основним автоантигеном при ЕОП є рецептор ТТГ [18]. Однак, за різними джерелами, до 30 % пацієнтів з ЕОП мають негативні чи гранично позитивні титри АТ-рТТГ. Причиною цього може бути низька чутливість наявних тестів або низька роль АТ-рТТГ у цих випадках у розвитку ЕОП. Іншими можливими мішенями автоімунної реакції можуть бути компоненти орбітальних тканин, такі як колаген XIII, що експресується на мембрані орбітальних фібробластів, і кальсеквестрин (кальцій-зв’язувальний білок, розташований в антисарколемальних міофібрилах) [13].
Ключову роль у патогенезі ЕОП відіграють орбітальні фібробласти, що надлишково експресуються на своїй поверхні CD40. Взаємодія СD40 орбітальних фібробластів із CD154 Т-лімфоцитів призводить до активації та проліферації фібробластів із синтезом інтерлейкінів-6, -8 і глікозаміногліканів. Автореактивні Т-лімфоцити сприяють адипогенезу, синтезу глікозаміногліканів та експресії імуномодуляторів в орбіті [14].
У першій фазі активного запалення (клітинної інфільтрації) відбуваються прогресуючі патологічні зміни з боку м’яких тканин очниці, зокрема в ретробульбарній клітковині (запалення, набряк), і екстраокулярних м’язів (інтерстиціальний набряк, інфільтрація лімфоцитами, плазмоцитами, тучними клітинами, макрофагами та мукополісахаридами). Останні товщають в 8–10 разів. Це, у свою чергу, викликає випинання очного яблука та порушення функції окорухових м’язів. З’являється неухильно прогресуючий екзофтальм із характерними ознаками, а в тяжких випадках — розвиток оптичної нейропатії з атрофією зорового нерва. Внаслідок нерівномірного ураження м’язів розвиваються окорухові порушення, з’являється диплопія, зазвичай із вертикальним компонентом, оскільки спочатку страждає нижній прямий м’яз, в тяжких випадках розвивається стійка косоокість. Стискання циліарних нервів може призвести до тяжкої кератопатії чи виразкових змін рогівки.
Основними клінічними проявами ЕОП є сльозотеча, відчуття смітини, піску в очах, печіння, світлобоязнь, відчуття тиску та розпирання в очах, тяжкості в орбіті, біль за очима (спонтанна чи при рухах очима), почервоніння очей, набряк кон’юнктиви й повік, екзофтальм (випинання очних яблук, що надає особі вираз здивування, переляку), утруднення при рухах очима, двоїння, неможливість повністю закрити очі; порушення зору.
У другій (неактивній) фазі ЕОП при легкому перебігу відбувається ремісія із поступовим затиханням запального процесу. У тяжких випадках без відповідного лікування захворювання через 6–12 міс. завершується фіброзом тканин орбіти, що супроводжується повною нерухомістю очей і різким зниженням зору внаслідок більма рогівки або атрофії зорового нерва. Імуносупресивна терапія в цій стадії неефективна.
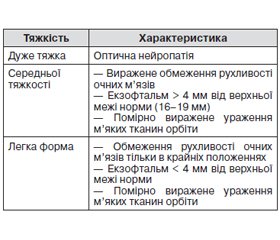
Згідно з консенсусом Європейської групи з вивчення офтальмопатії Грейвса (EUGOGO — European Group on Garves’ Orbitopathy) 2008 року [10], для встановлення класу ЕОП рекомендується використовувати класифікацію NOSPECS, що вперше запропонована в 1969 році та удосконалена в 1977 році Вернером (табл. 1).
Консенсусом (EUGOGO, 2008 р.) також запропоновано застосовувати шкалу клінічної активності ЕОП, згідно з якою виділяють активну та неактивну форми захворювання, установлення яких відіграє виняткову роль при з’ясуванні лікувальної тактики (табл. 2).
Діагностика ЕОП включає офтальмологічне обстеження, візуалізацію структури орбіти та визначення морфофункціонального стану ЩЗ. Основне значення в діагностиці має наявність ДТЗ, рідше — АІТ. У цьому випадку якщо є типові ознаки двобічної офтальмопатії, то діагноз не викликає труднощів.
Визначають рівні тиреоїдних гормонів (вільних тироксину, трийодтироніну), антитіл до рецептора ТТГ, тиреоїдної пероксидази, здійснюють УЗД ЩЗ. З урахуванням супресивного вплива AT-pTTГ на гіпофіз при високих його титрах рівень ТТГ тривалий час залишається низьким і не може використовуватися для оцінки ефективності тиреостатичної терапії. Окрім підтвердження діагнозу ДТЗ, високі титри АТ-рТТГ вказують на ризик прогресування ЕОП. Змeншeння рівня AT-pTTГ менше ніж на 50 % пicля тиреостатичної терапії свідчить про неможливість досягнення тривалої ремісії захворювання. Чинником ризику прогресування захворювання вважається титр AT-pTTГ 7,5 Од/л і вище [10].
Офтальмологічне обстеження є обов’язковим і включає екзофтальмометрію, дослідження полів зору, гостроти зору, офтальмоскопію, визначення обсягу рухів ока, позиційну тонометрію (вимірювання внутрішньоочного тиску у двох проекціях: при погляді прямо та при переведенні погляду вгору чи вниз під кутом 5–10°).
/171/171.jpg)
При огляді спостерігається виражений екзофтальм, частіше двобічний. Для оцінки ступеня прояву екзофтальму використовують екзофтальмометр. У нормі при екзофтальмометрії випинання очних яблук становить 16–19 мм, у хворих на ЕОП може перевищувати ці показники на 2–8 мм. При набряковому екзофтальмі відзначаються виражені набряки повік, кон’юнктиви, ін’єкція судин склер. При переважному залученні в патологічний процес екстраокулярних м’язів на перший план виступають симптоми, зумовлені їх ураженням: симптоми Мебіуса, Грефе, Дальрімпля, Штельвага та ін.; обмеження рухливості очних яблук аж до їх повної нерухомості.
Позиційна тонометрія виявляє збільшення внутрішньоочного тиску при погляді вгору та вниз. Справа в тому, що в місці прикріплення екстраокулярних м’язів до склери виникають застійні повнокровні, розширені та звивисті епісклеральні судини, що формують фігуру хреста. Симптом «хреста» — характерна ознака набрякового екзофтальму. Внутрішньоочний тиск залишається нормальним лише при положенні ока прямо, а при погляді вгору підвищується на 3–6 мм рт.ст. за рахунок притискання ока збільшеними щільними верхнім і нижнім прямими м’язами. Ця ознака не трапляється при пухлинах орбіти та притаманна тільки ЕОП [7].
При проведенні офтальмоскопії може відмічатися набряк сітківки, дисків зорових нервів, атрофія останніх. Відзначаються концентричне звуження полів зору, центральні скотоми. Можуть спостерігатися виразки рогівки, її перфорація, ознаки приєднання інфекції.
Також застосовуються методи орбітовізуалізації (УЗД/КТ/МРТ орбіт), що дозволяють оцінити довжину ретробульбарного простору, товщину (у нормі 4,0–4,5 мм) і щільність окорухових м’язів (на стадії клітинної інфільтрації щільність зменшується, при розвитку фіброзу — зростає). Як уже зазначалося, орбітовізуалізація дозволяє встановити морфологічні порушення навіть за відсутності вираженої клінічної симптоматики ЕОП. Найбільш характерними є зміни в нижньому й медіальному прямих м’язах. КТ/МРТ-обстеження є обов’язковим при однобічному ураженні очей для виключення пухлин ретробульбарної клітковини, головного мозку, тромбозів (переважно кавернозного синусу), аневризм судин головного мозку, травматичних пошкоджень, запальних процесів в орбіті та придаткових пазухах носу. Також проводиться диферен–ціальна діагностика з міастенією, синдромом Толоза — Ханта та нейропатією зорового нерва іншого генезу.
Додатковим критерієм встановлення активності ЕОП є визначення вмісту глікозаміногліканів у сечі. В активній фазі офтальмопатії він зростає та при зниженні активності процесу зменшується. Однак при наявності синдрому підвищеної деструкції сполучної тканини можна отримати хибнопозитивні результати [3, 7].
Лікування ЕОП повинно здійснюватися спільними зусиллями ендокринолога й офтальмолога, при цьому лікувальна тактика залежить від тяжкості та активності ЕОП.
У першу чергу необхідно відмовитися від паління, що негативно впливає на ефективність проведеного лікування, а також нормалізувати функцію ЩЗ. Як уже зазначалося, у хворих із тиреоїдною дисфункцією, причому як із тиреотоксикозом, так і з гіпотиреозом, частіше розвивається тяжка ЕОП, ніж у пацієнтів із еутиреозом [11, 20].
При тиреотоксикозі препаратами вибору є похідні тіонамідів (тіамазол, пропілтіоурацил). Початкова доза тіамазолу становить від 20 до 60 мг/добу і залежить від ступеня тяжкості тиреотоксикозу. У зазначеній дозі препарат застосовують до досягнення еутиреозу. Після досягнення компенсації надзвичайно важливою є своєчасна титрація дози препарату (поступове зменшення до підтримуючої під контролем рівня тиреоїдних гормонів), яку продовжують приймати 12–18 місяців.
На стадії еутиреозу до терапії приєднують препарати левотироксину в дозі 25–50 мкг для попередження медикаментозного гіпотиреозу та струмогенного ефекту тиреостатиків (за принципом «блокуй і заміщуй»). При цьому вкрай важливим є частий контроль функції ЩЗ (кожні 4–6 тижнів), особливо на початку лікування.
При неефективності консервативної терапії ДТЗ показано оперативне лікування, зокрема тотальна тиреоїдектомія, оскільки у хворих після неповного видалення ЩЗ відзначається стійке підвищення рівня АТ-рТТГ, що може призводити до прогресування ЕОП. З урахуванням провокуючого впливу різкої зміни тиреоїдного статусу на розвиток ЕОП, що можливо при оперативному лікуванні зоба, необхідна медикаментозна корекція гормональних порушень як до, так і після хірургічного втручання [15, 19].
При гіпотиреозі призначається замісна терапія левотироксином в адекватних дозах. При цьому важливим є досягнення стійкої компенсації захворювання та попередження різких перепадів функціонального стану ЩЗ, що негативно впливає на перебіг ЕОП.
Як вже зазначалося, консервативне лікування ЕОП ефективне тільки в активній фазі. Рекомендується застосування препаратів штучної сльози протягом дня та/або мазей на ніч для захисту рогівки, носіння темних окулярів, а пацієнтам із диплопією — призматичних окулярів. Перебування під час сну із піднятим узголів’ям дозволяє зменшити набряк повік у ранкові години.
В активній фазі хворим із середньотяжкою та тяжкою формою ЕОП призначають глюкокортикоїди, що чинять імуносупресивну, протизапальну та протинабрякову дію. Вони можуть призначатися внутрішньовенно, перорально та місцево (ретробульбарно або субкон’юнктивально).
Згідно з консенсусом EUGOGO (2008), терапією вибору при лікуванні ЕОП є пульс-терапія глюкокортикоїдами [10]. Вона є ефективнішою та краще переноситься пацієнтами порівняно з лікуванням таблетованими глюкокортикоїдами. Як правило, рекомендують одноразове введення 500 мг метилпреднізолону від одного до декількох днів на тиждень упродовж принаймні 12 тижнів. Пацієнтам із тяжкою формою ЕОП, що загрожує втратою зору, призначають метилпреднізолон по 1 г внутрішньовенно три дні підряд упродовж двох тижнів [4, 8]. Водночас слід сказати, що при терапії високими кумулятивними дозами глюкокортикоїдів приблизно в 0,8 % пацієнтів було зазначено розвиток гострого ураження печінки та летальної печінкової недостатності, що пов’язують із недостатнім обстеженням пацієнтів на підготовчому етапі [16]. Безпечною вважається сумарна доза метилпреднізолону менше 8 г.
При пероральній терапії призначають преднізолон із розрахунку 1 мг на 1 кг маси тіла (найбільш ефективні дози — 80–100 мг на добу) упродовж 12 тижнів із подальшою відміною. Сумарна доза повинна становити близько 4 г. Така схема є ефективною приблизно в 33–63 % випадків. Головним її недоліком є рецидив ЕОП як у випадку відміни препаратів, так і при зниженні їх дози [8, 20]. Також досить частим є розвиток побічних ефектів. Для попередження остеопорозу при пероральному та внутрішньовенному призначенні глюкокортикоїдів рекомендовано використання бісфосфонатів.
Ретробульбарне та субкон’юнктивальне введення глюкокортикоїдів вважається менш ефективним [10, 20].
При різко вираженому набряковому екзофтальмі та неефективності лікування тільки глюкокортикоїдами використовують рентгенотерапію орбіт, що чинить антипроліферативну та протизапальну дію. Зазвичай використовується сумарна доза 20 Гр, поділена на 10 доз, протягом 2 тижнів. Водночас існують дані, що режим з опроміненням по 1 Гр на тиждень протягом 20 тижнів переноситься краще та є достатньо результативним. Також доведено, що режим низьких доз опромінення (сумарна доза 10 Гр) не поступається в ефективності стандартному режиму (сумарна доза 20 Гр) [10].
Найкращий терапевтичний ефект відзначається при поєднанні променевої та глюкокортикоїдної терапії. На підставі результатів рандомізованих досліджень EUGOGO визначені показання до використання рентгенотерапії в лікуванні ЕОП (пацієнти з активною офтальмопатією, які страждають від диплопії або порушення рухливості очних яблук). Водночас слід зазначити, що рентгенотерапія збільшує ризик розвитку ретинопатії у хворих на цукровий діабет та артеріальну гіпертензію при використанні високих сумарних доз (20 Гр). Застосування рентгенотерапії в пацієнтів молодше 35 років повинно бути суворо обґрунтовано [10].
При тяжкій ретракції повік рекомендують введення ботулінічного токсину в м’яз Мюллера (м’яз, що піднімає верхню повіку). Ця процедура здійснюється тільки в спеціалізованих центрах [20].
Додатковими методами лікування є дегідратація за допомогою сечогінних засобів, прийом ноотропних і церебральних вазоактивних препаратів, ензимотерапія (вобензим). Останнім часом з’явилися дані щодо ефективності препаратів селену в комплексному лікуванні хворих на ЕОП. Деякі автори спостерігали покращання після плазмаферезу, магніто- та мікрохвильової терапії, електрофорезу з алое чи з лідазою на орбіти [1, 2, 6, 17].
З метою гальмування експресії ростових чинників пропонується терапія аналогами соматостатину (октреотидом, ланреотидом, сандостатином LAR, соматуліном). Зокрема, октреотид (сандостатин) призначають по 100 мкг тричі на день підшкірно впродовж трьох місяців, тривалодіючий аналог ланреотид (соматулін) — 1 раз на 10 днів. Водночас клінічні дослідження не довели вагомого ефекту від використання цих препаратів [12]. Застосування цитостатиків у лікуванні ЕОП на сьогодні вважається недоцільним [7, 20].
Одним із можливих методів імуносупресивної терапії ЕОП є використання моноклональних антитіл, зокрема до CD20 (ритуксимаб). Також існують дані щодо ефективності блокатора рецепторів ФНП-a етанерцепту [10].
У неактивній стадії імуносупресивна терапія є неефективною. При легкій формі призначають місцеве лікування, здійснюється динамічне спостереження за пацієнтами. У більш тяжких випадках застосовують рентгеноопромінення орбіт та/або хірургічне лікування.
До хірургічних методів лікування ЕОП відносяться декомпресія орбіти з метою усунення стискання зорового нерва, операції на окорухових м’язах і повіках [23]. У разі рецидиву захворювання після реконструктивної хірургії системна терапія глюкокортикоїдами та/або рентгенотерапія можуть призначатися із звичайною очікуваною ефективністю [10].
1. Абдазова Р.Б. Эндокринная офтальмопатия: этиология, патогенез, классификация, клиника, лечение / Р.Б. Абдазова, Л.Б. Нугманова, Т.Р. Чжен // Міжнародний ендокринологічний журнал. — 2009. — № 6. — С. 25–33.
2. Бровкина А.Ф. Эндокринная офтальмопатия / А.Ф. Бровкина. — М., 2004. — 875 с.
3. Бровкина А.Ф. Эндокринная офтальмопатия с позиций офтальмолога и ендокринолога / А.Ф. Бровкина, Т.Л. Павлова // Рус. мед. журнал. — 2004. — Т. 12, № 8(208). — С. 539–549.
4. Виноградская О.И. Эффективность пульстерапии метилпреднизолоном при лечении эндокринной офтальмопатии / О.И. Виноградская, Д.В. Липатов, В.В. Фадеев // Клиническая и экспериментальная тиреоидология. — 2012. — № 4. — С. 47–52.
5. Виноградская О.И. По материалам консенсуса европейской группы по изучению офтальмопатии Грейвса / О.И. Виноградская, В.В. Фадеев // Клиническая и экспериментальная тиреоидология. — 2007. — № 4. — С. 13–26.
6. Назаренко К.А. Энзимотерапия в офтальмологии / К.А. Назаренко, Ю.И. Хороших, И.В. Запускалов // Вестник офтальмологии. — 2006. — № 1. — С. 36–43.
7. Паньків В.І. Ендокринна офтальмопатія / В.І. Паньків // Новости медицины и фармации (в мире). — 2011. — № 10. — С. 18–20.
8. Черенько С.М. Сучасний стан проблеми діагностики та лікування хвороби Грейвса й аутоімунної офтальмопатії / С.М. Черенько, М.С. Черенько // Здоров’я України. — 2010. — № 1. — С. 58–59.
9. Шеремета М.С. Радиойодтерапия болезни Грейвса как фактор риска эндокринной офтальмопатии / М.С. Шеремета, И.М. Беловалова, М.Ю. Свириденко // Пробл. эндокринологии. — 2009. — Т. 55, № 1. — С. 51–55.
10. Bartalena L. European Group of Graves’ Orbitopathy. Consensus statement of the European Group on Graves’ orbitopathy (EUGOGO) on management of GO / L. Bartalena, L. Baldeschi, A. Dickinson [et al.] // — Eur. J. Endocrinol. — 2008. — Vol. 158, № 3. — Р. 273–85.
11. Bartalena L. Diagnosis and management of Graves disease: a global overview / L. Bartalena // Nat. Rev. Endocrinol. — 2013. — № 9(12). — Р. 724–734.
12. Bartalena L. The role of somatostatin analogs in the management of Graves’ ophthalmopathy / L. Bartalena, M. Tanda, E. Piantanida, A. Lai // J. Endocrinol. Invest. — 2003. — Vol. 26 (Suppl. 8). — Р. 109–113.
13. Gopinath B. Antibodies against calsequestrin and type XIII collagen are good markers for chronic upper eye lid retraction / B. Gopinath, C.L. Adams, R. Musselman // Ocul. Immunol. Inflamm. — 2007. — № 15. — Р. 81–88.
14. Jack R. Wall рathogenesis of thyroid eye disease — does autoimmunity against the TSH receptor explain all cases? / R. Jack // Endokrynologia Polska // Polish Journal of Endocrinology. — 2010. — Vol. 61, № 2. — P. 222–227.
15. Jarhult J. Graves’ disease with moderate-severe endocrine ophthalmopathy — long term results of a prospective, randomized study of total or subtotal thyroid resection / J. Jarhult, C. Rudberg, E. Larsson [et al.] // Thyroid. — 2005. — № 15. — Р. 1157–1164.
16. Marcocci C. European Group of Graves’ Orbitopathy. Fatal and non–fatal adverse events of glucocorticoid therapy for Graves’ orbitopathy: a questionnaire survey among members of the European Thyroid Association / C. Marcocci, Т. Watt, М.А. Altea [et al.] // Eur. J. Endocrinol. — 2012. — Vol. 166, № 2. — Р. 247–253.
17. Marcocci C. European Group on Graves’ Orbitopathy. Selenium and the course of mild Graves’ orbitopathy / С. Marcocci, G.J. Kahaly, G.E. Krassas [et al.] // N. Engl. J. Med. — 2011. — Vol. 364, № 20. — Р. 1920–1931.
18. Massart C. Intermethod variability in TSH-receptor antibody measurement: implications for the diagnosis of Graves’ disease and for the follow up of Graves’ ophthalmopathy / C. Massart, R. Sapin, J. Gibassier [et al.] // Clin. Chem. — 2009. — № 55. — Р. 183–186.
19. Menconi F. Effects of total thyroid ablation versus near-total thyroidectomy alone on mild to moderate Graves’ orbitopathy treated with intravenous glucocorticoids / F. Menconi, M. Marino, A. Pinchera [et al.] // Journal of Clinical Endocrinology & Metabolism. — 2007. — № 92. — Р. 1653–1658.
20. Soeters M.R. Optimal management of Graves orbitopathy: a multidisciplinary approach / M.R. Soeters, C.J. van Zeijl, A. Boelen [et al.] // Neth. J. Med. — 2011. — Vol. 69, № 7. — Р. 302–308.
21. Thornton J. Cigarette smoking and thyroid eye disease: a systematic review / J. Thornton, S.P. Kelly, R.A. Harrison et al. // Eye. — 2006. — № 20. — Р. 1–11.
22. Wiersinga W.M. Epidemiology and prevention of Graves’ ophthalmopathy / W.M. Wiersinga, L. Bartalena // Thyroid. — 2002. — № 12. — Р. 855–860.
23. Zhang-Nunes S.X. Characterization and Outcomes of Repeat Orbital Decompression for Thyroid–Associated Orbitopathy / S.X. Zhang-Nunes, S. Dang, H.C. Garneau // Orbit. — 2014. — № 22. — Р. 1–9.

/170/170.jpg)