Международный эндокринологический журнал 6 (62) 2014
Вернуться к номеру
Первичный гиперпаратиреоз: современная лабораторная диагностика и дифференциальная диагностика
Авторы: Черенько С.М. - Украинский научно-практический центр эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины, г. Киев
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 174-181
Гиперпаратиреоз — эндокринное нарушение, характеризующееся избыточным синтезом и секрецией гормона околощитовидных желез (паратгормона). Паратгормон является наиболее сильным из трех основных гормонов, участвующих в регуляции уровня внеклеточного кальция (остальные два — это гормон щитовидной железы кальцитонин и активная форма витамина D 1,25(ОН)2-витамин D3, называемый также гормоном D в силу его мощного метаболического действия). Действие паратгормона путем нескольких различных механизмов направлено на повышение уровня кальция в крови.
Первичный гиперпаратиреоз — эндокринное заболевание, изначально вызываемое опухолевым или гиперпластическим изменением одной или нескольких околощитовидных желез, приводящее к нерегулируемой гиперсекреции паратгормона, гиперкальциемии (с комплексом проявлений действия повышенного уровня кальция на центральную нервную систему, сердечно-сосудистую и выделительную системы) и ряду патологических изменений в органах-мишенях, прежде всего костях и почках (остеопороз, мочекаменная болезнь, почечная недостаточность).
Выделяют также вторичный и третичный гиперпаратиреоз — заболевания, которые отражают цепь поначалу компенсаторных, а затем патологических процессов, развивающихся в ответ на снижение уровня кальция в крови и сопровождающихся гиперплазией околощитовидных желез (вторичный гиперпаратиреоз) и в конечном итоге — их аденоматозной трансформацией и автономизацией (третичный гиперпаратиреоз).
Первичный гиперпаратиреоз в развитых странах рассматривается как одна из главных эндокринологических проблем наряду с сахарным диабетом и заболеваниями щитовидной железы, имеющих огромное социальное значение в силу распространенности и последствий для здоровья и жизни пациентов. С начала 70-х годов ХХ века эта патология перестала считаться редкой благодаря внедрению систематического лабораторного скрининга с применением автоматических анализаторов уровня кальция крови. Будучи преобладающей причиной гиперкальциемии в популяции, первичный гиперпаратиреоз таким образом стал выявляться с частотой 1–3 случая на 1000 населения.
Длительный скрытый характер развития болезни, отсутствие патогномоничных симптомов, несовершенство традиционных (часто устаревших) лабораторных методик, лабораторно-диагностические ошибки, связанные с человеческим фактором, малый клинический опыт врачей в данной сфере медицины привели к тому, что в нашей стране первичный гиперпаратиреоз выявляется преимущественно на стадии необратимых разрушительных процессов в организме (прежде всего скелета и почек) и продолжает считаться редкой патологией человека. Частота новых случаев первичного гиперпаратиреоза не превышает в Украине 200–300 случаев в год (сравните: в близких по количеству населения развитых странах — 50–60 тысяч и в США — 100 тысяч). Не проводится надлежащий статистический медицинский учет патологии.
Отсутствие эффективных патогенетических методов терапии оставляет хирургическое удаление патологических околощитовидных желез единственным приемлемым видом лечения. Однако кажущаяся простота выполнения операции может привести хирургов, не имеющих достаточного опыта в данной сфере, к трагическим, иногда неисправимым ошибкам, связанным с рецидивами и персистенцией болезни, тяжелыми специфическими осложнениями.
Будучи заболеванием, требующим обязательного надежного лабораторного подтверждения (в силу отсутствия в большинстве случаев специфических симптомов и безальтернативности хирургического лечения), первичный гиперпаратиреоз следует в первую очередь дифференцировать от других болезней и состояний, при которых отмечается повышение уровня кальция в крови. Это тем более актуально, поскольку в качестве рутинного популяционного скринингового теста используется определение общего или ионизированного кальция в сыворотке крови.
Гиперкальциемией считается состояние, при котором концентрация общего кальция плазмы крови превышает 2,55 ммоль/л (10,3 мг/дл). В соответствии с физиологией кальциевого обмена непосредственной причиной повышения уровня внеклеточного кальция является его усиленная мобилизация из костной ткани вследствие остеорезорбтивных процессов, повышенное всасывание кальция в кишечнике или усиленная реабсорбция его почками.
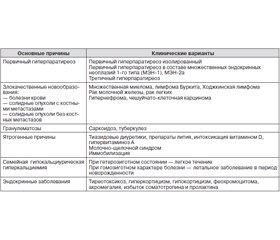
Схематично основные причины гиперкальциемии у человека представлены в табл. 1.
В общей популяции основной причиной гиперкальциемии является первичный гиперпаратиреоз, обусловливающий более 80 % всех случаев повышения кальция в крови. Среди госпитализированных пациентов в числе причин гиперкальциемии на первое место выходят злокачественные новообразования (50–60 %).
Первичный гиперпаратиреоз в 3–4 раза чаще поражает женщин, особенно постменопаузального возраста (до 3 % популяции).
Вторичный гиперпаратиреоз возникает вследствие длительной стимуляции околощитовидных желез сниженным уровнем кальция в крови (первоначально как компенсаторный процесс). Поэтому для вторичного гиперпаратиреоза, в большинстве случаев связанного с хронической почечной недостаточностью, характерной является не гиперкальциемия, а гипо- или нормокальциемия. Повышение уровня кальция в крови возникает на этапе перехода вторичного гиперпаратиреоза в третичный (то есть в процессе развития автономизации гиперплазированных или аденоматозно измененных околощитовидных желез при длительно существующем вторичном гиперпаратиреозе — при этом теряется обратная связь между кальцемией и адекватным синтезом паратгормона). Важно также помнить, что нередко попытки приостановить процесс компенсаторной гиперплазии и гиперфункции околощитовидных желез при вторичном гиперпаратиреозе путем назначения препаратов кальция и больших доз активного витамина D3 приводят к ятрогенной гиперкальциемии.
У пациентов, находящихся на лечении в стационаре, причиной гиперкальциемии чаще всего оказываются различные злокачественные новообразования. Механизмы гиперкальциемии при злокачественных опухолях неодинаковы, однако повышенным источником поступления кальция в кровь выступает практически всегда резорбция костного вещества.
Гематологические опухолевые заболевания — миелома, некоторые виды лимфом и лимфосарком — действуют на костную ткань посредством выработки особой группы цитокинов, которые стимулируют остеокласты, вызывая резорбцию костной ткани, формирование остеолитических изменений или диффузную остеопению.
Наиболее частой причиной гиперкальциемии при злокачественных образованиях выступают солидные опухоли с костными метастазами. Более 50 % всех случаев злокачественно-ассоциированной гиперкальциемии составляет рак молочной железы с отдаленными метастазами в кости. У таких пациентов остеорезорбция возникает либо вследствие локального синтеза остеокластактивирующих цитокинов или простагландинов, либо путем прямой деструкции костной ткани метастатической опухолью.
В ряде случаев гиперкальциемия возникает у пациентов со злокачественными опухолями без костных метастазов. Это характерно для разнообразных чешуйчато-клеточных карцином, почечно-клеточного рака, рака молочной железы или яичников. Ранее считалось, что такое состояние вызывается эктопической продукцией паратгормона. Однако современные исследования свидетельствуют, что злокачественные опухоли крайне редко продуцируют истинный паратгормон. Его уровень при стандартном лабораторном определении оказывается или супрессированным, или вовсе не определяемым, несмотря на наличие гипофосфатемии, фосфатурии и повышение нефрогенного циклического аденозинмонофосфата в моче. Паратгормонподобный пептид был недавно выделен из некоторых форм опухолей, связанных с гиперкальциемией без костных метастазов. Этот пептид значительно больше нативной молекулы паратгормона, но содержит N-концевой фрагмент его цепочки, который и связывается с рецепторами паратгормона в костях и почках, имитируя многие его гормональные эффекты. Этот паратгормонподобный пептид в настоящее время может определяться стандартными лабораторными наборами. Не исключено наличие и других форм пептида, связанных с отдельными опухолями человека. Существует также возможность патологического синтеза некоторыми опухолями (например, лимфомой или лейомиобластомой) активного 1,25(OH)2-витамина D3, приводящего к увеличению абсорбции кальция в кишечнике, хотя типичным является снижение уровня витамина D в крови при злокачественных солидных опухолях.
Саркоидоз ассоциируется с гиперкальциемией в 20 % случаев, а с гиперкальциурией — в 40 % случаев. Эти симптомы описаны также и при других гранулематозных заболеваниях, таких как туберкулез, лепра, бериллиоз, гистоплазмоз, кокцидиомикоз. Причиной гиперкальциемии в этих случаях является, по-видимому, нерегулируемая избыточная конверсия малоактивного 25(OH)-витамина D3 в мощный метаболит 1,25(OH)2D3 вследствие экспрессии 1a-гидроксилазы в мононуклеарах гранулем.
Многие эндокринные заболевания могут также протекать с явлениями умеренной гиперкальциемии. К ним относятся тиреотоксикоз, гипотиреоз, гиперкортицизм, гипокортицизм, феохромоцитома, акромегалия, избыток соматотропина и пролактина. Причем, если избыток гормонов действует в основном путем стимуляции секреции паратгормона, то их недостаток ведет к снижению процессов минерализации костной ткани. Кроме того, тиреоидные гормоны и глюкокортикоиды обладают непосредственным остеорезорбтивным действием, стимулируя активность остеокластов.
К ряду ятрогенных причин относятся передозировка витаминами D и А, длительный прием тиазидовых диуретиков, а также препаратов лития.
Гипервитаминоз D, как уже указывалось выше, вызывает гиперкальциемию путем усиления абсорбции кальция в кишечнике и стимуляции остеорезорбции в присутствии паратгормона.
Тиазидовые диуретики стимулируют реабсорбцию кальция и таким образом повышают его уровень в крови.
Действие препаратов лития окончательно не выяснено. Считается, что литий взаимодействует как с кальциевыми рецепторами, понижая их чувствительность, так и непосредственно с паратиреоцитами, стимулируя их гипертрофию и гиперплазию при длительном применении. Литий также снижает функциональную активность тиреоцитов, приводя к гипотиреозу, что подключает и другие, гормональные механизмы гиперкальциемии. Такой эффект этого элемента привел к выделению отдельной формы первичного гиперпаратиреоза — литийиндуцированного гиперпаратиреоза.
Так называемый молочно-щелочной синдром (milk-alkali syndrome), связанный с массивным поступлением с пищей избыточного количества кальция и щелочей, может привести к обратимой гиперкальциемии. Как правило, он наблюдается у пациентов, бесконтрольно лечащих гиперацидный гастрит или пептическую язву ощелачивающими препаратами и свежим коровьим молоком. При этом могут наблюдаться метаболический алкалоз и почечная недостаточность. Применение блокаторов протонной помпы и Н2-блокаторов значительно снизило вероятность такого состояния. При подозрении на молочно-щелочной синдром не следует забывать о возможной комбинации пептической язвы (с упорным тяжелым течением), гастриномы и первичного гиперпаратиреоза в рамках варианта синдрома МЭН-1 или синдрома Золлингера — Эллисона.
Состояние длительной иммобилизации, особенно полной, приводит к гиперкальциемии из-за ускоренной резорбции костного вещества. Этот не вполне объяснимый эффект связан с отсутствием действия силы тяжести и физических нагрузок на скелет. Гиперкальциемия развивается уже через 1–3 недели после начала постельного режима вследствие ортопедических процедур (гипс, скелетное вытяжение), спинальных травм или неврологических расстройств. С возобновлением физиологических нагрузок состояние кальциевого обмена нормализуется.
Доброкачественная семейная гипокальциурическая гиперкальциемия является аутосомно-доминантной наследственной патологией, связанной с мутацией кальцийчувствительных рецепторов, повышающей порог их чувствительности. Заболевание проявляется с самого рождения, поражает более половины кровных родственников и носит мягкий, клинически малозначимый характер. Синдром характеризуется гиперкальциемией (выраженной), гипокальциурией (менее 2 ммоль/сутки), сниженным отношением клиренса кальция к клиренсу креатинина (менее 1 %), умеренно повышенным или верхненормальным уровнем паратгормона в крови. Иногда наблюдается умеренная диффузная гиперплазия околощитовидных желез.
Идиопатическая гиперкальциемия младенцев представляет собой результат редких генетических расстройств, проявляющихся активизацией абсорбции кальция в кишечнике. Состояние связано с увеличенной чувствительностью рецепторов энтероцитов к витамину D или интоксикацией витамином D (обычно через организм кормящей матери, принимающей препараты витамина).
Дифференциальная диагностика первичного гиперпаратиреоза и других гиперкальциемических состояний нередко представляет собой серьезную клиническую проблему, однако некоторые принципиальные положения позволяют резко сузить круг возможных причин патологии.
Прежде всего следует учитывать, что для первичного гиперпаратиреоза характерно неадекватное повышение уровня паратгормона в крови (не соответствующее повышенному или верхненормальному уровню внеклеточного кальция). Одновременное повышение уровней кальция и паратгормона в крови можно обнаружить, кроме первичного гиперпаратиреоза, при третичном гиперпаратиреозе и семейной гипокальциурической гиперкальциемии. Однако вторичный и соответственно следующий за ним третичный гиперпаратиреоз имеют длительный анамнез и характерную исходную патологию. При семейной гипокальциурической гиперкальциемии отмечают снижение экскреции кальция с мочой, семейный характер болезни, раннее ее начало, не типичный для первичного гиперпаратиреоза высокий уровень кальция в крови при незначительном повышении паратгормона.
Иные формы гиперкальциемических состояний, за исключением крайне редкой эктопической секреции паратгормона нейроэндокринными опухолями других органов, сопровождаются естественной супрессией уровня паратгормона в крови. В случае гуморальной гиперкальциемии при злокачественных опухолях без костных метастазов можно выявить в крови паратгормонподобный пептид, уровень же нативного (1–84) паратгормона будет близким к нулю.
Для ряда заболеваний, связанных с усилением кишечной абсорбции кальция, может лабораторно быть обнаружен повышенный уровень 1,25(OH)2-витамина D3 в крови.
Лабораторная диагностика — это основа своевременного распознавания первичного гиперпаратиреоза и максимально широкого выявления заболевания в популяции.
Ключевыми критериями лабораторного диагноза первичного гиперпаратиреоза являются два показателя: повышенный уровень паратгормона и повышенный уровень кальция в плазме крови. Одновременное обнаружение у пациента этих двух лабораторных признаков практически не оставляет сомнений в диагнозе первичного гиперпаратиреоза. Таким образом, при классических ярких вариантах течения заболевания его лабораторная диагностика не может не изумлять своей простотой. Почему же тогда настолько часты ошибки в постановке диагноза? Отчего десятилетиями продолжает развиваться нераспознанная болезнь, оставляя разрушительные следы в организме?
Попытаемся проанализировать возможные подводные камни в лабораторной диагностике первичного гиперпаратиреоза, причины ошибок, пути верификации диагноза, а также патологические состояния, которые маскируют либо симулируют биохимическую картину заболевания.
Начнем с основных показателей — кальция и паратгормона крови.
Кальций в крови научились определять в клинике чуть более ста лет назад — в 1907 г. В крови кальций находится в трех основных формах: фракция, связанная с белками, — 40–45 %, фракция, состоящая из комплексных фосфатных и цитратных соединений, — 5 %, ионизированная фракция элемента — 50 %. Основные клинические лабораторные параметры изучения этого элемента в организме — концентрация общего кальция и концентрация ионизированного (или свободного) кальция крови.
Диапазон нормальных значений общего кальция — 2,1–2,55 ммоль/л; ионизированного кальция — 1,05–1,30 ммоль/л.
Следует заметить, что верхняя граница нормальных значений общего кальция пересматривалась неоднократно на протяжении последних 30 лет, причем каждый раз с корректировкой в меньшую сторону, и снизилась с 2,75 до 2,65 и 2,55 ммоль/л в последних руководствах. Общий кальций — наиболее широко применяемый показатель, который используется в качестве одного из главных компонентов комплексных биохимических исследований крови с помощью современных автоматических анализаторов. Именно внедрение автоматического исследования общего кальция помогло открыть истинную частоту первичного гиперпаратиреоза в популяции. При такой методике исследования этот параметр является достаточно надежным, так как мало зависит от человеческого фактора при соблюдении стандартных требований к забору и определению. Однако в реальной практике отечественной медицины можно чаще встретить ручное биохимическое исследование крови на общий кальций, при котором возможны довольно грубые отклонения как в сторону уменьшения (длительное пребывание крови в пробирке при комнатной температуре, ошибки калибровки и т.п.), так и в сторону увеличения (стеклянная посуда, а не пластиковые вакутайнеры для забора и центрифугирования крови, примеси других реагентов и т.д.).
Кроме того, даже правильно выполненный анализ на определение общего кальция крови требует корректировки по уровню содержания в крови белков, и прежде всего альбумина. Чем меньше концентрация альбумина по сравнению с нормой (40 г/л), тем выше должна быть истинная концентрация кальция при сравнении с зарегистрированной, и наоборот, при повышении концентрации альбумина коррекция должна проводиться в сторону снижения уровня кальция в крови. Метод является довольно приблизительным и требует поправки на 0,2 ммоль/л на каждые 10 г/л отклонения от средненормального значения альбумина (то есть 40 г/л).
Например, если при лабораторном показателе концентрации общего кальция крови 2,5 ммоль/л уровень альбумина составляет 20 г/л, то корректированная концентрация кальция составит 2,9 ммоль/л, то есть 2,5 + (40 – 20) : 10 × 0,2.
Другой метод коррекции показателя общего кальция по уровню протеинов крови подразумевает поправку значения общего кальция в зависимости от концентрации общего белка крови. Формула расчета имеет следующий вид:
Сакорр.прот. = Саобщ. : (белокобщ. : 160 + 0,55),
где Сакорр.прот — корректированный по общему белку кальций крови; Саобщ. — общий кальций крови в ммоль/л; белокобщ. — общий белок крови в г/л.
Например, при показателе общего кальция крови 2,5 ммоль/л и общем белке крови 60 г/л истинный уровень общего кальция составит 2,72 ммоль/л.
Таким образом, вполне реально не пропустить истинную гиперкальциемию при сниженном уровне альбумина или общего белка крови. Обратную картину можно наблюдать при повышении концентрации плазменных белков, что бывает, например, при миеломной болезни. Резкое увеличение протеинсвязанной фракции кальция приведет к повышенному показателю общего кальция крови. Таких погрешностей можно избежать путем непосредственного определения ионизированного кальция крови. Этот показатель менее вариабельный, однако для его определения необходимо специальное оборудование — анализатор с использованием ионселективных электродов.
Правильность определения и трактовки показателя уровня ионизированного кальция зависит от технического состояния и тщательной калибровки аппаратуры, а также от учета влияния на концентрацию кальция уровня рН крови. Кислотно-щелочное состояние влияет на содержание ионизированного кальция в крови путем воздействия на процесс связывания кальция с белками. Ацидоз уменьшает связывание кальция с белками крови и ведет к увеличению уровня ионизированного кальция, в то время как алкалоз усиливает процесс связывания кальция с протеинами и уменьшает уровень ионизированного кальция. Эта корректировка заложена в автоматическую программу современных анализаторов ионизированного кальция, однако в более ранних моделях не использовалась, что может приводить к неверной оценке показателя и явиться одной из причин задержки в постановке верного диагноза первичного гиперпаратиреоза.
Основными внешними факторами, влияющими на уровень кальция крови, являются прием витамина D и тиазидовых диуретиков (оба фактора способствуют повышению его), что, безусловно, следует учитывать при трактовке результатов.
Второй из основных компонентов лабораторной диагностики первичного гиперпаратиреоза — уровень паратиреоидного гормона крови — также требует грамотной оценки и учета объективных и субъективных факторов, способных искажать его истинное значение.
Не будем рассматривать особенности ранее использовавшихся лабораторных тестов на фрагменты молекулы паратгормона (С- и N-концевые части молекулы). Они имели целый ряд ограничений и погрешностей, поэтому сейчас практически не используются, уступив место иммунорадиометрическому или иммуноферментному определению целой (интактной) молекулы паратгормона, состоящей из 84 аминокислотных остатков.
Нормальный диапазон концентраций паратгормона у здоровых субъектов составляет 10–65 мкг/л (пг/мл) или 12–60 пмоль/дл.
Обладая несомненными преимуществами перед концевыми фрагментами молекулы паратгормона в плане адекватности параметра исследуемым целям, определение интактного паратгормона сопряжено с целым рядом сложностей. Прежде всего это очень короткий срок полураспада молекулы в организме (несколько минут) и чувствительность анализа к срокам пребывания крови и сыворотки при комнатной температуре. Вот почему порой так разнятся анализы, сделанные в один и тот же день в разных лабораториях. Ведь достаточно собрать кровь не в вакуумный резервуар, а в открытую пробирку, оставить пробирку при комнатной температуре на 10–15 минут или использовать неохлаждаемую центрифугу — и результат анализа может существенно измениться в сторону занижения концентрации. Как правило, на практике имеет место именно ложное занижение результатов исследования, поэтому из нескольких серийных исследований за короткое время следует доверять наивысшему результату. Поэтому критически важным является не только стандартизация самого гормонального исследования, но и этап забора крови и подготовки сыворотки к анализу. Это должно происходить с максимально короткими сроками пребывания крови в неохлажденном виде. Словом, чем более стандартизирован и автоматизирован процесс забора крови и проведения анализа, тем надежнее результаты.
При оценке результатов исследования паратгормона крови необходимо учитывать суточный ритм секреции гормона (с пиком концентрации в 2 часа ночи и минимумом — в 2 часа дня), возможность интерференции при ночном режиме работы.
Некоторые лекарства могут изменять естественную концентрацию паратгормона. Так, фосфаты, противосудорожные препараты, стероиды, изониазид, литий, рифампицин увеличивают концентрацию, а циметидин и пропранолол снижают уровень паратгормона в крови.
По-видимому, наиболее существенное влияние на правильную оценку основной лабораторной пары критериев — кальций/паратгормон — оказывают снижение функции почек и дефицит витамина D, частота которых в значительной степени недооценивается врачами.
Нарушение почечной функции оказывает многогранное влияние как на первичную диагностику, так и на клиническую оценку течения первичного гиперпаратиреоза. Так, снижение клубочковой фильтрации меньше 60 мл/мин признано показанием к хирургическому лечению малосимптомных вариантов болезни. Однако длительное нарушение функции почек, которое могло быть вызвано прямым действием паратгормона либо явлениями вторичного пиелонефрита на фоне мочекаменной болезни, само по себе сопровождается увеличенной потерей кальция с мочой (прежде всего в ответ на сниженную экскрецию фосфата в связи с утратой способности к его выведению пораженными почками). Раннее появление дефицита активного 1,25(ОН)2-витамина D3 при почечной недостаточности (в силу снижения активности почечной 1a-гидроксилазы) также способствует некоторому уменьшению сывороточной концентрации кальция вследствие сниженной его абсорбции в кишечнике. Эти факторы во многом способны объяснить нередкие случаи нормокальциемического первичного гиперпаратиреоза либо отсутствие устойчивой гиперкальциемии, что затрудняет постановку диагноза.
Нормокальциемический первичный гиперпаратиреоз, по мнению авторитетных современных ученых, — это настоящая диагностическая проблема и вызов современной лабораторной диагностике; его необходимо дифференцировать со случаями идиопатической гиперкальциурии, связанной с увеличенным всасыванием кальция в кишечнике, уменьшенной тубулярной реабсорбцией кальция или первичной гиперфосфатурией во избежание ненужных операций. С другой стороны, несвоевременный диагноз первичного нормокальциемического гиперпаратиреоза приведет к нарастанию почечной недостаточности, образованию новых мочевых камней. Различить эти два состояния, близкие по лабораторным признакам, может помочь проба с тиазидовыми диуретиками. Назначение последних приведет к коррекции гиперкальциурии, связанной со «сбросом» лишнего кальция, и нормализации уровня паратгормона. При нормокальциемическом первичном гиперпаратиреозе тиазидовые диуретики будут способствовать гиперкальциемии и не снизят уровень паратгормона.
В нашей серии клинических наблюдений нормокальциемическая форма первичного гиперпаратиреоза составила 14 %, а по данным литературы эта цифра варьирует в пределах 8–20 %.
В связи с вышеизложенными обстоятельствами необходимо упомянуть еще один очень важный критерий лабораторной диагностики — уровень суточной кальциурии. Этот показатель носит больше дифференциальное, чем диагностическое значение. Он позволяет отдифференцировать схожее по основным критериям (одновременное повышение уровня кальция и паратгормона в крови) заболевание — семейную доброкачественную гипокальциурическую гиперкальциемию. Эта патология сейчас стала более понятна и представляет собой скорее не одно, а целую группу состояний, связанных с нарушением регуляции кальциевого обмена, в основе которых лежат мутации гена кальциевого рецептора (их известно уже более 50). Коренным отличием этого состояния, при котором будут наблюдаться стабильная гиперкальциемия и незначительное повышение уровня паратгормона, является снижение уровня кальциурии (обычно менее 2 ммоль/сутки), тогда как при первичном гиперпаратиреозе уровень кальциурии остается нормальным или повышается (более 6–8 ммоль/л), в зависимости от тяжести процесса и состояния функции почек.
Наиболее точный метод оценки кальциурии — это расчет отношения клиренса кальция к клиренсу креатинина, так как экскреция кальция напрямую зависит от скорости клубочковой фильтрации. Формула расчета следующая:
Клиренс Ca/клиренс Cr = Cau × Crs / Cru × Cas,
где Cau — кальций мочи, Crs — креатинин сыворотки, Cru — креатинин мочи, Cas — кальций сыворотки.
Важно, чтобы все показатели были конвертированы в одинаковые единицы измерения (например, ммоль/л). Дифференцирующим (в пользу семейной гипокальциурической гиперкальциемии) является соотношение 1 : 100 (или 0,01), тогда как при первичном гиперпаратиреозе оно обычно составляет 3 : 100 — 4 : 100. Поможет в диагностике также исследование кровных родственников (сиблингов 1-й линии), поскольку заболевание носит аутосомно-доминантный характер и вероятностно поражает половину потомков (с развитием лабораторных проявлений уже в раннем детстве). В силу малосимптомного течения болезни лечение, как правило, не требуется, а операция не оказывает существенного клинического эффекта.
Не менее сложным видится влияние дефицита витамина D на клинические проявления и лабораторную диагностику первичного гиперпаратиреоза.
Витамин D действует в целом синергически с паратгормоном, оказывая гиперкальциемическое влияние. Однако существует и непосредственное отрицательное взаимодействие витамина D с паратиреоцитами, угнетающее синтез паратгормона (при избытке витамина) и стимулирующее его выработку (при его недостатке) через молекулярные механизмы транскрипции гена и, возможно, путем непосредственного действия на определенные рецепторы.
Дефицит витамина D, который ранее ассоциировался исключительно с проблемами педиатрии, оказался чрезвычайно распространенным во всех возрастных группах даже в благополучных развитых странах. Так, среди госпитализированных пациентов в США дефицит витамина D был обнаружен с частотой 57 %. Он встречается повсеместно и зависит от расовых, климатических, алиментарных факторов: от 20 % — на юге Франции до 90 % — в мало развитых странах. В Украине, по данным отечественных исследователей, — не менее 60–70 %.
Проблема сейчас является настолько актуальной, что дискутируется вопрос о пересмотре нормальных границ концентраций паратгормона в крови (с установлением оптимального минимума и безопасной верхней границы) с учетом степени витамин D-дефицита. Консенсусное руководство по диагностике и лечению асимптомного первичного гиперпаратиреоза (последняя рабочая встреча экспертов состоялась в конце 2013 г. во Флоренции) призывает к определению уровня 25(ОН)-витамина D3 у всех пациентов с подозрением на первичный гиперпаратиреоз. В случае выявления сниженного (менее 20 нг/мл) либо нижненормального уровня 25(ОН)-витамина D3 следует проводить осторожную коррекцию с последующим повторным обследованием для принятия решения о лечебной тактике. Такой тест позволит дифференцировать нормокальцемический вариант первичного гиперпаратиреоза и вторичный гиперпаратиреоз, вызванный гиповитаминозом D. Доказана безопасность контролируемого назначения холекальциферола на период 3–6 месяцев, после чего у больных с первичным гиперпаратиреозом будет наблюдаться легкая гиперкальцемия с незначительным снижением уровня паратгормона, в то время как у пациентов с изолированным D-дефицитом будет отмечаться нормализация паратгормона с верхненормальным уровнем кальция в крови.
При этом многие авторы акцентируют внимание на изменении клинического течения первичного гиперпаратиреоза в условиях дефицита витамина D (преимущественно в сторону утяжеления), несмотря на менее выраженные биохимические сдвиги.
Следует помнить, что определять следует именно 25(ОН)-витамин D3, а не активную его форму 1,25(ОН)2, которая не отражает степень дефицита витамина, кроме случаев вторичного гиперпаратиреоза, связанного с почечной недостаточностью.
К числу первоочередных дополнительных критериев диагностики и дифференцирования первичного гиперпаратиреоза и некоторых других состояний со сходными клинико-лабораторными показателями относится уровень фосфора в крови. Нормальное значение фосфатемии для взрослых находится в пределах 0,85–1,45 ммоль/л. Для первичного гиперпаратиреоза характерно уменьшение этого показателя до нижней границы нормы или ниже ее при тяжелой гиперкальциемии, что встречается примерно у 30 % пациентов. Особенно показателен этот параметр при выявлении одновременного повышения почечной экскреции фосфора, связанного с угнетением паратгормоном реабсорбции фосфатов. Гипофосфатемия может встречаться у некоторых пациентов с холестатической болезнью печени.
Напомним, что уровни кальция и фосфора в крови чрезвычайно тесно связаны в обратно пропорциональной зависимости; показатель произведения сывороточных концентраций общего кальция и фосфора (Са × Р) является очень важным и устойчивым параметром гомеостаза человека, контролируемым многими системами. Превышение этого произведения до значений более 4,5 (ммоль/л)2 или 70 (мг/л)2 приводит к образованию в крови нерастворимых фосфатных соединений кальция, которые могут вызвать всевозможные ишемические и некротические поражения. Кроме диагностического значения (для подтверждения диагноза первичного гиперпаратиреоза) уровень фосфора в крови служит дифференцирующим критерием для размежевания первичного и вторичного гиперпаратиреоза, вызванного хронической почечной недостаточностью. В этом случае уровень фосфора имеет тенденцию к повышению в зависимости от тяжести нарушения функции почек, что связано с утратой способности к активному выведению фосфатов. Тяжелая гиперфосфатемия при терминальных стадиях хронической почечной недостаточности может корригироваться только гемодиализом, поэтому оценивать показатель нужно перед диализом. Помимо гиперфосфатемии отличительной особенностью вторичного гиперпаратиреоза всегда будет нормальный или сниженный уровень кальция в крови, пока заболевание не перейдет в следующую фазу — третичный гиперпаратиреоз (развитие аденом на фоне длительной гиперплазии околощитовидных желез с автономизацией их функции).
Дополнительным лабораторным диагностическим критерием служит также умеренная гиперхлоремия. Она относится к непостоянным симптомам. Более точным показателем считается соотношение концентрации хлора к фосфору в крови: при первичном гиперпаратиреозе оно превышает 100 при измерении в ммоль/л, а в норме — менее 100.
Полезными для диагностики и установления тяжести заболевания являются показатели усиленной перестройки костного вещества и остеорезорбции под действием длительного избыточного выделения в кровь паратгормона. К числу маркеров остеорезорбции относят повышенный уровень щелочной фосфатазы (ее костной фракции), остеокальцина крови, а также экскрецию с мочой гидроксипролина и циклического аденозинмонофосфата. Однако эти показатели неспецифичны, могут встречаться при любой форме гиперпаратиреоза и других состояниях, связанных с активной перестройкой костного вещества (например, при болезни Педжета). Их значения более информативны в качестве показателей тяжести поражения костной системы.
Таким образом, суммируя принципы лабораторной диагностики первичного гиперпаратиреоза, можно сформулировать следующие ключевые тезисы.
Скрининг гиперкальциемии — необходимый и наиболее рациональный метод выявления первичного гиперпаратиреоза в популяции.
Наиболее важным диагностическим показателем является одновременное повышение уровней кальция и паратгормона крови. При этом следует учитывать определенные пропорции этого повышения: кальций при первичном гиперпаратиреозе редко превышает уровень 3 ммоль/л; тяжелая гиперкальциемия, как правило, сопровождается очень высоким уровнем паратгормона (как минимум 5–10-кратным).
Явственная гиперкальциемия и незначительное повышение уровня паратгормона (или верхненормальные его значения) более характерны для семейной гипокальциурической гиперкальциемии. Подтвердить ее можно исследованием суточной кальциурии (типично — снижена), предпочтительно в соотношении с клиренсом креатинина, а также обследованием кровных родственников.
Все случаи гиперкальциемии эндогенного (злокачественные опухоли, миеломная болезнь, гранулематозы, тиреотоксикоз и т.д.) или экзогенного (гипервитаминоз D, тиазидовые диуретики, молочно-щелочной синдром и др.) происхождения сопровождаются супрессированным или даже нулевым уровнем паратгормона крови.
Вторичный гиперпаратиреоз представляет диагностическую проблему чаще при первичном дефиците витамина D, когда присутствует умеренное повышение уровня паратгормона и нормальный уровень кальция в крови. Вторичный гиперпаратиреоз почечного генеза легче диагностировать в силу наличия гиперфосфатемии и сниженного или нижненормального уровня кальция в крови, а также признаков нарушения почечной функции.
Сочетание первичного гиперпаратиреоза и дефицита витамина D является фактором, усложняющим лабораторную диагностику и усугубляющим тяжесть болезни. Коррекция витамин D-недостаточности позволит быстрее дифференцировать первичный и вторичный гиперпаратиреоз, объяснить нормокальцемические варианты первого, избежать необоснованных операций.
В любом из клинических вариантов болезни очень важно взвешенное решение об окончательном диагнозе, серийное исследование параметров, изучение дополнительных диагностических факторов в связи с принципиальными отличиями в лечебной тактике при первичном гиперпаратиреозе и других состояниях.
К числу очень важных для выбора лечебной тактики лабораторных исследований при первичном гиперпаратиреозе следует отнести также генетическое тестирование на наличие возможных мутаций, определяющих развитие наследственных форм гиперпаратиреоза (МЭН-1, МЭН-2а, PHT-JT-синдром, синдром семейного гиперпаратиреоза) и вариантов патологии гена, кодирующего кальциевый рецептор. Однако, как и 5 лет назад, приходится констатировать практическую недоступность генетических методов для широкого клинического применения в Украине.
1. The Parthyroids: Basic and Clinical Concepts / Ed. Bilezikian J.P. — NY: Raven Press, 1994. — 746 p.
2. Черенько С.М. Первичный гиперпаратиреоз: основы патогенеза, диагностики и хирургического лечения. — К.: Экспресс-полиграф, 2011. — 148 с.
3. Bilezikian J.P., Khan A.A., Potts J.T. Jr. Оn behalf of the Third International Workshop on the Management of Asymptomatic Primary Hyperthyroidism Guidelines for the Management of Asymptomatic Primary Hyperparathyroidism: Summary Statement from the Third International Workshop // The Journal of Clinical Endocrinology & Metabolism. — 2009. — Vol. 94, № 2. — P. 335–339.
4. 4th International Workshop on «The Management of Asymptomatic Primary Hyperparathyroidism» (Florence, Italy, September 19–21, 2013) // Programme and abstracts. — 2013. — 39 p

/175/175.jpg)