Международный эндокринологический журнал 6 (62) 2014
Вернуться к номеру
Диагностика и лечение гипофизарного синдрома Кушинга
Авторы: Кирилюк М.Л. - Украинский НПЦ эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины, г. Киев
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
В статье рассматриваются этиология, патогенез и вопросы диагностики гипофизарного синдрома Кушинга. Описаны клинические признаки синдрома Кушинга, а также состояния, ассоциированные с гиперкортизолизмом при отсутствии синдрома Кушинга. Подробно изложены вопросы лабораторной и инструментальной диагностики и лечения данного синдрома.
У статті розглядаються етіологія, патогенез і питання діагностики гіпофізарного синдрому Кушинга. Описано клінічні ознаки синдрому Кушинга, а також стани, асоційовані з гіперкортизолізмом при відсутності синдрому Кушинга. Детально викладені питання лабораторної й інструментальної діагностики та лікування даного синдрому.
The paper deals with the questions on etiology, pathogenesis and diagnosis of hypophyseal Cushing’s syndrome. There are described the clinical picture of Cushing’s syndrome as well as the conditions associated with hypercorticoidism in the absence of Cushing’s syndrome. There are dwelt the principles of laboratory and instrumental diagnosis and treatment of this syndrome.
синдром Кушинга, диагностика, лечение.
синдром Кушинга, діагностика, лікування.
Cushing’s syndrome, diagnosis, treatment.
Статья опубликована на с. 182-193
Определение, эпидемиология и этиология гиперкортизолизма
Синдром Кушинга (гиперкортизолизм) включает в себя большую группу признаков и прогрессирующих симптомов, которые отражают длительное и чрезмерно высокое воздействие глюкокортикоидов на ткани. Несмотря на то, что наиболее распространенной причиной гиперкортизолизма считается ятрогенная, эндогенный синдром Кушинга является редким расстройством. Европейские популяционные исследования сообщают о 2–3 случаях на 1 млн жителей в год. Частота новых случаев гипофизарного синдрома Кушинга (ГСК) в США колеблется от 0,7 до 2,4 случая на 1 млн человек в год. Это означает, по оценкам, от 200 до 700 новых случаев ежегодно.
При ГСК в 90 % случаев источником кортикотропина (адренокортикотропного гормона — АКТГ) является микроаденома гипофиза, в 5–7 % — макроаденома, в остальных случаях выявляется гиперплазия клеток гипофиза.
Другие причины избыточной выработки кортизола, биохимического признака эндогенного синдрома Кушинга:
I. Эндогенный синдром Кушинга:
1. АКТГ-зависимый синдром Кушинга:
— избыточная секреция АКТГ гипофизом — гипофизарный синдром Кушинга (68–70 % всех случаев);
— эктопированная опухоль, продуцирующая АКТГ (овсяноклеточный рак легкого, карциноид бронхов, тимуса, поджелудочной железы) (10–15 %);
— эктопическая продукция кортиколиберина — менее 1 %.
2. АКТГ-независимый синдром Кушинга (17 %) (надпочечниковый синдром Кушинга) (избыточная выработка кортизола надпочечниками):
— аденома — 10 %;
— аденокарцинома — 5 %;
— микронодулярная надпочечниковая гиперплазия (одно- либо двусторонняя), спорадическая либо в рамках проявления синдрома Карни (сочетание с лентигинозом, миксомами сердца и кожи, крупноклеточной сертолиомой, а также рядом других неоплазий) — редко;
— макронодулярная надпочечниковая гиперплазия (AIMAH), спорадическая либо вследствие наличия эктопированных рецепторов к желудочному ингибирующему пептиду, лютропину, хориогонадотропину, гастрин-ингибирующему полипептиду, вазопрессину, иммуноглобулинам, интерлейкину-1, агонистам b-адренорецепторов — менее 2 %;
— первичная пигментная нодулярная болезнь надпочечников (PPNAD) — менее 2 %;
— узелковая гиперплазия в рамках синдрома МакКьюн — Олбрайта — редко.
II. Неизвестный источник АКТГ (5 %).
III. Экзогенный синдром Кушинга — ятрогенный (вследствие приема кортикостероидов по медицинским показаниям).
IV. Функциональный гиперкортицизм (псевдо-Кушинг).
V. Синдром Кушинга с циклическим течением.
VI. «Немая» кортикотропинома.
ГСК чаще встречается у женщин детородного возраста, эктопический вариант — преимущественно у взрослых мужчин, надпочечниковый — у детей.
Клинические проявления и дифференциальная диагностика
Главные признаки синдрома Кушинга включают в себя ожирение туловища (имеется у 86 % больных), артериальную гипертензию (у 68 %). Это самые ранние признаки гиперкортицизма. Далее следуют такие симптомы:
— нарушение толерантности к углеводам (у 45 %), вплоть до признаков сахарного диабета 2-го типа;
— лунообразное лицо, багровый румянец (у 80 %);
— красно-фиолетовые стрии на животе, груди и внутренней поверхности бедер (у 50 % женщин и у 72 % мужчин);
— вирилизация (гирсутизм, гипертрофия клитора, облысение висков) (у 65 %);
— нарушение менструального цикла (у 60 %);
— гипотрофия мышц конечностей и живота (миопатия) (у 45 % женщин и у 63 % мужчин);
— петехии, кровоподтеки (у 32 % женщин и у 21 % мужчин);
— остеопороз (у 31 % женщин и у 46 % мужчин).
Другие, менее важные, симптомы включают в себя:
— слабость;
— изменения психики (у 34 % женщин и у 25 % мужчин);
— гиперпигментацию кожи, угри;
— гипокалиемический алкалоз (у 21 % женщин и у 32 % мужчин);
— нефролитиаз (у 6 % женщин и у 21 % мужчин).
При резко выраженном спектре внешних проявлений с клинической точки зрения синдром Кушинга является очевидным. Главные симптомы болезни (красновато-фиолетовые стрии, плетора, проксимальная миопатия, легкие кровоизлияния без видимых травм и остеопороз неясной этиологии) являются уникальными и дискриминационными по отношению к другим признакам.
Ожирение, артериальная гипертензия и багровый румянец характерны для всех разновидностей синдрома Кушинга. Вирилизация чаще наблюдается при раке надпочечника, гипокалиемический алкалоз, миопатия и гиперпигментация — при эктопической продукции АКТГ.
Нарушение зрения (хиазмальный синдром), характерное для макроаденомы гипофиза с супраселлярным ростом, наблюдается очень редко, так как клинические признаки гиперкортизолизма по скорости проявления значительно опережают глазные симптомы.
В легких случаях диагностика ГСК может быть затруднена, т.к. гиперактивность гипоталамо-гипофизарно-надпочечниковой оси может возникнуть и без болезни Иценко — Кушинга, в результате чего происходит перекрытие между физиологическими и патофизиологическими причинами гиперкортицизма.
Состояния, ассоциированные с гиперкортизолизмом при отсутствии синдрома Кушинга
Некоторые клинические признаки синдрома Кушинга могут присутствовать при следующих состояниях:
— беременность;
— депрессия и другие психические расстройства;
— алкогольная зависимость;
— резистентность к глюкокортикоидам;
— патологическое ожирение;
— плохо контролируемый сахарный диабет.
Клинические признаки синдрома Кушинга не характерны при следующих состояниях:
— физический стресс (госпитализация, операция, боль);
— недоедание, нервная анорексия;
— интенсивные физические упражнения;
— избыток глобулина, связывающего кортизол (повышение кортизола в сыворотке, но не в моче).
Кроме того, пациенты могут иметь ряд патологических состояний или заболеваний, сопровождающихся умеренным избытком кортизола в крови, но считающихся обычным явлением среди населения в целом, например ожирение, депрессия, диабет, гипертония или нарушение менструального цикла. В результате происходит перекрытие в клинической картине у лиц с истинными расстройствами при синдроме Кушинга или без них (табл. 1).
Некоторые психические расстройства (депрессия, тревожное расстройство, обсессивно-компульсивное расстройство), слабо контролируемый сахарный диабет, алкоголизм могут быть связаны с умеренным гиперкортицизмом и привести к ложным результатам тестов, указывающим на синдром Кушинга.
Концентрация циркулирующего в крови кортизола, как правило, нормальная (или слегка снижена) при ожирении, но при тяжелой форме ожирения свободный кортизол в моче может быть повышен. Считается, что в таких условиях высшие корковые центры стимулируют высвобождение кортикотропин-рилизинг-гормона (CRH, КРГ, кортиколиберин) с последующей активацией всей гипоталамо-гипофизарно-надпочечниковой оси. При этом ингибирование кортизолом выработки АКТГ по принципу отрицательной обратной связи частично сдерживает гиперкортизолемию. В результате уровень экскреции свободного кортизола в моче ограничивается приблизительно 4-кратными значениями по отношению к нормальным значениям.
Встречается вариант синдрома Кушинга с циклическим течением (волнообразным), когда гиперкортизолемия чередуется с периодами его нормальных значений. В данном случае внешние признаки синдрома Кушинга могут проявляться на фоне нормокортизолемии.
Большой интерес представляет заболевание, носящее название «немая» кортикотропинома». Заболевание проявляется повышенным уровнем АКТГ в крови без клиники болезни Иценко — Кушинга, хотя опухоль существует и может характеризоваться инвазией в окружающие ткани. Показано, что при «немых» кортикотропиномах отсутствует экспрессия фермента прогормонконвертазы РС1/3. Очевидно, эти аденомы состоят из клеток, вырабатывающих только прогормон проопиомеланокортин (ПОМК). В норме ПОМК переходит в биологически активный АКТГ под влиянием РС1/3. Отсутствие экспрессии мешает этому процессу, в результате высокий уровень биологически неактивного АКТГ не сопровождается повышением уровня кортизола и появлением признаков синдрома Кушинга.
Лабораторная и инструментальная диагностика
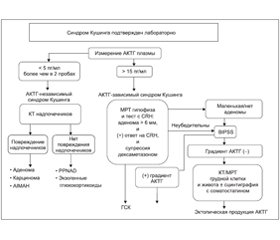
Для первоначального тестирования синдрома Кушинга (подтверждение либо исключение эндогенного гиперкортицизма) предлагаются следующие биохимические тесты (рис. 1):
1. Свободный кортизол в моче (UFC, по меньшей мере 2 измерения).
2. Ночной кортизол в слюне (2 измерения).
3. Короткий (ночной) супрессивный тест с дексаметазоном (короткая проба с дексаметазоном, DST) — 1 мг на ночь.
4. Малый супрессивный тест с дексаметазоном (низкодозовый супрессивный тест (LDDST)) (2 мг/сут в течение 48 часов).
5. Малый супрессивный тест с дексаметазоном в сочетании со стимуляцией кортиколиберином.
Для дифференциальной диагностики разновидностей синдрома Кушинга применяют следующие пробы (рис. 2–4):
1. Длинная супрессивная проба с дексаметазоном (8 мг/сут в течение 48 часов).
2. Проба с кортиколиберином (CRH).
3. Забор крови из нижних (задних) каменистых синусов.
Не рекомендуется использовать для диагностики синдрома Кушинга следующие тесты:
— случайное измерение уровня кортизола в сыворотке или АКТГ в плазме из-за его низкой диагностической точности;
— 17-кетостероиды в моче (17-КС) (низкая диагностическая точность);
— проба с инсулином (низкая диагностическая точность).
— проба с лоперамидом (имеется недостаточно доказательств ее диагностической точности);
— десмопрессиновый тест (за исключением научных исследований), пока дополнительные данные не подтвердят его полезность.
Измерение кортизола (мочи, сыворотки или слюны) и/или АКТГ сыворотки является главной конечной точкой для каждого из рекомендуемых тестов. Первые 4 теста обладают приемлемой точностью для амбулаторных условий. У пациентов с высокой клинической предсказуемостью результата, чтобы ускорить диагностику, можно одновременно выполнять два теста.
Перечень препаратов, влияющих на оценку тестов для диагностики синдрома Кушинга*
1. Препараты, которые ускоряют метаболизм дексаметазона путем индуцирования CYP 3A4:
— фенобарбитал;
— фенитоин;
— примидон;
— рифампин;
— рифапентин;
— этосуксимид;
— пиоглитазон.
2. Препараты, которые ослабляют метаболизм дексаметазона путем ингибирования CYP 3A4:
— апрепитант/фозапрепитант;
— итраконазол;
— ритонавир;
— флуоксетин;
— дилтиазем;
— циметидин;
— карбамазепин.
3. Препараты, которые увеличивают концентрацию CBG и могут привести к ложному повышению кортизола крови:
— эстрогены;
— митотан.
4. Препараты, которые повышают результаты UFC:
— карбамазепин (увеличение);
— фенофибрат (увеличение при измерении HPLC);
— некоторые синтетические глюкокортикоиды (иммуноанализы);
— препараты, которые ингибируют 11-b-гидрокси-стероид-дегидрогеназу 2-го типа (11b-HSD2) (солодка, карбеноксолон).
Примечание: * — изложенный список не следует считать полным списком возможного взаимодействия препаратов. Данные в отношении CYP3A4 получены из http://medicine. iupui.edu/flockhart/table.htm.
Свободный кортизол в моче (UFC). UFC обеспечивает комплексную оценку секреции кортизола в течение 24-часового периода. Он показывает уровень кортизола, который не связан с CBG, и выводится с почками в неизмененном виде. Поэтому, в отличие от кортизола сыворотки, который включает как кортизол, комплексированный с глобулином, его связывающим, так и свободный гормон, на UFC не влияют некоторые состояния и лекарства, изменяющие выработку и уровень CBG. Например, у здоровых женщин, принимающих оральные эстрогены, как было сказано выше, может повыситься CBG и, следовательно, обнаруживается высокая концентрация кортизола сыворотки, но UFC у них остается нормальным. Поскольку при синдроме Кушинга выработка кортизола повышается, количество свободной фракции гормона в сыворотке также повышается, в результате чего увеличиваются и значения UFC.
Ложноположительное повышение UFC можно наблюдать при нескольких условиях. Высокое потребление жидкости (> 5 л/сут) значительно увеличивает UFC. Любое физиологическое или патологическое состояние, которое увеличивает выработку кортизола, повышает UFC. При этих состояниях нормальный результат анализа является более надежным, чем аномальный.
Ложноотрицательные результаты (ложнонизкое значение) анализа кортизола мочи могут наблюдаться у пациентов с умеренной и тяжелой почечной недостаточностью, когда СКФ снижается менее 60 мл/мин. Свободный кортизол в моче может быть нормальным, если у пациента циклическое течение синдрома Кушинга, а забор мочи происходит при неактивной стадии заболевания. Наконец, этот показатель может быть нормальным у некоторых пациентов с легкой формой синдрома Кушинга.
Ночной кортизол в слюне. Этот легко выполняемый неинвазивный метод часто используется у детей для дифференциальной диагностики синдрома Кушинга и простого ожирения.
Биологически активный свободный кортизол в крови находится в равновесии с кортизолом в слюне, а концентрация кортизола в слюне, по-видимому, не зависит от скорости выработки слюны. Увеличение содержания в крови кортизола отражается на его концентрации в слюне уже в течение нескольких минут.
Большинство клиницистов, использующих тест на ночной кортизол в слюне, просят пациентов собирать слюну в течение двух отдельных вечеров в период между 23:00 и 24:00. Слюна собирается либо пассивным слюнотечением в пластиковую трубку, либо путем размещения хлопчатого тампона (salivette) во рту и жевания в течение 1–2 минут.
Уровень кортизола в слюне в ночное время обеспечивает 92–100% чувствительность и 93–100% специфичность при диагностике синдрома Кушинга. Точность этого теста аналогична точности UFC. У пациентов, страдающих ожирением, при использовании метода RIA специфичность составляет только 85 % и 92 % — при использовании тандемной масс-спектрометрии.
Наиболее достоверными анализами, используемыми в США для измерения кортизола в слюне, являются ELISA и LC-MS/MS. При использовании этих двух методов у здоровых лиц, как правило, уровни кортизола в слюне во время сна или между 23:00 и 24:00 составляют менее 145 нг/дл (4 нмоль/л).
При оценке результатов необходимо учитывать несколько факторов, которые влияют на тест слюнного кортизола. Ложноположительные результаты получены при обследовании мужчин в возрасте от 60 лет и старше: у 20 % от всех участников и 40 % диабетических больных, страдающих гипертонией, наблюдалось по меньшей мере одно завышенное значение ночного кортизола в слюне. Ночной уровень кортизола в слюне может быть временно аномальным у лиц, пересекающих разные часовые пояса, а также у лиц, перенесших стресс непосредственно перед сбором анализа.
Короткий (ночной) супрессивный тест с дексаметазоном (DST) (короткая проба с дексаметазоном). Тест предназначен для выявления гиперкортизолемии как таковой.
Ночной супрессивный тест представляет собой простой амбулаторный тест. 1 мг дексаметазона обычно принимается пациентом в период между 23:00 и 24:00, а кортизол измеряется в период с 08:00 до 09:00 на следующее утро.
В норме назначение супрафизиологической дозы глюкокортикоидов приводит к подавлению выработки АКТГ и кортизола. При эндогенном синдроме Кушинга любой этиологии подавление выработки АКТГ и кортизола, как правило, не происходит.
Широко известной нормальной ответной реакцией на тест при использовании современного RIA со специфичностью до 95 % является уровень сывороточного кортизола менее 5 мкг/дл (< 140 нмоль/л) (пограничные значения от 3,6 до 7,2 мкг/дл (100–200 нмоль/л)).
В настоящее время при условии применения тестов с высокой чувствительностью рекомендуется использовать более жесткие предельные значения от 1,8 мкг/дл (50 нмоль/л).
Определение сывороточного ночного кортизола. В основе метода лежит факт потери у больных с синдромом Кушинга низшего уровня значений сывороточного кортизола в ночное время. Кровь необходимо взять на анализ в течение 5–10 минут после пробуждения пациента. Тест повышает точность UFC и DST 1 мг. Так, при использовании у больных с высоким клиническим индексом подозрения на синдром Кушинга, но нормальными результатами UFC и супрессивной пробы с дексаметазоном концентрация ночного сывороточного кортизола во время сна более 1,8 мкг/дл (50 нмоль/л) или во время бодрствования выше 7,5 мкг/дл (207 нмоль/л) увеличивает вероятность наличия синдрома Кушинга.
И наоборот, при низком клиническом индексе подозрения на синдром Кушинга, например, при простом ожирении, но при отрицательной супрессивной пробе с дексаметазоном и умеренно повышенном UFC ночной сывороточный кортизол во время сна менее 1,8 мкг/дл (50 нмоль/л) фактически исключает синдром Кушинга. Чувствительность метода составляет 100 % при критерии оценки в 1,8 мкг/дл и более (> 50 нмоль/л).
Малый супрессивный тест с дексаметазоном (2 мг/сут в течение 48 часов). Впервые описан Лиддлом в 1960 году. Дексаметазон назначается в дозе 0,5 мг в течение 48 часов начиная с 09:00 в 1-й день, с 6-часовым интервалом, то есть в 09:00, 15:00, 21:00 и 03:00. Сывороточный кортизол измеряют в 09:00, через 6 часов после приема последней дозы дексаметазона. При строгом соблюдении условий теста его можно проводить амбулаторно.
При пороговом значении кортизола на уровне 50 нмоль/л (1,8 мкг/дл) чувствительность теста составляет более 95 %, специфичность — 70 %. Причины такого очевидного снижения специфичности неизвестны. Поэтому этот тест имеет аналогичную или чуть меньшую диагностическую точность, чем другие тесты, рекомендуемые для первоначального тестирования.
Малый супрессивный тест с дексаметазоном в сочетании со стимуляцией кортиколиберином (CRH). В целях улучшения чувствительности 48-часового теста (LDDST) (2 мг/сутки), а также в случаях сомнительных результатов в отношении UFC разработан новый комбинированный тест со стимуляцией кортиколиберином.
Тест лучше проводить в стационаре. Осуществляется с использованием малого супрессивного теста дексаметазоном (2 мг/сут в течение 48 часов) с последующим введением CRH (1 мкг/кг внутривенно, максимально 100 мкг) через 2 ч после приема последней дозы дексаметазона. Кортизол сыворотки измеряют через 15 минут после введения CRH.
Теоретически дексаметазон подавляет уровни сывороточного кортизола у лиц, не страдающих синдромом Кушинга, а также у небольшого количества больных с синдромом Кушинга. Но если учитывать эффект введения CRH, то пациенты с синдромом Кушинга должны реагировать увеличением АКТГ и кортизола. Повышение кортизола более 1,4 мг/дл (38 нмоль/л) подтверждает наличие эндогенного гиперкортицизма.
Чувствительность теста составляет 86–98 %, специфичность — 60 %. Причина низкой специфичности неясна.
Длинная супрессивная проба с дексаметазоном. Тест используется для дифференциальной диагностики гиперкортизолизма в стационарных условиях. Дексаметазон назначается в дозе 2 мг в течение 48 часов начиная с 09:00 в 1-й день, с 6-часовым интервалом. Сывороточный кортизол измеряют в 09:00, т.е. через 6 часов после приема последней дозы дексаметазона.
Проба основана на том, что при болезни Иценко — Кушинга аденома гипофиза продолжает хотя бы частично подчиняться регуляторным механизмам, свойственным здоровой ткани гипофиза (снижение выработки АКТГ в ответ на большие дозы глюкокортикоидов или стимуляция АКТГ в ответ на введение кортиколиберина), в то время как АКТГ-эктопическая опухоль или гормонально-активная опухоль надпочечника не обладают такими свойствами.
При ГСК длительный прием дексаметазона должен снижать UFC и кортизол сыворотки более чем на 50 % по сравнению с исходным уровнем. Специфичность метода составляет 85 %.
Однако иногда секреция АКТГ аденомой гипофиза, особенно макроаденомой, не подавляется большими дозами дексаметазона, а у 10–15 % больных с ГСК в ответ на пробу имеет место парадоксальное повышение кортизола в крови. При эктопическом синдроме Кушинга, обусловленном АКТГ-секретирующим раком легкого, в 10–30 % случаев опухоль остается чувствительной к значительному влиянию глюкокортикоидов и дексаметазон подавляет секрецию АКТГ клетками этой опухоли, поэтому уровень кортизола в крови снижается. Надо помнить, что реакция на этот тест может быть аномальной у здоровых людей.
При проведении пробы следует учитывать, что прием больших доз глюкокортикоидов при наличии у пациента эндогенного гиперкортицизма может привести к гипергликемии, повышению потребности в инсулине, утяжелению имеющихся у пациента психических расстройств.
Проба со стимуляцией кортиколиберином и определение АКТГ. Проба применяется для дифференциальной диагностики гиперкортизолизма наряду с длинной супрессивной пробой с дексаметазоном в условиях специализированного стационара.
Если на фоне гиперкортизолемии у больного обнаруживается минимальное количество АКТГ (базальный уровень более 5–10 пг/мл), то следует диагностировать гипофизарный или эктопический синдром Кушинга. При эктопическом синдроме Кушинга, обусловленном овсяноклеточным раком легкого, уровень АКТГ крови чаще более высокий, чем при ГСК (более чем в 2,5 раза — 100–200 пг/мл), в то время как при карциноиде бронхов он в норме или слегка повышен. Если же при гиперкортизолемии уровень АКТГ не определяется или менее 5 пг/мл, то диагностируют надпочечниковый АКТГ-независимый синдром Кушинга, хотя в некоторых случаях при этом синдроме уровень АКТГ не снижен и даже повышен (карцинома надпочечника, продуцирующая АКТГ).
При ГСК базальный уровень АКТГ слегка или умеренно повышен в половине случаев (более 15–20 пг/мл), хотя у 10 % АКТГ менее 10 пг/мл. У остальных больных с гипофизарным синдромом Кушинга эта закономерность отсутствует (сомнительный результат АКТГ крови составляет 10–20 пг/мл), что диктует проведение стимуляционных проб. Следует помнить, что некоторые аденомы гипофиза при ГСК приобретают полную автономию и не отвечают на стимуляцию кортиколиберином, а 10 % эктопических опухолей все же остаются чувствительными к стимулирующему влиянию CRH.
Быстрое внутривенное введение CRH (1 мкг/кг внутривенно, максимально 100 мкг, кровь на АКТГ забирают уже через 3 минуты, на кортизол — через 15 минут) при болезни Иценко — Кушинга повышает уровни АКТГ и кортизола на 90 %.
При интерпретации пиковых значений АКТГ (через 30, 45, 60, 90 и 120 минут) по отношению к базальному необходима 86% чувствительность и 95% специфичность пробы при превышении уровня АКТГ на 20 %, 91% чувствительность и 95% специфичность — при превышении на 50 %.
Данная проба дает лучшие результаты, чем длинная проба с дексаметазоном. Совпадение результатов положительной большой дексаметазоновой пробы (длинной супрессивной пробы) и стимуляционного теста с кортиколиберином с чувствительностью 98–100 % и специфичностью 88–100 % свидетельствует о болезни Иценко — Кушинга.
Забор крови из нижних (задних) каменистых синусов. Данный метод используется для дифференциальной диагностики гипофизарного и эктопического синдрома Кушинга в нейроэндокринологическом стационаре. Взятие крови из правого и левого нижних каменистых синусов с одновременным забором крови из периферической вены после стимуляции CRH (1 мкг/кг внутривенно) с определением уровня АКТГ (на 3, 5, 10-й минутах) позволяет установить диагноз болезни Иценко — Кушинга в 96 % случаев и локализацию аденомы гипофиза в 85 % случаев. В норме соотношение концентрации АКТГ гипофиза/АКТГ периферической крови составляет 20, при болезни Иценко — Кушинга — 2. После стимуляции CRH соотношение концентрации АКТГ гипофиза/АКТГ периферической крови при ГСК составляет > 3, а при эктопическом варианте — < 3 (обычно не превышает 2), т.к. эктопическая опухоль не реагирует на кортиколиберин. Если визуализировать аденому гипофиза на МРТ невозможно, то максимальный градиент между правым и левым синусом > 1,4 до или после стимуляции кортиколиберином дает информацию о стороне поражения, а градиент < 1,4 указывает на срединное расположение кортикотропиномы с точностью только до 70 % из-за асимметричного венозного оттока.
Особые факторы и состояния
Беременность. Рекомендуется использовать UFC и не рекомендуется применять супрессивный дексаметазоновый тест при первоначальном исследовании беременных женщин.
Скрининг гиперкортицизма является более трудным при беременности, особенно во 2-м и 3-м триместрах. В 1-м триместре беременности UFC находится в пределах нормальных величин, однако повышается до 3 раз с увеличением срока, достигая значений, наблюдающихся у женщин с синдромом Кушинга. Таким образом, для верификации синдрома Кушинга могут быть приняты значения UFC только во 2-м или 3-м триместре беременности, превышающие верхнюю границу нормы более чем в 3 раза.
Циркадные изменения сывороточного кортизола сохраняются при нормальной беременности, хотя максимальное снижение выше в ночное время.
Надо помнить, что диагностический порог концентрации вечернего сывороточного или слюнного кортизола у беременных неизвестен. Кроме того, супрессия дексаметазоном выработки кортизола, определяемого в сыворотке или слюне, у беременных притупляется. Следовательно, тест с дексаметазоном во время беременности повышает вероятность ложноположительных результатов.
Эпилепсия. Не рекомендуется использовать дексаметазоновый тест у пациентов, принимающих противоэпилептические препараты, которые, как известно, способствуют выведению дексаметазона, и вместо этого рекомендуется измерять базальный (несупрессивный) кортизол в крови, слюне или моче в 23:00. Измерение кортизола сыворотки в 23:00 можно проводить во время сна (с предварительной катетеризацией), не позднее чем через 5–10 минут после просыпания или в состоянии бодрствования.
Почечная недостаточность. У пациентов с тяжелой почечной недостаточностью для первоначального скрининга синдрома Кушинга рекомендуется скорее использовать тест подавления дексаметазона (1 мг на ночь), чем измерять свободный кортизол в моче. При отсутствии дополнительных данных нормальная реакция на введение 1 мг дексаметазона, вероятно, исключает синдром Кушинга, но и аномальный ответ требует дополнительного подтверждения.
Циклический синдром Кушинга. У пациентов, у которых подозревается наличие циклического синдрома Кушинга, предлагается использовать скорее тест на UFC или ночной слюнной кортизол, чем DST, так как результаты DST могут быть нормальными у пациентов с циклическим гиперкортицизмом.
Инструментальная диагностика. Методом выбора диагностики является МРТ гипоталамо-гипофизарной области. Модифицированный протокол сканирования гипофиза предусматривает динамическое МРТ-сканирование (аппарат с напряженностью магнитного поля 3Т) с введением 1/2 дозы гадолиний-содержащего контрастного препарата. Может использоваться 1,5Т МРТ с различными вариантами стандартных импульсных последовательностей:
а) SPGR — импульсная последовательность (измененная специфическая градиентная последовательность);
б) Т1-взвешенный спин-эхо режим сканирования.
До 40 % микроаденом гипофиза при болезни Иценко — Кушинга имеют негативный 1,5Т МРТ-сигнал.
КТ с внутривенным контрастированием менее эффективно, чем МРТ, в диагностике небольших аденом (менее 5 мм) и в верификации распространения больших опухолей, но может быть использована, если МРТ недоступно или противопоказано.
Ангиография повышает точность локализации аденомы при исследовании венозного оттока от гипофиза (см. тест со стимуляцией кортиколиберином)
Лечение
Методом выбора лечения ГСК является хирургический. Вторая линия лечения включает повторную операцию, лучевую терапию, медикаментозную терапию, а также двустороннюю адреналэктомию.
Методом выбора хирургического лечения ГСК является трансназальная транссфеноидальная аденомэктомия. Показания: микроаденома (диаметр менее 1 см), кровоизлияние в опухоль, опухоль, прорастающая в клиновидную пазуху или сопровождающаяся ликвором из носа, макроаденома с умеренным супра- или параселлярным ростом.
Стойкая ремиссия ГСК после транссфеноидальной аденомэктомии достигается примерно в 65–98 % случаев. С другой стороны, частота рецидивов заболевания после микрохирургической аденомэктомии может достигать 2–26 % (5–10 % в течение первых 5 лет после операции, 10–20 % через 10 лет), риск развития послеоперационных осложнений — 15 %. Время возникновения рецидива колеблется от 0,5 года до 20 лет. При этом частота осложнений после транссфеноидальной аденомэктомии по поводу болезни Иценко — Кушинга значительно выше, чем после микрохирургического лечения больных с аденомами гипофиза в целом.
Показания к субфронтальной аденомэктомии: значительное экстраселлярное распространение опухоли, супраселлярная опухоль с боковыми отростками, форма опухоли в виде гантели с сужением в области турецкого седла, невозможность проведения транссфеноидальной аденомэктомии.
Хирургическое лечение ГСК может быть симптоматическим, направленным на быстрое подавление избыточной продукции глюкокортикоидов. Для этого выполняют одно- или двустороннюю адреналэктомию, чрескатетерную чрезвенозную химическую деструкцию надпочечников, что в последующем приводит к возникновению синдрома Нельсона.
Синдром Нельсона — состояние, возникающее как следствие неадекватной заместительной терапии хронической надпочечниковой недостаточности или ее лабильного течения после двусторонней тотальной адреналэктомии при болезни Иценко — Кушинга и характеризующееся появлением в дополнение к хронической надпочечниковой недостаточности и активному прогрессирующему росту АКТГ-продуцирующей аденомы гипофиза гиперпигментации кожных покровов и слизистых оболочек. Возникает в 5–10 % случаев после данного оперативного вмешательства. Ключевой момент патогенеза — повышение продукции АКТГ вследствие нарушения механизмов обратной связи.
Лучевая терапия. Фракционная лучевая y-терапия может быть традиционно рекомендована после субтотальной резекции макроаденомы гипофиза, при рецидивах опухолей, при сохранении гиперсекреции АКТГ после операции. Доза на курс — 40–45 Гр. Клинико-биохимическая ремиссия после лучевой терапии достигается у 42–83 % взрослых больных. Контроль роста опухоли варьирует от 93 до 100 %.
При торпидном течении заболевания, когда состояние пациента позволяет ждать отсроченное наступление ремиссии, в качестве метода лечения может быть выбрана стереотаксическая радиохирургия узкоколлимированными фотонными пучками (Gamma-Knife), высокоэнергетическим излучением с применением медицинских линейных ускорителей (LINAC), кибер-нож (CyberKnife®), протонотерапия.
Протонотерапия может быть использована как самостоятельный метод лечения ГСК при отсутствии срочных показаний к аденомэктомии, в то же время протонное облучение гипофиза на первом этапе лечения тяжелой формы болезни Иценко — Кушинга не дает должного клинического эффекта. Клинико-биохимическая ремиссия достигается у 80 % больных. При легкой и средней форме течения заболевания клиническая ремиссия наблюдается в 96 % случаев. Поглощенная доза излучения должна быть не менее 70–80 Гр. При этом сроки наступления клинической и гормональной ремиссии варьируют в достаточно широких пределах (от 6 месяцев до 3 лет) и зависят от степени тяжести заболевания и возраста больных.
Преимущества стереотаксической радиохирургии перед традиционной лучевой терапией заключаются в следующем:
— реже развиваются вторичные (радиационно-индуцированные) опухоли мозга и нейрокогнитивные осложнения;
— безопаснее для зрительного тракта;
— может быть использована для воздействия на аденомы гипофиза, прорастающие в кавернозный синус;
— достигается более быстрый гормональный и клинический ответ.
При сроке наблюдения в 6–36 месяцев после использования y-–ножа при лечении ГСК нормализация уровня АКТГ достигается у 58 %, снижение — у 19 %.
Комбинирование стереотаксической радиохирургии с другими видами лечения, в частности с односторонней адреналэктомией и/или химической деструкцией надпочечников, позволяет, как правило, достигать клинического улучшения и ремиссии заболевания за более короткий промежуток времени.
Лучевая деструкция опухоли начинает проявляться в среднем через 9 месяцев и продолжается после 3 лет со времени облучения. В течение этого перида больные должны принимать ингибиторы стероидогенеза. Эффективность метода предопределяется и низкой (2–4 %) частотой рецидивов заболевания в постлучевой период.
Частота гипопитуитаризма после традиционной лучевой терапии ГСК составляет 13–56 %, после стереотаксической радиохирургии — 8–66 %, хотя есть и более узкие данные в 11–22 % (после y-ножа). Описаны случаи развития менингиом, нейробластом и астроцитом спустя много лет после лучевой терапии. Редким осложнением лучевой терапии является нейропатия зрительного нерва. Имеют место и единичные случаи темпоральной эпилепсии.
Медикаментозное лечение. Медикаментозное лечение ГСК направлено на подавление избыточной продукции АКТГ, глюкокортикоидов, блокаду действия гормонов на периферии. Лекарственное лечение применяют в том числе в качестве предоперационной подготовки.
Терапия ингибиторами стероидогенеза:
— кетоконазол, ингибитор 20,22-десмолазы, наиболее предпочтительный, имеет мало побочных эффектов. Стартовая доза 400–600 мг (до 800 мг) в день титруется до 1200–1600 мг. Применяют в качестве монотерапии примерно у 70 % больных;
— митотан (хлодитан), ингибитор 18-бета-гидроксилазы и 3-бета-гидроксистероид-дегидрогеназы, применяется в дозе 0,5–1 г в день в течение 1–4 недель. Используется в виде монотерапии. В дозе 4 г в день сохраняется в жировой ткани на протяжении 22 месяцев. Приводит фактически к медикаментозной адреналэктомии;
— метирапон, ингибитор 11-гидроксилазы, доза от 0,5–1 г в день до 6 г в день. Осложнения: гипертония, гипокалиемия, гирсутизм. В США не используется;
— аминоглютетимид блокирует превращение холестерина в прегненолон, доза 1–2 г в сутки. Используется в комбинации с другими методами лечения;
— этомидат (вводится внутривенно) может применяться, когда пациенты не могут принимать лекарства per os.
Относительно новым препаратом, блокирующим действие кортизола, прогестинов и андрогенов, является мифепристон, однако пока нет достаточно данных о его эффективности при болезни Иценко — Кушинга. Этот препарат связывается с рецепторами кортизола, андрогенов и прогестинов, снижает клинические симптомы болезни и проявления сахарного диабета на протяжении не менее 6 месяцев лечения. Есть данные о его эффективном использовании при эктопической продукции АКТГ. В США позиционируется только как средство для аборта.
К препаратам, слабо влияющим на секрецию АКТГ и малоэффективным при легком течении болезни Иценко — Кушинга, относятся ципрогептадин, антагонисты серотонина (ритансерин и кетансерин), вальпроевая кислота, ГАМК. Никаких крупномасштабных плацебо–контролируемых исследований с участием этой группы препаратов в мире не проводилось. Как и в случае препаратов, используемых для ингибирования синтеза стероидов, ни одно из этих средств не одобрено FDA для лечения ГСК.
Каберголин в дозе 3,5 мг (1,5–6 мг) в неделю у 30–40 % пациентов отдельных групп способствует наступлению ремиссии заболевания на протяжении 2–5 лет наблюдения.
Пасиреотид — аналог соматостатиновых рецепторов (sst2, sst5), позволяет достичь полной ремиссии у 29–36 % и частичной — у 15 % пациентов до 6 лет. Эксперты FDA в 2012 году приняли положительное решение по заявке на регистрацию пасиреотида, основываясь на результатах клинического рандомизированного исследования III фазы PORTfolio. У части пациентов, принимавших лекарственное средство, было отмечено снижение уровня свободного кортизола в моче, а также у отдельной подгруппы участников исследователи зафиксировали его нормализацию. У 26,3 % пациентов, получавших пасиреотид п/к в дозе 900 мкг 2 раза в сутки, и у 14,6 % больных, получавших препарат п/к в дозе 600 мкг 2 раза в сутки, средний уровень свободного кортизола в моче достиг нормального. Данный терапевтический эффект был достигнут на шестом месяце терапии. Препарат используется у пациентов, которым не показана операция, когда она неэффективна или в случае отказа от нее. В сочетании с каберголином эффективность (ремиссия) повышается до 53 %, а при тройной терапии (пасиреотид 250 мкг 3 раза в день, каберголин 0,5 мг 1 раз в неделю и кетоконазол 200 мг 3 раза в день) — до 88 %.
1. Гончаров Н.П., Марова Е.И., Колесникова Г.С., Рожинская Л.Я., Манченко О.В., Арапова С.А., Жимирикина М.Л. Радиохирургия с применением пучков протонов при болезни Иценко — Кушинга: гормональный мониторинг отдаленных результатов // Проблемы эндокринологии. — 2010. — № 3. — С. 3–10.
2. Кирилюк М.Л. Болезнь Иценко — Кушинга. Современные подходы к диагностике и лечению (клиническая лекция) // Эндокринология: новости, мнения, обучение. — 2014. — 1(5). — С. 54–67 (с разрешения автора).
3. Трошина Е.А., Бельцевич Д.Г., Молашенко Н.В., Газизова Д.О. Диагностика, дифференциальная диагностика и лечение эндогенного гиперкортицизма // Проблемы эндокринологии. — 2010. — № 2. — С. 53–63.
4. Эндокринология: Пер. с англ. / Под ред. Н. Лавина. — М.: Практика, 1999. — 1128 с.
5. Biller B.M.K., Grossman A.B., Stewart P.M. et al. Treatment of adrenocorticotropin-dependent Cushing’s syndrome: A consensus statement // J. Clin. Endocrinol. Metab. — 2008. — 93. — Р. 2454–2462.
6. Brada M., Ajithkumar T.V., Minniti G. Radiosurgery for pituitary adenomas // Clin. Endocrinol. (Oxford) — 2004. — 61, № 5. — P. 541–543.
7. Clayton R.N., Raskauskiene D., Reulen R.C. et al. Mortality and morbidity in Cushing’s Disease over 50 Years in Stoke-on-Trent, UK: Audit and Meta-Analysis of Literature // J. Clin. Endocrinol. Metab. — 2011. — 96. — Р. 632–642.
8. Colao A., Petersenn S., Newell-Price J. et al. A 12-month phase 3 study of pasireotide in Cushing’s disease // N. Engl. J. Med. — 2012. — 366. — Р. 914–924.
9. De Bruin C., Pereira A.M., Feelders R.A., Romijn J.A., Roelfsema F. et al. Coexpression of dopamine and somatostatin receptor subtypes in corticotroph adenomas // J. Clin. Endocrinol. Metab. — 2009. — 94. — Р. 1118–1124.
10. Losa M., Picozzi P., Redaelli M.G., Laurenzi A., Mortini P. Pituitary radiotherapy for Cushing’s disease // Neuroendocrinology. — 2010. — 92, Suppl. 1. — Р. 107–10.
11. Mahmoud-Ahmed Ashraf S., Suh John H. Radiation therapy for Cushing`s disease. A review // Pituitary. — 2002. — 5(3). — P. 175–180.
12. Newell-Price J., Bertagna X., Grossman A.B. et al. Cushing’s syndrome // Lancet. — 2006. — 367. — Р. 1605–1617.
13. Nieman L.K., Biller B.M.K., Findling J.W., Newell-Price J., Savage M.O., Stewart P.M., Montori V.M. The Diagnosis of Cushing’s Syndrome: An Endocrine Society Clinical Practice Guideline // First published in the Journal of Clinical Endocrinology & Metabolism. — May 2008. — 93(5). — P. 1526–1540.
14. Nieman L.K. Medical therapy of Cushing’s disease // Pituitary. — 2002. — 5(2). — Р. 77–82.
15. Tritos N.A., Biller B.M., Swearingen B. Management of Cushing disease // Nat. Rev. Endocrinol. — 2011. — 7(5). — Р. 279–289.
16. Vance M.L. Cushing’s disease: radiation therapy // Pituitary. — 2009. — 12(1). — Р. 11–14.

/184/184.jpg)
/185/185.jpg)
/186/186.jpg)
/187/187.jpg)